2. 广东省农业科学院植物保护研究所, 广州 510640
2. Plant Protection Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
鱼粉和鱼油一直是肉食性鱼虾类饲料的关键营养成分,在海水鱼虾饲料中的添加量一般分别高于30%和7%,这远远高于禽畜的用量,据统计,2006年水产养殖业的鱼粉和鱼油消耗量就分别占到全球产量的68.2%和88.5%[1, 2]。然而,受海洋渔业资源过度捕捞和全球气候变化等因素的影响,近年来全球鱼粉和鱼油产品呈现供应紧张、价格飙升的局面[3]。为了降低养殖成本、保护海洋渔业资源,减少鱼粉和鱼油使用量成为水产饲料行业的研究热点之一。众多研究结果已证实了使用价格低廉且来源丰富的陆生动、植物蛋白质源部分替代鱼粉在水产养殖中的可行性[4, 5],而且在饲料中添加适量的非蛋白质能源(如脂肪和碳水化合物),通过提高饲料的消化能水平,可减少蛋白质作为能源的消耗,从而起到节约蛋白质的作用[6, 7]。然而,采用脂肪节约蛋白质的做法,若添加的脂肪过量,很容易导致鱼类出现脂肪肝[8]、免疫力下降等疾病,还会增加体脂的沉积,影响鱼体品质[9],同时饲料容易因脂肪氧化而变质[10],所以饲料中脂肪的适宜添加量是水产动物营养研究中的重要内容。
美国红鱼是肉食性鱼类,属鲈形目,石首鱼科,拟石首鱼属,学名为眼斑拟石首鱼(Sciaenops ocellatus),俗称红姑鱼。自国家海洋局于1991年首次引进美国红鱼仔鱼,并于1995年成功培育出我国第1代美国红鱼幼鱼后,发展至今,美国红鱼已成为我国重要的养殖鱼类之一[11]。然而,目前美国红鱼的养殖主要以鲜杂鱼虾[12]或其他海水鱼料[13]作为主要喂养食料,有关专用人工配合饲料的研究和开发较滞后[11, 14],其中关于饲料脂肪需求量的研究更少,仅见Williams等[15]和Ellis等[16]有所报道,前者主要以鲱鱼油为脂肪源且饲料脂肪水平在组间的递增梯度达4%,而后者只设了6%和10% 2个脂肪水平,两者设计的脂肪水平跨度都较大,难以对美国红鱼的脂肪需求量作较为准确的衡量。因此,本试验以美国红鱼为研究对象,在较低鱼粉水平下,搭配多种陆生动、植物原料为复合蛋白质源,同时以鱼油、豆油、磷脂油为混合脂肪源,设计5种脂肪水平不同的配合饲料来探究饲料脂肪水平对美国红鱼生长性能、体组成、肝脏组织结构的影响,以期为美国红鱼的营养学研究和人工配合饲料的研制提供参考数据。
1 材料与方法 1.1 试验饲料以25%鱼粉和多种陆生动、植物原料为混合蛋白质源,以鱼油和豆油、磷脂油为脂肪源,配制5种含有47%蛋白质的等氮饲料,饲料脂肪水平梯度增长,其实测水平分别为7.19%、9.17%、10.94%、13.04%和14.20%。所有原料经粉碎过40目筛,按饲料组成比例称重、混合后,使用双螺杆制粒机加工成粒径为2.5 mm的颗粒饲料,自然晾干至水分约为10%,置于-20 ℃冰箱中保存备用。试验饲料组成及营养水平见表1。
| 表1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
养殖试验在珠海市鹤洲北基地进行。试验用美国红鱼取自鹤洲北种苗场。试验鱼苗首先暂养在室外水泥池(4.0 m×3.0 m×1.2 m)中,用经过曝气的自来水兑海水进行淡化适应,养殖用水的盐度由最初的5.0‰逐步淡化为0.5‰,期间使用商用海鲈饲料投喂驯化,暂养4周后进入养殖试验。
试验期间采用室外水泥池挂网箱养殖方式(每个网箱体积为1 m×1 m×1 m),每个饲料设4个重复(网箱),共计20个网箱,每个网箱随机放鱼30尾,初始鱼均重为(19.88±0.26) g。试验期水质条件如下:水温25~32 ℃,溶解氧浓度>6 mg/L,pH 7.5~8.5,氨氮浓度<0.2 mg/L,盐度约为0.5‰;保持微流水,使各试验池水体每天的交换量为100%。采取定量投喂的方式(最初投饲率为4%,之后按摄食情况渐增调整投饲量,记录每箱鱼摄入干物质总量),每天2次,时间分别为06:00和18:00,养殖期共57 d。
1.3 样品的采集养殖试验结束后,禁食24 h,对每个网箱中的试验鱼进行计数并称重,从每个网箱中随机取2尾鱼经冷冻干燥作为全鱼样品;另取5尾鱼分别称重,测量体长和全长;然后解剖,分离内脏团、肝脏、肠系膜脂肪,分别称重;剥取背部白肌烘干作为肌肉样品。同时各网箱取3尾鱼的肝脏,保存到4%中性甲醛固定液中以备切片用。
1.4 指标测定饲料和肌肉水分含量的测定采用105 ℃恒温干燥法,全鱼和肝脏水分含量的测定则采用冷冻干燥法(Unicryo FD5525s,德国);饲料、全鱼、肌肉、肝脏粗蛋白质、粗脂肪、粗灰分含量的测定分别采用凯氏定氮法(FOSS Kjeltec 8400,丹麦)、索氏抽提法(HT6,Tecator AB,瑞典)和马福炉550 ℃灼烧法。肝脏使用石蜡固定之后,采用自动切片机切片(厚度5 μm),苏木精-伊红(HE)染色[17]后,显微镜下观察并拍照。
1.5 计算公式增重率(weight gain ratio,WGR,%)=100×(末均重-初均重)/初均重;
特定生长率(specific growth ratio,SGR,%/d)=100×(ln末均重-ln初均重)/天数;
饲料系数(feed conversion ratio,FCR)=饲料总摄食量/(试验中死鱼重+终末鱼体总重-初始鱼体总重);
蛋白质效率(protein efficiency ratio,PER)=(试验中死鱼重+终末鱼体总重-初始鱼体总重)/(饲料总摄食量×饲料粗蛋白质含量);
存活率(survival rate,SR,%)=100×终末尾数/初始尾数;
肥满度(condition factor,CF,%)=100×体重/体长3;
脏体比(viscerasomatic index,VSI,%)=100×内脏团重/体重;
肝体比(hepatosomatic index,HSI,%)=100×肝脏重/体重;
肠脂比(mesenteric fat index,MFI,%)=100×肠系膜脂肪重/体重。
1.6 数据与统计分析试验所有数据均用4个重复的平均值±标准差(mean±SD)表示,使用SPSS 20.0统计软件进行单因素方差分析(one-way ANOVA),采用LSD和Duncan氏多重比较检验组间差异的显著性,当P<0.05时,表示组间差异显著。
2 结果与分析 2.1 饲料脂肪水平对美国红鱼生长性能和饲料利用的影响饲料脂肪水平对美国红鱼生长性能和饲料利用的影响见表2。7.19%组的末均重、增重率、特定生长率显著高于13.04%、14.20%组(P<0.05),而9.17%、10.94%组与7.19%组无显著性差异(P>0.05)。蛋白质效率随饲料脂肪水平的升高而下降;与之相反,饲料系数则随饲料脂肪水平的升高呈上升趋势,其中7.19%、9.17%组显著低于13.04%、14.20%组(P<0.05),10.94%组亦显著低于14.20%组(P<0.05),而与7.19%、9.17%组差异不显著(P>0.05)。各组的存活率没有显著差异(P>0.05)。
| 表2 饲料脂肪水平对美国红鱼生长性能和饲料利用的影响 Table 2 Effects of dietary lipid level on growth performance and feed utilization of red drum (Sciaenops ocellatus) |
饲料脂肪水平对美国红鱼形态学指标的影响见表3。随着饲料脂肪水平的升高,各组红鱼的脏体比、肝体比、肠脂比基本呈现上升趋势,其中7.19%、9.17%组显著低于13.04%、14.20%组(P<0.05),而10.94%组与7.19%、9.17%组无显著差异(P>0.05)。各组的肥满度无显著差异(P>0.05)。
| 表3 饲料脂肪水平对美国红鱼形态学指标的影响 Table 3 Effects of dietary lipid level on morphological indexes of red drum (Sciaenops ocellatus) |
饲料脂肪水平对美国红鱼体组成的影响见表4。9.17%组的全鱼粗蛋白质含量显著高于10.94%、14.20%组(P<0.05),与其他2组差异不显著(P>0.05)。全鱼、肝脏的粗脂肪含量以7.19%组最低,且随着饲料中脂肪水平的升高呈上 升趋势;肝脏水分含量则随着饲料中脂肪水平的升高逐渐下降,其中7.19%组显著高于其他4组(P<0.05)。各组美国红鱼肌肉水分、粗蛋白质、粗脂肪、粗灰分,全鱼水分、粗灰分及肝脏粗蛋白质含量均无显著差异(P>0.05)。
| 表4 饲料脂肪水平对美国红鱼体组成的影响(湿重基础) Table 4 Effects of dietary lipid level on body composition of red drum (Sciaenops ocellatus) (wet weight basis) |
肝脏组织切片显微观察结果如图1所示。各组的肝细胞出现不同程度的脂肪变性,肝组织受损程度随着饲料脂肪水平的升高而不断加剧。7.19%组,肝组织轻度脂肪变性,尚存部分肝索结构,部分肝细胞形态正常、胞核位于中央,而部分肝细胞胞质内含大小不一的脂滴空泡,肝窦狭窄微充血;脂变程度分级+。9.17%组,肝组织中度脂肪变性,肝索解离,肝细胞明显肿胀、排列较紊乱,细胞核被胞质内油滴挤在一侧,肝窦狭窄重度充血;脂变程度分级++。10.94%和13.04%组,肝组织形态相似,发生重度脂肪变性,肝细胞空泡化肿胀,细胞核进一步被挤压甚至消失,肝窦狭隙充血、炎症细胞浸润,出现嗜酸小体;脂变程度分级+++。14.20%组,肝组织重度脂肪变性,肝细胞溶解,呈弥漫性大片坏死,炎症细胞浸润,存在大量嗜酸小体;脂变程度分级++++[8, 18, 19]。
3 讨 论脂肪是维持鱼类正常生命活动的必需营养素和重要能源物质。饲料中脂肪水平低会导致鱼体代谢紊乱,降低饲料蛋白质利用效率,同时还会引发养殖鱼类必需脂肪酸和脂溶性维生素缺乏症[10];适当地提高饲料脂肪水平则能够有效促进动物生长、降低饲料系数,如Ellis等[16]报道,美国红鱼饲料中添加10%的脂肪比添加6%的脂肪能获得更好的增重、饲料效率、净蛋白质保留和净能量保留。但当饲料中脂肪的添加量超过动物的适宜水平上限往往会不利于其生长,如褐菖鲉(Sebastiscus marmoratus)[20]、吉富罗非鱼(Oreochromis niloticus)[21]、斜带石斑鱼(Epinephelus coioides)[22]、日本鲈(Lateolabrax japonicus)[23]等鱼类的生长都会因为饲料脂肪水平过高而降低。在本试验中,随着饲料脂肪水平的升高,美国红鱼的末均重、增重率、特定生长率总体为下降趋势,其中高脂肪水平组(13.04%~14.20%组)显著低于最低脂肪水平组(7.19%组);而饲料系数则呈现递增趋势,7.19%、9.17%组显著低于13.04%、14.20%组。由此可见,美国红鱼摄食过多的脂肪会减缓生长,降低饲料利用效率。Wang等[24]认为高脂肪水平饲料由于能量过高,会使鱼类降低饲料消耗;甚至会阻碍对其他营养素的吸收利用[16],最终降低鱼类生长。本试验结果亦显示,美国红鱼蛋白质效率随饲料脂肪水平的升高而下降。在大菱鲆(Psetta maxima)[25]和塞内加尔鳎(Solea senegalensis)[26]的研究中也发现提高饲料脂肪水平会增加体组织的脂肪沉积,却不能起到节约蛋白质的作用。纵观本试验5个饲料组的生长情况,前3个组(7.19%、9.17%、10.94%组)生长较优,其生长性能、饲料利用效率虽有所下降,但差异并不显著,此结果与Williams等[15]的研究相近,该学者发现美国红鱼摄食脂肪水平分别为7.4%和11.2%的2种饲料时,鱼体在增重率、饲料转化率和存活率方面都较为理想。但从脂肪来源看,Williams等[15]是采用鲱鱼油为主要脂肪源的,而本文是以鱼油、豆油、磷脂油为复合脂肪源,说明豆油和磷脂油可用于节约鱼油,而对美国红鱼的生长无负面影响。
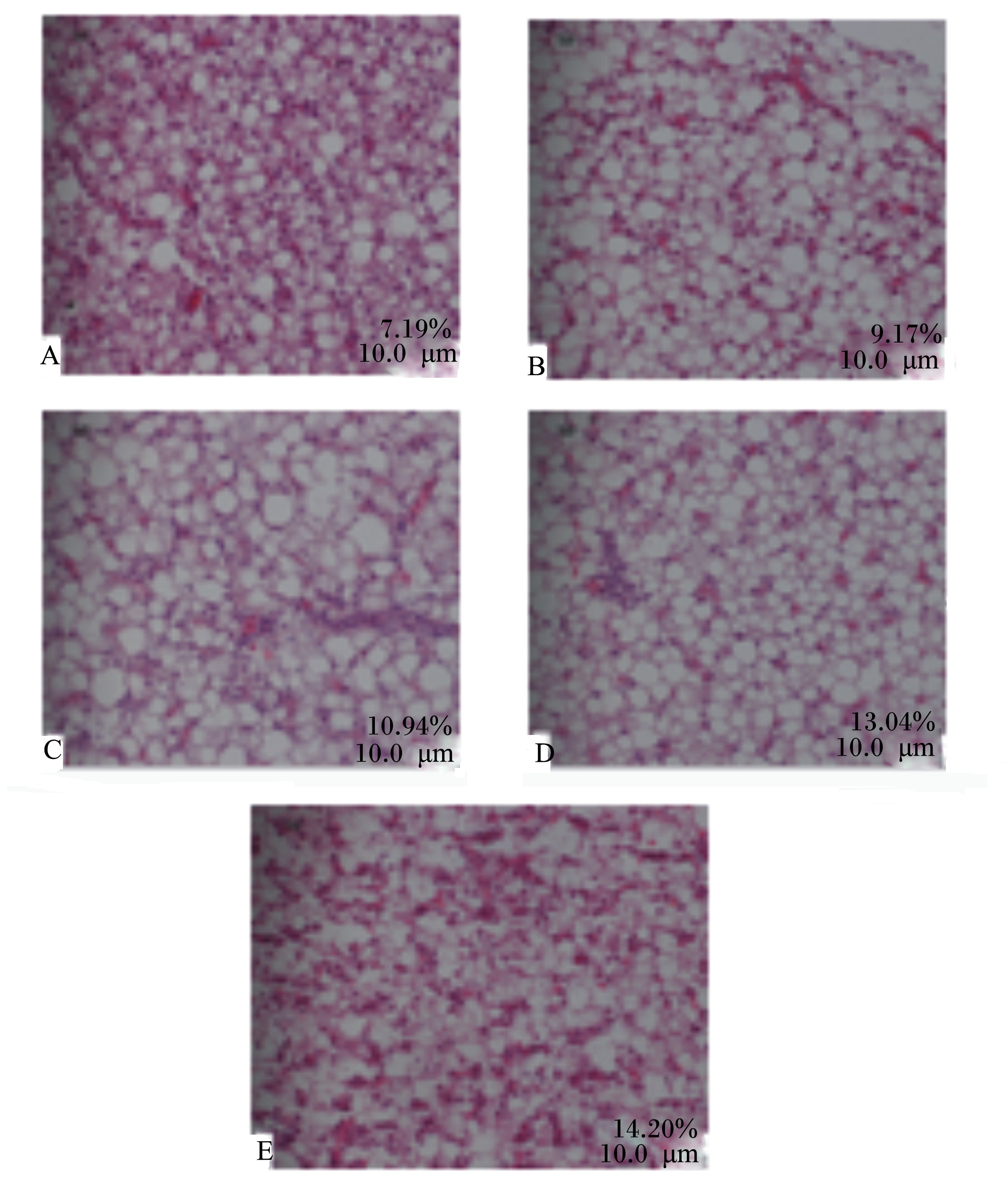 | A:7.19%组 7.19% group;B:9.17%组 9.17% group;C:10.94%组 10.94% group;D:13.04%组 13.04% group;E:14.20%组 14.20% group。图1 美国红鱼肝脏组织切片(HE染色) Fig. 1 Liver tissue slices of red drum (Sciaenops ocellatus) (HE staining,400×) |
饲料中脂肪水平过高会降低鱼类生长,可能归因于蛋白质和脂肪比例不平衡[27],进而引起粗蛋白质与可消化能之间比例的不平衡,同时造成脂肪在肝脏和其他组织中的过量积累[11]。本试验中,在47%蛋白质水平条件下,随着饲料脂肪水平(7.19%~14.20%)、总能(19.78~21.44 kJ/g)、能蛋比(41.46~45.42 kJ/g)的上升,美国红鱼的生长性能不断下降,说明美国红鱼对高脂肪高能量高能蛋比饲料的耐受能力较低,可能是因为在高蛋白质水平饲料中,较少量的脂肪已足以供给动物所需[28],过多的脂肪反而会降低机体对脂质的消化吸收能力,并抑制脂肪酸在体内的重新合成,从而使养殖动物生长速率下降[29]。但Turano等[30]研究发现,145 g以上的美国红鱼能利用更宽范围内的脂肪水平(8%~16%)、能蛋比(34.5~46.7 kJ/g),而对其生长无负面影响,是因为不同生长发育阶段的鱼类对营养的需求有所不同。本试验以20 g美国红鱼为研究对象,当能蛋比为41.46~43.31 kJ/g 时,生长较好;但当脂肪水平达到13.04%以上时,饲料利用能力则显著下降,说明幼稚鱼对饲料营养素、能量水平的要求较为严格。虽然Thoman等[31]建议海水养殖美国红鱼饲料中的蛋白质和脂肪水平分别为44%和9.2%;而刘永坚等[13]在探讨蛋能比水平对美国红鱼生长性能的影响时则认为美国红鱼最适饲料蛋白质水平为46%;但二者所得出的可消化能蛋比(36.48 kJ/g、35.13 kJ/g)较一致,并与刘世禄等[32]测出的美国红鱼肌肉能蛋比(34.07 kJ/g)相近,说明适宜的能蛋比有利于节约蛋白质,从而提升蛋白质保留率[31]。然而,本试验的能蛋比高于此值,一方面是根据养殖条件所设,过往的研究集中在海水、半咸水的养殖环境,本试验是在淡水(盐度仅为0.5‰)条件下进行的,所以能量水平设计较高,以使鱼体有足够的能量代谢应对渗透调节所需[33],然而本试验结果反映,在淡水条件下,美国红鱼亦不需过高的能蛋比。
鱼类对脂肪的利用是有限的,过量增加饲料脂肪水平会造成肝脏、肠道、腹腔和肌肉等体组织脂肪沉积[24]。本试验中,随着饲料脂肪水平的升高,美国红鱼的脏体比、肝体比、肠脂比在脂肪水平最高的2组(13.04%、14.20%组)较脂肪水平最低的组(7.19%组)出现显著性变大,说明饲料脂肪水平超过某一限度就显著影响美国红鱼鱼体形态。各组鱼体组成结果显示,美国红鱼的全鱼和肝脏粗脂肪含量随饲料脂肪水平的升高而升高,结合形态指标的变化,认为是肝脏脂肪及肠系膜脂肪的积累造成了内脏团的增大、全鱼粗脂肪含量的增加;而各组肌肉粗脂肪含量都很低,这与刘世禄等[32]对美国红鱼肌肉的营养组成分析结果一致。张春暖等[34]对梭鱼(Chelon haematocheilus)的研究结果也与本试验相似,鱼体脂肪主要沉积在肝脏组织中,而肌肉粗脂肪含量不受饲料脂肪水平的影响,这可能是由于某些鱼类肌肉组织储存脂肪的能力相对较弱[35]。肝脏则是鱼类脂肪代谢的重要器官,鱼类摄食过多的脂肪,会导致肝脏中脂肪细胞体积增大、数量增多,进而使肝脏组织容纳更多的脂肪,最终造成肝体比升高、肝脏粗脂肪含量增加[9]。在本试验取样过程、解剖中发现,大部分美国红鱼肝脏肿大、肝色苍白、肝体比增加;并且,在肝组织切片显微观察中,肝细胞具有不同程度肿胀、脂肪浸润、脂滴空泡增大增多、细胞核偏移等现象,发生了营养型脂肪肝[36],其受损程度随着饲料脂肪水平的升高而不断加剧。冯健等[8]也发现4%、8%的饲料脂肪水平即可使红姑鱼肝细胞发生中度脂肪病变,且达到12%就会引发重度病变。Mandrioli等[26]对塞内加尔鳎肝组织超微结构的观察同样发现,高脂饲料会导致鱼体肝脏脂肪沉积加重。实际上,基于当前鱼类固有的生理机制,在快速高效、集约化的现代水产养殖模式下,鱼类脂肪肝频发、高发、易发成为一种常见现状,高脂饲料往往会导致脂肪在体内尤其是肝脏内大量沉积,损伤肝脏代谢功能[36],降低鱼体抗病能力[10],严重危害鱼体健康。因此,在人工配合饲料的研发过程中,必须对脂肪的添加量作较精确的衡量。
4 结 论本试验中,随着饲料脂肪水平的升高,美国红鱼的生长性能、饲料利用率逐渐下降,全鱼、肝脏的粗脂肪含量则逐渐升高,同时发生肝细胞脂肪变性的程度也不断加剧。综合上述结果,在本试验条件下,建议美国红鱼配合饲料中脂肪水平不宜超过11%,且推荐水平为7.19%~9.17%。
| [1] | TACON A G J,METIAN M.Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds:trends and future prospects[J]. Aquaculture,2008,285(1/2/3/4):146-158. ( 1) 1)
|
| [2] | NAYLOR R L,HARDY R W,BUREAU D P,et al.Feeding aquaculture in an era of finite resources[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(36):15103-1511. ( 1) 1)
|
| [3] | 艾春香,陶青燕.鱼粉替代——鱼粉高价运行下水产配合饲料研发的技术对策[J]. 饲料工业,2013,34(10):1-7. ( 1) 1)
|
| [4] | 董纯,周慧慧,麦康森,等.复合蛋白源替代鱼粉对大菱鲆生长、体组成和表观消化率的影响[J]. 中国海洋大学学报:自然科学版,2015,45(4):27-34. ( 1) 1)
|
| [5] | WATSON A M,BUENTELLO A,PLACE A R.Partial replacement of fishmeal,poultry by-product meal and soy protein concentrate with two non-genetically modified soybean cultivars in diets for juvenile cobia,Rachycentron canadum[J]. Aquaculture,2014,434:129-136. ( 1) 1)
|
| [6] | KARALAZOS V,BENDIKSEN E Å,BELL J G.Interactive effects of dietary protein/lipid level and oil source on growth,feed utilisation and nutrient and fatty acid digestibility of Atlantic salmon[J]. Aquaculture,2011,311(1/2/3/4):193-200. ( 1) 1)
|
| [7] | 陈乃松,肖温温,梁勤朗,等.饲料中脂肪与蛋白质比对大口黑鲈生长、体组成和非特异性免疫的影响[J]. 水产学报,2012,36(8):1270-1280. ( 1) 1)
|
| [8] | 冯健,贾刚.饵料中不同脂肪水平诱导红姑鱼脂肪肝病的研究[J]. 水生生物学报,2005,29(1):61-64. ( 3) 3)
|
| [9] | 覃川杰,陈立侨,李二超,等.饲料脂肪水平对鱼类生长及脂肪代谢的影响[J]. 水产科学,2013,32(8):485-491. ( 2) 2)
|
| [10] | 李爱杰.水产动物营养与饲料学[M]. 北京:中国农业出版社,1994:39. ( 3) 3)
|
| [11] | 邓锦锋,王安利.美国红鱼营养研究进展[J]. 水利渔业,2006,26(2):75-78. ( 3) 3)
|
| [12] | 黎文辉.浅谈美国红鱼海水养殖技术[J]. 北京农业,2012(4):46-47. ( 1) 1)
|
| [13] | 刘永坚,刘栋辉,田丽霞,等.饲料蛋白质和能量水平对红姑鱼生长和鱼体组成的影响[J]. 水产学报,2002,26(3):242-246. ( 2) 2)
|
| [14] | 周立斌,王树齐,张海发.饲料维生素C对美国红鱼(Sciaenops ocellatus)生长、免疫的影响[J]. 海洋与湖沼,2013,44(4):1108-1114. ( 1) 1)
|
| [15] | WILLIAMS C D,ROBINSON E H.Response of red drum to various dietary levels of menhaden oil[J]. Aquaculture,1988,70(1/2):107-120. ( 3) 3)
|
| [16] | ELLIS S C,REIGH R C.Effects of dietary lipid and carbohydrate levels on growth and body composition of juvenile red drum,Sciaenops ocellatus[J]. Aquaculture,1991,97(4):383-394. ( 3) 3)
|
| [17] | 李秋静.病理组织学诊断检材的制备技术[J]. 中外健康文摘,2011,8(19):186-187. ( 1) 1)
|
| [18] | 宋宝萍,路建平,宋伯根.病理组织学实习图谱[M]. 昆明:云南科技出版社,2000:3-4,88-96. ( 1) 1)
|
| [19] | 刘嵩,卢笑丛,葛建,等.高脂所致脂肪肝动物模型建立的动态研究[J]. 中国药理学通报,2006,22(11):1399-1402. ( 1) 1)
|
| [20] | 岳彦峰,彭士明,施兆鸿,等.饲料脂肪水平对褐菖鲉生长、肠道消化酶及主要脂代谢酶活力的影响[J]. 南方水产科学,2012,8(6):50-56. ( 1) 1)
|
| [21] | 王爱民,韩光明,封功能,等.饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响[J]. 水生生物学报,2011,35(1):80-87. ( 1) 1)
|
| [22] | 董晓慧,杨俊江,谭北平,等.幼鱼和养成阶段斜带石斑鱼对饲料中脂肪的需要量[J]. 动物营养学报,2015,27(1):133-146. ( 1) 1)
|
| [23] | LUO G,XU J H,TENG Y J,et al.Effects of dietary lipid levels on the growth,digestive enzyme,feed utilization and fatty acid composition of Japanese sea bass (Lateolabrax japonicus L.) reared in freshwater[J]. Aquaculture Research,2010,41(2):210-219. ( 1) 1)
|
| [24] | WANG J T,LIU Y J,TIAN L X,et al.Effect of dietary lipid level on growth performance,lipid deposition,hepatic lipogenesis in juvenile cobia (Rachycentron canadum)[J]. Aquaculture,2005,249(1/2/3/4):439-447. ( 2) 2)
|
| [25] | SEVGILI H,KURTOLU A,OIKAWA M,et al.High dietary lipids elevate carbon loss without sparing protein in adequate protein-fed juvenile turbot (Psetta maxima)[J]. Aquaculture International,2014,22(2):797-810. ( 1) 1)
|
| [26] | MANDRIOLI L,SIRRI R,GATTA P P,et al.Histomorphologic hepatic features and growth performances of juvenile Senegalese sole (Solea senegalensis) fed isogenertic practical diets with variable protein/lipid levels[J]. Journal of Applied Ichthyology,2012,28(4):628-632. ( 2) 2)
|
| [27] | MOHANTA K N,MOHANTY S N,JENA J K,et al.Optimal dietary lipid level of silver barb,Puntius gonionotus fingerlings in relation to growth,nutrient retention and digestibility,muscle nucleic acid content and digestive enzyme activity[J]. Aquaculture Nutrition,2008,14(4):350-359. ( 1) 1)
|
| [28] | MA X,HU Y,WANG X Q,et al.Effects of practical dietary protein to lipid levels on growth,digestive enzyme activities and body composition of juvenile rice field eel (Monopterus albus)[J]. Aquaculture International,2014,22(2):749-760. ( 1) 1)
|
| [29] | 朱卫,刘鉴毅,庄平,等.饲料脂肪水平对点篮子鱼生长和体成分的影响[J]. 海洋渔业,2013,35(1):65-71. ( 1) 1)
|
| [30] | TURANO M J,DAVIS D A,ARNOLD C R.Optimization of growout diets for red drum,Sciaenops ocellatus[J]. Aquaculture Nutrition,2002,8(2):95-101. ( 1) 1)
|
| [31] | THOMAN E S,DAVIS D A,ARNOLD C R.Evaluation of growout diets with varying protein and energy levels for red drum (Sciaenops ocellatus)[J]. Aquaculture,1999,176(3/4):343-353. ( 2) 2)
|
| [32] | 刘世禄,王波,张锡烈,等.美国红鱼的营养成分分析与评价[J]. 海洋水产研究,2002,23(2):25-32. ( 2) 2)
|
| [33] | CRAIG S R,NEILL W H,GATLIN D M,Ⅲ.Effects of dietary lipid and environmental salinity on growth,body composition,and cold tolerance of juvenile red drum (Sciaenops ocellatus)[J]. Fish Physiology and Biochemistry,1995,14(1):49-61. ( 1) 1)
|
| [34] | 张春暖,王爱民,刘文斌,等.饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响[J]. 中国水产科学,2013,20(1):108-115. ( 1) 1)
|
| [35] | NANTON D A,LALL S P,MCNIVEN M A.Effects of dietary lipid level on liver and muscle lipid deposition in juvenile haddock,Melanogrammus aeglefinus L.[J]. Aquaculture Research,2001,32(S1):225-234. ( 1) 1)
|
| [36] | 杜震宇.养殖鱼类脂肪肝成因及相关思考[J]. 水产学报,2014,38(9):1628-1638. ( 2) 2)
|




