2. 甘肃省肉羊繁育 生物技术工程实验室, 民勤 733300;
3. 甘肃农业大学动物科技学院, 兰州 730070
2. Gansu Province Mutton Sheep Breeding Biotechnology Engineering Laboratory, Minqin 733300, China;
3. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China
实时定量PCR(RT-PCR)是继Northern印迹杂交、原位杂交和RNA保护酶技术之后发展起来的一种新的mRNA表达定量方法,与之前的技术相比具有准确、高效、重复性好等特点。在相对定量中选取表达稳定的管家基因作为内参基因,可以校正不同样品因RNA质量、反转录效率的差异而造成的定量结果差异[1]。但是,常见的内参基因在不同的组织和不同生理状态下表达并不稳定[2, 3],如没有针对试验要求进行内参基因的稳定性检验,目的基因的表达有可能被错估。
近年来,利用相对定量方法研究黏膜免疫及转运功能的文章发表较多(表1)[4, 5, 6, 7, 8, 9, 10]。由表1可知,甘油醛-3-磷酸脱氢酶(GAPDH)、磷酸甘油酸激酶1(PGK1)、18S rRNA和β-肌动蛋白(ACTB)基因是研究胃肠道黏膜常用的内参基因,但是尚未有文献报道这些内参在湖羊小肠黏膜内表达是否稳定,有待研究。
| 表1 黏膜基因相对定量常用内参基因 Table 1 Common reference genes used in relative quantification of mucosal genes |
小肠黏膜具有营养物质吸收、转运及免疫屏障等功能[11],研究肠黏膜有助于了解营养物质吸收转运、肠道功能及肠内环境稳态的维持过程。生产中,羔羊一般在42和84日龄进行饲粮过渡(由母乳或代乳料向开食料过渡,由开食料向育肥料过渡),营养素是影响肠道发育与功能建立的关键因素,导致小肠黏膜形态、结构与转运功能在该时间点变化较大[12],但该阶段稳定表达的内参基因有哪些尚不清楚。因此,本试验利用RT-PCR法,检测候选内参基因GAPDH、PGK1、18S rRNA和ACTB在42和84日龄湖羊公羔小肠黏膜中表达稳定性,筛选出适用于湖羊小肠黏膜RT-RCR内参基因。
1 材料与方法 1.1 试验材料选用金昌中天羊业纯种湖羊公羔6只随母补饲,7日龄开始补饲开食料,56日龄断奶,继续饲喂开食料至60日龄逐渐更换生长料,过渡期10 d。分别于42和84日龄颈静脉放血各屠宰3只,解剖腹部后棉线结扎分离十二指肠、空肠、回肠,去除食糜后用载玻片刮取各小肠肠段黏膜,迅速置于液氮冷冻,-80 ℃冰箱保存备用。
试验中所用到的仪器有Nanodrop核酸分析仪(Thermo,美国),FlexCycler2 PCR仪(Biometra,德国),Bio-Rad CFX96TM Real-Time System(Bio-Rad,美国)。
试验中所用到的试剂药品TriZol试剂盒(TransZol)、反转录试剂盒(TransScript one-step gDNA Removal and cDNA Synthesis SuperMix)以及定量试剂盒(TransStart Top Green qPCR SuperMix)均由北京全式金生物技术有限公司生产。
1.2 总RNA提取及cDNA第1条链合成将小肠黏膜样于研钵内加液氮磨碎后,取粉样0.10 g,加入1 mL TransZol颠倒混匀,室温静置5 min,加入200 μm氯仿颠倒混匀,静置3 min,4 ℃离心(10 000×g)10 min,取上清液500 μL于新离心管内,加入预冷异丙醇500 μL,静置10 min后4 ℃离心(1 000×g),弃上清,用75%乙醇洗涤RNA沉淀后,加60 μL 0.1%焦碳酸二乙酯(DEPC)水溶解。所得RNA样品利用Nanodrop核酸分析仪测定OD260 nm/OD280 nm检测RNA纯度和浓度,1%琼脂糖凝胶电泳检测18S与28S条带清晰,无杂质污染。
cDNA第1条链按照TransScript one-step gDNA Removal and cDNA Synthesis SuperMix说明合成,反应体系为:模板1 μL,Oligo(d)T 1 μL,gDNA Remover 1 μL,2×TS Reaction Mix 10 μL,无RNA酶水补足20 μL。FlexCycler2 PCR仪反应条件为:42 ℃持续30 min,85 ℃持续5 min。反应结束后利用GAPDH引物扩增,反应体系为:模板1 μL,上、下游引物各0.8 μL,Super mix 12.5 μL,ddH2O补足25 μL 。反应条件为:94 ℃预变性30 s;94 ℃变性15 s,56 ℃退火20 s,72℃延伸15 s, 25个循环。1%琼脂糖凝胶电泳检测目的片段清晰,无杂质污染,表明样品反转成功。cDNA样按照OD计算稀释至同一浓度后-20 ℃保存备用。
1.3 候选管家基因及引物设计候选基因GAPDH、PGK1、18S rRNA、ACTB引物通过Primer 6.0软件设计。经1%琼脂糖凝胶电泳检测,扩增片段特异性好,无引物二聚体(图1)。引物由上海生工合成,信息见表2。
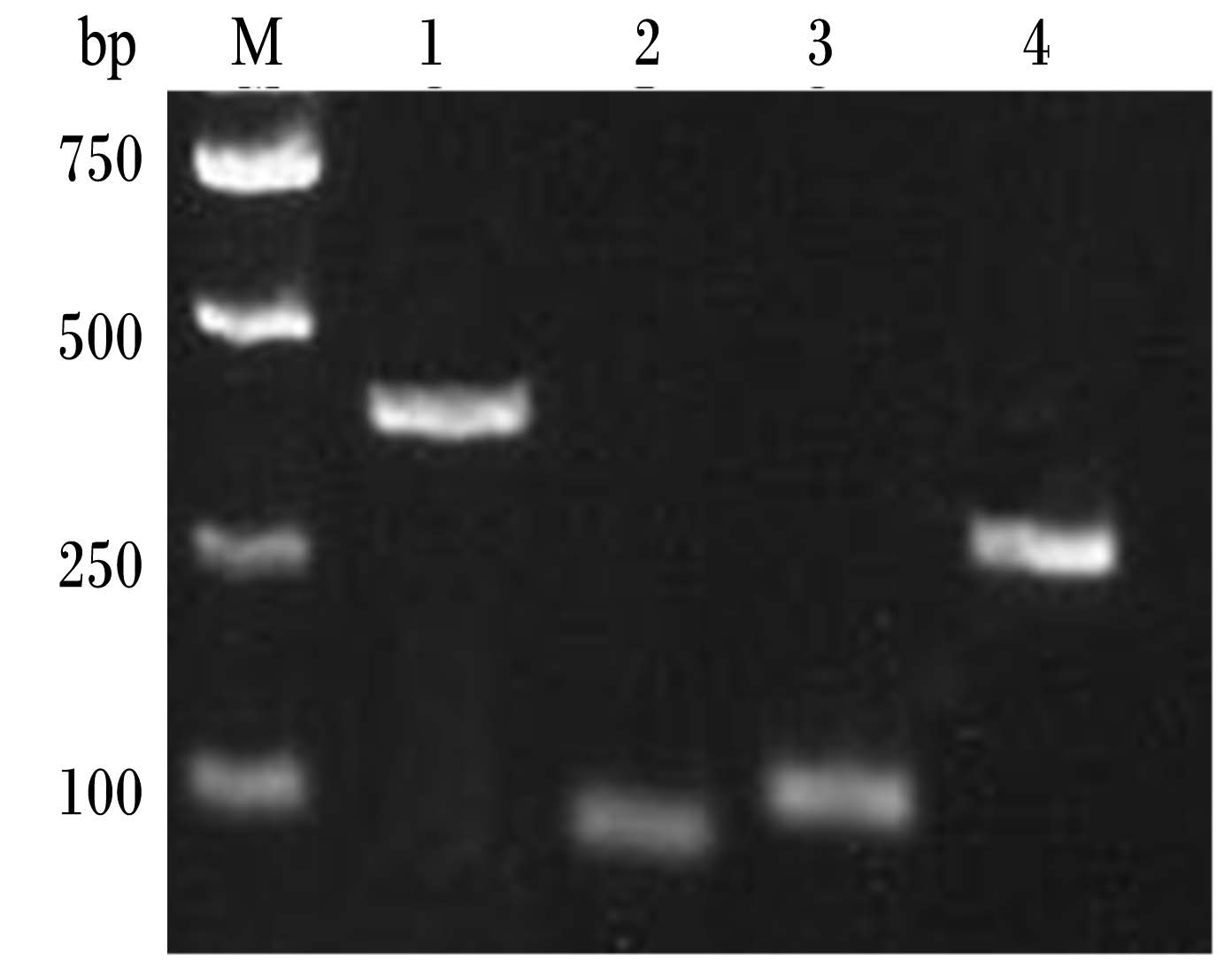 | M:DNA 分子质量标准DNA molecular maker;1:甘油醛-3-磷酸脱氢酶GAPDH;2:磷酸甘油酸激酶1 PGK1;3:18S rRNA;4:β-肌动蛋白ACTB。图1 候选管家基因引物特异性扩增 Fig. 1 The specific amplification of candidate housekeeping gene primers |
| 表2 候选管家基因引物信息 Table 2 Primer information of candidate housekeeping genes |
RT-PCR在Bio-Rad CFX96TM Real-Time System进行。反应体系按TransStart Top Green qPCR SuperMix说明进行,反应体系为:模板1 μL,2×TransStart Top Green qPCR SuperMix 10 μL,上、下游引物各0.4 μL,ddH2O补足20 μL。反应条件为:94 ℃预变性30 s;94 ℃变性15 s,63 ℃退火20 s,72 ℃延伸15 s,41个循环。从56~95 ℃,每循环增加0.5 ℃,持续0.05 s获得解链温度,采集 熔解曲线荧光信号。
1.5 标准曲线的绘制和引物扩增效率验证将稀释至相同浓度的cDNA模板按1、1/5、1/25、1/125、1/625倍连续稀释5个梯度,每个梯度3个技术重复,利用CFX ManagerTM Software分析计算相关系数、斜率、扩增效率,详见表3。
| 表3 候选管家基因标准曲线相关系数、斜率、扩增效率 Table 3 R2,slope and amplification efficiency of standard curves of candidate housekeeping genes |
引物扩增效率计算方程式如下:
候选管家基因表达的稳定性利用ΔCt法[13]、geNorm软件[14]、BestKeeper软件[15]进行分析和评价。
2 结 果 2.1 不同小肠肠段和日龄Ct的比较Ct越小,基因的表达丰度越高,反之,基因表达丰度越低。由图2和图3可知,18S rRNA的表达丰度是4个候选基因中最高的,GAPDH和ACTB较低,PGK1居中。在不同的小肠肠段黏膜中,PGK1和ACTB表达较为稳定,不同日龄4个候选基因的表达都较稳定,以ACTB为最。
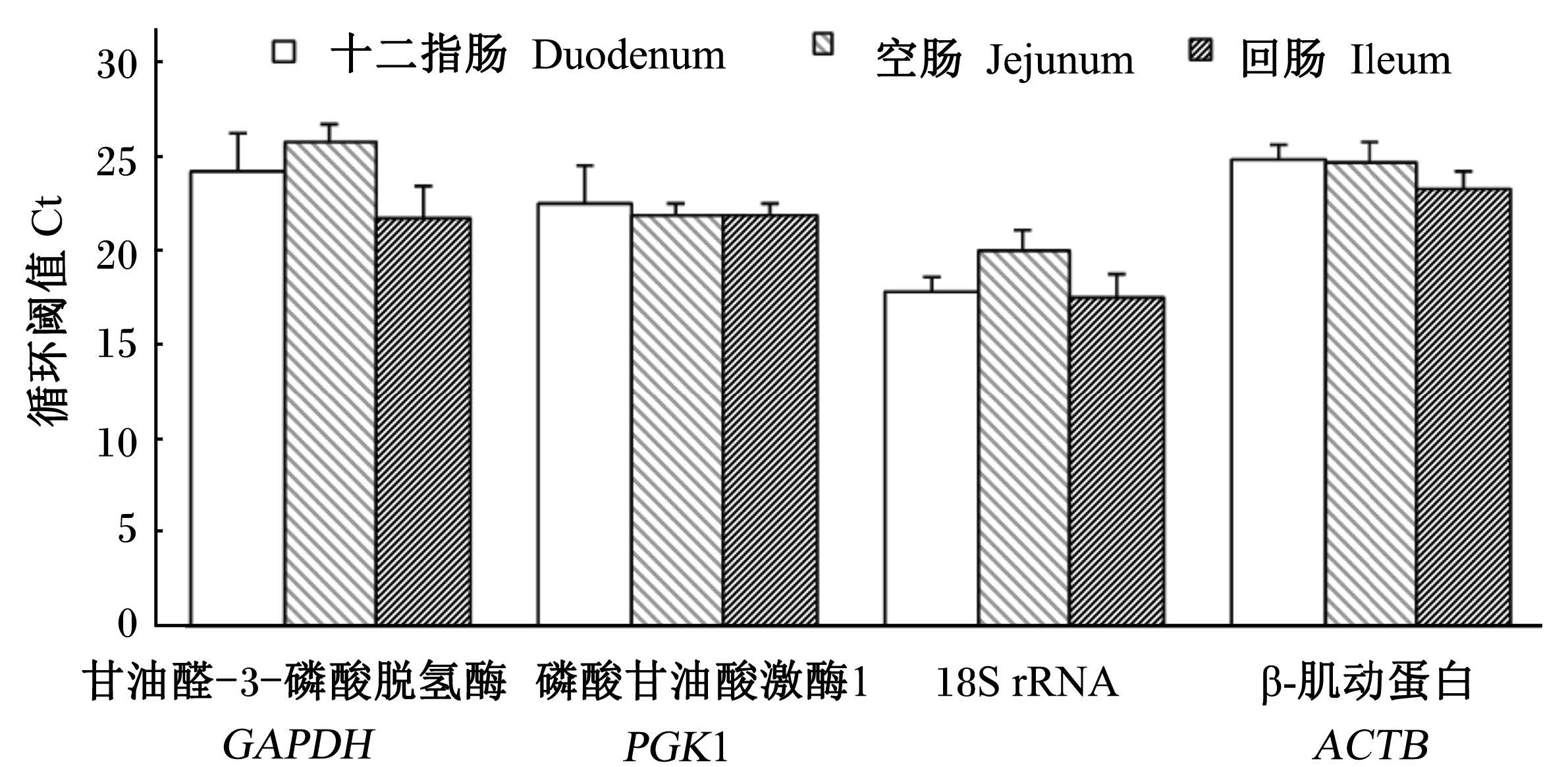 | 图2 候选管家基因在不同小肠肠段的黏膜中Ct的比较 Fig. 2 Comparison of Ct of candidate mucosal housekeeping genes in small intestinal tract compartments |
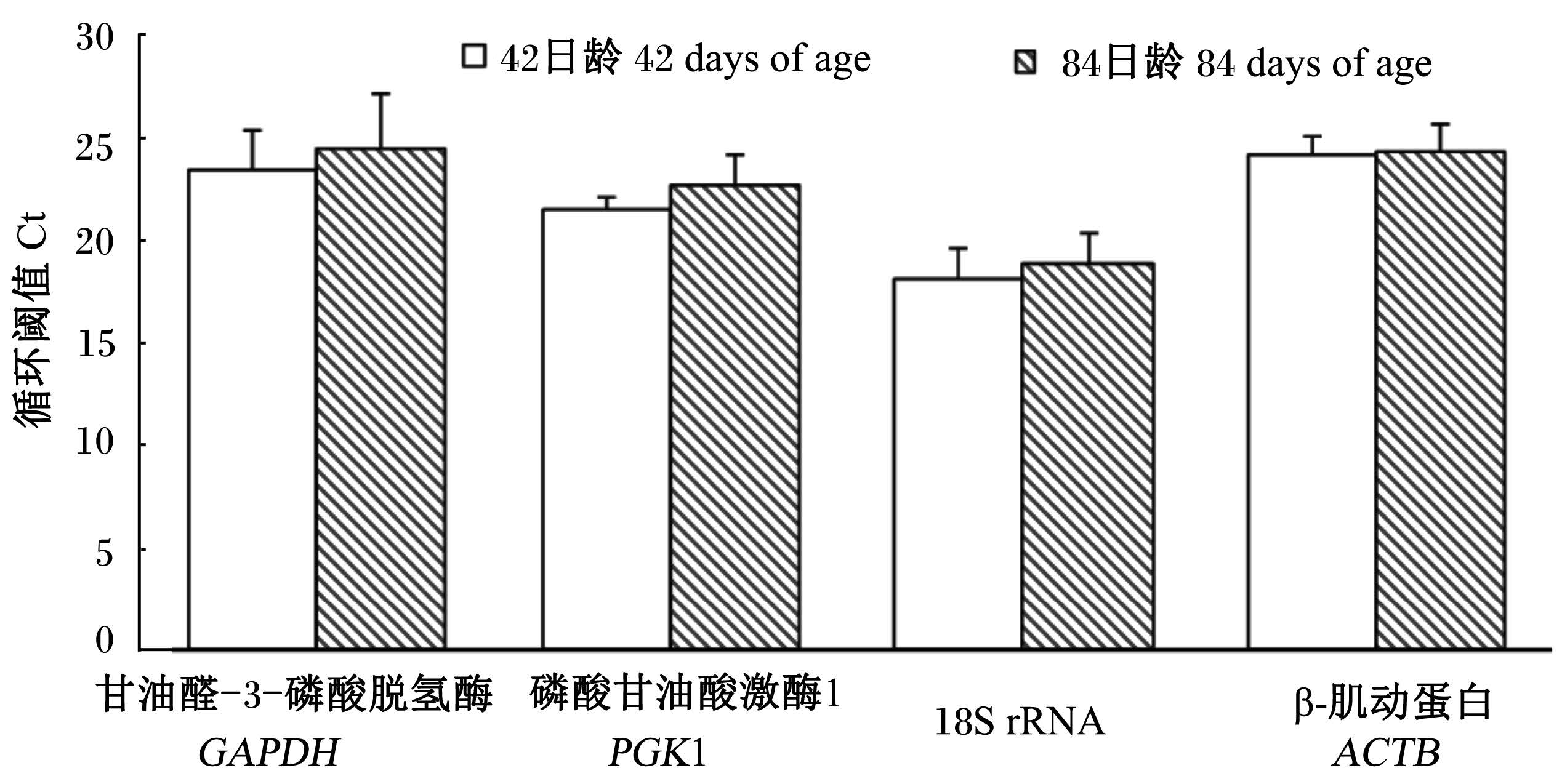 | 图3 候选管家基因在不同日龄的小肠黏膜中Ct比较 Fig. 3 Comparison of Ct of candidate mucosal housekeeping genes in small intestine at different days of age |
由表4可知,geNorm软件M值得出稳定性排名为ACTB=PGK1>GAPDH>18S rRNA,ΔCt法得出排名为ACTB>PGK1>18S rRNA>GAPDH、平均标准差排名为ACTB>18S rRNA>PGK1>GAPDH。
| 表4 geNorm软件、ΔCt法分析候选管家基因稳定性排序 Table 4 Stability ranking of the candidate housekeeping genes by geNorm software and ΔCt method |
由表5可知,根据变异系数可以看出,BestKeeper软件分析内参表达稳定性排序为PGK1=ACTB>18S rRNA>GAPDH。
| 表5 BestKeeper软件分析候选管家基因稳定性(表达丰度交叉点) Table 5 Stability of candidate housekeeping genes by BestKeeper software (cross points of expression level) |
在肠隐窝中存在大量多功能干细胞保证肠黏膜细胞快速持续更新,新生肠上皮细胞在向绒毛层迁移的过程中逐渐分化成熟,最终死亡脱落进入消化管内[11]。针对隐窝干细胞及黏膜功能细胞的研究有助于肠道疾病的治疗及肠道功能机理的揭示,目前大量肠道分子机理研究都应用了RT-PCR技术[4, 5, 6, 7, 8, 9, 10],涉及到黏膜这类含多种组织的器官时,选择表达稳定的内参基因至关重要。
目前用于筛选内参基因常用的软件有geNorm软件、BestKeeper软件以及ΔCt法等。geNorm软件录入的数据为相对表达丰度(2-ΔCt,ΔCt为每个基因不同样本Ct与其中最小Ct之差),M值是单个内参基因与其他内参基因表达丰度的两两比值后的对数变换从而计算出的平均标准差,M值越小稳定性越好;BestKeeper软件计算得出表达丰度交叉点(CP)的平均值、最大值、最小值、标准差及变异系数,CP的标准差和变异系数越小,内参基因表达越稳定,反之越不稳定。此外BestKeeper软件还可以录入目标基因的Ct数据,对内参基因和目标基因进行单独分析;ΔCt法通过计算各内参之间的平均标准差,对内参基因表达稳定性进行排序,标准差越小稳定性越好。理想的内参基因应在不同类型细胞中稳定表达,且不受内外源因素影响,常见的内参基因在不同的试验条件下表达稳定性差异较大[16, 17],本试验中发现4种候选基因在小肠各段间以及不同时间点上的表达稳定性存在差异,3种方法计算的候选基因稳定性排名各不相同,但ACTB排名均靠前。
GAPDH和PGK1是糖酵解及糖异生过程中的关键酶基因,是常见的内参基因,但是,在特殊条件下作为内参存在缺陷。黏膜细胞供能主要依靠谷氨酰胺(Gln)、谷氨酸(Glu)和天冬氨酸(Asp)氧化[18, 19],本试验中GAPDH在不同肠段内表达丰度并不稳定,3种内参稳定性分析法得出GAPDH稳定性排名均较次可能与此有关。PGK1在本试验中表达较稳定,但是该基因在胰腺导管腺癌[20]、结肠癌[21]等多种癌变细胞中表达丰度升高,且该基因在肠道炎症病变条件下表达不稳定[22]。
18S rRNA合成调节独立于mRNA,一般情况下其表达丰度较稳定,但是在有丝分裂时期,18S rRNA表达丰度会降低[23]。本试验中,42~84日龄是小肠快速发育时期,其在不同肠段上表达存在较大差异,可能与发育过程中有丝分裂强弱有关。此外,18S rRNA的表达丰度高,Ct较低,与目标基因的ΔCt较大,也是其作为内参基因的缺陷[2]。
ACTB是组成细胞的骨架蛋白,在真核细胞中表达稳定[24],但是也有报道指出,其在成纤维细胞[25],仔猪的心脏、肝脏、脾脏[26],山羊的肝脏、皮下脂肪和背最长肌中表达稳定性较差[27]。在本试验中,ACTB在各肠段各时间点上表达最稳定,在3种不同分析方法下排名也最稳定。董晓丽等[28]通过筛选幼龄小鼠肠道内参后发现,幼龄小鼠小肠发育过程中,ACTB的稳定性高于GAPDH,这与本试验结果相同。
本试验羔羊均从56日龄断奶,7日龄开始补饲开食料,60日龄逐渐更换生长料,内参基因表达稳定性是否与断奶日龄及饲粮有关有待进一步研究;本试验仅选取28和84日龄湖羊羔羊小肠黏膜样品检验内参表达稳定性,ACTB是否适用于湖羊整个生理阶段有待证明。
4 结 论综上,利用RT-PCR研究湖羊小肠黏膜的内参基因最佳选择为ACTB,其次为PGK1。18S rRNA和GAPDH表达的稳定性较差,不适宜作为小肠黏膜研究内参基因。
| [1] | GINZINGER D G.Gene quantification using real-time quantitative PCR:an emerging technology hits the mainstream[J]. Experimental Hematology, 2002, 30(6):503-512. ( 1) 1)
|
| [2] | ZHENG W J, SUN L.Evaluation of housekeeping genes as references for quantitative real time RT-PCR analysis of gene expression in Japanese flounder (Paralichthys olivaceus)[J]. Fish & Shellfish Immunology, 2011, 30(2):638-645. ( 2) 2)
|
| [3] | WANG E L, WANG K Y, CHEN D F, et al.Evaluation and selection of appropriate reference genes for real-time quantitative PCR analysis of gene expression in Nile Tilapia (Oreochromis niloticus) during vaccination and infection[J]. International Journal of Molecular Sciences, 2015, 16(5):9998-10015. ( 1) 1)
|
| [4] | HIROSHI O, TAKADA K, SUNDEN Y, et al.CD4+ T cell cytokine gene and protein expression in duodenal mucosa of dogs with inflammatory bowel disease[J]. The Journal of Veterinary Medical Science, 2014, 76(3):409-414. ( 3) 3)
|
| [5] | WATERS S M, KEOGH K, BUCKLEY F, et al.Effect of genotype on duodenal expression of nutrient transporter genes in dairy cows[J]. Journal of Animal Science and Biotechnology, 2013, 4:49-58. ( 3) 3)
|
| [6] | 欧阳五庆.动物生理学[M]. 北京:科学出版社, 2010. ( 3) 3)
|
| [7] | 王彩莲.0-56日龄放牧绵羊消化系统发育变化的研究[D]. 博士学位论文.兰州:甘肃农业大学, 2009. ( 3) 3)
|
| [8] | SAPONE A, LAMMERS K M, CASOLARO V, et al.Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions:celiac disease and gluten sensitivity[J]. BMC Medicine, 2011, 9:23. ( 3) 3)
|
| [9] | LUNDGREN A, STRÖMBERG E, SJÖLING Ä, et al.Mucosal FOXP3-expressing CD4+ CD25 high regulatory T cells in helicobacter pylori-infected patients[J]. Infection and Immunity, 2005, 73(1):523-531. ( 3) 3)
|
| [10] | GRIGORYAN M, KEDEES M H, CHARRON M J, et al.Regulation of mouse intestinal L cell progenitors proliferation by the glucagon family of peptides[J]. Endocrinology, 2012, 153(7):3076-3088. ( 3) 3)
|
| [11] | BALLENT M, WILKENS M R, MATÉ L, et al.P-glycoprotein in sheep liver and small intestine:gene expression and transport efflux activity[J]. Journal of Veterinary Pharmacology and Therapeutics, 2013, 36(6):576-582. ( 2) 2)
|
| [12] | JIANG R, SHI Z G, JOHNSON J J, et al.Kallikrein-5 promotes cleavage of desmoglein-1 and loss of cell-cell cohesion in oral squamous cell carcinoma[J]. Journal of Biological Chemistry, 2011, 286(11):9127-9135. ( 1) 1)
|
| [13] | SILVER N, BEST S, JIANG J, et al.Selection of housekeeping genes for gene expression studies in human reticulocytes using real-time PCR[J]. BMC Molecular Biology, 2006, 7:33. ( 1) 1)
|
| [14] | VANDESOMPELE J, De PRETER K, PATTYN F, et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology, 2002, 3(7):RESEARCH0034. ( 1) 1)
|
| [15] | PFAFFL M W, TICHOPAD A, PRGOMET C, et al.Determination of stable housekeeping genes, differentially regulated target genes and sample integrity:bestkeeper-excel-based tool using pair-wise correlations[J]. Biotechnology Letters, 2004, 26(6):509-515. ( 1) 1)
|
| [16] | SCHMITTGEN T D, ZAKRAJSEK B A.Effect of experimental treatment on housekeeping gene expression:validation by real-time, quantitative RT-PCR[J]. Journal of Biochemical and Biophysical Methods, 2000, 46(1-2):69-81. ( 1) 1)
|
| [17] | LEE M A, GUO R Y, EBENEZER V, et al.Evaluation and selection of reference genes for ecotoxicogenomic study of the green alga Closterium ehrenbergii using quantitative real-time PCR[J]. Ecotoxicology, 2015, 24(4):863-872. ( 1) 1)
|
| [18] | FINCH L R, HIRD F J R.The uptake of amino acids by isolated segments of rat intestine Ⅱ.A survey of affinity for uptake from rates of uptake and competition for uptake[J]. Biochimica et Biophysica Acta, 1960, 43:278-287. ( 1) 1)
|
| [19] | RAO R,CHAUDHRY K.Glutamine protects GI epithelial tight junctions[M]//RAJENDRAM R,PREEDY V R,PATEL V B.Glutamine in clinical nutrition.New York:Springer,2015:323-337. ( 1) 1)
|
| [20] | PROFESSOR T L H, LIANG Y, CHIEN K-Y, et al.Overexpression and elevated serum levels of phosphoglycerate kinase 1 in pancreatic ductal adenocarcinoma[J]. Proteomics, 2006, 6(7):2259-2272. ( 1) 1)
|
| [21] | ZIEKER D, KÖNIGSRAINER I, TRITSCHLER I, et al.Phosphoglycerate kinase 1 a promoting enzyme for peritoneal dissemination in gastric cancer[J]. International Journal of Cancer, 2010, 126(6):1513-1520. ( 1) 1)
|
| [22] | KRZYSTEK-KORPACKA M, DIAKOWSKA D, BANIA J, et al.Expression stability of common housekeeping genes is differently affected by bowel inflammation and cancer:implications for finding suitable normalizers for inflammatory bowel disease studies[J]. Inflammatory Bowel Diseases, 2014, 20(7):1147-1156. ( 1) 1)
|
| [23] | LOSSOS I S, CZERWINSKI D K, WECHSER M A, et al.Optimization of quantitative real-time RT-PCR parameters for the study of lymphoid malignancies[J]. Leukemia, 2003, 17(4):789-795. ( 1) 1)
|
| [24] | 董恩妮, 梁青, 李利, 等.实时荧光定量PCR内参基因的选择[J]. 中国畜牧杂志, 2013, 49(11):92-96. ( 1) 1)
|
| [25] | 王子东.亚麻脂肪酸去饱和酶基因FAD3B表达载体构建、鉴定与表达研究及牛转基因细胞中内参基因稳定性评价[D]. 硕士学位论文.呼和浩特:内蒙古大学, 2012. ( 1) 1)
|
| [26] | 台玉磊, 韩立强, 杨国庆, 等.仔猪组织基因表达中实时定量PCR内参基因的选择[J]. 农业生物技术学报, 2010, 18(4)732-736. ( 1) 1)
|
| [27] | NAJAFPANAH M J, SADEGHI M, BAKHTIARIZADEH M R.Reference genes selection for quantitative real-time PCR using RankAggreg method in different tissues of capra hircus[J]. PLoS One, 2013, 8(12):e83041. ( 1) 1)
|
| [28] | 董晓丽, 王加启, 卜登攀, 等.幼龄小鼠小肠组织内参基因的选择[J]. 甘肃农业大学学报, 2009, 44(5):20-24, 29. ( 1) 1)
|




