2. 南京农业大学动物科技学院, 南京 210095;
3. 南京师范大学金陵女子学院, 南京 210097
2. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;
3. Jinling College, Nanjing Normal University, Nanjing 210097, China
保育期仔猪面临多种应激,影响肠道屏障和微生态环境,肠道黏膜屏障损伤后,会导致肠道内的病原微生物及其代谢产物通过肠黏膜进入机体循环系统,易引起仔猪腹泻、生长性能下降。生产实践中广泛添加抗生素来降低腹泻和促生长,抗生素的长期使用导致病原菌耐药性、畜产品药残等问题,不仅影响人类健康,同时也是畜牧业发展的瓶颈。因此,通过绿色安全高效的饲料添加剂使用来替代抗生素成为畜牧业的研究热点。抗菌肽,又称抗微生物肽,是动植物及微生物自身产生的一类具有抗菌、抗病毒活性的小分子多肽,其抗菌机理不同于抗生素,且不易产生耐药性[1, 2],是抗生素的潜在替代品。
黏膜屏障是肠道重要的屏障,其由上皮细胞以及细胞间的众多连接所构成。紧密连接主要位于细胞顶端表面,是上皮细胞间连接最为重要的结构复合物,在维持肠黏膜的屏障功能方面发挥重要的作用。目前已证明多种蛋白质参与紧密连接的形成,包括闭合蛋白(Claudin)、咬合蛋白(Occludin)、连接黏附分子(JAM)及闭合小环蛋白(ZO)家族。紧密连接蛋白常被用来作为观察肠道紧密连接屏障功能和通透性功能的指标[3]。目前,对抗菌肽的研究多集中于体外抑菌、分子结构改良及在工程菌中的表达等方面,在动物生产方面,尤其在仔猪肠道屏障功能的研究鲜有报道。本试验旨在研究饲粮中添加抗菌肽,对仔猪血清生化指标、小肠黏膜形态结构及空肠紧密连接蛋白基因相对表达量的影响,以期为抗菌肽的研究与应用提供科学依据。
1 材料与方法 1.1 试验材料抗菌肽由北京中农颖泰生物技术有限公司提供,是人工设计合成天蚕素抗菌肽CAD并在枯草芽孢杆菌中表达的微生物发酵产物(活性单位为1.0×106 U/g);试验所用抗生素为杆菌肽锌和硫酸黏杆菌素。
1.2 基础饲粮基础饲粮参照NRC(1998)猪的营养需要配制,饲粮组成及营养水平见表1。
1.3 试验设计本试验分为3组,具体分组如下:对照组(CG)饲喂基础饲粮;抗生素组(ABG)在基础饲粮中添加40 mg/kg杆菌肽锌和20 mg/kg硫酸黏杆菌素;抗菌肽组(AMPG)在基础饲粮中添加300 mg/kg抗菌肽。
1.4 试验动物及其管理将108头35日龄、体重13 kg左右的苏钟猪,按公母各占1/2的原则,随机分成3组,每组3个重复,每个重复12头。自由采食及饮水。驱虫、免疫按照猪场常规程序进行。预试期7 d,正试期49 d。试验于江苏省农业科学院试验猪场进行。
1.5 样品的采集与制备于试验期第49天时,08:00空腹称重,每重复选2头猪进行屠宰。采集血液,静置,在低温离心机中4 000 r/m离心15 min,取上清液-20 ℃保存;分离十二指肠、空肠、回肠,将内容物挤出,分别取十二指肠(距幽门约5 cm)、空肠(中间)、回肠(距回肠末端约20 cm)1.5 cm左右放入4%甲醛溶液中固定;另取小肠各段10 cm左右,用手术剪将肠段纵向剪开,然后用载玻片刮取黏膜,装于冻存管在液氮中保存。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
血清碱性磷酸酶、谷丙转氨酶活性及总蛋白、尿素氮和总胆固醇含量均用南京建成生物工程研究所试剂盒测定。
1.7 肠黏膜形态结构的测定切片制作步骤:组织修整→脱水→透明→浸蜡→包埋→切片。
苏木精-伊红(HE)染色步骤:二甲苯脱蜡→脱二甲苯→染色→脱水→透明→封片。
每个样品(重复)做3张不连续的切片,每张切片测定5根完整绒毛的绒毛高度和隐窝深度。用Olympus显微镜观察,Shineso(杭州迅数)显微图像分析系统进行拍照分析。
1.8 空肠上皮紧密连接蛋白基因相对表达量的测定 1.8.1 引物的设计与合成各目标引物采用Premier 5.0设计(表2),由上海生工有限公司合成。
1.8.2 总RNA的提取与反转录总RNA的提取步骤: 将样品用液氮研磨;加入Trizol剧烈振荡15 s,室温放置3 min;4 ℃ 12 000 r/min离心10~15 min,将水相转入新的离心管;加入等体积异丙醇,室温放置20~30 min;4 ℃ 12 000 r/min离心10 min,去上清;加入1 mL 75%乙醇洗涤沉淀;4 ℃ 5 000 r/min离心3 min;室温晾干,加入30~100 μL RNase-Free ddH2O,反复吹打,混匀,充分溶解。
按试剂盒操作步骤进行反转录(试剂盒购于TaKaRa公司)。
1.8.3 实时荧光定量PCR实时荧光定量PCR以3-磷酸甘油醛脱氢酶(GAPDH)为内参基因,反应条件为95 ℃预变性2 min;95 ℃变性10 s;60 ℃退火并延伸40 s,循环40 次;荧光的采集与溶解曲线的制作按照荧光定量PCR仪(美国ABI公司)操作说明进行;每个样品做3次重复;紧密连接蛋白Claudin-1、Occludin和ZO-1的基因相对表达量用2-△△Ct法[4]计算。
1.9 数据处理与统计分析用Excel 2003对原始数据初步统计,用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较,结果以“平均值±标准误”表示。
|
|
表 2 实时荧光定量PCR引物序列 Table 2 Primer sequences for fluorescence-based quantitative real-time PCR |
由表3可知,与对照组相比,饲粮中添加抗菌肽能够在一定程度上提高仔猪平均日增重、平均日采食量,降低料重比,但差异均不显著(P>0.05),其中,平均日增重比对照组提高了3.97%;抗生素组仔猪生长性能也比对照组有所提高(P>0.05),抗生素组、抗菌肽组的腹泻率低于对照组,差异不显著(P>0.05)。
2.2 抗菌肽对仔猪血清生化指标的影响由表4可知,与对照组相比,饲粮中添加抗菌肽能够显著提高仔猪血清总蛋白含量和谷丙转氨酶活性(P<0.05),其中,总蛋白含量比对照组提高了11.22%,谷丙转氨酶活性比对照组提高了24.47%;抗菌肽组血清碱性磷酸酶活性比对照组提高了7.92%,但未达到显著水平(P>0.05);与抗生素组相比,抗菌肽组血清总蛋白含量提高了14.64%(P<0.01);各组血清尿素氮和总胆固醇含量均无显著差异(P>0.05)。
2.3 抗菌肽对仔猪肠黏膜形态结构的影响图1显示的是各组仔猪十二指肠、空肠和回肠的肠黏膜形态结构。从图中可以看出,对照组有的绒毛顶端上皮细胞脱落,而抗生素组和抗菌肽组的的空肠和回肠绒毛都较长,隐绒毛也相对密集,其完整性也更好。
由表5可知,与对照组相比,饲粮中添加抗菌肽能够在一定程度上提高仔猪十二指肠、空肠和回肠绒毛高度,但均未达到显著水平(P>0.05);抗菌肽组仔猪空肠隐窝深度比对照组显著降低(P<0.05);仔猪十二指肠绒毛高度与隐窝深度的比值,抗菌肽组和抗生素组均比对照组显著提高(P<0.05),抗菌肽组空肠绒毛高度与隐窝深度的比值比对照组极显著提高(P<0.01)。
|
|
表 3 抗菌肽对仔猪生长性能的影响 Table 3 Effects of antimicrobial peptides on growth performance of piglets |
|
|
表 4 抗菌肽对仔猪血清生化指标的影响 Table 4 Effects of antimicrobial peptides on serum biochemical indices of piglets |
|
|
表 5 抗菌肽对仔猪肠黏膜形态结构的影响 Table 5 Effects of antimicrobial peptides on intestinal mucosa morphology of piglets |
由表6可知,抗菌肽组仔猪空肠紧密连接蛋白Claudin-1基因相对表达量比对照组显著提高(P<0.05),比抗生素组提高了32.52%,但没有达到显著水平(P>0.05);与对照组相比,饲粮中添加抗菌肽使紧密连接蛋白Occludin基因相对表达量提高了34.83%(P>0.05);抗菌肽组仔猪紧密连接 蛋白ZO-1基因相对表达量比对照组提高了8.57%, 比抗生素组降低了5.00%,但均未达到显著水平(P>0.05)。
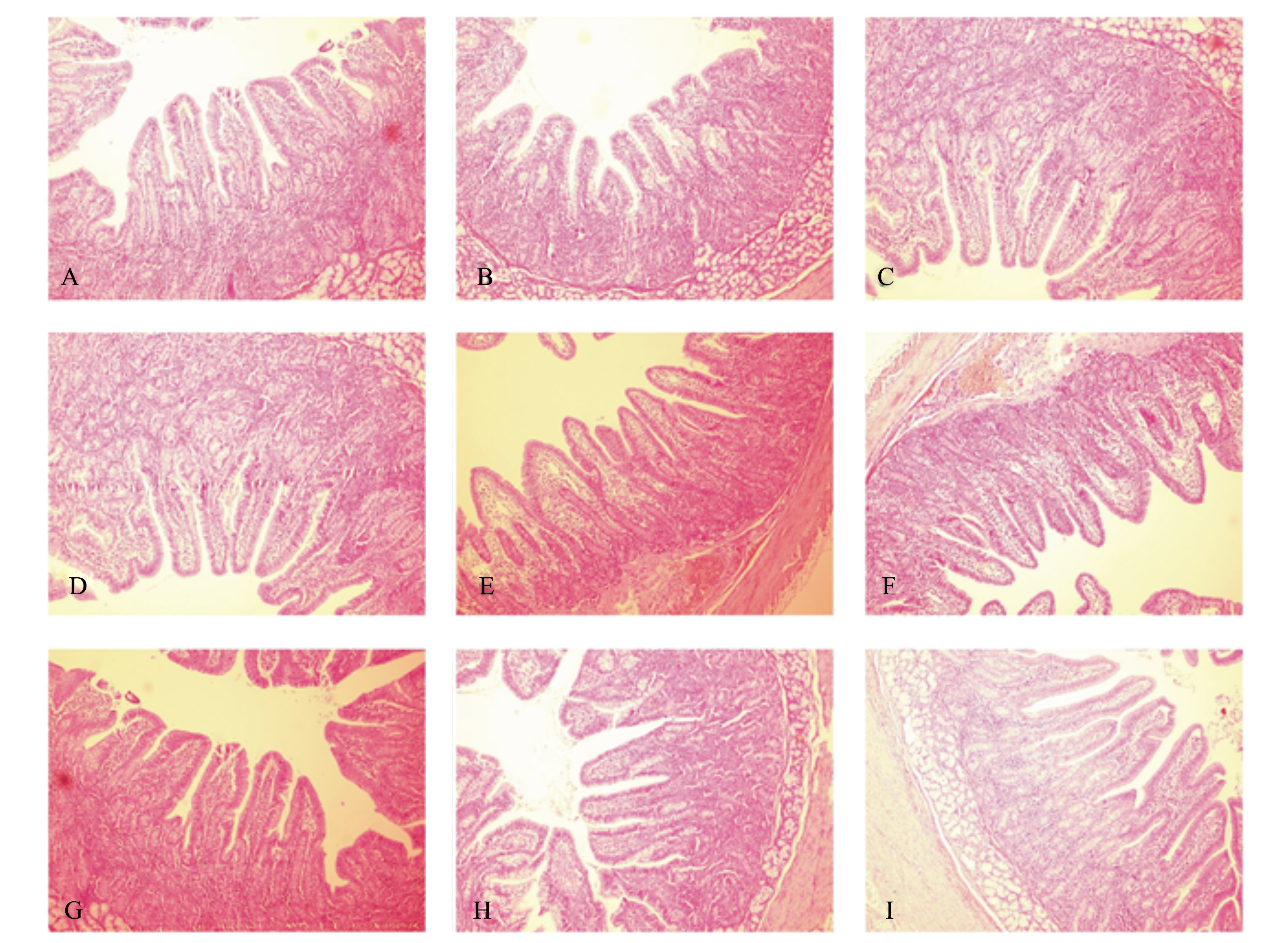 | A、B、C 分别为对照组、抗生素组、抗菌肽组的十二指肠切片,D、E、F 分别为对照组、抗生素组、抗菌肽组的空肠切片,
G、H、I 分别为对照组、抗生素组、抗菌肽组的回肠切片。 A, B, C were duodenum slices of CG, ABG and AMPG; D, E, F were jejunum slices of CG, ABG and AMPG; G, H, I were ideal slices of CG, ABG and AMPG. 图1 仔猪肠组织结构图 Fig. 1 Intestinal tissue structure graphs of piglets (100×) |
|
|
表 6 抗菌肽对仔猪空肠上皮紧密连接蛋白基因相对表达量的影响 Table 6 Effects of antimicrobial peptides on the relative expression level of Claudin-1,Occludin and ZO-1 genes in jejunum of piglets |
血清生化指标的改变是组织细胞通透性发生改变和机体新陈代谢机能发生改变的反映。
血清中总蛋白含量反映了机体对蛋白质的吸收状况以及与体液免疫的关系[5]。尿素氮是体内蛋白质分解代谢的主要产物之一,其血清含量直接反映蛋白质代谢水平和营养情况,其含量越低表明氮的利用率越高,即蛋白质合成代谢加强,分解代谢降低[6]。本试验结果发现饲粮中添加抗菌肽能够显著提高仔猪血清总蛋白含量,但尿素氮含量没有显著差异,表明抗菌肽有助于提高仔猪机体免疫力,从而促进仔猪生长。总胆固醇是指血清中所有脂蛋白所含胆固醇之和,其含量高低能够在一定程度上反映机体脂肪的代谢情况。本试验中各组间的总胆固醇含量没有显著变化,表明抗菌肽、抗生素对仔猪的脂类代谢没有影响。谷丙转氨酶是动物体内一种重要的转氨酶,它催化氨基在丙氨酸和谷氨酸之间转移,在非必需氨基酸的合成和蛋白质分解代谢中起重要的中介作用[7]。血清中谷丙转氨酶和碱性磷酸酶活性均可反映动物对蛋白质的代谢效率,特别是碱性磷酸酶,其活性的高低可反映动物的生长速度等生长性能[8]。本试验结果发现,抗菌肽、抗生素组的碱性磷酸酶活性都有提高的趋势,而抗菌肽组仔猪血清中谷丙转氨酶的活性显著提高,这与生长性能的结果相一致,进一步证实了抗菌肽可以一定程度上提高仔猪生长性能。
3.2 抗菌肽对仔猪肠黏膜形态结构的影响仔猪肠黏膜形态结构的完整性是其有效利用饲料养分,保持健康生长的基础,而绒毛高度、隐窝深度及绒毛高度与隐窝深度的比值是反映肠黏膜形态结构完整性的重要指标,尤其是绒毛高度与隐窝深度的比值,比值增大表明小肠消化吸收能力增强,比值减小说明肠黏膜受损,影响营养物质的消化吸收[9, 10]。据报道饲粮中添加抗菌肽能够有效改善肉鸡小肠黏膜形态结构[11, 12, 13]。刘莉如等[12]向海兰褐仔公鸡饲粮中添加300 mg/kg的天蚕素抗菌肽,发现仔公鸡肠绒毛高度显著提高,隐窝深度显著降低。本研究表明饲粮中添加抗菌肽能够在不同程度上提高十二指肠、空肠和回肠绒毛高度,降低隐窝深度,提高绒毛高度与隐窝深度的比值,说明抗菌肽能够改善仔猪小肠黏膜形态结构,增强小肠消化吸收功能。抗菌肽对十二指肠和空肠的作用大于对回肠的作用,原因可能是随着抗菌肽在小肠的后移,其作用也逐渐减弱。本试验中,抗菌肽组隐窝深度降低的比例大于绒毛高度升高的比例,原因可能是抗菌肽能够增加肠道成熟细胞数量,促进肠道的发育[14],而隐窝深度与肠黏膜细胞生成率或细胞成熟率密切相关,细胞成熟率提高,隐窝深度则降低[9, 10]。另外,抗菌肽还可能通过杀菌或抑菌作用,减少肠道有害菌对肠黏膜的破坏作用,进而达到对黏膜形态结构和功能的改善[15]。
3.3 抗菌肽对仔猪肠上皮紧密连接蛋白基因相对表达量的影响Claudin是保证紧密连接的渗透性具有特异性的主要蛋白,ZO-1与维持和调节上皮栅栏和屏障功能有关,参与调节细胞物质转运、维持上皮极性等重要过程。Occludin的功能涉及细胞间黏附、移动及通透性,一旦其发生变异、减少和缺失可引起肠上皮细胞间隙通透性增加,其中Claudin、Occludin属于跨膜蛋白,ZO家族属于胞质蛋白,各蛋白之间相互影响,共同发挥作用[16]。紧密连接蛋白的基因表达量能直接影响紧密连接蛋白的表达与分布,因此紧密连接蛋白的基因表达量是衡量肠上皮屏障功能的重要指标[17]。刘倚帆[4]向离体培养至亚融合状态的猪空肠上皮细胞中加入蛇源抗菌肽,使细胞培养基中抗菌肽的浓度分别为2.5、5.0、10.0、20.0 μg/mL,培养24 h,发现含5.0、10.0、20.0 μg/mL抗菌肽的培养基中上皮细胞紧密连接蛋白Claudin、Occludin、ZO-1、ZO-2的基因表达量均显著提高。本研究表明,饲粮中添加抗菌肽能够显著提高仔猪空肠上皮紧密连接蛋白Claudin-1的基因相对表达量,Occludin和ZO-1的基因相对表达量也有升高趋势。有研究表明肠上皮细胞紧密连接蛋白的基因表达与肠道细菌的代谢产物(如磷壁酸、丁酸等)有关[18, 19],抗菌肽具有广谱抗菌活性,能够有效抑制肠道有害菌,减少有害代谢产物的生成[20]。肠上皮间杯状细胞数量的增多能够增加黏液的分泌,提高肠黏膜黏液层对病原菌及其代谢产物的阻挡作用,从而有效保护肠上皮。因此,抗菌肽可能通过对肠道微生态平衡的维持及对肠黏膜免疫能力的提高来间接促进肠上皮紧密连接蛋白的基因表达,但其具体作用机理还需进一步研究。
4 结 论本试验条件下,饲粮中添加300 mg/kg的抗菌肽,能够显著提高仔猪血清总蛋白含量和谷丙转氨酶活性;能够在不同程度上提高肠绒毛高度,降低隐窝深度,显著提高绒毛高度与隐窝深度的比值;同时,还能提高仔猪空肠上皮紧密连接蛋白Claudin-1、Occludin和ZO-1的基因相对表达量。
| [1] |
李冠楠,夏雪娟,隆耀航,等.抗菌肽的研究进展及其应用[J].动物营养学报,2014,26(1):17-25.( 1) 1)
|
| [2] |
SEO M D,WON H S,KIM J H,et al.Antimicrobial peptides for therapeutic applications:a review[J].Molecules,2012,17(10):12276-12286.( 1) 1)
|
| [3] |
肖定福,唐志如,印遇龙,等.壳聚糖对仔猪肠黏膜通透性及Occluding和ZO-1表达的影响[J].畜牧兽医学报,2012,43(6):894-900.( 1) 1)
|
| [4] |
刘倚帆.动物源抗菌肽的分子改良及其对猪肠道上皮屏障功能的保护作用研究[D].博士学位论文.杭州:浙江大学,2012.( 2) 2)
|
| [5] |
李梦云,朱宽佑,刘延贺,等.饲粮中添加果寡糖对初产母猪生产性能,血清指标及粪便pH、微生物菌群数量和挥发性脂肪酸含量的影响[J].动物营养学报,2015,27(2):510-516.( 1) 1)
|
| [6] |
RECJTEBWALD E B,ROSS D A,FESSENDEN S W,et al.Urea-N recycling in lactating dairy cows fed diets with 2 different levels of dietary crude protein and starch with or without monensin[J].Journal of Dairy Science,2014,97(3):1611-1622.( 1) 1)
|
| [7] |
胡新旭,周映华,刘惠知,等.无抗发酵饲料对断奶仔猪生长性能、肠道菌群、血液生化指标和免疫性能的影响[J].动物营养学报,2013,25(12):2989-2997.( 1) 1)
|
| [8] |
吴信生,杨凤萍,王金玉,等.兔血浆碱性磷酸酶活性与生产性能关系的研究[J].江苏农业研究,2001,22(2):48-50.( 1) 1)
|
| [9] |
TANG M,LAARVELD B,VAN KESSEL A G,et al.Effect of segregated early weaning on postweaning small intestinal development in pigs[J].Journal of Animal Science,1999,77(12):3191-3200.( 2) 2)
|
| [10] |
韩正康.家畜营养生理学[M].北京:农业出版社,1991.( 2) 2)
|
| [11] |
马卫明,佘锐萍,胡艳欣,等.猪小肠抗菌肽对雏鸡的促生长作用及其机理初探[J].中国农业科学,2006,39(8):1723-1728.( 1) 1)
|
| [12] |
刘莉如,杨开伦,滑静,等.抗菌肽对海兰褐仔公鸡小肠黏膜形态结构及免疫活性细胞数量的影响[J].动物营养学报,2013,25(1):190-197.( 1) 1)
|
| [13] |
BAO H,SHE R,LIU T,et al.Effects of pig antibacterial peptides on growth performance and intestine mucosal immune of broiler chickens[J].Poultry Science,2009,88(2):291-297.( 1) 1)
|
| [14] |
KELSALL B L,STROBER W.Distinct population of dendritic cells are present in the subepithelial dome and T cell regions of the murine Peyer's patch[J].The Journal of Experimental Medicine,1996,183(1):237-247.( 1) 1)
|
| [15] |
谢天宇,胡红莲,高民.肠黏膜免疫屏障及其保护措施[J].动物营养学报,2014,26(5):1157-1163.( 1) 1)
|
| [16] |
SHEN L,WEBER C R,RSLEIGH D R,et al.Tight junction pore and leak pathways:a dynamic duo[J].Annual Review of Physiology,2011,73:283-309.( 1) 1)
|
| [17] |
GROSCHWITZ K R,HOGAN S P.Intestinal barrier function:molecular regulation and disease pathogenesis[J].Journal of Allergy and Clinical Immunology,2009,124(1):3-20.( 1) 1)
|
| [18] |
MIYAUCHII E,MORITA M,ROSSI M,et al.Effects of D-alanine in teichoic acid from the Streptococcus thermophilus cell wall on the barrier-protection of intestinal epithelial cells[J].Bioscience,Biotechnology,and Biochemistry,2012,76(2):283-288.( 1) 1)
|
| [19] |
SEGAWA S,FUJIYA M,KONISH H,et al.Probiotic-derived polyphosphate enhances the epithelial barrier function and maintains intestinal homeostasis through integrin-P38 MAPK pathway[J].PLoS One,2011,6(8):e23278.( 1) 1)
|
| [20] |
张勇军.抗菌肽在断奶仔猪日粮中添加效果的研究[D].硕士学位论文.长沙:湖南农业大学,2012.( 1) 1)
|



