2. 浙江大学动物科学学院, 杭州 310058;
3. 浙江农林大学动物科技学院, 杭州 311300
2. College of Animal Sciences, Zhejiang University, Hangzhou 310058, China;
3. College of Animal Science & Technology, Zhejiang A & F University, Hangzhou 311300, China
早期断奶仔猪由于受环境、心理及营养应激等因素影响,常常会表现出一系列的不良症状,如厌食或拒食、生长迟滞、消化机能紊乱、腹泻水肿、饲料利用率低等现象,这对仔猪机体代谢产生严重影响。氨基酸作为体内蛋白质代谢及其他物质代谢的产物,对动物体生长、维持和健康等重要代谢通路起着调控作用[1]。血液中由各种氨基酸及其含量组成的氨基酸谱,即氨基酸模式,蕴含着反映机体代谢和功能状态的重要生物化学信息。然而,受数据分析技术的限制,血浆氨基酸模式蕴含的生物学信息不能被充分利用,其分析应用也长期停留在简单的Fischer物质的量比值或支链氨基酸和酪氨酸物质的量比值上。
代谢组学作为系统生物学一个新的分支,通过定量测定生物样品的小分子代谢物来进行研究,在营养分析、疾病诊断等方面发挥着越来越重要的作用[1, 2]。代谢组学研究技术基于对代谢产物变化的指纹图谱分析和数学模型的建立,寻找与该生理过程紧密相关的生物标志物,为饲粮中营养组分作用效果研究提供了新的思路[3]。血浆氨基酸作为代谢网络中重要的代谢物,反映着机体组织蛋白质代谢和能量代谢的状况。本试验的目的是采用代谢组学方法对仔猪早期断奶过程中血浆氨基酸代谢谱进行系统研究,探讨其动态变化规律和筛选出重要的氨基酸。
1 材料与方法 1.1 试验动物选择4头产第3胎的经产母猪,每头母猪哺乳10头“杜×长×大(Duroc×Landrace×Large Yorkshire)”仔猪。
1.2 试验设计在21日龄时将仔猪作断奶处理,选择8头体重一致的健康仔猪(公母各占1/2)用于试验,分别来自于4头母猪。试验仔猪单独饲养,参照Flynn等[4]的方法分别用于断奶后0、1、3、5、7、10、15、30 d测定体重和采集血液样本。试验过程中仔猪饲养在环境可控的保育室中,温度为(25±2) ℃,相对湿度为65%~75%,持续光照。试验期间自由饮水和采食,试验饲粮由浙江国茂饲料有限公司提供,基础饲粮参考NRC(1998)断奶仔猪营养需要标准配制,其组成及营养水平见表1。
|
|
表 1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as-fed basis) |
在断奶后0、1、3、5、7、10、15和30 d仔猪哺乳或饲喂8 h后,分别从前腔静脉采集血液样本(4 mL),于4 ℃下3 000 r/min离心10 min得到血清,保存在-20 ℃用于氨基酸分析[3]。
1.4 血浆游离氨基酸含量测定取1 mL血清加入2.5 mL 7.5%的三氯乙酸漩涡混匀,12 000 r/min离心15 min(4 ℃),上清液用于氨基酸分析(离子交换氨基酸分析仪,Hitachi L-8900 Auto-Analyzer,Tokyo,日本)。每个样本进样量为20 μL,分析周期为150 min。柱平衡时间为35 min,检测波长570 nm,其中脯氨酸为440 nm[5]。
1.5 统计分析仔猪体重和血浆氨基酸含量采用SPSS 16.0软件进行单因素方差分析(one-way ANOVA)和LSD多重比较,数据采用平均值±标准误(mean±SEM)。
将这20种氨基酸的数据导入到SIMCA-P(Version 12.0)软件。首先采用非监督的主成分分析(principal component analysis,PCA)方法观察断奶后不同时间点样品聚焦、离散及变化趋势。为了进一步区分仔猪断奶后不同时间点氨基酸代谢的差异,采用有监督的偏最小二乘判别分析(partial least-squares discrimnant analysis,PLS-DA)筛选使不同时间点血浆样本发生聚集或离散的主要差异变量,从而找到使断奶后不同时间点氨基酸代谢谱发生变化最相关的氨基酸。以断奶后的时间点(天数)为Y矩阵,以氨基酸含量为X矩阵进行PLS-DA建模,然后采用正交偏最小方差判别分析(orthogonal partial least-square discriminant analysis,O-PLS-DA)对筛选出的重要差异变量进行验证[6]。
2 结 果 2.1 断奶仔猪体重仔猪在断奶后1~3 d,体重变化较小;在断奶后5 d始,仔猪体重逐渐增大,至断奶后30 d仔猪体重为14.75 kg(表2)。
|
|
表 2 仔猪断奶后的体重变化 Table 2 Changes of body weight in piglets post-weaning |
由表3可知,血浆精氨酸与其直接的前体物质瓜氨酸和鸟氨酸含量在断奶后1~5 d内显著下降(P<0.05),在断奶后7~30 d上升。亮氨酸、脯氨酸、酪氨酸和牛磺酸含量在断奶后1~3 d内显著下降(P<0.05),然后上升。异亮氨酸、赖氨酸、甘氨酸和丝氨酸含量在断奶后5 d显著低于其他时间点的含量(P<0.05),然后在断奶后7~30 d上升。蛋氨酸含量在断奶后0~3 d内变化较小(P>0.05),在断奶后5 d,其含量分别比断奶后0、1和3 d增加了41.61%(P<0.05)、43.51%(P<0.05)和41.11%(P<0.05),之后其含量保持稳定。血浆苏氨酸含量在断奶后3 d比断奶后0和1 d分别增加 了31.67%(P<0.05)和79.06%(P<0.05),断奶后10 d含量达到最大值,在断奶后15和30 d其含量显著降低(P<0.05)。谷氨酸(由于在氨基酸分析仪中谷氨酸和谷氨酰胺不能分开,实际为谷氨酸+谷氨酰胺)含量在断奶后0、1和10 d显著低于其他时间点含量(P<0.05)。丙氨酸含量在断奶后1 d显著降低(P<0.05),断奶后3~10 d升高,在断奶后15~30 d降低。总氨基酸含量在断奶后0 d显著高于断奶后各时间点总氨基酸含量(P<0.05),从断奶后1 d始至断奶后5 d,总氨基酸含量逐渐降低,断奶后7 d起升高并至断奶后30 d无显著变化(P>0.05)。
|
|
表 3 断奶仔猪血浆氨基酸含量 Table 3 Plasma contents of amino acids in weaned pigs |
为了使多样品的分析结果更加直观和可视化,且具有统计学意义,本研究首先采用了非监督的PCA的方法,对仔猪血浆样本进行分组处理。由PCA得分图(图1)可见,断奶后0 d血浆样本与其余各个时间点样本显著分开(PCA得分图上的任一点表示一个对应的样本),断奶后1 d与断奶后15和30 d聚类在一起;断奶后3 d与断奶后5 d聚集,且与断奶后0 d差异最大;断奶后7和10 d与其他个时间点的样本分开。PCA分析结果反映出,仔猪断奶后血浆氨基酸表现出较大的动态变化,断奶后15 d开始趋于稳定。
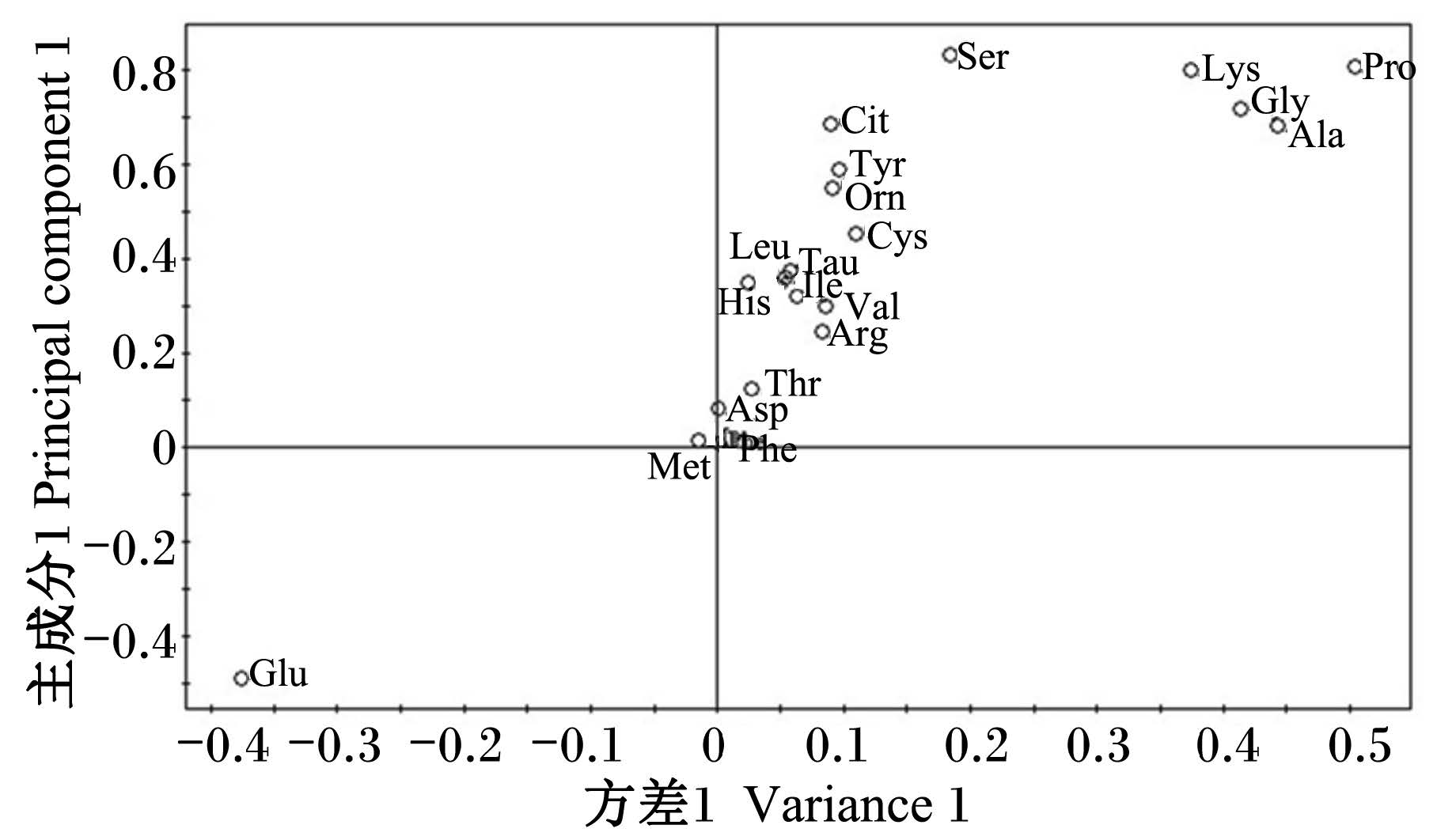
载荷图中的变量反映了对不同时间点样品判别的贡献率及变量之间的相关程度,离原点越远,对分组的贡献越大。由图2中可见谷氨酸、苏氨酸、脯氨酸、瓜氨酸位于较远处,说明其对不同时间点样品判别的贡献率较大,被这2个主成分解释得越充分。
此外,本试验利用这20种氨基酸含量的平均值,通过PCA模型描绘了断奶仔猪血浆氨基酸代谢谱随时间变化的趋势图(图3和图4)。2个图明显地揭示了血浆氨基酸在断奶后一段时间内从较大的变化幅度到趋于稳定的变化规律。从断奶后1 d始与断奶后0 d不同;断奶后3和5 d变化 幅度最大,偏离其余的各个时间点样品;断奶后7 d代谢谱的空间位点开始逐渐向断奶后1 d靠拢,断奶后30 d代谢谱的空间位点已靠近于断奶后1 d,距断奶后0 d的位置较近。
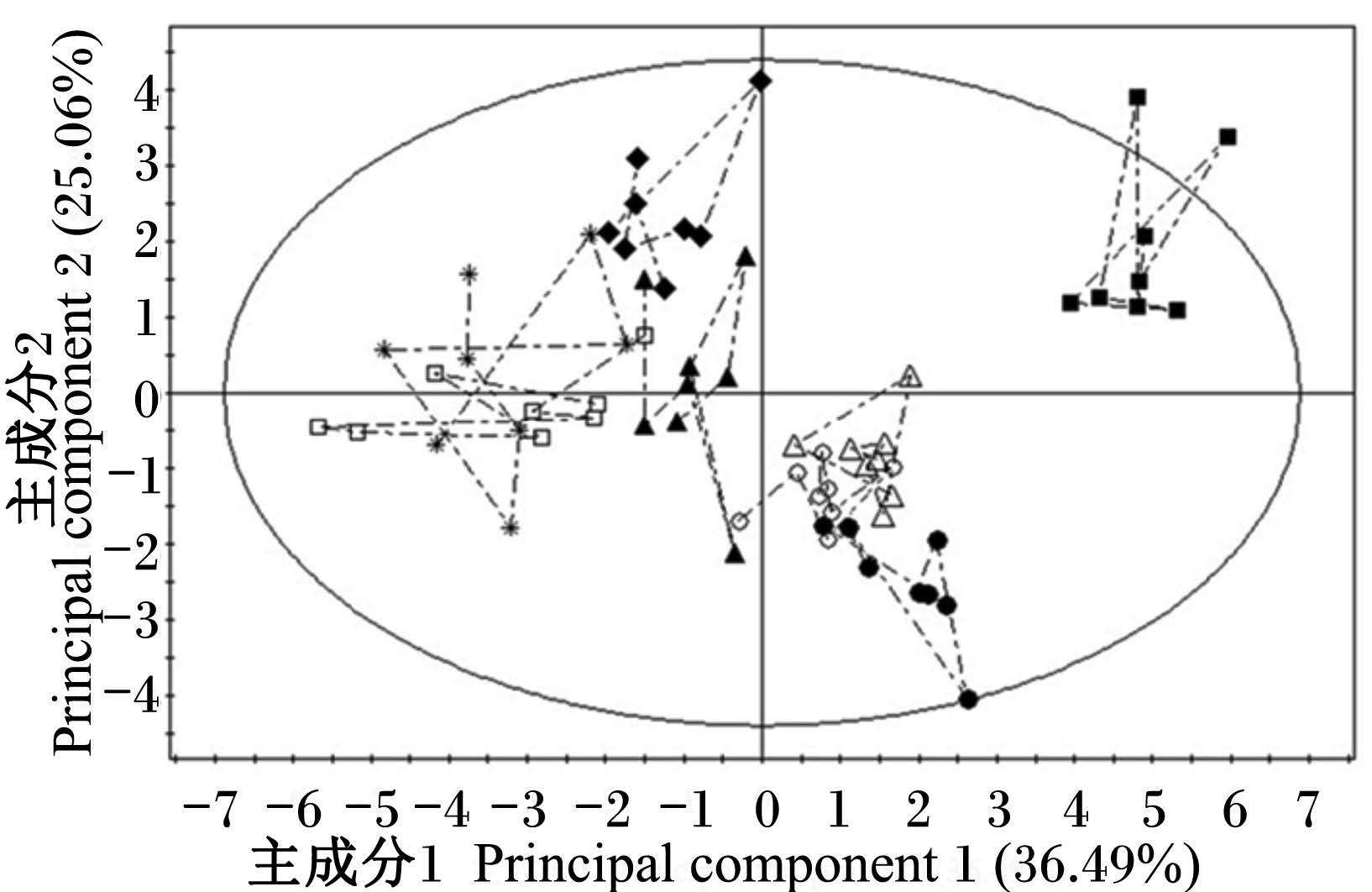 | ■ 断奶后0 d 0 d after weaning (d0) ● 断奶后1 d 1 d after weaning (d1) ∗ 断奶后3 d 3 d after weaning (d3) 口断奶后5 d 5 d after weaning (d5) ▲ 断奶后7 d 7 d after weaning (d7) ◆ 断奶后10 d 10 d after weaning (d10) ○ 断奶后15 d 15 d after weaning (d15) △ 断奶后30 d 30 d after weaning (d30) 图1 不同时间点氨基酸代谢谱PCA得分图 Fig. 1 PCA score plot of AA metabolic profiling at different time points |
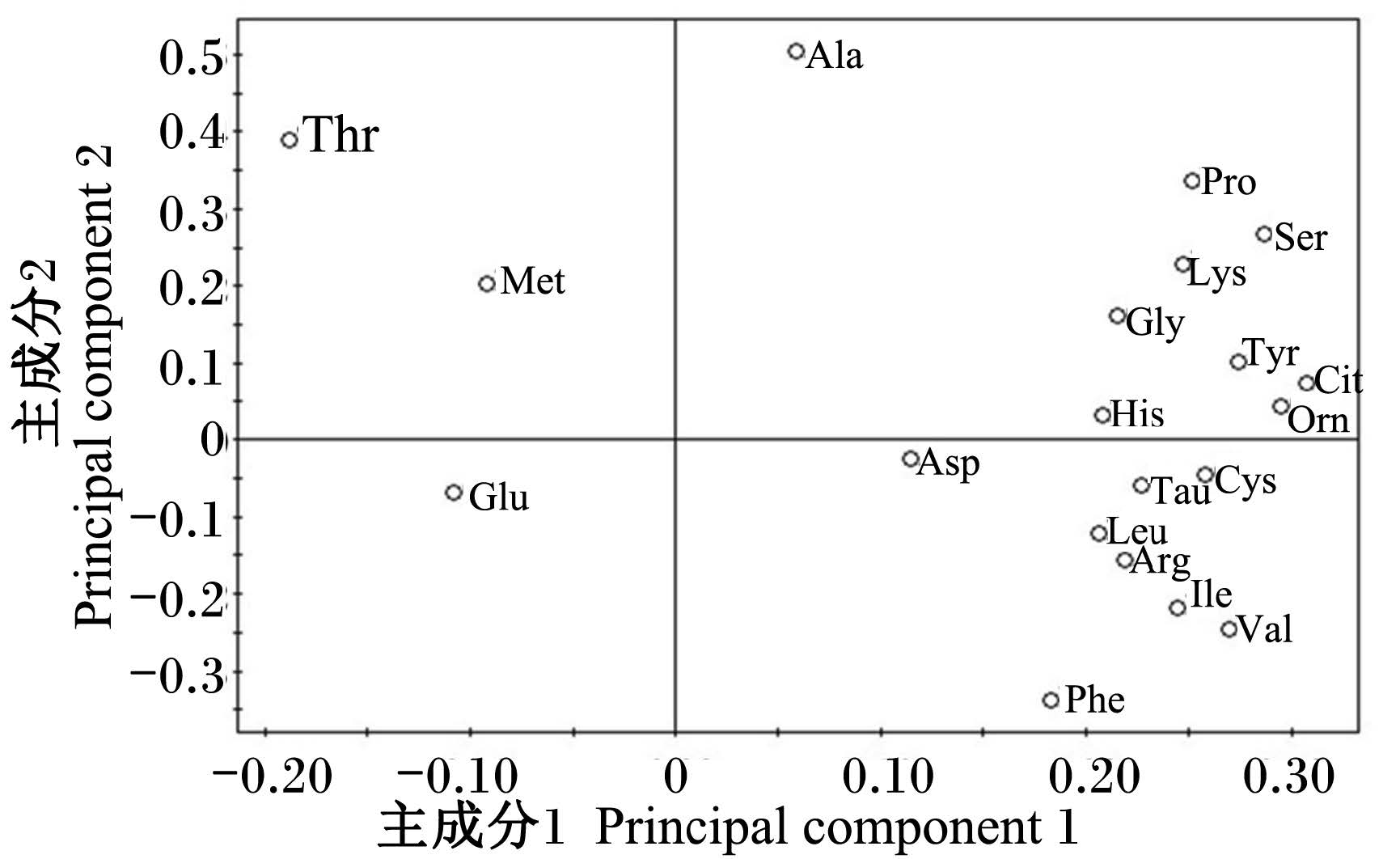 | 图2 不同时间点氨基酸代谢谱PCA载荷图 Fig. 2 PCA loading plot of AA metabolic profiling at different time points |
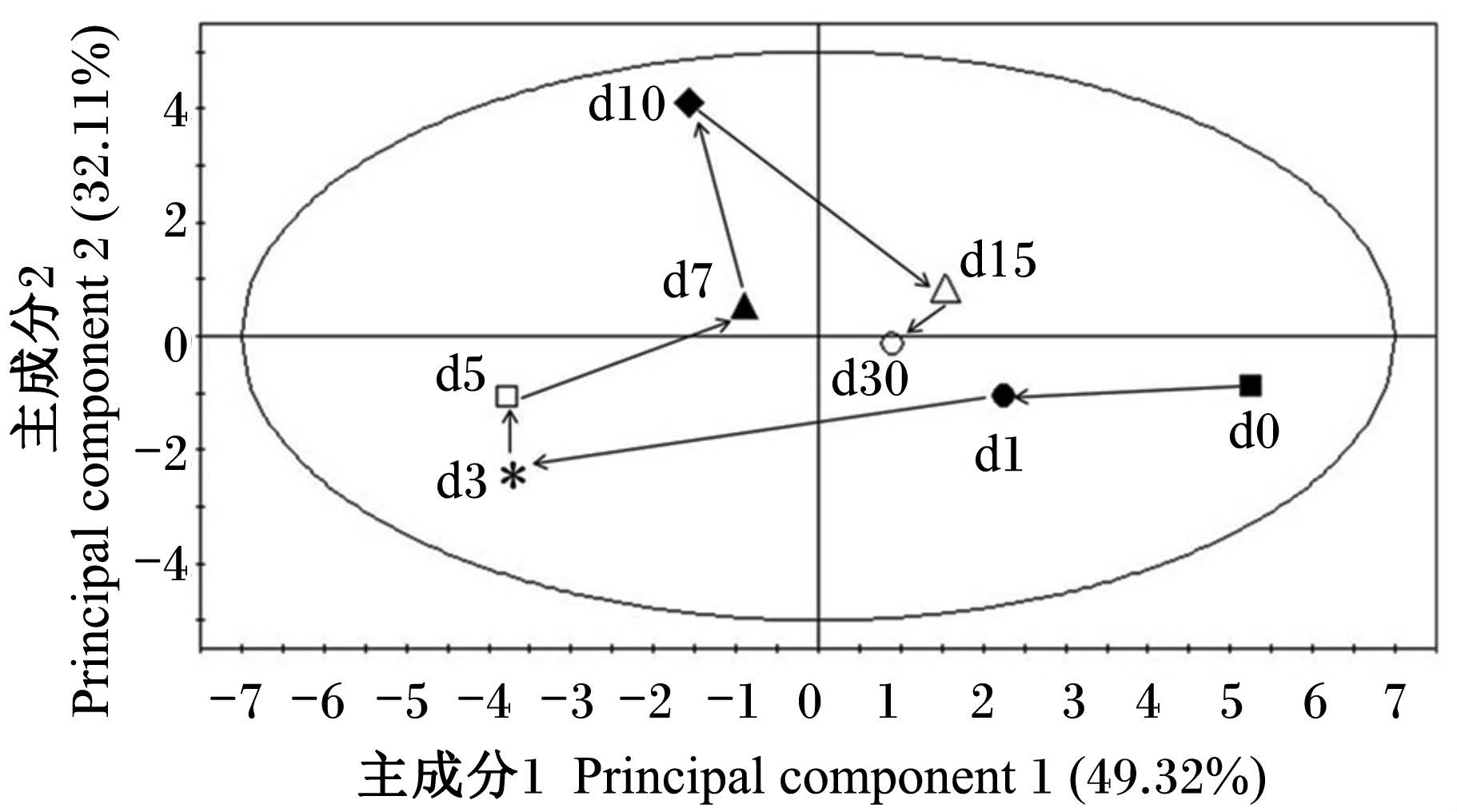 | 图3 断奶仔猪氨基酸代谢模式平均值 随时间变化的PCA 2D-轨迹图 Fig. 3 Corresponding PCA 2D-trajectory of AA means at different time points by a metabolic profiling approach in weaned piglets |
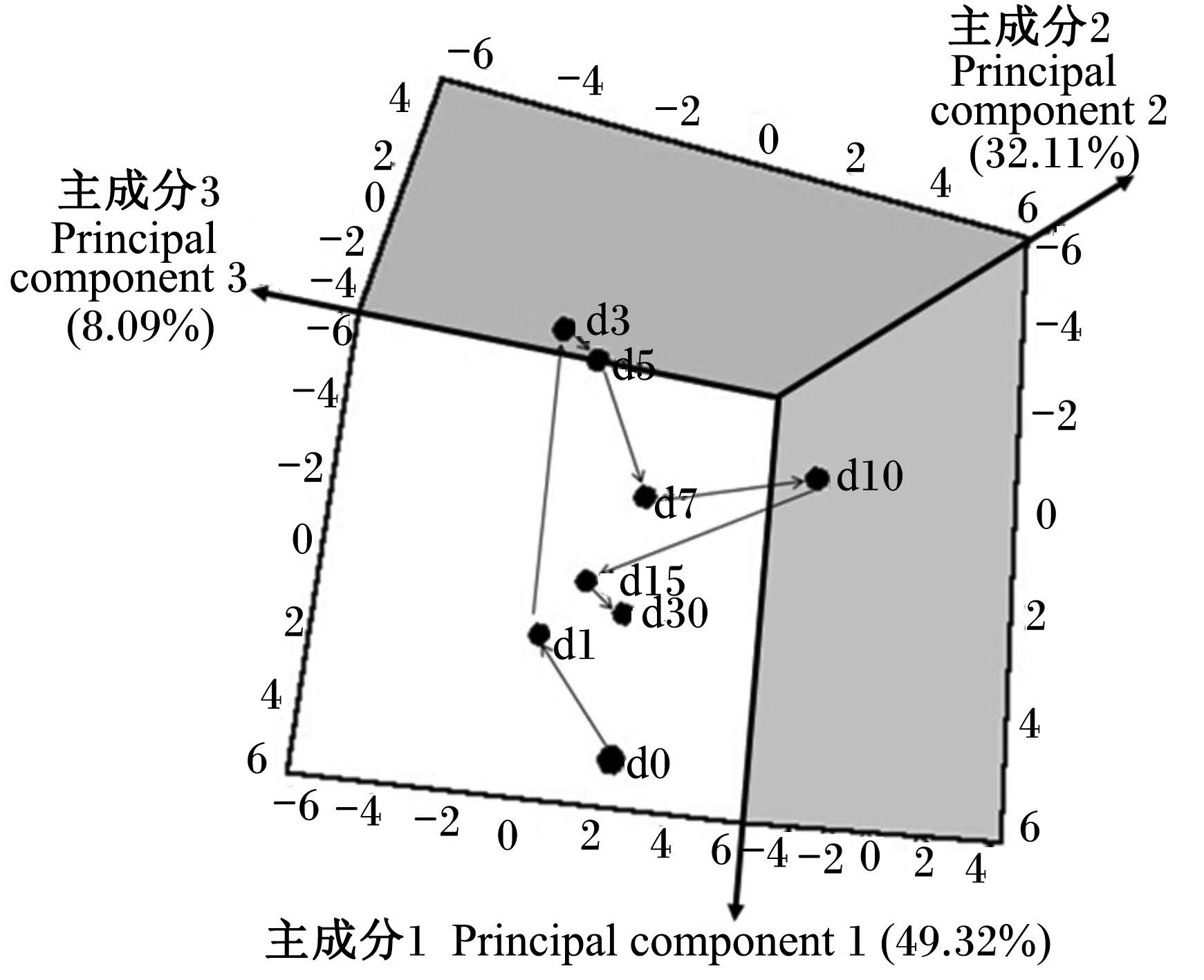 | 图4 断奶仔猪氨基酸代谢模式平均值 随时间变化的PCA 3D轨迹图 Fig. 4 Corresponding PCA 3D-trajectory of AA means at different time points by a metabolic profiling approach in weaned piglets |
PLS-DA是基于PCA模型的一种有监督的分析方法,用于建立类别间的数学模型,使各类样品间达到最大的分离,并利用建立的多参数模型对未知的样本进行预测。在本试验中,为了进一步研究早期断奶对仔猪血浆氨基酸代谢谱的影响,采用PLS-DA方法对断奶后不同时间点血浆样本重新建模,以找到伴随模型贡献较大的氨基酸,有利于从氨基酸代谢物角度就断奶应激对仔猪蛋白质和氨基酸代谢影响机制做深入的理解。PLS-DA模型中变量投影重要性(variable importance in the project,VIP)值能够反映变量X和Y之间的相关性,用来选择重要的代谢物。通常VIP值大于1与Y之间有较好的相关性。图5显示,在氨基酸代谢谱PLS-DA模型中,谷氨酸+谷氨酰胺、甘氨酸、丙氨酸、脯氨酸、赖氨酸和苏氨酸的VIP值大于1,即为较重要的氨基酸,其中谷氨酸的VIP值最大,为1.74。
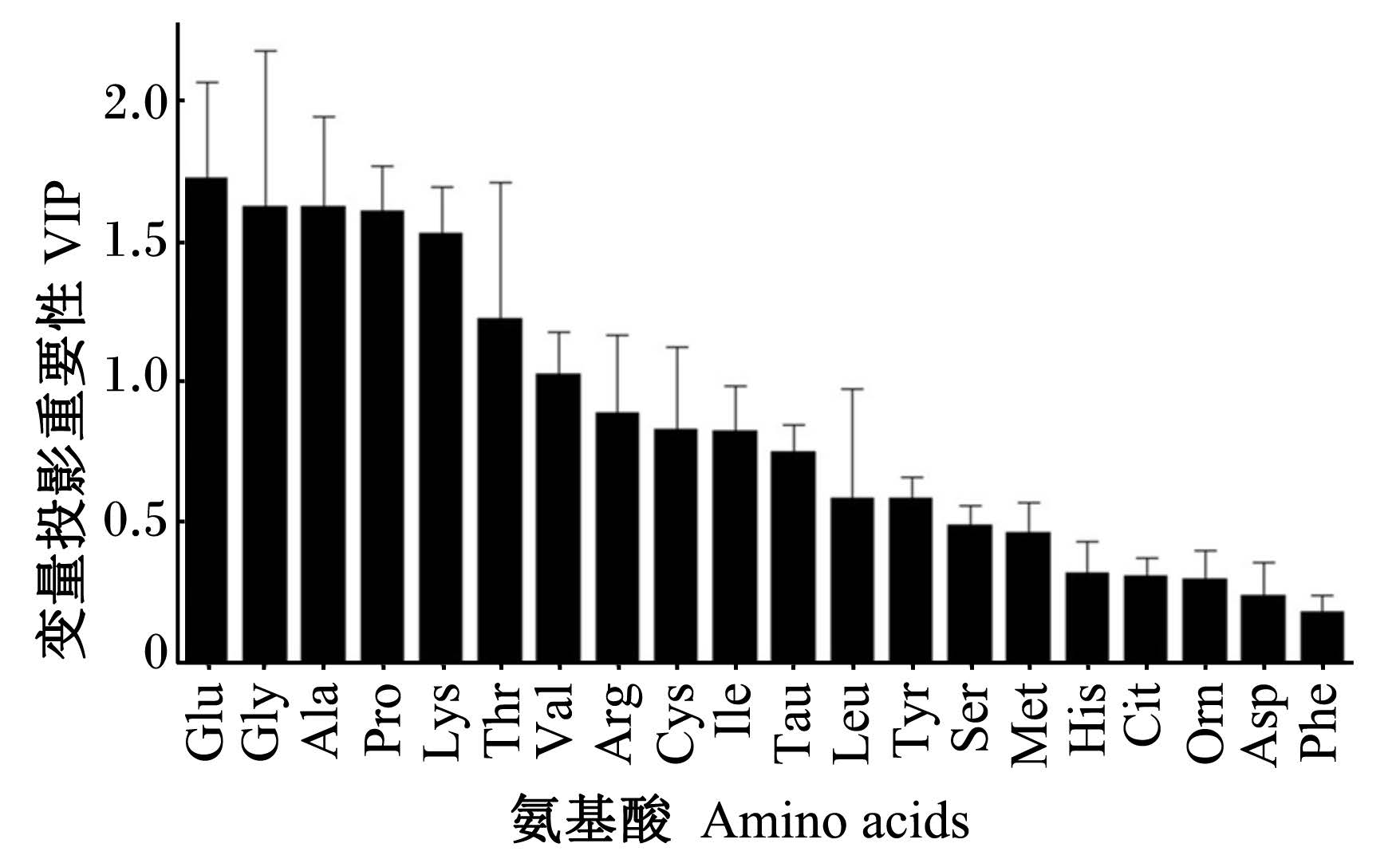 | 图5 各氨基酸的变量投影重要性
Fig. 5 The VIP value of each amino acid in PLS-DA project |
正交偏最小方差得分图从另一角度反应了PLS-DA模型中的重要变量,离原点越远的变量,其重要性越大。从图6可发现,可见谷氨酸+谷氨酰胺、甘氨酸、丙氨酸、脯氨酸与赖氨酸位于离原点的较远处。与VIP值排序图的结果相符合。
3 讨 论氨基酸是构成蛋白质的基本组分,也是生命活动中的一类重要物质,在体内通过一系列生化代谢途径转化为糖类或者脂类,并合成多种重要的生物活性物质,如激素、酶、核酸、多胺及神经递质等。正常机体内游离氨基酸水平是相对稳定的,体内不能合成的必需氨基酸主要从食物摄入,而体内可以合成的非必需氨基酸由合成、释放、利用等因素调节[7]。氨基酸的失衡通常会导致机体正常生长代谢受阻,甚至引起病理学改变。构成哺乳动物有机体的氨基酸有20多种,形成一个系统的氨基酸代谢库。氨基酸代谢库是由外源性氨基酸和内源性氨基酸组成,分别为由胃肠道消化吸收的氨基酸与体内蛋白质降解或重新合成的氨基酸,参与体内多种代谢。以游离氨基酸总量计算,肌肉中氨基酸占氨基酸代谢库的50%~80%,肝脏占10%,肾脏约占4%,血液占1%~6%。虽然血液中氨基酸含量不高,但代谢速度快,对氨基酸池中各种氨基酸运输和交换起着重要作用,其含量在正常情况下可保持恒定水平。血浆氨基酸含量不仅受生长阶段、饲粮(食谱)及环境因素的影响,同时也受蛋白质的消化、吸收、合成与分解,糖原异生与氧化分解,氨基酸转运等多种因素的影响,但通过一定的代谢调节机制,使其含量保持相对恒定,构成一定比例,简称为氨基酸谱。
 | 图6 正交偏最小方差得分图
Fig. 6 Orthogonal partial least square score plot |
尽管氨基酸组成通常保持相对恒定,血浆、乳汁等生理体液的氨基酸含量在不同的阶段可发生相应的动态变化。Flynn等[4]发现,哺乳仔猪从出生后3~14 d血浆精氨酸及其直接前体物质瓜氨酸和鸟氨酸含量逐渐下降;谷氨酰胺含量在出生后7 d内连续下降;与出生后1和3 d比较,出生后14和21 d支链氨基酸、缬氨酸和丙氨酸含量明显降低。在哺乳期的1~21 d内,猪乳汁中游离谷氨酰胺含量由0.1 mmol/L增加到4 mmol/L[8],与之对应的是哺乳母猪肌肉内谷氨酰胺含量下降了50%以上[9]。本试验对仔猪早期断奶后血浆氨基酸动态变化进行了系统的研究,结果发现21日龄断奶仔猪在断奶后3~7 d氨基酸含量与断奶后0 d相比较,变化幅度较大,大部分氨基酸含量呈下降的趋势;从断奶后10~30 d开始,血浆中游离氨基酸含量开始维持相对稳定且处于较高的水平。血浆总氨基酸含量在断奶后5 d最低,分别为断奶后0 d的73.61%和断奶后30 d的86.16%。
断奶通常伴随着仔猪生存环境、食物类型与摄入模式的剧烈变化[10],断奶后仔猪摄取富含氮化合物的全价配合饲料,而易于消化吸收的脂肪、蛋白质和碳水化合物含量较少,基本无游离氨基酸[11, 12]。食物结构的变化导致仔猪断奶后肠道结构发生较大变化,采食量、营养物质的消化吸收能力急剧下降[13]。Pié等[14]研究发现仔猪在断奶后的24 h内仅采食11 g饲粮;近端小肠的绒毛周长在断奶后24 h下降了29%,在随后的8 d内无显著变化;中端和远端小肠的绒毛周长在断奶后1和2 d均显著性地降低了约16%;近端小肠蔗糖酶活力在断奶后1 d下降了85%,远端小肠蔗糖酶活力在断奶后2 d与断奶后1 d比较,下降了30%;小肠白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-β(TNF-β) mRNA水平升高。这反映了仔猪断奶后从小肠中吸收的氨基酸含量迅速减少,从而进入血液中的氨基酸含量降低,在一定程度上解释了断奶后3~7 d氨基酸含量降低的原因。随着断奶后时间的延长,仔猪适应了新的生长环境和固态饲粮,同时其胃肠道进一步发育,消化酶活力增高,在断奶后2周,肠道消化酶活力恢复到断奶前的水平[15, 16]。在本研究中,自断奶后10 d始,仔猪血浆氨基酸含量逐渐恢复到正常水平,原因可能是仔猪胃肠道功能恢复,消化吸收饲粮营养物质的能力增强,经过肠道上皮细胞进入血液的氨基酸含量增多,使得血浆游离氨基酸含量升高。
谷氨酰胺对机体蛋白质合成与降解、胞外基质合成、糖原生成、脂质代谢、细胞增殖与凋亡、氧化还原潜能、呼吸爆发、胰岛素分泌和抵抗等生理活动均有直接或者间接的影响[7, 17]。本试验发现,断奶后仔猪血浆谷氨酸和谷氨酰胺含量表现为下降→上升→下降→上升趋势。断奶后1 d仔猪血浆谷氨酸和谷氨酰胺含量显著降低,比断奶后0 d下降了17.50%。谷氨酰胺是母猪乳中含量最丰富的游离氨基酸[8],在断奶后,仔猪无乳汁的摄入,同时在断奶后1 d体内肌肉等组织分解产生谷氨酰胺作用较弱,因此出现血浆中谷氨酰胺含量下降现象。断奶后3~5 d,由于连续较长时间的低采食量和低消化吸收率,外界摄入的氨基酸含量降低,仔猪体内肌肉蛋白质加速分解以满足机体对氨基酸代谢的需要,因此大量谷氨酰胺和丙氨酸释放进入血液中[18],使得断奶后3和5 d血浆谷氨酸和谷氨酰胺总含量分别比断奶当天上升了23.42%和20.90%,丙氨酸含量也有了不同程度的升高。从营养学角度来讲,肌肉蛋白质分解加速,必需氨基酸在肌肉中的利用率下降[18],所以断奶后3~5 d,赖氨酸含量也相应地降低。断奶后7~10 d,谷氨酸和谷氨酰胺含量开始下降,在断奶后10 d其含量与断奶当天比较下降了23.34%。可能是由于肌肉中谷氨酰胺已大量消耗,而仔猪消化吸收而来的谷氨酰胺仍然较少,导致血浆谷氨酸和谷氨酰胺含量降低。断奶14 d后,仔猪的肠道结构发育得到了较大的完善,消化吸收能力增强[16],从肠道吸收大量的氨基酸,保证了氨基酸池中各氨基酸的平衡。所以在断奶后15~30 d,谷氨酸和谷氨酰胺总含量上升至较高水平,为断奶当天的1.12~1.19倍。
4 结 论仔猪在早期断奶后血浆氨基酸代谢谱处于动态变化中,总氨基酸含量在断奶当天显著高于断奶后各时间点总氨基酸含量,在断奶后1~5 d,总氨基酸含量逐渐降低,断奶后7 d起升高并至断奶后30 d无显著变化。主成分分析得分图显示,随着断奶后时间的延长,血浆氨基酸代谢谱先远离断奶后0 d的代谢谱,然后逐渐向断奶后0 d代谢谱位置靠拢,并趋于稳定,其中断后3~5 d血浆氨基酸代谢谱变化幅度最大。谷氨酸为在本偏最小二乘法判别分析模型中区分仔猪在NRC(1998)饲养标准下断奶后各时间点血浆代谢谱最重要的氨基酸。
| [1] |
XIAO Y P,WU T X,HONG Q H,et al.Response to weaning and dietary L-glutamine supplementation:metabolomic analysis in piglets by gas chromatography/mass spectrometry[J].Journal of Zhejiang University Science B,2012,13(7):567-578.( 2) 2)
|
| [2] |
GROMSKI P S,MUHAMADALI H,ELLIS D I,et al.A tutorial review:metabolomics and partial least squares-discriminant analysis-a marriage of convenience or a shotgun wedding[J].Analytical Chimica Acta,2015,879:10-23.( 1) 1)
|
| [3] |
XIAO Y P,WU T X,SUN J M,et al.Response to dietary L-glutamine supplementation in weaned piglets:a serum metabolomic comparison and hepatic metabolic regulation analysis[J].Journal of Animal Science,2012,90(12):4421-4430.( 2) 2)
|
| [4] |
FLYNN N E,KNABE D A,MALLICK B K,et al.Postnatal changes of plasma amino acids in suckling pigs[J].Journal of Animal Science,2000,78(9):2369-2375.( 2) 2)
|
| [5] |
KONG X F,YIN Y L,HE Q H,et al.Dietary supplementation with Chinese herbal powder enhances ileal digestibilities and serum concentrations of amino acids in young pigs[J].Amino Acids,2009,37(4):573-582.( 1) 1)
|
| [6] |
TRYGG J,HOLMES E,LUNDSTEDT T.Chemometrics in metabonomics[J].Journal of Proteome Research,2007,6(2):469-479.( 1) 1)
|
| [7] |
WU G Y.Amino acids:metabolism,functions,and nutrition[J].Amino Acids,2009,37(1):1-17.( 2) 2)
|
| [8] |
WU G,KNABE D A.Free and protein-bound amino acids in sow's colostrum and milk[J].The Journal of Nutrition,1994,124(3):415-424.( 2) 2)
|
| [9] |
CLOWES E J,AHERNE F X,BARACOS V E.Skeletal muscle protein mobilization during the progression of lactation[J].American Journal of Physiology Endocrinology and Metabolism,2004,288(3):E564-E572.( 1) 1)
|
| [10] |
DIVIDICH J L,SÈVE B.Effects of underfeeding during the weaning period on growth,metabolism,and hormonal adjustments in the piglet[J].Domestic Animal Endocrinology,2000,19(2):63-74.( 1) 1)
|
| [11] |
GU X,LI D.Fat nutrition and metabolism in piglets:a review[J].Animal Feed Science and Technology,2003,109(1/2/3/4):151-170.( 1) 1)
|
| [12] |
PETROVIĈ V,NOVOTNÝ J,HISIRA V,et al.The impact of suckling and post-weaning period on blood chemistry of piglets[J].Acta Veterinaria Brno,2009,78(3):365-371.( 1) 1)
|
| [13] |
GU X,LI D,SHE R.Effect of weaning on small intestinal structure and function in the piglet[J].Archives of Animal Nutrition,2002,56(4):275-286.( 1) 1)
|
| [14] |
PIÉ S,LALLÈS J P,BLAZY F,et al.Weaning is associated with an upregulation of expression of inflammatory cytokines in the intestine of piglets[J].The Journal of Nutrition,2004,134(3):641-647.( 1) 1)
|
| [15] |
MONTAGNE L,BOUDRY G,FAVIER C,et al.Main intestinal markers associated with the changes in gut architecture and function in piglets after weaning[J].British Journal of Nutrition,2007,97(1):45-57.( 1) 1)
|
| [16] |
BARSZCZ M,SKOMIAL J.The development of the small intestine of piglets-chosen aspects[J].Journal of Animal and Feed Sciences,2011,20(1):3-15.( 2) 2)
|
| [17] |
JEWELL J L,KIM Y C,RUSSWLL R C,et al.Differential regulation of mTORC1 by leucine and glutamine[J].Science,2015,347(6218):194-198( 1) 1)
|
| [18] |
GUAY F,TROTTIER N L.Muscle growth and plasma concentrations of amino acids,insulin-like growth factor-Ⅰ,and insulin in growing pigs fed reduced-protein diets[J].Journal of Animal Science,2006,84(11):3010-3019.( 2) 2)
|




