牛乳蛋白作为人类膳食蛋白质的重要来源以及原料奶质量、收购定价的重要指标,其重要性已受到生产者和研究者的广泛关注。但是,目前我国奶业生产中乳蛋白水平整体偏低的问题特别突出,直接影响原料奶质量和饲养者经济效益。因此,乳蛋白调控将成为我国奶业发展当前和今后相当长时间内反刍动物营养学研究的重要课题。乳腺在自身发育过程中受到多种甾类和肽类激素等因子的调控[1],其中催乳素(prolactin)在乳腺发育、启动泌乳和维持泌乳中都起着至关重要的作用,并直接调控泌乳期乳腺的乳蛋白合成[2]。而脂肪细胞因子瘦素(leptin)在动物孕期和泌乳期有关营养物质分配的能量代谢过程中发挥着重要调控功能[3]。但从目前已有的关于催乳素和瘦素对乳蛋白调控的文献来看,就动物模型而言,大多数的研究集中在人类和啮齿类动物的乳腺模型上[4, 5, 6],反刍动物此类研究很少;就研究深度来看,催乳素对乳腺上皮细胞功能影响的研究逐渐深入,且越来越趋向于信号转导与分子机制的研究[7],而乳腺中瘦素的研究仅限于其组织分布、mRNA水平的表达和简单的功能确定[8, 9, 10]。Feuermann等[11, 12]、王春艳等[13]对奶牛乳腺瘦素及其受体的表达以及瘦素的剂量效应进行了初步研究。目前尚缺乏催乳素与瘦素对奶牛乳腺泌乳功能,特别是乳蛋白合成方面的互作调控研究。作为乳腺发育进程中重要激素和细胞因子,催乳素和瘦素在奶牛的乳蛋白调控中究竟发挥怎样的协同作用?为此,本研究进行了催乳素和瘦素对奶牛乳蛋白基因及乳蛋白合成主要信号通路关键因子基因表达的影响研究,旨在为生产实践中奶牛乳蛋白调控提供基础研究支持。
1 材料与方法 1.1 主要仪器和试剂CO2培养箱(Heal Force HF240),倒置相差显微镜(Olympus LX71),离心机(Eppendorf,5417R),普通PCR仪(PTC-200,MJ,美国),电泳仪(Bio-Rad),凝胶成像仪(UVP),定量PCR仪(IQ5,Bio-Rad),多功能酶标仪(BioTek Synergy H4),-80 ℃冰箱(Thermo)。
DMEM/F12培养基(11330-032,Gibco),胎牛血清(04-001-1A,BI),磷酸盐缓冲液(DPBS)(Hyclone SH30028-01B),Ⅱ型胶原酶(17101-015,Gibco),噻唑蓝(MTT)(M2182,Sigma),催乳素(L6520,Sigma),瘦素(L4146,Sigma),总RNA提取试剂盒(DP430,TIANGEN),反转录试剂盒(DRR036A,TaKaRa),实时定量PCR试剂盒(DRR081,TaKaRa)。
1.2 试验设计试验分为4个处理,瘦素浓度均为100 ng/mL,催乳素浓度分别为0、0.1、1.0、10.0 μg/mL,每个处理6个重复。
引物设计见表1。根据GenBank提供的序列设计引物,由生工生物工程(上海)股份有限公司合成,甘油醛-3-磷酸脱氢酶(GAPDH)为管家基因。将冻干粉状态的引物离心后,用灭菌超纯水配制成100 μmol/L贮备液和10 μmol/L工作液,-20 ℃保存。
|
|
表 1 实时定量PCR引物序列 Table 1 Sequences of primers for the real-time PCR |
参照Miranda等[14]方法,无菌条件下采集泌乳期健康中国荷斯坦奶牛乳腺组织,75%酒精与DPBS交替冲洗并剪碎,Ⅱ型胶原酶消化后离心,弃去上清液,加入培养基接种于25 cm2 细胞培养瓶中,置于37 ℃、5% CO2培养箱内培养4 d左右,然后换液。以后每隔1 d换1次液,并观察细胞生长状况,根据细胞密度和生长情况来决定传代时间。利用细胞对胰酶的敏感度进行传代并冻存。冻存的细胞复苏后,加完全培养基(DMEM/F12培养基,含10%胎牛血清、10 μg/mL表皮生长因子、10 μg/mL胰岛素转铁蛋白硒、1 μg/mL氢化可的松)制成5.0×105 个/mL的细胞悬液,接种到6孔板,每组6个重复,于37 ℃、5% CO2培养箱中培养。24 h后镜下观察细胞是否汇合,完全汇合后,培养基换成催乳素和瘦素处理的培养基继续培养48 h。
1.3.2 细胞生长曲线绘制细胞分别以0.5×104、1.0×104、2.0×104、3.0×104 个/mL的浓度接种于24孔培养板中,每天同一时间进行细胞计数,考察细胞增殖规律。
1.3.3 MTT法检测复苏好的细胞,加完全培养基制成浓度为5.0×104 个/mL的细胞悬液,接种96孔板,每组5个重复,每孔200 μL细胞悬液培养24 h后,换成催乳素和瘦素处理培养基,48 h后,每孔加入5 mg/mL的MTT 20 μL,4 h后,倒掉培养液,每孔加入150 μL的二甲基亚砜(DMSO),酶标仪450 nm波长下测吸光度(OD)值。
1.3.4 总RNA提取按照试剂盒说明进行,处理细胞消化离心后提取总RNA,应用1.5%琼脂糖凝胶电泳检测所提取RNA是否完整,并用多功能酶标仪测定490 nm下RNA浓度及OD260 nm/OD280 nm。
1.3.5 反转录使用反转录试剂盒把所提取的RNA反转录成cDNA,反应体系为10 μL(200 ng RNA):无酶水6 μL,dNTP Mix 2 μL,RNA 2 μL。反应条件为37 ℃,15 min;85 ℃,5 s。
1.3.6 实时定量PCR反应体系为20 μL,SYBR Premix Ex TaqTM Ⅱ(2×)10 μL,上、下游引物(10 μmol/L)各0.4 μL,cDNA 2 μL,无酶水7.2 μL。主要反应条件为95 ℃预变性30 s;95 ℃变性30 s,退火20 s,72 ℃延伸30 s,40个循环;70~95 ℃熔解曲线0.5 ℃每6 s。
1.4 数据统计分析基因表达数据采用2-△△Ct法进行计算,公式如下:
△Ct=Ct目的基因-Ct管家基因;
△△Ct=△Ct试验组-△Ct对照组;
基因表达=2-△△Ct。
数据采用SAS 9.0软件包中的平衡试验设计方差分析过程(ANOVA),平均值的多重比较采用Duncan氏法进行,结果用平均值±标准误来表示,其中P<0.05表示处理间差异显著,P<0.01表示处理间差异极显著。
2 结果与分析 2.1 奶牛乳腺上皮细胞体外培养体系的建立 2.1.1 奶牛乳腺上皮细胞形态学观察如图1所示,培养3 d的原代细胞,乳腺上皮细胞刚贴壁,多为椭圆形,而多角形的细胞为成纤维细胞。培养5 d的原代细胞,乳腺上皮细胞生长旺盛。培养24 h的经纯化的传1代细胞,贴壁细胞基本上是呈鹅卵石样的乳腺上皮细胞,成纤维细胞很少。培养24 h的传2代细胞,此时乳腺上皮细胞较纯,基本上看不到成纤维细胞。
2.1.2 生长曲线绘制如图2所示,细胞生长包括3个时期,即潜伏期、指数期和平台期。正常的细胞生长曲线呈“S”形。摸索试验分别以0.5×104、1.0×104、2.0×104、3.0×104 个/mL的浓度接种于24孔培养板中,每天同一时间进行细胞计数,考察细胞增殖规律。结果显示3.0×104 个/mL最符合乳腺上皮细胞生长“S”形曲线,具有正常的分裂增殖特性。
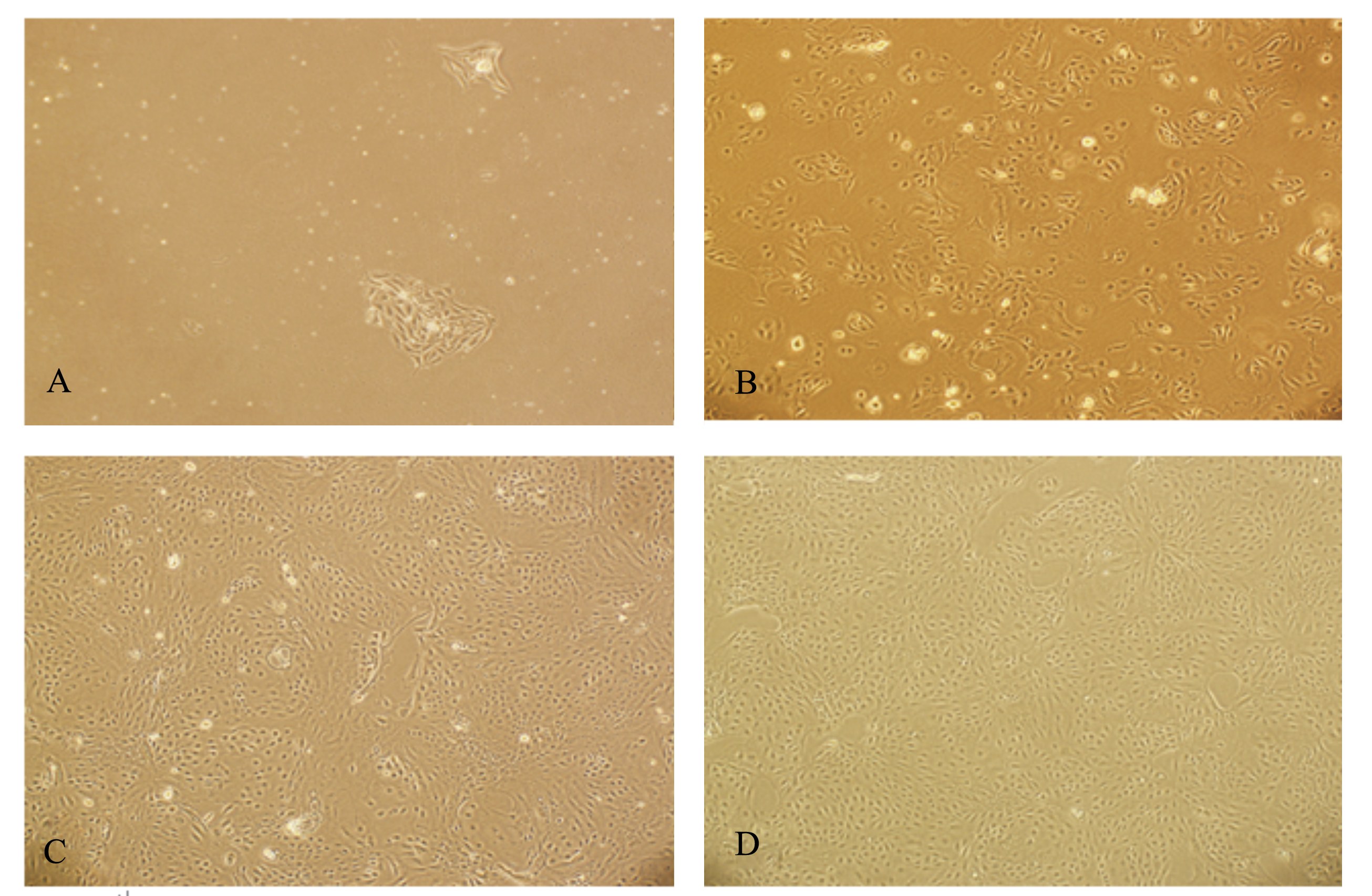 | A:3 d 原代细胞;B:5 d 原代细胞;C:24 h 传1 代细胞;D:24 h 传2 代细胞。
A: 3 d primary cell; B: 5 d primary cell; C: 24 h 1st passage cell; D: 24 h 2nd passage cell. 图1 乳腺上皮细胞形态学观察 Fig. 1 The morphology of mammary epithelial cells (100×) |
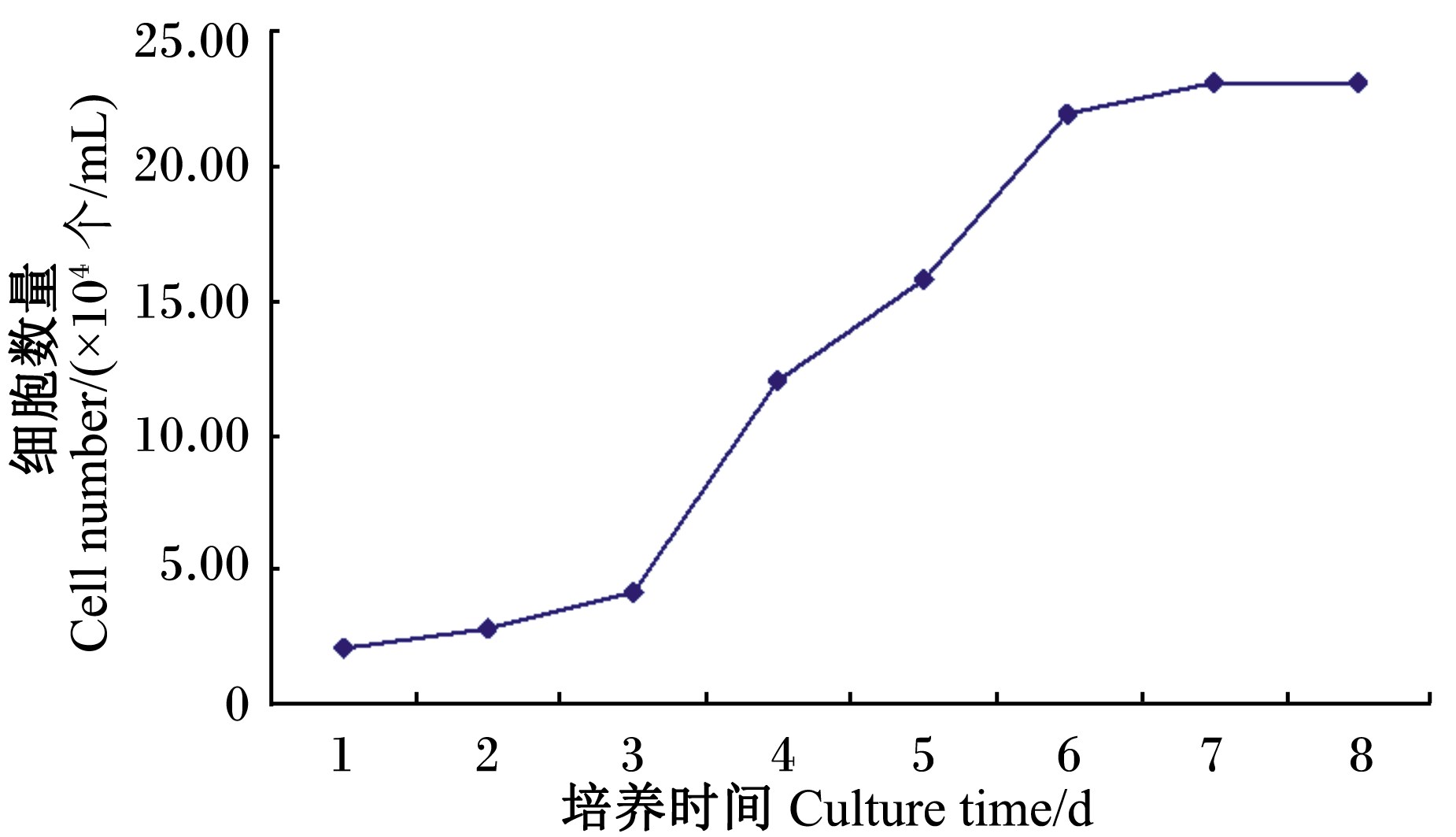 | 图2 乳腺上皮细胞生长曲线 Fig. 2 Growth curve of mammary epithelial cells |
如图3所示,检测得到的目的基因α-酪蛋白(α-casein)、β-酪蛋白(β-casein)与β-乳球蛋白(β-LGB)基因片段大小分别与预期片段大小189、146和115 bp相符,且无非特异性条带。
通过以上对所培养细胞进行形态学观察、细胞生长曲线绘制及乳腺上皮细胞特有乳蛋白基因表达的检测,确定从培养体系中能获得大量纯净且有较好增殖分化潜能的乳腺上皮细胞,可用于后续的试验研究。
2.2 催乳素和瘦素互作对奶牛乳腺上皮细胞增殖的 影响在相同的瘦素(100 ng/mL)处理浓度下,添加4个梯度浓度催乳素(0、0.1、1.0、10.0 μg/mL),处理细胞48 h后MTT法测细胞增殖。由表2可知,0.1和1.0 μg/mL催乳素处理显著高于0 μg/mL催乳素处理(P<0.05),但0.1和1.0 μg/mL 2个处理之间无显著差异(P>0.05);由于10.0 μg/mL催乳素处理数据差异变动异常,所以剔除。由此推断在瘦素一定浓度基础上,催乳素浓度增加对乳腺上皮细胞有促增殖作用,但浓度的不断增高并不会进一步促进增殖。
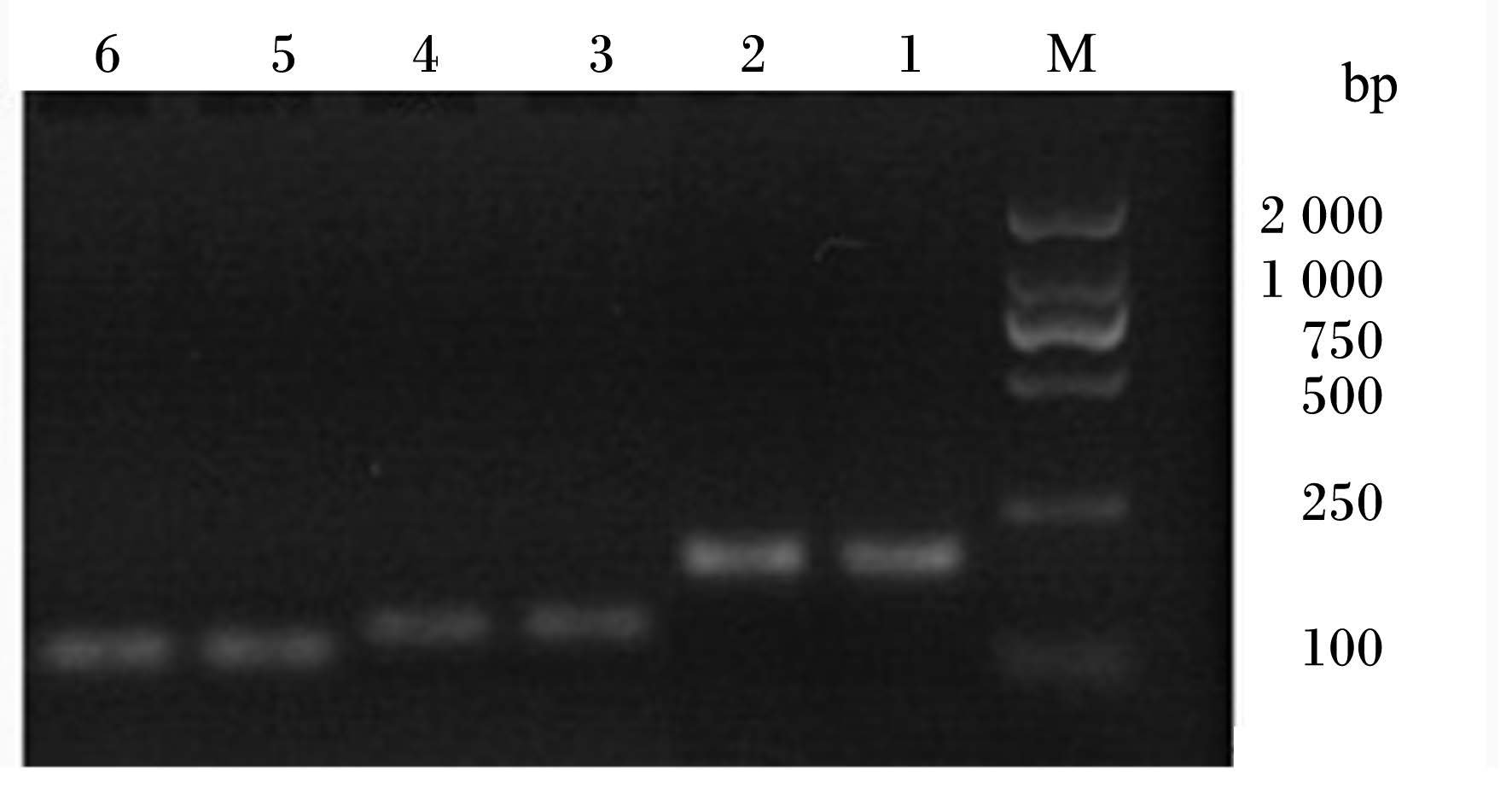 | M:DNA 分子质量标准DNA molecular weight marker; 1 ~ 2:α-酪蛋白α⁃casein;3 ~ 4:β-乳球蛋白β⁃LGB;5 ~ 6: β-酪蛋白β⁃casein。图3 主要乳蛋白基因表达PCR检测结果 Fig. 3 The results of gene expressions of main milk proteins detected by PCR |
提取培养细胞总RNA,RNA浓度和纯度检测正常,各处理样品浓度均保持在200~300 ng/μL的范围,OD260 nm/OD280 nm测定值在1.8~2.0之间,没有蛋白质和DNA的污染,如图4所示,可用于后续基因表达的分析。
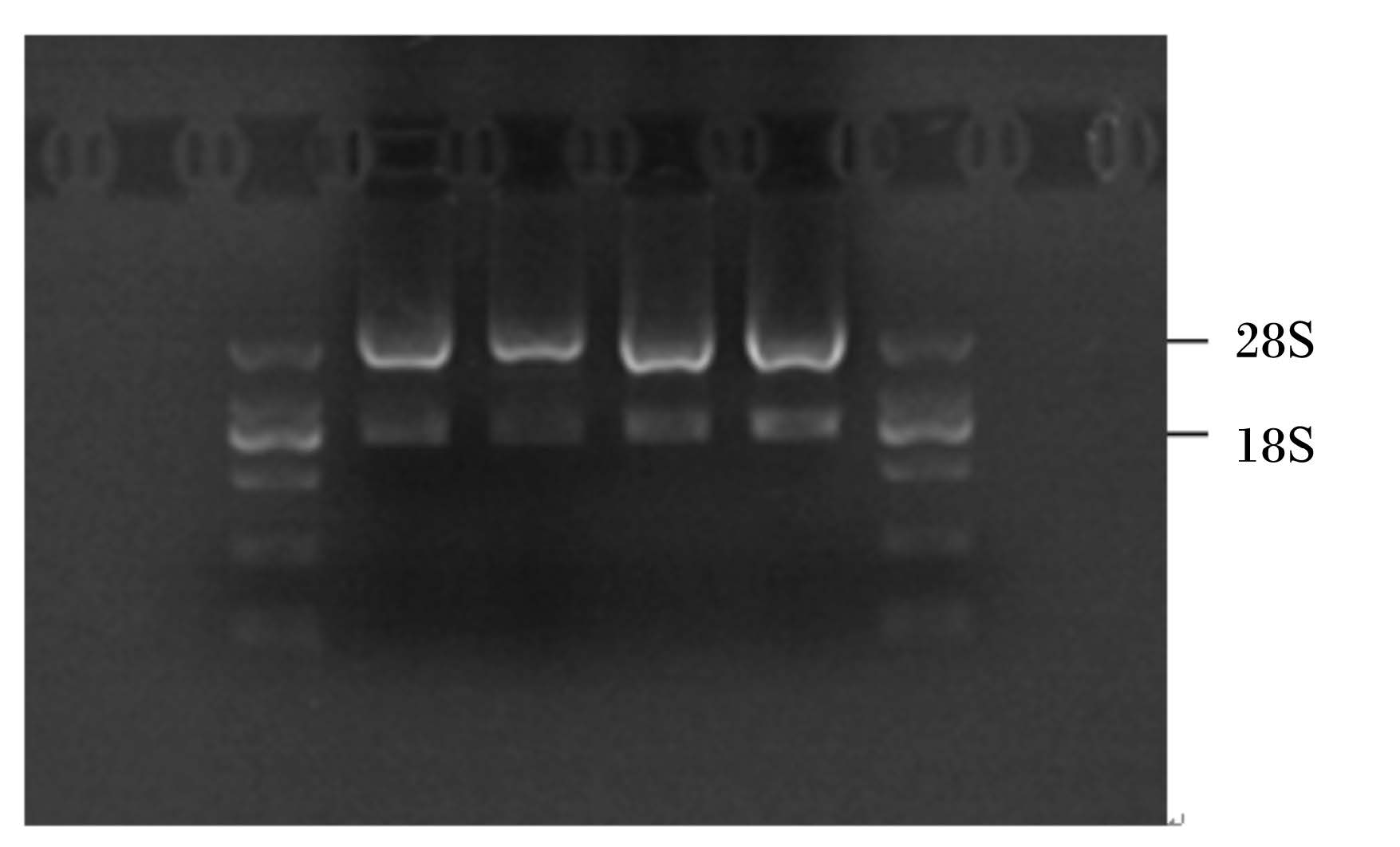 | 图4 奶牛乳腺上皮细胞总RNA电泳结果 Fig. 4 Total RNA electrophoresis result of bovine mammary epithelial cells |
如图5所示,瘦素一定浓度(100 ng/mL)前提下,随着催乳素浓度提高,αs1-酪蛋白、αs2-酪蛋白、κ-酪蛋白和β-LGB基因表达呈先下降、上升再下降的动态。αs1-酪蛋白、β-酪蛋白、β-LGB基因表达先显著下降、再显著升高、再显著下降(P<0.05);αs2-酪蛋白基因表达0.1和10.0 μg/mL催乳素处理显著低于0 μg/mL催乳素处理(P<0.05);κ-酪蛋白基因表达1.0 μg/mL催乳素处理显著高于其他处理(P<0.05)。
2.3.3 催乳素和瘦素互作对JAK2、STAT5与mTOR信号分子基因表达的影响如图6所示,JAK2基因表达随着催乳素浓度的提高而显著上升(P<0.05);而STAT5基因表达则先显著下降、再显著上升、再显著下降(P<0.05),10.0 μg/mL催乳素处理与0 μg/mL催乳素处理相比没有显著变化(P>0.05);mTOR基因表达1.0 μg/mL催乳素处理显著高于其他处理(P<0.05)。
3 讨 论乳蛋白的合成与分泌受基因型和环境因素的双重调控,乳蛋白含量的变化主要跟营养水平、内分泌变化以及乳腺中众多影响蛋白质代谢的调控因子相关。这些调节因素共同作用,形成复杂而精密的乳蛋白合成调控网络,从基因转录、蛋白翻译和代谢水平等多个层次影响乳蛋白的合成[15]。同机体其他任何生理系统相比,内分泌系统在调控乳腺发育、泌乳起始和维持泌乳过程中起主导作用。影响乳蛋白合成与分泌的激素主要有生长激素、胰岛素、催乳素和雌激素等[16]。催乳素是由脑垂体的嗜酸细胞分泌的一类单链多肽类激素,是最重要的一种泌乳激素,它在怀孕期乳腺上皮细胞的形态发生和分化中起着重要作用,并直接调控泌乳期乳腺的乳蛋白合成[2]。催乳素对奶牛泌乳的影响包括:刺激氨基酸和葡萄糖吸收,促进乳腺发育、乳汁生成,发动和维持泌乳等[17]。而脂肪细胞因子瘦素主要是由白色脂肪组织分泌的一种肽类激素,其他组织内也有少量分泌。瘦素在能量代谢的调控和协同中起着关键性的作用[18],因此,瘦素可能在孕期和泌乳期的能量消耗过程中对有关营养物质分配的能量代谢发挥着重要作用[3]。
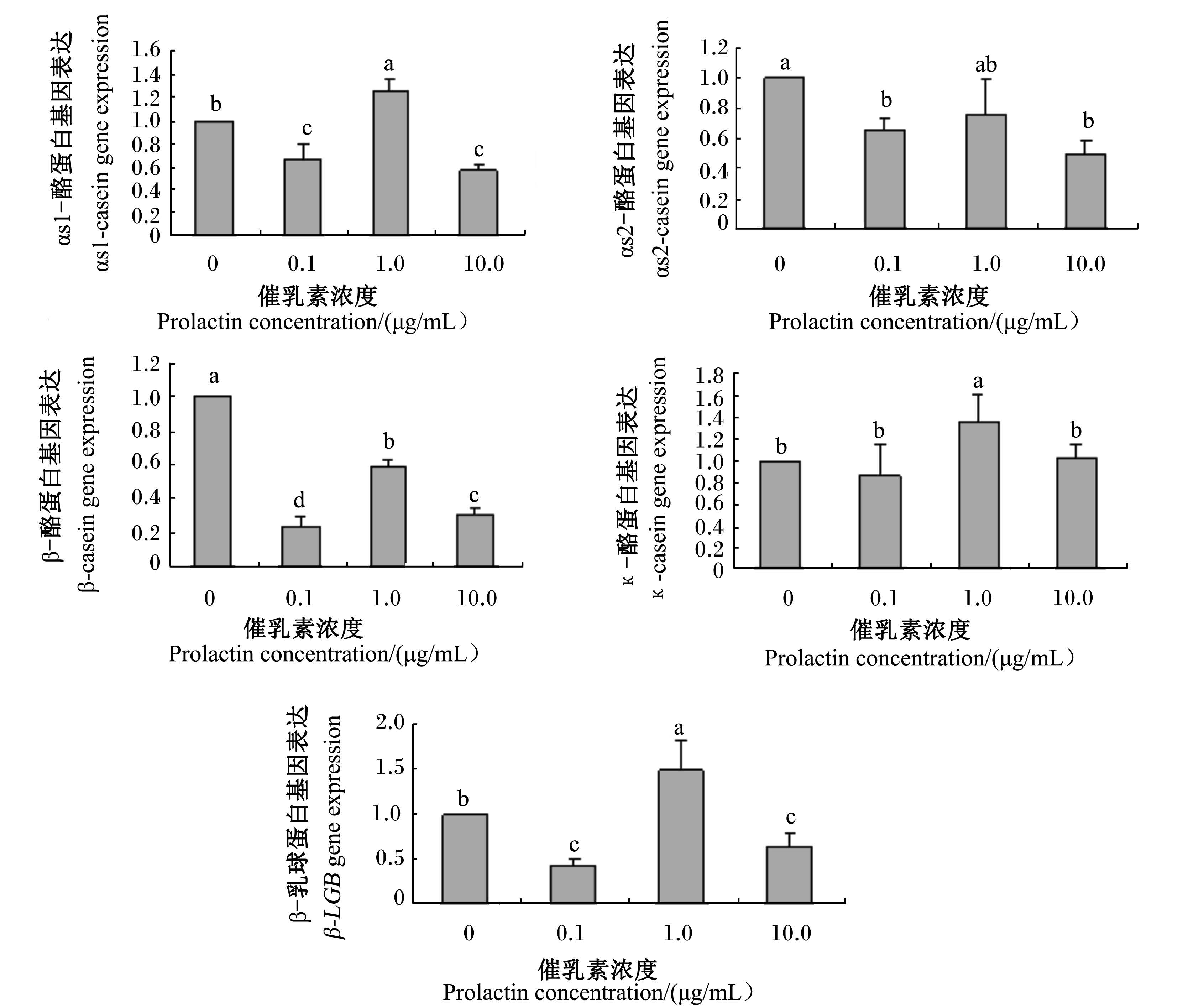 | 数据柱形标注不同小写字母表示差异显著(P<0.05)。图6 同。 Value columns with different small letters mean significant difference (P<0.05). The same as Fig 6.图5 催乳素和瘦素对αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白、β-LGB基因表达的影响 Fig. 5 Effects of prolactin and leptin on αs1-casein,αs2-casein,β-casein,κ-casein and β-LGB gene expressions |
目前,瘦素和催乳素对乳腺泌乳功能的作用研究大多数集中在人类和啮齿类动物(大鼠、小鼠)的乳腺模型上[4, 5, 6];催乳素对乳腺上皮细胞功能影响的研究逐渐深入,且越来越趋向于泌乳信号转导与分子机制的研究[7],而乳腺中瘦素的研究相对薄弱,多数限于组织分布、mRNA水平表达和简单的功能确定等[8, 9, 10]。Chebel等[19]研究认为瘦素基因型与荷斯坦奶牛的泌乳性能和健康状况紧密相关,而关于二者的交互作用报道很少。本研究选取的瘦素浓度为100 ng/mL,是基于我们前期的试验结果和文献研究的基础上确定的。Feuermann等[11]利用泌乳奶牛和犊牛乳腺组织块培养研究了不同梯度浓度瘦素(0、10、100 ng/mL)在催乳素添加和不添加(0、1 μg/mL)情况下对乳腺泌乳特性的影响,结果表明,催乳素显著诱导β-LGB和α-酪蛋白基因表达,瘦素添加情况下,更进一步促进了这2个乳蛋白的基因表达,是单纯添加催乳素基因表达的3倍之多,瘦素浓度增加没有剂量效应。王春艳等[13]也在催乳素添加和不添加条件下,研究了不同浓度瘦素对奶牛乳腺上皮细胞中主要乳蛋白基因表达的影响,结果显示,在无催乳素条件下,瘦素未促进、甚至抑制α-酪蛋白、β-酪蛋白基因的表达,而在有催乳素条件下,瘦素极显著促进α-酪蛋白、β-酪蛋白基因的表达,其中100 ng/mL处理效果最显著。另外不论有、无催乳素,瘦素均促进奶牛乳腺上皮细胞中β-LGB基因的表达。我们的结果也进一步验证了前人的研究,本研究中,瘦素固定浓度(100 ng/mL)下不同梯度浓度催乳素处理后,1.0 μg/mL的催乳素处理对αs1-酪蛋白、κ-酪蛋白和β-LGB基因表达有显著的促进作用,低于或高于这个浓度都显著降低或无显著影响,规律较一致。这样的结果说明催乳素的影响有剂量范围。瘦素本身也受到催乳素的调节,Feuermann等[11]的研究还表明泌乳乳腺组织中催乳素诱导瘦素及其受体基因显著表达,但对犊牛乳腺组织的瘦素及其受体表达无显著影响。瘦素的表达和分泌也受其他各种因子的调控,例如胰岛素、糖皮质激素、肿瘤坏死因子-α(TNF-α)、雌激素和CCAAT增强子结合蛋白可以提高瘦素的表达和分泌,雄激素、游离脂肪酸、生长激素和过氧化物酶体增殖物激活受体γ(PPAR-γ)激动剂可以减少瘦素的表达和分泌[20]。对乳腺上皮细胞增殖的作用,本研究瘦素存在基础上,催乳素浓度呈现了和对乳蛋白基因表达影响较为一致的规律,即 1.0 μg/mL催乳素处理显著促进乳腺上皮增殖,浓 度增大并不会提高促进作用,Silva等[21]对青春期前的小母牛经乳头管进行了高剂量瘦素灌注(100 μg/d),同时灌注0、10 μg/d胰岛素样生长因子Ⅰ(IGF-Ⅰ),结果表明,瘦素显著降低了乳腺上皮细胞的增殖,且对IGF-Ⅰ有抑制作用。王春艳等[22]研究表明适宜浓度的瘦素可促进奶牛乳腺上皮细胞的增殖,并呈现一定的浓度和时间依赖性,在无催乳素的情况下,促增殖效果更明显,但是高浓度的瘦素对乳腺上皮细胞的增殖表现为显著的抑制作用,这也和Silva等[21]的体内试验结论一致。此方面研究人和啮齿类动物及反刍动物的报道结果各有差异,究其原因,动物品种、培养体系、使用剂量等都可能造成结论的不同。
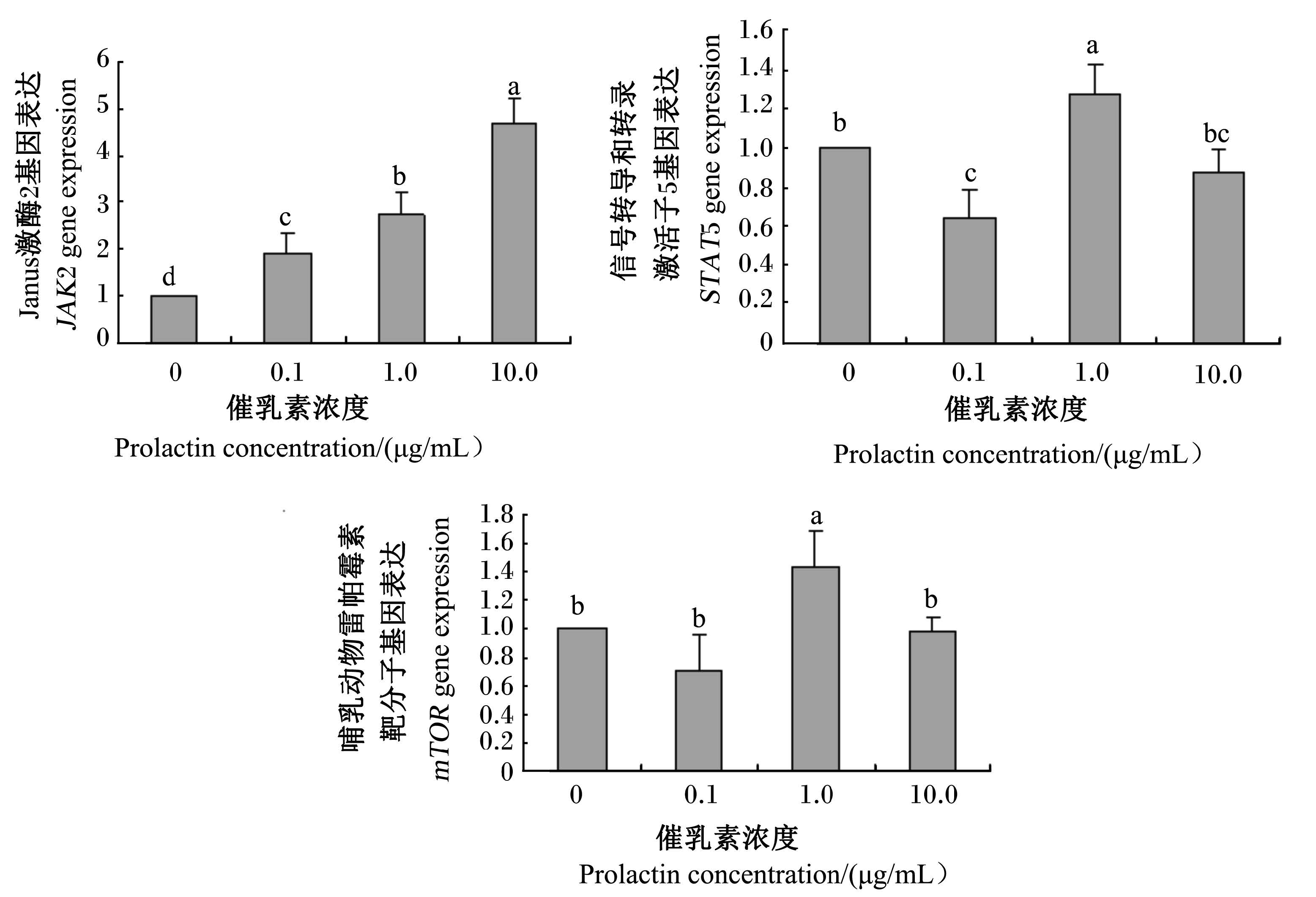 | 图6 催乳素和瘦素对Janus激酶2、信号转导和转录激活子5、哺乳动物雷帕霉素靶分子基因表达的影响 Fig. 6 Effects of prolactin and leptin on JAK2,STAT5 and mTOR gene expressions |
前人研究认为,乳腺的发育和泌乳由激素及由乳腺上皮细胞本身或乳腺脂肪垫中产生的细胞因子协同作用得以调控[23]。脂肪细胞产生的细胞因子可以调节脂肪-上皮细胞间的相互作用,以及改变一些类固醇和肽类激素的活性[24]。足够大的脂肪垫是乳腺成功发育的必需条件,而且乳腺脂肪-上皮细胞间的相互作用对导管的生长和乳腺的形态发生起着关键作用[25]。Feuermann等[26]采用奶牛乳腺脂肪垫脂肪组织块与乳腺上皮细胞共培养体系研究认为,脂肪组织分泌的瘦素受到催乳素的调节,共培养体系中α-酪蛋白基因表达显著高于上皮细胞单独培养体系,并认为瘦素和催乳素正是经由乳腺脂肪垫才发挥了互作作用。所以,我们的结果和相关研究中关于催乳素和瘦素的互作也进一步说明了乳腺脂肪垫和乳腺上皮细胞之间的分子对话联系。
催乳素、瘦素与受体结合后都可以通过Janus激酶(JAK)/信号转导和转录激活子(STAT)细胞信号转导途径调控乳蛋白的合成[7, 16]。当前,最为人们关注的乳蛋白合成的基因转录调控就是JAK/STAT信号转导途径,参与乳蛋白合成的主要是JAK2/STAT5信号通路,该途径可以发挥信号转导和基因转录活化子蛋白的双重作用,介导多种细胞因子和生长因子的细胞内信号转导过程,并活化相应靶基因,从而产生生物学效应[27]。由催乳素介导的JAK2/STAT5信号途径的机制研究已经比较透彻,乳蛋白的合成过程中,催乳素等激素及IGF、表皮生长因子等细胞因子与其受体结合后,通过JAK2激活STAT5,STAT5进入细胞核内与靶基因结合,调控基因的转录[28]。本研究中,催乳素的不同梯度对JAK2、STAT5 2个因子基因表达的影响不尽一致,但1.0 μg/mL催乳素处理 均显著促进了2个因子的基因表达。另外,这些 激素和细胞因子也可能通过mTOR信号途径调控乳蛋白合成[29],mTOR信号通路是乳蛋白合成的重要调控途径。mTOR是雷帕霉素(rapamycin)的靶分子,是一种丝氨酸/苏氨酸激酶,mTOR不仅是氨基酸驱动蛋白合成的信号通路,同时也是生长激素、胰岛素等激素调节乳蛋白合成的关键分子[30]。我们的研究表明,100 ng/mL瘦素和1.0 μg/mL催乳素处理显著提高了mTOR的基因表达。以上这些结果也从信号转导途径解释了催乳素和瘦素对乳蛋白基因表达的影响机制,即催乳素和瘦素很可能通过调控信号转导因子JAK2/STAT5和mTOR因子的表达从而影响乳蛋白基因的表达,见图7,但催乳素的浓度须控制在一定范围,过高或过低剂量都会呈现反向抑制效应。
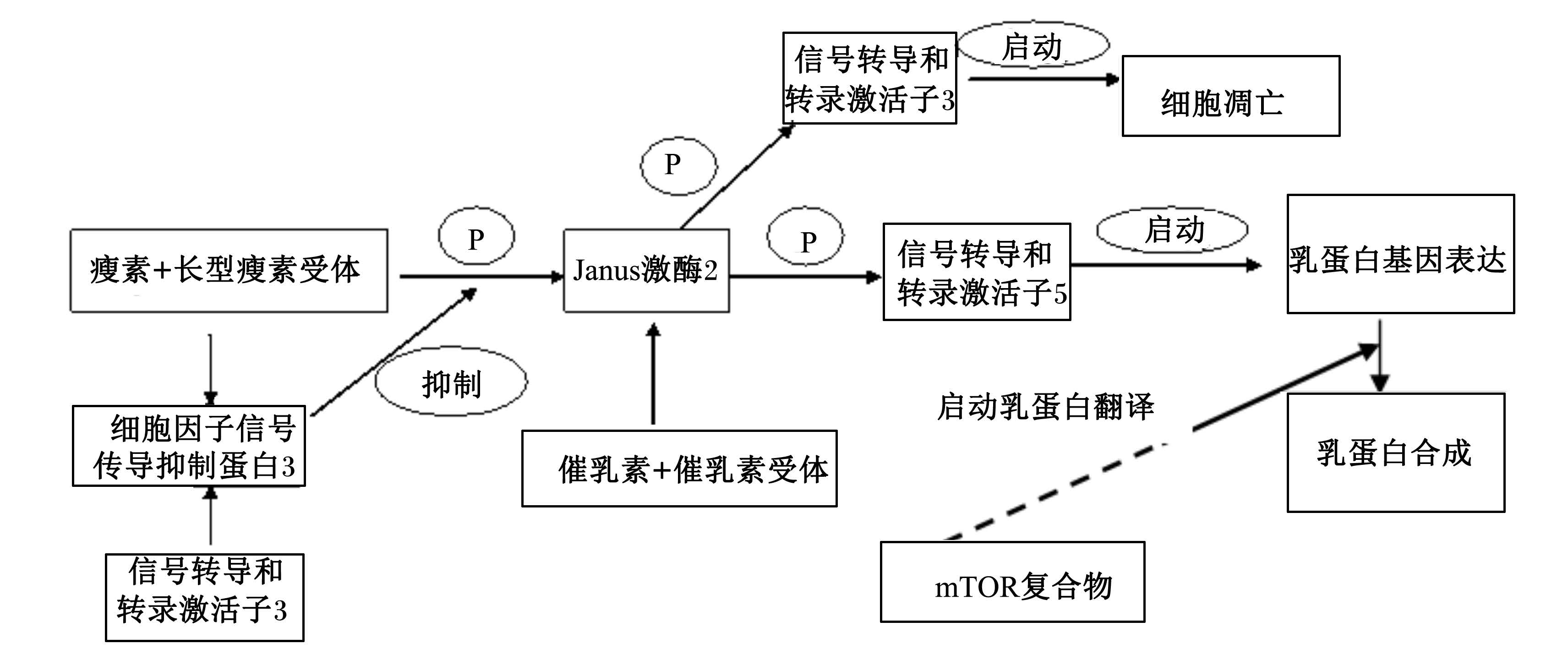 | 图7 催乳素和瘦素调控乳蛋白合成的分子机制 Fig. 7 Molecular mechanism of protein synthesis regulated by prolactin and leptin |
激素对乳品质形成的影响机制十分复杂,除直接调节乳腺中乳蛋白基因转录和翻译过程以外,还可以通过调节乳腺血流量、通过调节机体能量平衡和物质代谢过程对流经乳腺的乳成分前体物的构成进行调节,间接影响乳蛋白的合成[31]。关于激素对乳蛋白合成的影响还需要更多横向和纵向的深入研究。总而言之,通过营养调控等手段维持机体能量平衡,发挥激素促进乳蛋白合成的正向作用,减少异常代谢或病理变化引发的负调控作用,将对提高牛奶营养品质和促进我国奶业健康可持续发展具有重要意义[32]。
4 结 论① 乳腺上皮细胞体外培养条件下,培养液含瘦素100 ng/mL基础上,催乳素对乳蛋白及信号通路关键因子基因表达有促进作用,但浓度限制在一定范围(0.1~1.0 μg/mL),过高或过低都会呈现抑制效应。
② 瘦素100 ng/mL与催乳素1.0 μg/mL对部分乳蛋白基因及乳蛋白合成相关基因表达有显著的促进作用,且通过调控信号转导因子JAK2、STAT5与mTOR基因表达,从而影响乳蛋白基因的表达。
| [1] |
FRIEDMAN J M,HALAAS J L.Leptin and the regulation of body weight in mammals[J].Nature,1998,395(6704):763-770.( 1) 1)
|
| [2] |
GRONER B.Transcription factor regulation in mammary epithelial cells[J].Domestic Animal Endocrinology,2002,23(1/2):25-32.( 2) 2)
|
| [3] |
MOSCHOS S,CHAN J L,MANTZOROS C S.Leptin and reproduction:a review[J].Fertility and Sterility,2002,77(3):433-444.( 2) 2)
|
| [4] |
ROH S G,BAIK M G,CHOI Y J,et al.The effect of lactogenic hormones on protein synthesis and amino acid uptake in rat mammary acinar cell culture at various physiological stages[J].International Journal of Biochemistry,1994,26(4):479-485.( 2) 2)
|
| [5] |
JANSSON N,GREENWOOD S L,JOHANSSON B R,et al.Leptin stimulates the activity of the system A amino acid transporter in human placental villous fragments[J].The Journal of Clinical Endocrinology & Metabolism,2003,88(3):1205-1211.( 2) 2)
|
| [6] |
QIAN L,LOPEZ V,SEO Y A,et al.Prolactin regulates ZNT2 expression through the JAK2/STAT5 signaling pathway in mammary cells[J].American Journal of Physiology:Cell Physiology,2009,297(2):C369-C377.( 2) 2)
|
| [7] |
BROCKMAN J L,SCHROEDER M D,SCHULER L A.PRL activates the cyclin D1 promoter via the JAK2/STAT pathway[J].Molecular Endocrinology,2002,16(4):774-784.( 3) 3)
|
| [8] |
ZHANG Y,PROENCA R,MAFFEI M,et al.Positional cloning of the mouse obese gene and its human homologue[J].Nature,1994,372(6505):425-432.( 2) 2)
|
| [9] |
YANAGIHARA N,UTSUNOMIYA K,CHEAH T B,et al.Characterization and functional role of leptin receptor in bovine adrenal medullary cells[J].Biochemical Pharmacology,2000,59(9):1141-1145.( 2) 2)
|
| [10] |
CHELIKANI P K,GLIMM D R,KENNELLY J J.Short Communication:tissue distribution of leptin and leptin receptor mRNA in the bovine[J].Journal of Dairy Science,2003,86(7):2369-2372.( 2) 2)
|
| [11] |
FEUERMANN Y,MABJEESH S J,SHAMAY A.Leptin affects prolactin action on milk protein and fat synthesis in the bovine mammary gland[J].Journal of Dairy Science,2004,87(9):2941-2946.( 3) 3)
|
| [12] |
FEUERMANN Y,MABJEESH S J,SHAMAY A.Mammary fat can adjust prolactin effect on mammary epithelial cells via leptin and estrogen[J].International Journal of Endocrinology,2009,2009:427260.( 1) 1)
|
| [13] |
王春艳,杜瑞平,高民,等.Leptin对奶牛乳腺上皮细胞主要乳蛋白基因表达的影响[J].中国畜牧杂志,2013,49(15):58-61.( 2) 2)
|
| [14] |
MIRANDA S G,WANG Y J,PURDIE N G,et al.Selenomethionine stimulates expression of glutathione peroxidase 1 and 3 and growth of bovine mammary epithelial cells in primary culture[J].Journal of Dairy Science,2009,92(6):2670-2683.( 1) 1)
|
| [15] |
BIONAZ M,LOOR J J.Gene networks driving bovine mammary protein synthesis during the lactation cycle[J].Bioinformatics and Biology Insights,2011,5:83-98.( 1) 1)
|
| [16] |
AKERS R M.Major advances associated with hormone and growth factor regulation of mammary growth and lactation in dairy cows[J].Journal of Dairy Science,2006,89(4):1222-1234.( 2) 2)
|
| [17] |
FREEMAN M E,KANYICSKA B,LERANT A,et al.Prolactin:structure,function,and regulation of secretion[J].Physiology Review,2000,80(4):1523-1631.( 1) 1)
|
| [18] |
BANKS A S,DAVIS S M,BATES S H,et al.Activation of downstream signals by the long form of the leptin receptor[J].The Journal of Biological Chemistry,2000,275:14563-14572.( 1) 1)
|
| [19] |
CHEBEL R C,SUSCA F,SANTOS J E P.Leptin genotype is associated with lactation performance and health of Holstein cows[J].Journal of Dairy Science,2008,91(7):2893-2900.( 1) 1)
|
| [20] |
MARGETIC S,GAZZOLA C,PEGG G G,et al.Leptin:a review of its peripheral actions and interactions[J].International Journal of Obesity and Related Metabolic Disorders,2002,26(11):1407-1433.( 1) 1)
|
| [21] |
SILVA L F P,ETCHEBARNE B E,WEBER MIELSEN M S,et al.Intramammary infusion of leptin decreases proliferation of mammary epithelial cells in prepubertal heifers[J].Journal of Dairy Science,2008,91(8):3034-3044.( 2) 2)
|
| [22] |
王春艳.瘦素对奶牛乳腺上皮细胞乳蛋白合成的调控作用研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2012.( 1) 1)
|
| [23] |
NEVILLE M C,MEDINA D,MONKS J,et al.The mammary fat pad[J].Journal of Mammary Gland Biology and Neoplasia,1998,3(2):109-116.( 1) 1)
|
| [24] |
ZANGANI D,DARCY K M,SHOEMAKER S,et al.Adipocyte-epithelial interactions regulate the in vitro development of normal mammary epithelial cells[J].Experimental Cell Research,1999,247(2):399-409.( 1) 1)
|
| [25] |
HOVEY R C,MCFADDEN T B,AKERS R M.Regulation of mammary gland growth and morphogenesis by the mammary fat pad:a species comparison[J].Journal of Mammary Gland Biology and Neoplasia,1999,4(1):53-68.( 1) 1)
|
| [26] |
FEUERMANN Y,MABJEESH S J,NIV-SPECTOR L,et al.Prolactin affects leptin action in the bovine mammary gland via the mammary fat pad[J].Journal of Endocrinology,2006,191:407-413.( 1) 1)
|
| [27] |
SHILLINGFORD J M,HENNIGHAUSEN L.Experimental mouse genetics-answering fundamental questions about mammary gland biology[J].Trends in Endocrinology & Metabolism,2001,12(9):402-408.( 1) 1)
|
| [28] |
BROCKMAN J L,SCHULER L A.Prolactin signals via STAT5 and Oct-1 to the proximal cyclin D1 promoter[J].Molecular and Cellular Endocrinology,2005,239(1/2):45-53.( 1) 1)
|
| [29] |
BURGOS S A,DAI M,CANT J P.Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J].Journal of Dairy Science,2010,93(1):153-161.( 1) 1)
|
| [30] |
BEUGNET A,TEE A R,TAYLOR P M,et al.Regulation of targets of mTOR(mammalian target of rapamycin) signalling by intracellular amino acid availability[J].Biochemical Journal,2003,372(Pt 2):555-566.( 1) 1)
|
| [31] |
文静.两种典型日粮模式对奶牛泌乳量、乳品质及泌乳相关激素的影响[D].硕士学位论文.长春:吉林大学,2013.( 1) 1)
|
| [32] |
王建发.乳脂肪和乳蛋白主要前体物对DCAPCs中GH和PRL的影响及机制研究[D].博士学位论文.长春:吉林大学,2013.( 1) 1)
|




