传统代谢模型认为蛋白质须被消化成游离氨基酸后方可吸收利用,而国内外试验研究表明,小肽是肠道中蛋白质分解的主要产物,且小肽比氨基酸更易被机体吸收。因小肽种类繁多,较难检测,转运小肽蛋白研究为小肽营养研究提供了新思路。且有研究表明,消化过程中形成寡肽的数量和比例与饲粮蛋白质品质有关。随着分子克隆技术的出现,小肽转运蛋白的功能和结构逐渐被人们发现。研究表明,质子依赖的寡肽转运蛋白(proton-dependent oligopeptide transporters,POTs)利用质子的动力介导一系列短链肽和拟肽类物质的细胞转运。目前POTs家族在哺乳动物中已确定出4个成员,分别是PepT1、PepT2、PHT1和PHT2[1, 2]。近年来,小肽的营养学价值受到人们的不断关注,小肽转运蛋白的研究也成为了现在的研究热点。而肠道是蛋白质消化吸收的主要场所,蛋白质经胃和小肠内蛋白酶和肽酶作用,降解为游离氨基酸和寡肽(二肽和三肽),然后分别由氨基酸转运载体蛋白以及寡肽转运蛋白吸收并转运进入体内。Aguerre等[3]用粗蛋白质含量为16.2%,而精粗比不同的饲粮饲喂奶牛,发现随着饲粮中粗料水平的增加,乳蛋白率呈线性下降。目前,已知属于POTs家族的转运蛋白包括PepT1、PepT2、PHT1和PHT2等[1],但鲜见PepT1和PepT2在犊牛肠道小肽营养吸收的研究。本试验旨在研究不同精粗比饲粮对犊牛各肠段PepT1、PepT2、PHT1和PHT2 mRNA表达的影响,并为进一步的研究提供理论依据。
1 材料与方法 1.1 试验动物及饲粮试验于2014年3月至2014年5月在扬州大学实验农牧场进行。选择6头(104±2)日龄、平均体重为(121.25±4.12) kg的中国荷斯坦断奶公犊牛。根据NRC(2001)营养需要配制各处理犊牛颗粒料。保证各处理颗粒料营养水平一致的前提下,通过调整精料中的玉米、豆粕、DDGS、麦麸和粗料的苜蓿、小黑麦草的含量来配制不同精粗比的颗粒料。处理Ⅰ和处理Ⅱ分别饲喂精粗比为75 ∶ 25和65 ∶ 35的颗粒料。粗料按照苜蓿和小黑麦草3 ∶ 1组成。所有原料经粉碎后在扬州大学农牧场采用20型颗粒料机组制成。颗粒料组成及营养水平见表1,营养水平检测方法参照《饲料分析及饲料质量检测技术》[4]。
|
|
表 1 颗粒料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of pellet feeds (DM basis) |
按日龄、体重相近,遗传基础相似的原则,试验犊牛随机分为2个处理,每个处理3头。颗粒料每天于08:30、14:30、20:30饲喂3次,预试期14 d,正试期 56 d。根据3~6月龄犊牛采食量需要,每周调整1次饲喂量,并保证每个处理犊牛的干物质采食量基本一致。试验期每个处理犊牛分栏饲养,自由饮水,保证每天有6~7 h户外活动时间,每日清晨犊牛饲喂后打扫圈舍,且每周对牛舍至少2次消毒。
试验结束后,宰前禁食12 h。沿纵向剖开腹腔,分离肠道,采集十二指肠、空肠、回肠、盲肠、结肠的黏膜层,用少许4 ℃预冷的灭菌生理盐水冲洗,分别分装入1.5 mL的离心管中,至液氮速冻,-80 ℃冷冻保存,以备逐一测定。
1.3 试验方法 1.3.1 肠道各段组织总RNA的提取及检测应用Grinder公司高通量组织研磨仪对组织进行匀浆,按照天根生化科技有限公司的RNA提取试剂盒提取。One Drop测定总RNA的浓度和纯度,根据OD260 nm/OD280 nm来评价RNA纯度。再进行1%甲醛变性琼脂糖凝胶电泳,根据28S rRNA、18S rRNA、5S rRNA的亮度评价RNA是否有降解。
1.3.2 cDNA的合成采用TaKaRa的反转录试剂盒。试验于冰上进行,取PrimeScriptTM RT Master Mix 2 μL,dH2O和RNA组成10 μL体系,再在Eppendorf公司的PCR仪上进行反转录。反应条件:37 ℃扩增15 min,85 ℃变性5 s,4 ℃保存,长期保存于-20 ℃。
1.3.3 引物设计与实时荧光定量PCR条件PCR引物采用Primer软件设计,由Invitrogen公司合成,引物序列及参数见表2,将PepT1、PepT2、PHT1、PHT2引物浓度分别稀释成10 μmol/L。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内标,对PepT1、PepT2、PHT1、PHT2 mRNA进行相对定量分析。
|
|
表 2 引物设计 Table 2 Primer design |
以犊牛十二指肠、空肠、回肠和盲肠组织的cDNA为模板,在罗氏Light Cycler 96 PCR仪上进行反应,反应体系20 μL:SYBR Premix Ex Taq Ⅱ(2×) 10 μL,正、反向引物(10 μmol/L)各0.8 μL,cDNA模板 2 μL,灭菌蒸馏水6.4 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,40个循环;95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。反应结束后,根据基因熔解曲线判定PCR反应特异性,根据扩增动力学曲线的循环阈值(Ct)计算荧光定量结果,每个待测样品重复3次。
1.4 数据处理与统计分析各样品引物PCR扩增的Ct由各自的扩增曲线分别得出,并根据公式2-△Ct数学推导得出目的基因的量,在该公式中Ct是热循环仪检测到反应体系中荧光信号的强度值,△Ct=Ct目的基因-Ct管家基因,计算出样品中PepT1、PepT2、PHT1、PHT2基因与管家基因GAPDH相对表达丰度。应用GraphPad Prism 5.0软件进行单因素方差分析(one-way ANOVA),用Tukey’s法进行多重比较,最后结果经均一化处理后,取平均值和标准误作柱状分布图。
2 结 果 2.1 总RNA质量及反转录效果总RNA的OD260 nm/OD280 nm在1.8~2.0之间。用1%琼脂糖凝胶电泳检测,从图1可知,未降解的RNA样品可见到28S、18S带均很清晰、完整,且其亮度比基本符合2 ∶ 1,表明所提取的RNA纯度较高,质量可靠。
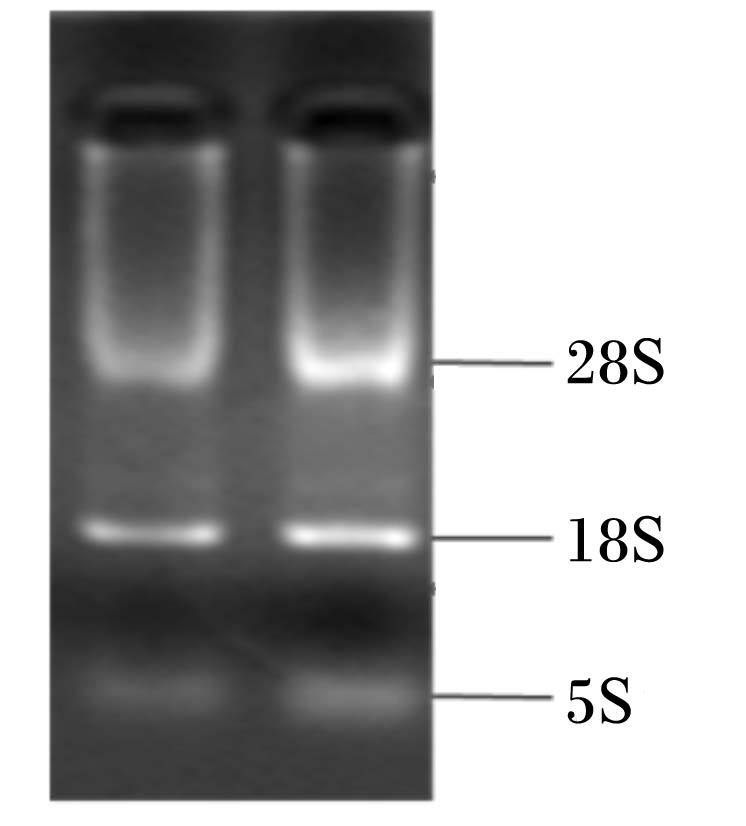 | 图1 总RNA凝胶电泳图 Fig. 1 The electrophoretogram of total RNA |
GAPDH、PepT1、PepT2、PHT1和PHT2基因实时荧光定量PCR扩增产物的退火温度(Tm)分别为87.16、86.42、84.67、88.90和86.42 ℃。GAPDH、PepT1、PepT2、PHT1和PHT2基因实时荧光定量PCR扩增产物的电泳结果如图2所示,根据表1给出的产物大小判定相应的条带是目的基因扩增产物。
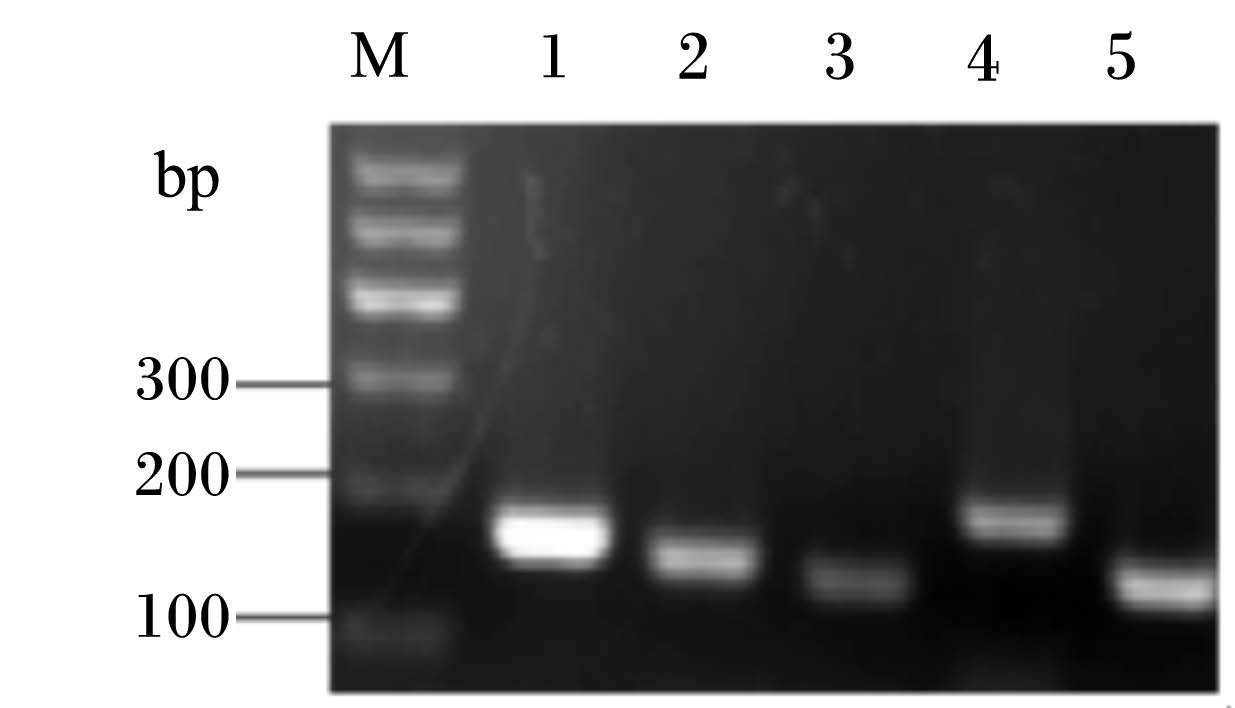 | M:分子质量标准Molecular weight marker;1:甘油醛- 3- 磷酸脱氢酶GAPDH;2:PepT1;3:PepT2;4:PHT1;5: PHT2。 图2 GAPDH、PepT1、PepT2、PHT1和PHT2 mRNA实时荧光定量PCR电泳图 Fig. 2 The electrophoretogram of GAPDH,PepT1,PepT2,PHT1 and PHT2 mRNA by real-time fluorescence quantitative PCR |
由图3可知,十二指肠和空肠PepT1 mRNA表达丰度分别极显著高于回肠、盲肠和结肠(P<0.01),结肠PepT1 mRNA表达丰度显著高于盲肠(P<0.05)。
2.4 犊牛肠道各段组织中PepT1、PepT2、PHT1、PHT2 mRNA的表达由图4-A可知,处理Ⅰ犊牛十二指肠和空肠PepT1 mRNA表达丰度极显著高于处理Ⅱ(P<0.01),结肠PepT1 mRNA表达丰度显著高于处理Ⅱ(P<0.05)。由图4-B可知,处理Ⅰ犊牛十二指肠和结肠PepT2 mRNA表达丰度极显著高于处理Ⅱ(P<0.01)。由图4-C可知,处理Ⅰ犊牛盲肠PHT1 mRNA表达丰度极显著低于处理Ⅱ(P<0.01),回肠和结肠PHT1 mRNA表达丰度显著高于处理Ⅱ(P<0.05)。由图4-D可知,处理Ⅰ犊牛十二指肠、结肠PHT2 mRNA表达丰度极显著高于处理Ⅱ(P<0.01),盲肠PHT2 mRNA表达丰度极显著低于处理Ⅱ(P<0.01)。
3 讨 论 3.1 PepT1和PepT2 mRNA在犊牛肠道中的表达前人在单胃动物[5, 6, 7]和反刍动物[8, 9]的研究中,均发现PepT1 mRNA主要在小肠表达。Chen等[7]和Pan等[8]Northern Blot分析表明,绵羊和泌乳奶牛的PepT1 mRNA在空肠和回肠表达丰度最高,十二指肠较低,盲肠和结肠未检测到。随着检测技术的更新,应用实时荧光定量PCR方法检测牛消化道各段Ⅰ型肽载体的表达,李燕[10]发现牛各肠段PepT1 mRNA表达丰度由高到低的顺序依次为回肠、空肠、十二指肠、盲肠和结肠,刘桂梅[11]的结果由高到低的顺序依次为空肠、回肠、盲肠、十二指肠和结肠。本试验结果表明,PepT1 mRNA主要在犊牛十二指肠和空肠表达,与前人反刍动物的检测结果略有不同。出现这样的差异,可能跟动物的日龄、品种、饲粮组成等有关,具体原因还有待进一步研究。且Xie等[12]认为奶牛十二指肠是小肽吸收的主要部位,与本试验PepT1 mRNA表达结果一致。本试验结果表明,精粗比为75 ∶ 25比65 ∶ 35饲粮更能促进PepT1 mRNA的表达,可能是因为饲粮中蛋白质来源不同。
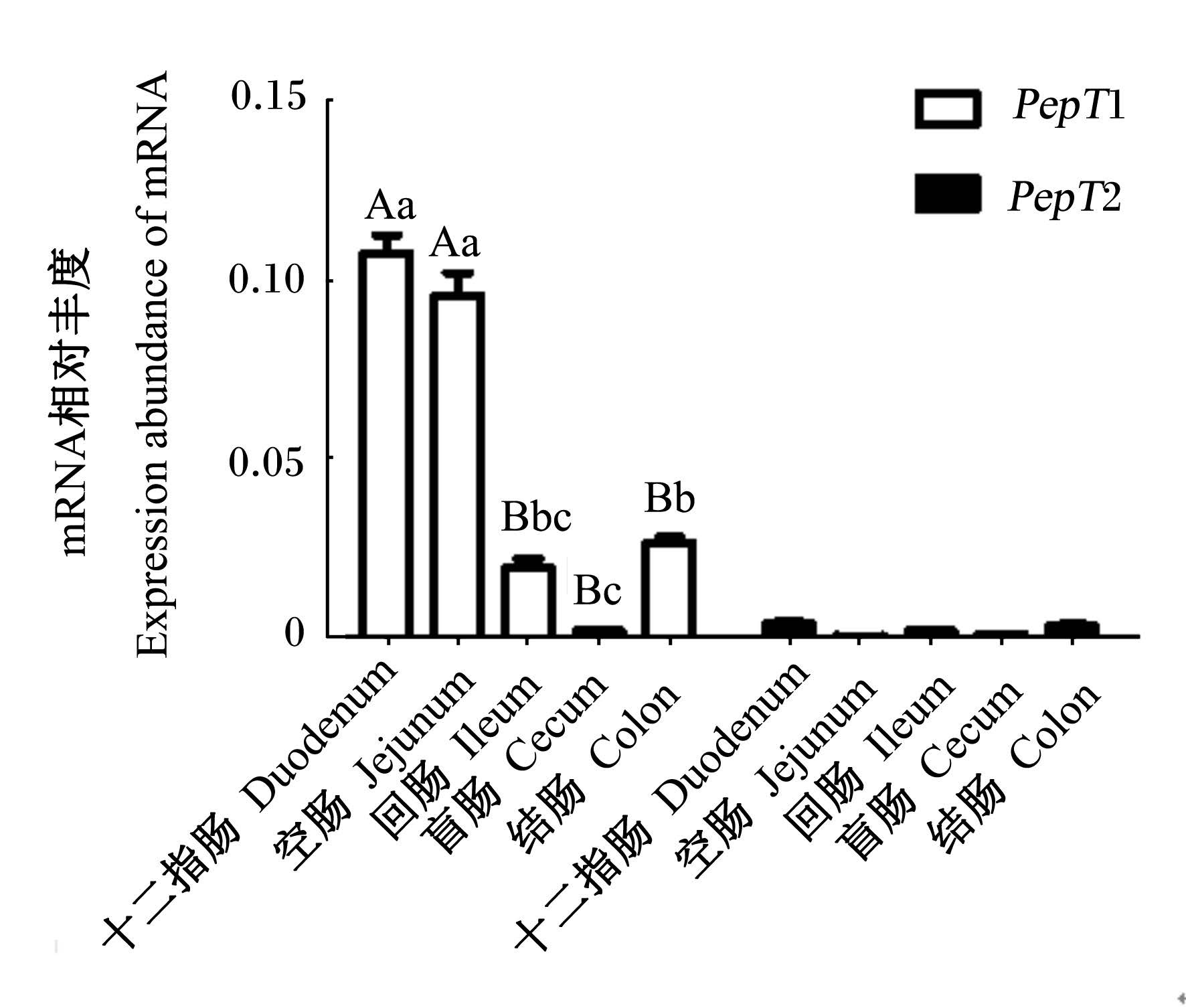 | 数据柱形相同或无字母标注表示无显著差异(P >
0.05),不同小写字母表示差异显著(P<0.05),不同大写字
母表示差异极显著(P<0.01)。 Values with the same or no letters mean no significant difference (P>0. 05),while with different small letters mean significant difference(P<0.05), and with different capital let⁃ ters mean significant difference (P<0.01). 图3 PepT1和PepT2 mRNA在 犊牛肠道中的差异性表达 Fig. 3 Differential expression of PepT1 and PepT2 mRNA in intestine of calves |
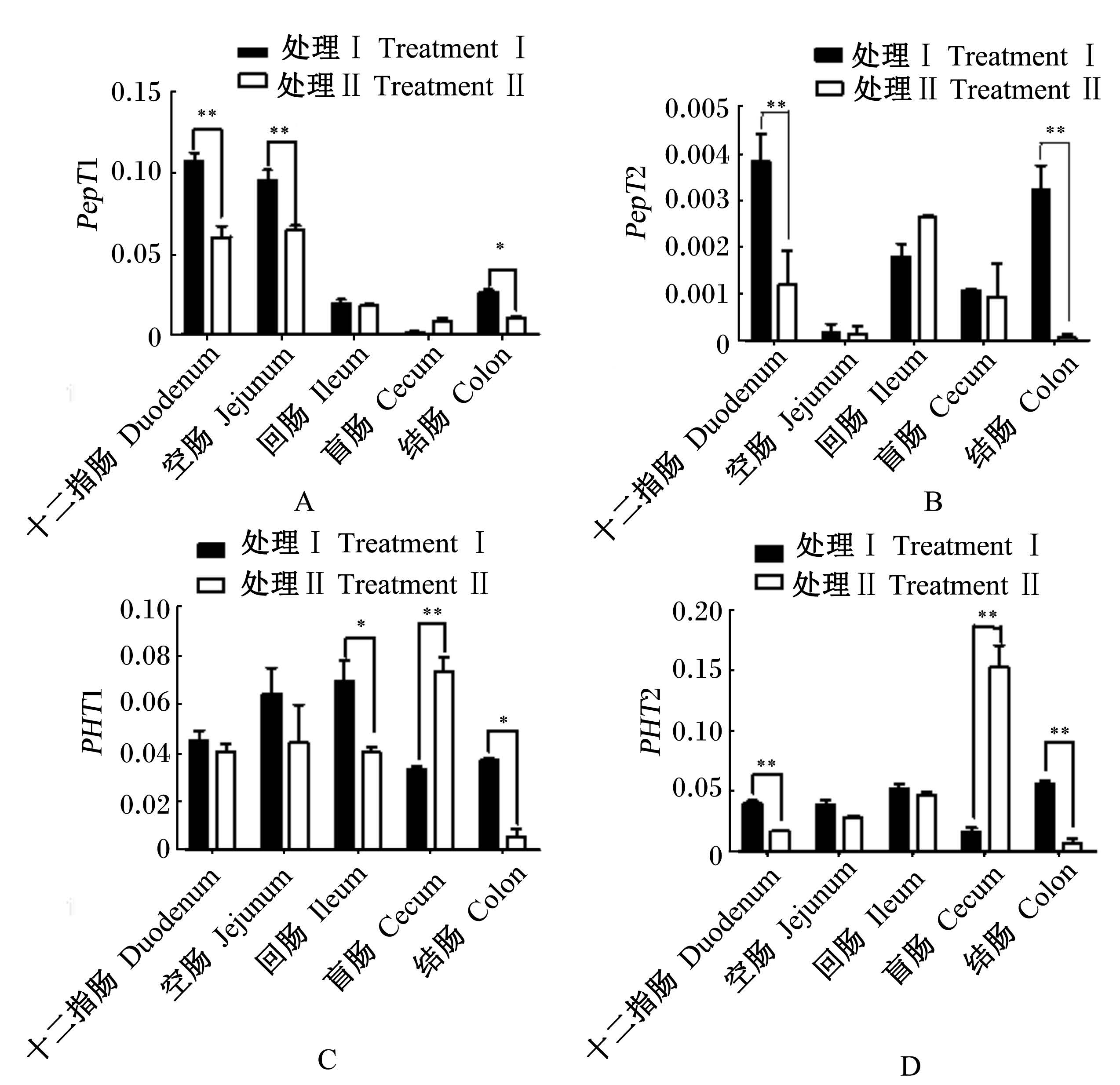 | ∗表示差异显著(P<0.05),∗∗表示差异极显著(P<0.01)。 ∗ mean significant difference (P<0.05), ∗∗ mean extremely significant difference (P<0.01). 图4 PepT1、PepT2、PHT1和PHT2 mRNA在犊牛肠道中的差异性表达 Fig. 4 Differential expression of PepT1,PepT2,PHT1 and PHT2 mRNA in intestine of calves |
PepT2是高亲和力/低容量(high affinity/low capacity)的肽转运蛋白[13]。在大鼠、兔子、牛等动物中检测到肾脏、乳腺、大脑、肺、胰腺、巨噬细胞[14]等组织和细胞均有表达[15, 16]。Zhang等[17]Northern Blot分析表明猴子的肠道中PepT2 mRNA不表达,实时荧光定量PCR分析表明人的肠道中少量表达,本试验中,PepT2 mRNA在肠道中的表达丰度很低,与Zhang等[17]的研究结果一致。本试验中,PepT2 mRNA在肠道中表达丰度虽低,但精粗比为75 ∶ 25饲粮处理十二指肠和结肠PepT2 mRNA表达丰度极显著高于精粗比为65 ∶ 35饲粮处理,与对应的PepT1 mRNA表达一致,PepT1和PepT2之间是否存在一定的相互作用关系还有待进一步研究。
3.2 PHT1和PHT2 mRNA在犊牛肠道中的表达PHT1又叫肽/组氨酸转运蛋白,对组氨酸和肌肽表现出高亲和力[18, 19]。PHT1主要在大鼠脑和视网膜中表达,肠道中不表达[20],而在孵化后的鸡中各组织广泛表达。Bhardwaj等[21]免疫组织化学分析表明PHT1在小肠的绒毛上皮表达。本试验中PHT1 mRNA在犊牛肠中广泛表达,且表达丰度由高到低依次为盲肠、回肠、空肠、十二指肠、结肠,精粗比为75:25饲粮处理回肠、结肠中表达丰度显著高于精粗比为65 ∶ 35饲粮处理,而盲肠中却相反,出现这种情况可能是反刍动物盲肠对粗纤维的消化率高的特点造成的[22]。
PHT2除识别二、三肽化合物为底物之外,还介导组氨酸的转运,但不介导甘氨酸的吸收[20]。目前关于PHT2的研究鲜少,已知大鼠中主要在淋巴系统表达。本试验中,PHT2 mRNA在犊牛肠道中广泛表达,且表达丰度由高到低依次为盲肠、结肠、回肠、空肠、十二指肠,精粗比为75 ∶ 25饲粮处理十二指肠和结肠中的表达丰度显著高于精粗比为65 ∶ 35饲粮处理,而盲肠中却相反,出现这种情况可能也是反刍动物盲肠对粗纤维消化率高的特点造成的[21]。PHT2是582个氨基酸编码的蛋白质,与PHT1具有49%的同一性。Shen等[20]报道鼠中PHT1、PHT2和PepT1、PepT2的同源性低于25%。POTs家族成员的结构、功能、特异性、调节作用及各成员之间的相关性还有待进一步阐明。
3.3 犊牛肠道POTs mRNA表达影响因素研究报道,POTs mRNA的表达受动物的日龄、品种、激素、饲粮组成等因素的影响。Gilbert等[23]给雏鸡饲喂等量优质蛋白质饲粮(大豆蛋白粉),从第3~14天肉鸡体内PepT1 mRNA表达丰度呈不断上升的趋势,同时雏鸡体重显著增加,可见饲粮蛋白质品质是影响PepT1活性的重要因素。本试验中,精粗比为75 ∶ 25比65 ∶ 35饲粮更能促进犊牛十二指肠、空肠、回肠和结肠POTs mRNA的表达,说明犊牛肠道POTs mRNA的表达受饲粮中蛋白质来源的影响。而犊牛屠宰试验结果表明,精粗比为65 ∶ 35饲粮处理犊牛屠宰性能和内脏器官发育均比精粗比为75 ∶ 25饲粮处理略高[24],且精粗比为65 ∶ 35饲粮处理犊牛胃肠道生长发育较好[25],说明犊牛肠道POTs mRNA的表达并不能反映动物个体对蛋白质的吸收利用效率,具体原因还有待进一步研究。
4 结 论① PepT1 mRNA主要在犊牛十二指肠和空肠表达,PepT2 mRNA在犊牛肠道中微弱表达。PHT1主要在犊牛盲肠、回肠、空肠、十二指肠表达,PHT2在犊牛十二指肠、盲肠和结肠表达,尤其是盲肠表达丰度最高。
② 精粗比为75 ∶ 25比65 ∶ 35饲粮更能促进犊牛十二指肠、空肠、回肠和结肠POTs mRNA的表达,而十二指肠作为小肽吸收的主要部位,说明精粗比75 ∶ 25处理随着肠道转运蛋白质分解产物POTs增加,蛋白质更易被吸收。
③ 肠道POTs mRNA的表达受饲粮蛋白质来源的影响,但其并不能反映动物个体对蛋白质的吸收利用效率。
| [1] |
SMITH D E,ClÉMENÇON B,HEDIGER M A.Proton-coupled oligopeptide transporter family SLC15:physiological,pharmacological and pathological implications[J].Molecular Aspects of Medicine,2013,34(2/3):323-336.( 2) 2)
|
| [2] |
SUN D L,WANG Y Q,TAN F Q,et al.Functional and molecular expression of the proton-coupled oligopeptide transporters in spleen and macrophages from mouse and human[J].Molecular Pharmaceutics,2013,10(4):1409-1416.( 1) 1)
|
| [3] |
AGUERRE M J,WATTIAUX M A,POWELL J M,et al.Effect of forage-to-concentrate ratio in dairy cow diets on emission of methane,carbon dioxide,and ammonia,lactation performance,and manure excretion[J].Journal of Dairy Science,2011,94(6):3081-3093.( 1) 1)
|
| [4] |
张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2007.( 1) 1)
|
| [5] |
LIANG R,FEI Y J,PRASAD P D,et al.Human intestinal H+/peptide cotransporter:cloning, functional expression,and chromosomal localization[J].Journal of Biological Chemistry,1995,270(12):6456-6463.( 1) 1)
|
| [6] |
CHEN H,PAN Y X,WONG E A,et al.Molecular cloning and functional expression of a chicken intestinal peptide transporter(cPepT1) in Xenopus oocytes and Chinese hamster ovary cells[J].The Journal of Nutrition,2002,132(3):387-393.( 1) 1)
|
| [7] |
CHEN H,WONG E A,WEBB K E,Jr.Tissue distribution of a peptide transporter mRNA in sheep,dairy cows,pigs,and chickens[J].Journal of Animal Sciences,1999,77(5):1277-1283.( 2) 2)
|
| [8] |
PAN Y X,WONG E A,BLOOMQUIST J R,et al.Expression of a cloned ovine gastrointestinal peptide transporter(oPepT1) in Xenopus oocytes induces uptake of oligopeptides in vitro[J].Journal of Nutrition,2001,131(4):1264-1270.( 2) 2)
|
| [9] |
POOLE C A,WONG E A,MCELROY A P,et al.Ontogenesis of peptide transport and morphological changes in the ovine gastrointestinal tract[J].Small Ruminant Research,2003,50(1/2):163-176.( 1) 1)
|
| [10] |
李燕.牛Ⅰ型肽载体(bPepT1)的克隆及在消化道组织中的表达分析[D].硕士学位论文.泰安:山东农业大学,2006.( 1) 1)
|
| [11] |
刘桂梅.牛消化道Ⅰ型肽载体(bPepT1)表达定量与真核表达技术研究[D].硕士学位论文.泰安:山东农业大学,2009.( 1) 1)
|
| [12] |
XIE Y M,XU Q B,WU Y M,et al.Concentration of soluble non-ammonia nitrogen and related transporter expression in non-mesenteric gastrointestines of dairy cows[C]//2014 ADSA-ASAS-CSAS joint annual meeting. Asas:[s.n.],2014.( 1) 1)
|
| [13] |
GANAPATHY L F H.Is intestinal peptide transport energized by a proton gradient?[J].The American Journal of Physiology,1985,249(2 Pt 1):G153-G160.( 1) 1)
|
| [14] |
RVHL A, HOPPE S, FREY I,et al.Functional expression of the peptide transporter PEPT2 in the mammalian enteric nervous system[J].The Journal of Comparative Neurology,2005,490(1):1-11.( 1) 1)
|
| [15] |
RUBIO-ALIAGA I, DANIEL H.Peptide transporters and their roles in physiological processes and drug disposition[J].Xenobiotica,2008,38(7/8):1022-1042.( 1) 1)
|
| [16] |
BRANDSCH M,KNVTTER I,BOSSE-DOENECKE E.Pharmaceutical and pharmacological importance of peptide transporters[J].Journal of Pharmacy and Pharmacology,2008,60(5):543-585.( 1) 1)
|
| [17] |
ZHANG E Y,EMERICK R M,PAK Y A,et al.Comparison of human and monkey peptide transporters:PepT1 and PepT2[J].Molecular Pharmaceutics,2004,1(3):201-210.( 2) 2)
|
| [18] |
YAMASHITA T,SHIMADA S,GUO W,et al.Cloning and functional expression of a brain peptide/histidine transporter[J].Journal of Biological Chemistry,1997,272(15):10205-10211.( 1) 1)
|
| [19] |
LINDLEY D J,CARL S M,MOWERY S A,et al.The evaluation of peptide/histidine transporter 1(PHT1) function:uptake kinetics utilizing a cos-7 stably transfected cell line[J].Revista Mexicana de Ciencias Farmaceutica,2011,42(4):57-65.( 1) 1)
|
| [20] |
SHEN H,SMITH D E,KEEP R F,et al.Targeted disruption of the PEPT2 gene markedly reduces dipeptide uptake in choroid plexus[J].Journal of Biological Chemistry,2003,278(7):4786-4791.( 3) 3)
|
| [21] |
BHARDWAJ R K,HERRERA-RUIZ D,ELTOUKHY N,et al.The functional evaluation of human peptide/histidine transporter 1(hPHT1) in transiently transfected COS-7 cells[J].European Journal of Pharmaceutical Sciences,2006,27(5):533-542.( 2) 2)
|
| [22] |
秋尾光美,李明贵.犊牛回盲口狭窄的盲肠切除术一例[J].动物医学进展,1980(2):34-35.( 1) 1)
|
| [23] |
GILBERT E R,LI H F,EMMERSON D A,et al.Dietary protein quality and feed restriction influence abundance of nutrient transporter mRNA in the small intestine of broiler chicks[J].The Journal of Nutrition,2008,138(2):262-271.( 1) 1)
|
| [24] |
杨宏波,刘红,朱隆基,等.不同NDF水平全价颗粒饲料对断奶公犊牛屠宰性能和组织器官发育的影响[J].中国农业大学学报,2015,20(2):124-130.( 1) 1)
|
| [25] |
杨宏波,刘红.日粮精粗比对反刍动物生产性能的影响[J].中国奶牛,2015(5):11-14.( 1) 1)
|




