自然界生活的鱼类经常因季节更替或环境变化引起食物的缺乏,从而导致饥饿胁迫,此时鱼类机体中的蛋白质、脂肪、糖原、水分等含量会发生较大变化,这些变化在一定程度上反映了饥饿鱼类对营养物质的利用顺序及其生存策略。国内外学者已就这方面做了大量的研究,如龙章强等[1]、柳敏海等[2]、Einen等[3]、王文等[4]、Tian等[5]分别研究了饥饿条件下黑鲷(Acanthopagrus schlegelii)幼鱼、 鱼(Miichthys miiuy)幼鱼、大西洋鲑(Salmo salar)、尼罗罗非鱼(Oreochromis niloticus)幼鱼、半滑舌鳎(Cynoglossus semilaevis)生化组成的变化规律。同时,在饥饿情况下鱼体内的消化酶活性也会发生相应的变化,出现消化酶活性的负反馈上升[6]。有关鱼类在饥饿过程中消化酶活性的变化报道却较少,仅对花鲈(Lateolabrax japonicus)[7]、施氏鲟(Acipenser schrenckii)[8]、虎鲨(Heterodontus)[9]、锦鲤(Cyprinus carpio)[10]、千年笛鲷(Lutjanus sebae)[11]、大口黑鲈(Micropterus salmoides)[12]、真鲷(Pagrus pagrus)[13]和南亚野鲮(Labeo rohita)[14]等鱼类有过相关研究报道。
银鲳(Pampus argenteus)属鲈形目(Perciformes),鲳科(Stromateidae),鲳属(Pampus),为暖水性中下层集群性鱼类,是我国广泛分布的重要的海洋经济鱼种之一,近十几年国内外已经开展了银鲳的人工育苗与养殖技术研究[15, 16, 17, 18]。目前,对银鲳的研究涉及到分类、资源评估、生态和繁殖特性、人工繁殖、营养成分分析等[19, 20, 21, 22, 23, 24, 25, 26]诸多方面,但关于饥饿胁迫下银鲳幼鱼的生存策略研究尚未见报道。因此,本试验通过研究饥饿条件下银鲳幼鱼生化组成及消化酶活性的变化,进而探讨饥饿银鲳幼鱼的生理策略及物质利用特点,为今后规模化养殖银鲳提供理论参考。
1 材料与方法 1.1 试验鱼来源及驯化试验用银鲳幼鱼为浙江省海洋水产养殖研究所洞头基地室内人工养殖的鱼苗。试验前2周,选取120尾幼鱼在2个直径1.0 m、水深0.7 m的圆形水槽中驯养,每天投饵3次,投饵量为鱼体重的3%~5%。试验鱼体重(2.61±1.05) g,体长(4.70±0.22) cm。试验期间水温为25~27 ℃。饲料为日本林兼株式会社生产的“鱼宝”5#和新鲜马鲛鱼(Scomberomorus niphonius)肉按1 ∶ 1反复绞碎制成的团状料。
1.2 试验设计试验开始后,将经驯化后的幼鱼随机分成3桶饲养,并开始禁食。分别在饥饿0、3、5、7、9 d时取样,并分别命名为S0、S3、S5、S7、S9组。每次从3个试验桶中分别随机取6尾,即每组3个重复,每个重复6尾鱼。
1.3 样品处理活鱼经测量体长和体重后,在冰盘上迅速解剖取肝脏及胃肠道,胃肠道需去除内容物,用预冷的生理盐水冲净后,置-24 ℃下保存备用。去除内脏的全鱼60 ℃烘干至恒重,然后保存在干燥器中用于粗蛋白质、粗脂肪、水分、粗灰分含量及比能值的测定。
1.4 分析测定方法 1.4.1 基本生化成分及比能值的测定采用凯氏定氮法(GB/T 6432—1994)测定粗蛋白质含量;采用索氏乙醚抽提法(GB/T 6433—1994)测定粗脂肪含量;采用105 ℃恒温烘干湿重法(GB/T 6435—1986)测定水分含量;采用连续灰分测定仪在550 ℃灼烧6 h测定粗灰分含量。
鱼体比能值用WGR-1型氧弹式热量计测定,单位为kJ/g。
1.4.2 消化酶活性的测定粗酶液的制备:将肝脏或胃肠道样品称重后加入4倍体积(m/v)的预冷生理盐水,匀浆后用冷冻离心机(Eppendorf-5430R)于4 ℃、2 500 r/min条件下离心10 min,取上清液置于4 ℃下保存,24 h内测定完毕。
酶活性的测定:采用南京建成生物工程研究所的试剂盒测定胃蛋白酶、胰蛋白酶、脂肪酶、淀粉酶活性。采用考马斯亮蓝染色法测定组织样中蛋白质浓度。胃蛋白酶活性单位定义:每毫克组织蛋白质37 ℃下1 min分解蛋白质生成1 μg氨基酸相当于1个酶活性单位;胰蛋白酶活性单位定义:于pH 8.0、37 ℃条件下,每毫克组织蛋白质中含有的胰蛋白酶每分钟使吸光度变化0.003即为1个酶活性单位;脂肪酶活性单位定义:在37 ℃条件下,每毫克组织蛋白质在本反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活性单位;淀粉酶活性单位定义:在37 ℃条件下,每毫克组织蛋白质与底物作用30 min,水解10 mg淀粉定义为1个酶活性单位。酶活性以比活力(每毫克蛋白质的活性单位,U/mg prot)表示。
1.5 数据统计与分析生化成分的变化特征采用以下公式来表示:
ΔC=C1-C2;
PC=(C1-C2)/C1×100;
MC=(C0-Ca)/C0×100。
式中:ΔC表示阶段损失;PC表示相对损失率;MC表示累计损失率;C1表示前1个组饥饿后的基本营养成分百分含量;C2表示后1个组饥饿后的基本营养成分百分含量;C0表示饥饿前S0组的基本营养成分百分含量;Ca表示饥饿处理后的基本营养成分百分含量。
试验数据采用SPSS 17.0软件进行方差分析,用Duncan氏法多重比较检验组间的差异显著性,以P<0.05作为差异显著水平。数据用平均值±标准差(mean±SD)表示。
2 结 果 2.1 饥饿对银鲳幼鱼生化组成的影响 2.1.1 饥饿后粗蛋白质含量的变化饥饿对银鲳幼鱼粗蛋白质含量的影响见表1。饥饿过程中,随着饥饿时间的延长,银鲳幼鱼粗蛋白质含量呈逐渐下降趋势。饥饿3 d时,粗蛋白质含量由S0组的15.36%显著下降至14.69%(P<0.05),相对损失率达4.36%;饥饿5 d时,累计损失率显著上升至7.16%(P<0.05);饥饿7 d时,粗蛋白质含量迅速降至13.47%,显著低于饥饿5 d时(P<0.05);饥饿9 d时,粗蛋白质含量显著下降至13.02%(P<0.05),累计损失率继续上升至15.23%(P<0.05)。从相对损失率来看,高峰出现在饥饿7 d时,为5.51%;饥饿9 d时相对损失率降至3.37%,与饥饿7 d时差异显著(P<0.05)。
|
|
表 1 饥饿对银鲳幼鱼粗蛋白质含量的影响(湿重基础) Table 1 Effect of starvation on crude protein content of juvenile Pampus argenteus (wet weight basis) |
饥饿对银鲳幼鱼粗脂肪含量的影响见表2。鱼体粗脂肪含量在饥饿过程中不断下降,与粗蛋白质含量变化不同的是,饥饿前期下降较快,饥饿后期下降速率降低。饥饿3 d时粗脂肪含量已出现迅速下降,由S0组的1.28%显著下降至0.70%(P<0.05),相对损失率高达45.31%;饥饿5 d时,粗脂肪含量继续显著下降至0.28%(P<0.05),相对损失率达到峰值60%,累计损失率高达77.86%;此后,粗脂肪含量下降速率减缓,至饥饿9 d时,粗脂肪含量为0.21%,累计损失率提高到83.59%。由此可见,粗脂肪的损失以饥饿3~5 d时最快。
|
|
表 2 饥饿对银鲳幼鱼粗脂肪含量的影响(湿重基础) Table 2 Effect of starvation on crude fat content of juvenile Pampus argenteus (wet weight basis) |
饥饿对银鲳幼鱼粗灰分含量的影响见表3。与粗蛋白质和粗脂肪含量的变化不同,随饥饿时间的延长粗灰分含量持续上升。饥饿3 d时,银鲳幼鱼的粗灰分含量由S0组的1.06%迅速上升为2.89%(P<0.05),增幅达1.7倍;但此后上升缓慢,无显著差异(P>0.05)。
|
|
表 3 饥饿对银鲳幼鱼粗灰分含量的影响(湿重基础) Table 3 Effect of starvation on ash content of juvenile Pampus argenteus (wet weight basis) |
饥饿对银鲳幼鱼无氮浸出物含量的影响见表4。鱼体无氮浸出物含量在饥饿过程中不断下降,表现为前期下降较快,中期下降最慢,后期下降最快。在饥饿3、5 d时迅速下降,由S0组的1.30%降至S5组的0.89%(P<0.05),累计损失率为31.53%;饥饿7 d时,下降明显减缓,相对损失率 仅为5.48%;但饥饿9 d时,相对损失率又骤降至28.15%(P<0.05),累计损失率达到53.48%(P<0.05)。
|
|
表 4 饥饿对银鲳幼鱼无氮浸出物含量的影响(湿重基础) Table 4 Effect of starvation on nitrogen-free extract content of juvenile Pampus argenteus (wet weight basis) |
由图1可见,S0组肝脏和胃肠道中的胃蛋白酶活性分别为0.43和1.37 U/mg,随饥饿时间的延长两者均呈上升趋势。饥饿3 d时,肝脏和胃肠道中的胃蛋白酶活性与S0组相比无显著差异(P>0.05);饥饿5 d时,肝脏和胃肠道中的胃蛋白酶活性显著上升,分别是饥饿3 d时的2.7和1.3倍(P<0.05);饥饿7 d时,肝脏中的胃蛋白酶活性上升迅速,超过了胃肠道中的胃蛋白酶活性,是S0组的6.1倍(P<0.05),胃肠道中的胃蛋白酶活性较饥饿5 d时也有升高,但差异不显著(P>0.05);饥饿9 d时,肝脏和胃肠道中的胃蛋白酶活性分别为3.05和2.44 U/mg,分别是S0组的7.1和1.8倍(P<0.05)。
2.2.2 饥饿后胰蛋白酶活性的变化由图2可见,在整个饥饿过程中,银鲳幼鱼肝脏中的胰蛋白酶活性远低于胃肠道中,且两者均随饥饿时间的延长呈线性下降趋势。饥饿3 d时,肝脏和胃肠道中的胰蛋白酶活性分别较S0组显 著下降了46.4%和25.2%(P<0.05);此后至饥饿7 d时,胃肠道中的胰蛋白酶活性一直呈显著性下降(P<0.05),而肝脏中的胰蛋白酶活性下降不显著(P>0.05);至饥饿9 d时,肝脏和胃肠道中的胰蛋白酶活性分别仅为S0组的6.0%和15.9%(P<0.05)。
2.2.3 饥饿后脂肪酶活性的变化由图3可见,在整个饥饿过程中,银鲳幼鱼肝脏和胃肠道中的脂肪酶活性十分接近,且变化趋势一致,两者的脂肪酶活性随饥饿时间的延长呈先升高后下降的态势。饥饿3 d时,肝脏和胃肠道中的脂肪酶活性略有上升,但与S0组无显著差异(P>0.05);饥饿5 d时,肝脏和胃肠道中的脂肪酶活性均较S0、S3组显著升高(P<0.05),分别是S0组的1.5、1.4倍;饥饿7 d时,肝脏和胃肠道中的脂肪酶活性均呈显著性下跌(P<0.05),分别跌至S0组的58.0%和55.0%;饥饿9 d时,肝脏和胃肠道中的脂肪酶活性较饥饿7 d时无显著变化(P>0.05)。
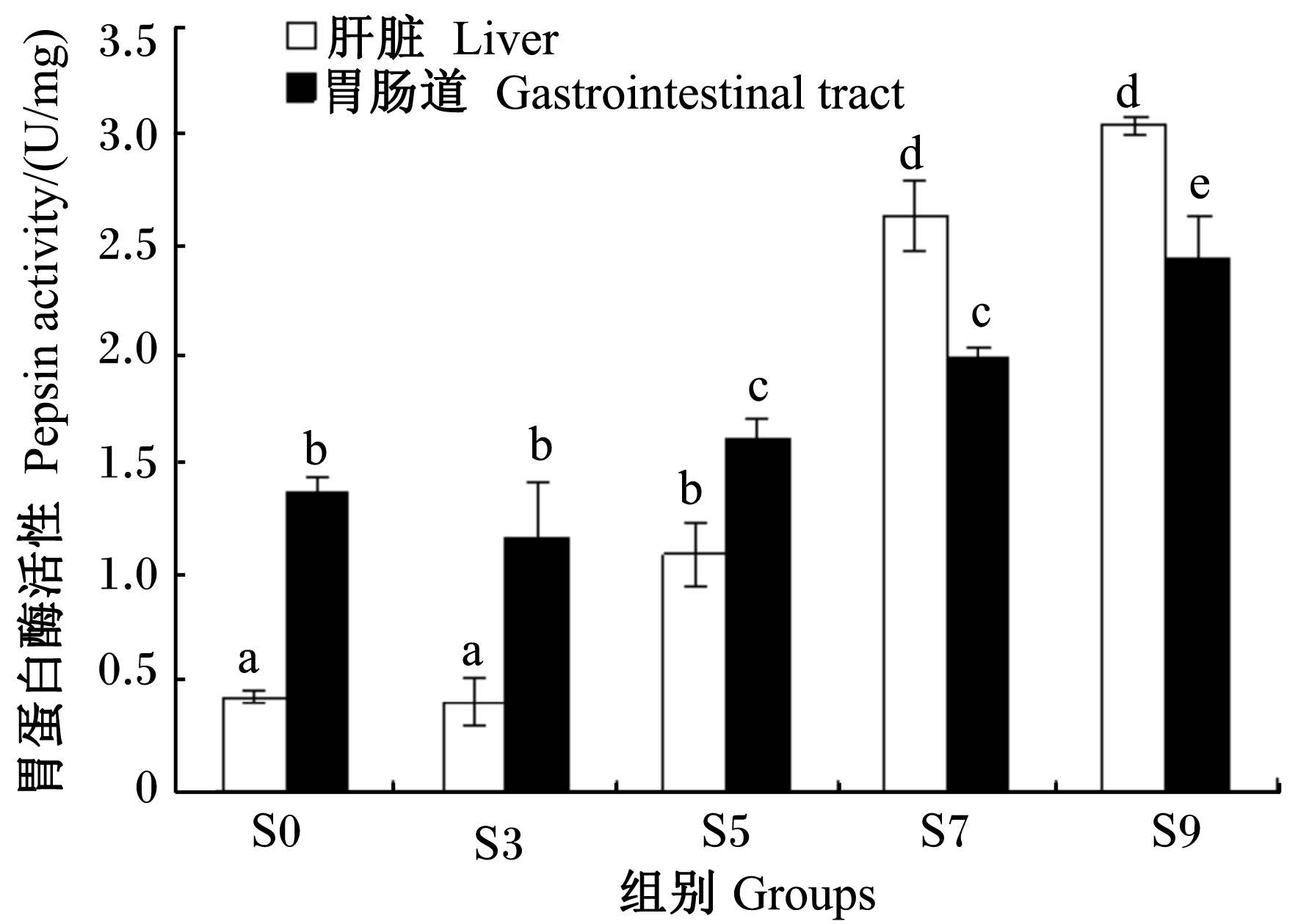 | 图1 不同饥饿时间组的胃蛋白酶活性比较 Fig. 1 Comparison of pepsin activity in groups with different starvation time |
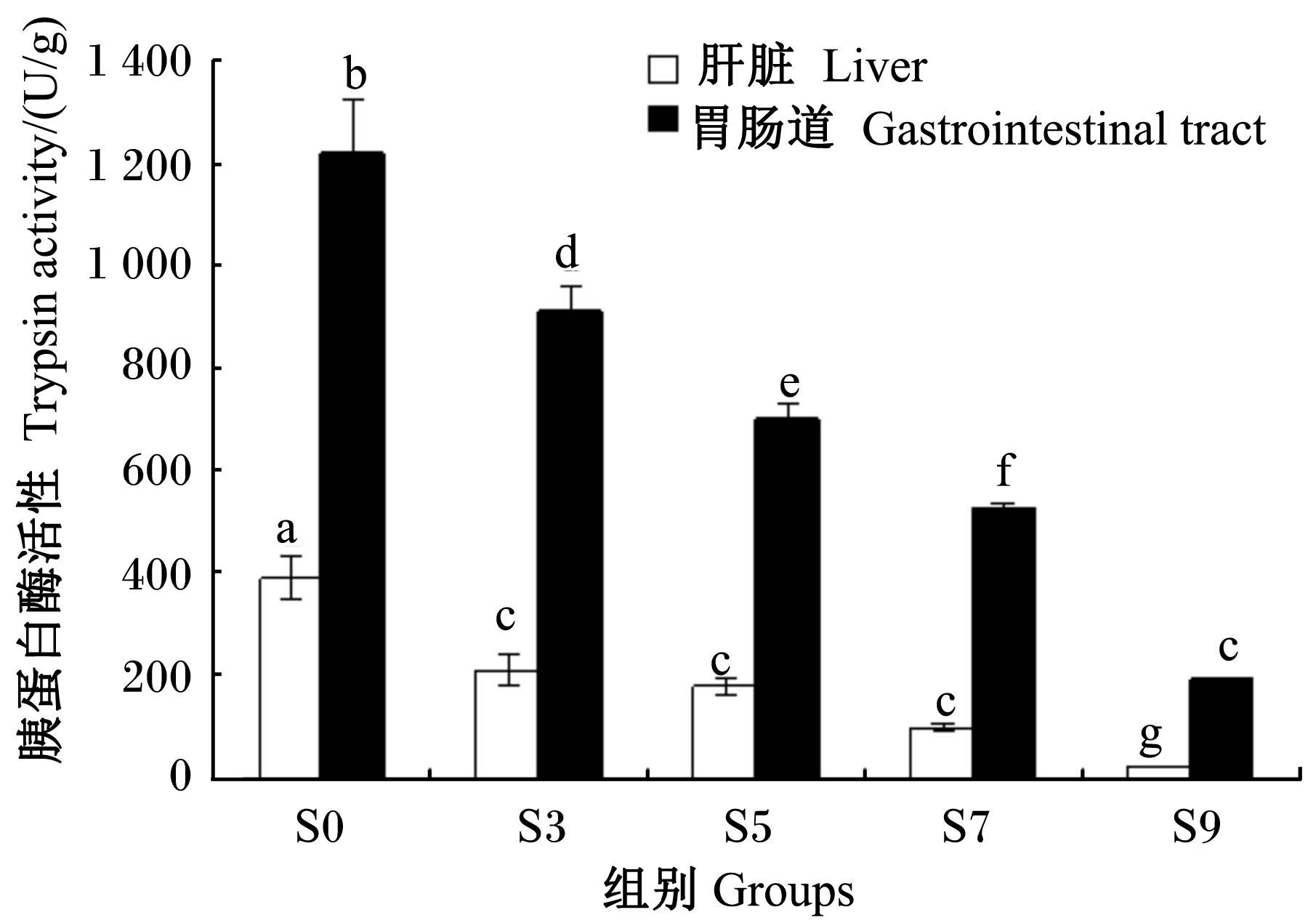 | 图2 不同饥饿时间组的胰蛋白酶活性比较 Fig. 2 Comparison of trypsin activity in different groups with different starvation time |
由图4可见,饥饿银鲳幼鱼的淀粉酶活性在肝脏和胃肠道中呈现不同的变化。饥饿3 d时,肝脏和胃肠道中的淀粉酶活性较S0组无显著变化(P>0.05);饥饿5 d时,肝脏中淀粉酶活性较之前略有升高(P>0.05),而胃肠道中淀粉酶活性则略有降低(P>0.05);饥饿7 d时,肝脏中的淀粉酶活性较之前显著升高(P<0.05),而胃肠道中的淀粉酶活性则显著下降(P<0.05);饥饿9 d时,肝脏中的淀粉酶活性已由S0组的0.31 U/mg升至0.69 U/mg,而胃肠道中的淀粉酶活性则由S0组的0.36 U/mg降至0.18 U/mg,前者升高1倍,后者下跌1/2。
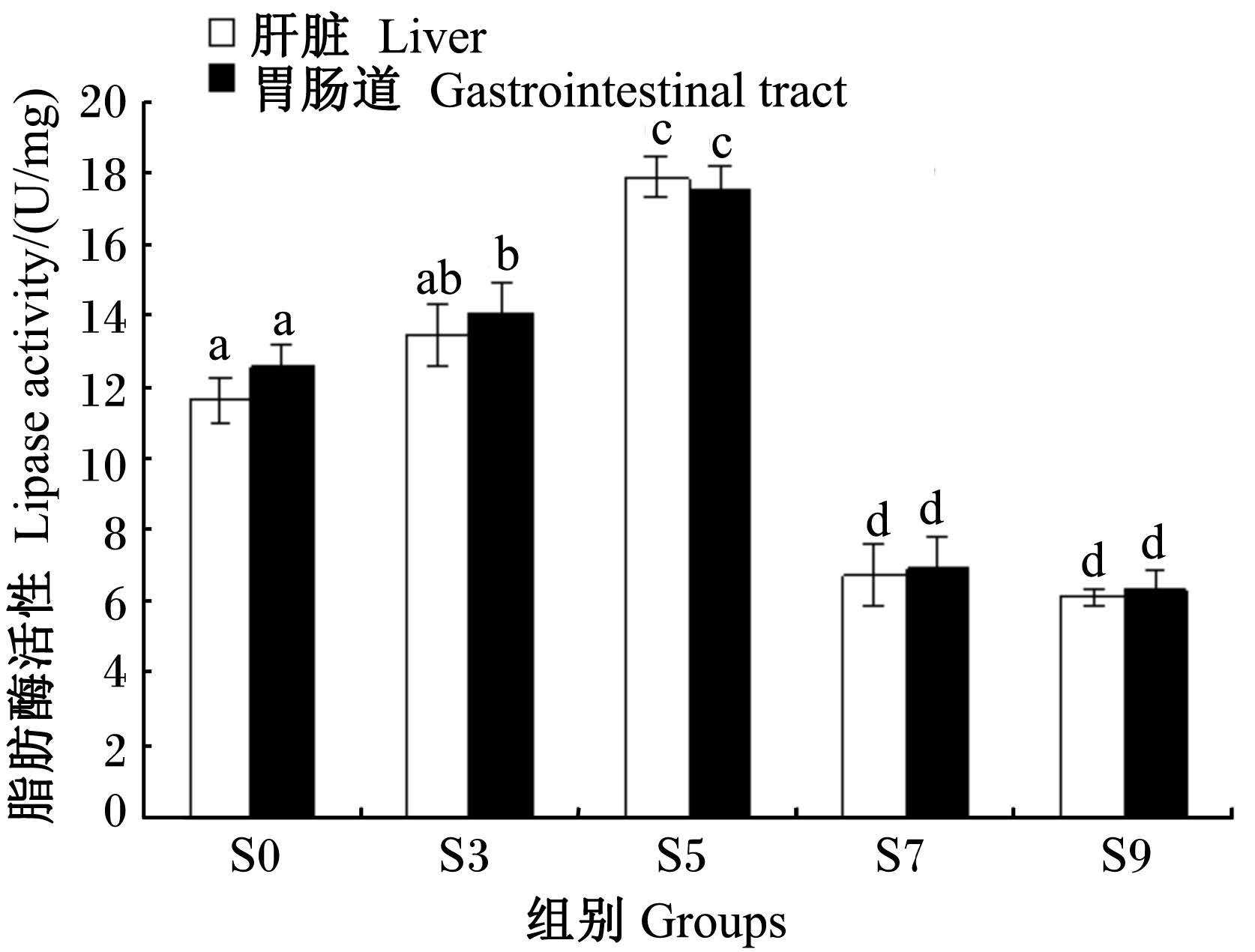 | 图3 不同饥饿时间组的脂肪酶活性比较 Fig. 3 Comparison of lipase activity in different groups with different starvation time |
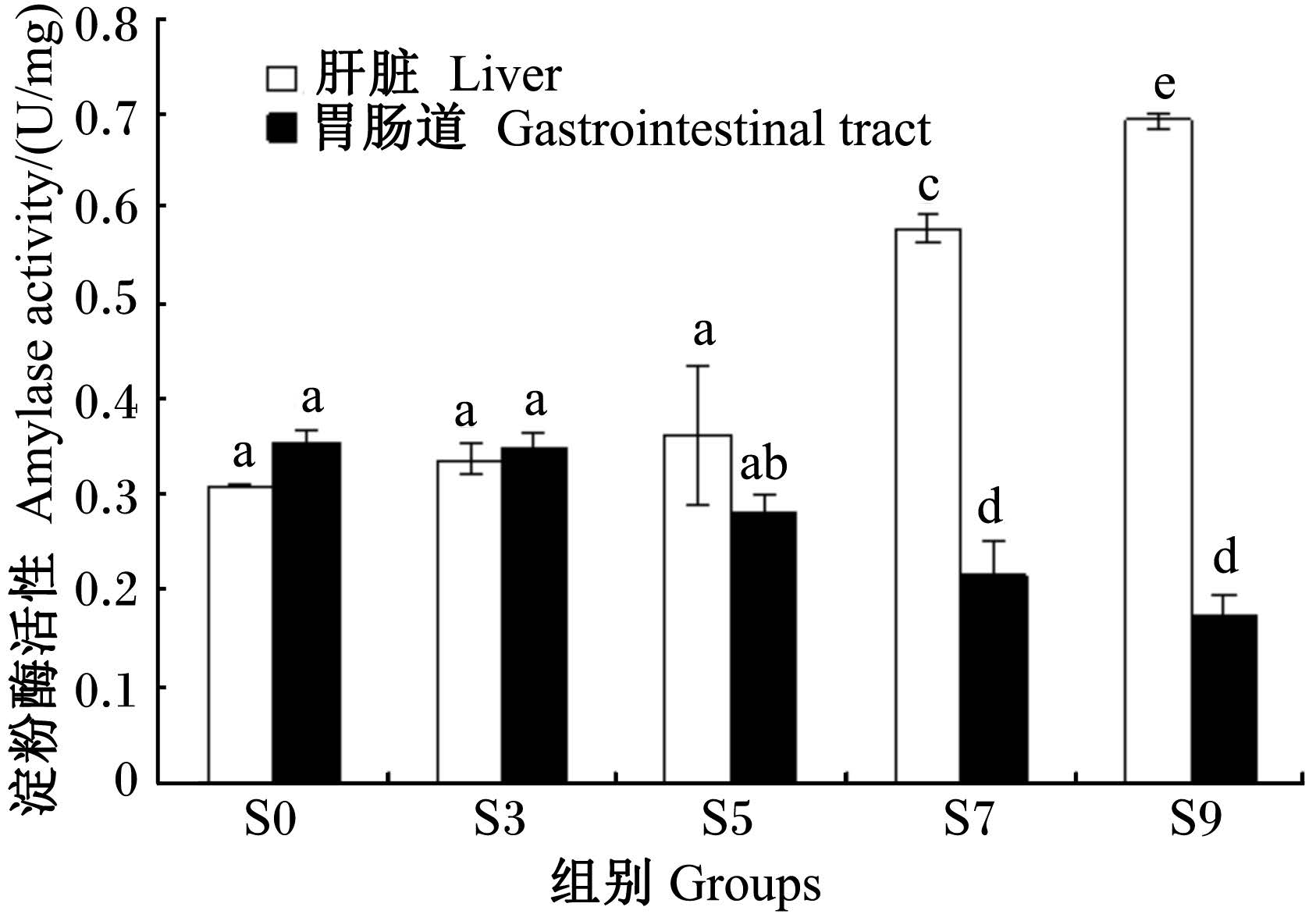 | 图4 不同饥饿时间组的淀粉酶活性比较
Fig. 4 Comparison of amylase activity in different |
饥饿对银鲳幼鱼比能值的影响见表5。S0组银鲳幼鱼的比能值平均为21.85 kJ/g(干重基础),饥饿3 d后降至20.57 kJ/g(干重基础),跌幅为5.85%;饥饿5 d后比能值骤降,跌幅达到20.05%,但此后比能值跌幅较小,饥饿9 d时比能值为16.94 kJ/g(干重基础),显著低于S0、S3和S5组(P<0.05)。
|
|
表 5 饥饿对银鲳幼鱼比能值的影响 Table 5 Effect of starvation on energy content of juvenile Pampus argenteus |
由于食性、生活方式、饵料质量和鱼体生化组成等差异,不同鱼类对饥饿的适应调节有所不同,饥饿时所动用的能源物质先后顺序也不同。多数鱼类在饥饿开始后,脂肪和糖类作为能量利用物质首先在短时间内被大量分解,在脂肪被大量消耗之后,才开始利用部分蛋白质[1, 2, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37]。也有个别鱼类在饥饿期间则以消耗蛋白质为主[38, 39]。本试验观察发现,银鲳幼鱼的耐饥能力极差,在水温25~27 ℃条件下,9 d饥饿已基本到达银鲳幼鱼的耐饥极限,陆续出现幼鱼因饥饿死亡。同时,试验结果表明,饥饿状态下银鲳幼鱼的粗蛋白质、粗脂肪、粗灰分和水分含量有显著变化;在9 d饥饿期间,粗蛋白质含量表现为饥饿初期缓慢下降,最大降幅出现在饥饿7 d时,阶段降幅5.51%,此后降幅又变小;粗脂肪含量的变化则呈现与粗蛋白质互补的规律,脂肪消耗高峰出现在饥饿3~5 d时,累计损失率高达77.86%,至饥饿7 d时,随着蛋白质分解供能的增加,粗脂肪消耗显著减少。表5的鱼体比能值变化也证实了这一点,由于脂肪的单位能值高于蛋白质和糖类,故表现出饥饿5 d时比能值骤跌的现象。许多鱼类的研究结果与银鲳十分相似,邓利等[34]发现黑鲷白肌中粗脂肪含量在饥饿2 d后就开始下降,但白肌中粗蛋白质含量不变,饥饿15 d后粗蛋白质含量才显著降低;柳敏海等[2]发现 鱼饥饿前9 d粗脂肪含量下降了26.51%,粗蛋白质含量仅下降了9.83%,且粗脂肪含量的降幅高峰出现时段早于粗蛋白质;刘波等[35]发现吉富罗非鱼在饥饿14 d后肠系膜粗脂肪含量显著降低,在饥饿21 d后肌肉粗脂肪含量显著降低,而肌肉和肝脏中粗蛋白质含量没有受到显著影响;周爱国等[36]也发现随饥饿时间的延长,杂交鳢(Hybrid snakehead)的粗脂肪含量下降较为明显,到第9周时下降了32.46%,粗蛋白质含量在饥饿前期变化不明显。这些研究所得到的共同结论是,鱼体粗脂肪含量的降幅高峰早于粗蛋白质,且粗脂肪含量的降幅远大于粗蛋白质。但由于不同的鱼类所处的环境不同,其耐饥策略也存在差异,表现为蛋白质和脂肪的利用程度和比例存在种间的差异。但也有个别鱼类在饥饿期间则以消耗蛋白质为主,如张波等[38]发现真鲷(Pagrosomus major)在20 ℃下饥饿15 d,鱼体粗蛋白质含量略有下降,粗脂肪和粗灰分含量没有显著变化;Weatherley等[39]研究发现,硬头鳟(Salmo gairdneri Richardson)饥饿时先以蛋白质作为能源物质,然后才利用脂肪。
随着饥饿银鲳粗蛋白质和粗脂肪含量的下降,鱼体粗灰分含量显著增加,这是个普遍的现象[2, 35, 40, 41, 42]。由于鱼类机体内有机物含量减少,无机物相对含量便会提高。无氮浸出物主要是储存于鱼体肝脏和肌肉中的糖类,在银鲳幼鱼9 d饥饿过程中呈持续下降,说明饥饿银鲳幼鱼也利用糖类供能,尤其在饥饿9 d时消耗加快,表明此时幼鱼体内的脂肪和蛋白质利用已经到了极限,只能加大对糖原的利用。
由此可见,银鲳幼鱼不同于硬头鳟和真鲷在饥饿期间主要消耗蛋白质,而与 鱼[2]、史氏鲟幼鱼[8]、黑鲷[34]、尼罗罗非鱼[35]和杂交鳢[36]等大多数鱼类一样,在短时间饥饿时主要利用脂肪提供能量以维持生命活动,蛋白质和糖类仅是起辅助作用。当饥饿时间进一步延长,脂肪物质已近乎消耗殆尽(饥饿7 d时粗脂肪已消耗81.25%),鱼体重急剧下降,便转向动用蛋白质来提供能量。这是因为蛋白质是构成机体结构的框架物质,鱼类不轻易大量动用来供能,故短时间饥饿时银鲳幼鱼利用脂肪提供能量,就足以维持其基本生命活动,但当饥饿时间延长,饥饿胁迫加重时,便不得不利用蛋白质作为主要能源物质,饥饿后期对碳水化合物的利用也迅速增加。这也是银鲳幼鱼首先利用单位能值更高的脂肪供能,抵御饥饿胁迫的生存策略。
3.2 消化酶活性变化与能量物质利用的关系鱼类在遭到饥饿胁迫时,体内代谢发生着相应的适应性变化,通过调节体内各种酶的活性,以合理利用体内储存的物质,使生命得以维持。很多种鱼类在饥饿胁迫时消化酶的活性会下降,但也会出现消化酶活性的负反馈上升。本试验发现,在9 d饥饿期间,银鲳幼鱼的胃蛋白酶活性变化规律与粗蛋白质的消耗特点相吻合,肝脏及胃肠道中的胃蛋白酶活性在饥饿7 d时明显升高,这与上面提到的粗蛋白质消耗高峰出现在饥饿7 d时的结果相一致,也与高露姣等[8]研究施氏鲟幼鱼胃蛋白酶活性变化的结果相近。同样,试验还发现,在饥饿初期的第3天,只有脂肪酶的活性呈现显著上调,且脂肪酶活性随饥饿时间延长逐渐升高。无论胃肠道中还是肝脏组织中,饥饿5 d时脂肪酶活性皆达最高,饥饿7 d时骤然下跌,这也与粗脂肪的消耗呈正相关,饥饿3~5 d粗脂肪已消耗2/3以上,饥饿7 d时随着脂肪酶活性骤然下降,粗脂肪的消耗也立即减慢。再从银鲳幼鱼淀粉酶活性在肝脏、胃肠道中的分布看,饥饿5 d后,胃肠道中由于缺乏碳水化合物,淀粉酶活性开始显著下降。与此同时,极度饥饿的银鲳幼鱼要利用肝脏中储存的肝糖原,因此肝脏中的淀粉酶活性迅速上升,在饥饿9 d时达到峰值,这也与饥饿过程中无氮浸出物的利用规律十分吻合。王燕妮等[43]研究饥饿对鲤鱼淀粉酶活性的影响时也得到了相似的结果。
因此,从饥饿银鲳幼鱼的消化酶活性变化规律,结合粗蛋白质、粗脂肪、无氮浸出物的消耗特点,可以认为饥饿0~5 d时脂肪酶活性显著升高,加快了体内脂肪的分解供能;饥饿5~7 d时蛋白酶活性迅速升高,促进了蛋白质的分解供能;饥饿7~9 d时则肝脏中淀粉酶活性骤升,表明极度饥饿的银鲳幼鱼开始大量动用碳水化合物作为能源。
4 结 论银鲳幼鱼在短时间饥饿时主要利用脂肪提供能量维持其基本生命活动,但当饥饿时间延长,饥饿胁迫加重时,便开始利用蛋白质作为主要能源物质,饥饿后期随着脂肪与蛋白质利用接近极限,对碳水化合物的利用也迅速增加,这是银鲳幼鱼抵御饥饿胁迫的生存策略。
| [1] |
龙章强,彭士明,陈立侨,等.饥饿与再投喂对黑鲷幼鱼体质量变化、生化组成及肝脏消化酶活性的影响[J].中国水产科学,2008,15(4):606-614.( 2) 2)
|
| [2] |
柳敏海,罗海忠,傅荣兵,等.短期饥饿胁迫对鮸鱼生化组成、脂肪酸和氨基酸组成的影响[J].水生生物学报,2009,33(2):230-235.( 5) 5)
|
| [3] |
EINEN O,WAAGAN B,THOMASSEN M S.Starvation prior to slaughter in Atlantic salmon(Salmo salar) Ⅰ.Effects on weight loss,body shape,slaughter- and fillet-yield,proximate and fatty acid composition[J].Aquaculture,1998,166(1/2):85-104.( 1) 1)
|
| [4] |
王文,王倩倩,张玉蓉,等.饥饿对尼罗罗非鱼幼鱼粗化学成分的影响[J].重庆师范大学学报:自然科学版,2012,29(5):20-25.( 1) 1)
|
| [5] |
TIAN X L,FANG J H,DONG S L.Effects of starvation and recovery on the growth,metabolism and energy budget of juvenile tongue sole(Cynoglossus semilaevis)[J].Aquaculture,2010,310(1/2):122-129.( 1) 1)
|
| [6] |
邓利,张波,谢小军.南方鲇继饥饿后的恢复生长[J].水生生物学报,1999,23(2):167-173.( 1) 1)
|
| [7] |
钱云霞.饥饿对养殖鲈蛋白酶活力的影响[J].水产科学,2002,21(3):6-7.( 1) 1)
|
| [8] |
高露姣,陈立侨,赵晓勤,等.施氏鲟幼鱼的饥饿和补偿生长研究——对消化器官结构和酶活性的影响[J].中国水产科学,2004,11(5):413-419.( 3) 3)
|
| [9] |
郑曙明,王燕妮,聂迎霞,等.虎鲨饥饿后的补偿生长及淀粉酶活性研究[J].华中农业大学学报,2003,22(5):483-487.( 1) 1)
|
| [10] |
柴鹏,李吉方,吴蒙蒙,等.饥饿和再投喂对锦鲤幼鱼几种消化酶活性的影响[J].水利渔业,2007,27(4):12-14.( 1) 1)
|
| [11] |
区又君,刘泽伟.饥饿和再投喂对千年笛鲷幼鱼消化酶活性的影响[J].海洋学报,2007,29(1):86-91.( 1) 1)
|
| [12] |
关胜军,吴锐全,谢骏,等.饥饿对大口黑鲈消化器官、蛋白酶和淀粉酶活力的影响[J].南方水产,2007,3(2):25-29.( 1) 1)
|
| [13] |
CARUSO G,DENARO M G,CARUSO R,et al.Changes in digestive enzyme activities of red porgy Pagrus pagrus during a fasting-refeeding experiment[J].Fish Physiology and Biochemistry,2014,40(5):1373-1382.( 1) 1)
|
| [14] |
YENGKOKPAM S,DEBNATH D,PAL A K,et al.Short-term periodic feed deprivation in Labeo rohita fingerlings:effect on the activities of digestive,metabolic and anti-oxidative enzymes[J].Aquaculture,2013,412/413:186-192.( 1) 1)
|
| [15] |
施兆鸿,赵峰,傅荣兵,等.银鲳人工育苗技术研究[J].海洋渔业,2009,31(1):53-57.( 1) 1)
|
| [16] |
施兆鸿,彭士明,王建钢,等.人工养殖银鲳子代胚胎发育及仔稚幼鱼形态观察[J].中国水产科学,2011,18(2):267-274.( 1) 1)
|
| [17] |
李明华.科威特开展银鲳人工养殖技术研究现状[J].中国水产,2006,372(11):54-57.( 1) 1)
|
| [18] |
祝世军.工厂化室内育苗池养殖银鲳试验[J].河北渔业,2008(3):19-20.( 1) 1)
|
| [19] |
ZHAO F,DONG Y H,ZHUANG P,et al.Genetic diversity of silver pomfret(Pampus argenteus) in the southern Yellow and East China Seas[J].Biochemical Systematics and Ecology,2011,39(2):145-150.( 1) 1)
|
| [20] |
SUN P,YIN F,GAO Q X,et al.Genetic diversity and population structure of silver pomfret(Pampus argenteus) in the Indo-West Pacific revealed by mitochondrial control region sequences[J].Biochemical Systematics and Ecology,2013,51:28-36.( 1) 1)
|
| [21] |
崔青曼,袁春营,李小双.渤海银鲳生殖力的研究[J].海洋通报,2009,28(6):66-69.( 1) 1)
|
| [22] |
赵峰,施兆鸿,庄平.银鲳繁育生物学研究进展[J].海洋科学,2010,34(1):90-96.( 1) 1)
|
| [23] |
JAMES C M,ALMATAR S M.Potential of silver pomfret(Pampus argenteus) as a new candidate species for aquaculture[J].Aquaculture Asia,2008,13(2):49-50.( 1) 1)
|
| [24] |
黄旭雄,施兆鸿,李伟微,等.银鲳亲鱼不同组织的氨基酸及其随性腺发育的变化[J].水产学报,2009,33(2):278-287.( 1) 1)
|
| [25] |
ZHAO F,ZHUANG P,SONG C,et al.Amino acid and fatty acid compositions and nutritional quality of muscle in the pomfret,Pampus punctatissimus[J].Food Chemistry,2010,118(2):224-227.( 1) 1)
|
| [26] |
徐善良,王丹丽,徐继林,等.东海银鲳(Pampus argenteus)、灰鲳(P.cinereus)和中国鲳(P.sinensis)肌肉主要营养成分分析与评价[J].海洋与湖沼,2012,43(4):775-782.( 1) 1)
|
| [27] |
钱周兴,徐永清,方一峰.饥饿对鱼类的影响[J].生物学通报,2006,41(6):9-11.( 1) 1)
|
| [28] |
谭肖英,罗智,王为民,等.饥饿对小规格斑点叉尾 体重及鱼体生化组成的影响[J].水生生物学报,2009,33(1):39-45.( 1) 1)
|
| [29] |
高露姣,陈立侨,宋兵,等.饥饿和补偿生长对史氏鲟幼鱼摄食、生长和体成分的影响[J].水产学报,2004,28(3):279-284.( 1) 1)
|
| [30] |
楼宝,史会来,毛国民,等.饥饿及恢复投饵过程中花鲈肌肉组成及非特异免疫水平的变化[J].水产学报,2008,32(6):929-938.( 1) 1)
|
| [31] |
王志铮,施建军,吕敢堂,等.受短期饥饿胁迫下麦瑞加拉鲮鱼(Cirrhina mrigola)幼鱼的生长、肌体组分及其内脏消化酶活力的变化特征[J].海洋与湖沼,2006,37(3):218-224.( 1) 1)
|
| [32] |
MADDOCK D M,BURTON M P M.Some effects of starvation on the lipid and skeletal muscle layers of the winter flounder,Pleuronectes americanus[J].Canadian Journal of Zoology,1994,72(9):1672-1679.( 1) 1)
|
| [33] |
张守领,顾若波,徐钢春,等.饥饿对于花 肌肉和血清主要生化指标的影响[J].上海交通大学学报:农业科学版,2006,24(6):513-516.( 1) 1)
|
| [34] |
邓利,张为民,林浩然.饥饿对黑鲷血清生长激素、甲状腺激素以及白肌和肝脏脂肪、蛋白质含量的影响[J].动物学研究,2003,24(2):94-98.( 3) 3)
|
| [35] |
刘波,何庆国,唐永凯,等.饥饿胁迫对吉富罗非鱼生长及生理生化指标的影响[J].中国水产科学,2009,16(2):230-237.( 4) 4)
|
| [36] |
周爱国,茅沈丽,王超,等.饥饿胁迫对杂交鳢生长及生化组成的影响[J].水生态学杂志,2012,33(5):78-82.( 3) 3)
|
| [37] |
黄权,高峰,孟繁伊,等.饥饿和再投喂对花羔红点鲑肌肉组分和血液指标的影响[J].吉林农业大学学报,2009,31(4):460-466,475.( 1) 1)
|
| [38] |
张波,孙耀,唐启升.饥饿对真鲷生长及生化组成的影响[J].水产学报,2000,24(3):206-210.( 2) 2)
|
| [39] |
WEATHERLEY A H,GILL H S.Recovery growth following periods of restricted rations and starvation in rainbow trout Salmo gairdneri Richardson[J].Journal of Fish Biology,1981,18(2):195-208.( 2) 2)
|
| [40] |
仇明,封功能,张启焕,等.饥饿胁迫对瓦氏黄颡鱼(Pelteobagrus vachelli)幼鱼肌肉营养成分及血液指标的影响[J].饲料工业,2011,32(14):41-43.( 1) 1)
|
| [41] |
孙向军,梁拥军,张升利,等.饥饿后再投喂对星斑川鲽生化组成以及能值的影响[J].渔业科学进展,2011,32(1):24-31.( 1) 1)
|
| [42] |
万丽娟.饥饿和恢复投喂对萍乡肉红鲫补偿生长的影响[D].硕士学位论文.南昌:南昌大学,2007.( 1) 1)
|
| [43] |
王燕妮,张志蓉,郑曙明.鲤鱼的补偿生长及饥饿对淀粉酶的影响[J].水利渔业,2001,21(5):6-7.( 1) 1)
|




