青贮饲料常被认为是乳酸菌发酵的产物,然而实际上是一个极其复杂的微生物共生体系,参与青贮过程的微生物种类非常多,包括青贮原料上附着的微生物、引起青贮饲料发酵的微生物以及引起青贮腐败变质的微生物等[1]。在青贮发酵过程中,菌落的构成及丰度是不断变化的,乳酸菌等少数优势种群对整个种群起决定作用[2]。为对青贮过程进行调控,促进青贮过程中有益菌种的生长,使青贮饲料迅速进入稳定状态,抑制有害菌的繁殖,从而降低干物质、蛋白质及可溶性糖等营养物质的损失率,提高青贮发酵品质,了解各种微生物的活动规律是非常有必要的,特别是青贮前后起主要作用的菌群的活动规律[3]。近些年来有关青贮过程中微生物种类和丰度的研究一直是国内外该领域研究的热点,这些研究主要包括:1)不同青贮阶段中微生物的动态变化,如乳酸菌、大肠杆菌、霉菌和酵母等[1, 2, 4];2)不同青贮剂、青贮原料及青贮条件对青贮过程中微生物种类的影响[5, 6]。我国玉米秸秆资源丰富,玉米秸秆青贮应用广泛,青贮后有机物消化率可提高4.8%~15.4%,消化能提高0.23~0.62 MJ,代谢能提高0.19~0.56 MJ[5, 6]。然而目前有关玉米秸秆青贮饲料品质的研究较多,而对发酵前后微生物菌群变化的研究以及玉米秸秆青贮品质及细菌群落相关性的探讨较少。另外,目前有关青贮饲料中微生物研究的方法多采用传统的微生物平板纯培养方法、微平板分析方法、磷脂脂肪酸法以及分子生物学方法[变性梯度凝胶电泳(DGGE)/温度梯度凝胶电泳(TGGE)/瞬时温度梯度电泳(TTGE)、16sRNA基因的末端限制性片段分析技术(T-RFLP)、PCR-单链构象多态性(SSCP)、荧光原位杂交技术(FISH)、印记杂交、定量PCR、基因芯片]等,只能反映出样品中少数优势菌的信息,无法对样品中的微生物做到绝对定量,为微生物进化关系的研究提供的信息也很有限[7, 8]。第二代测序技术MiSeq高通量测序平台采用边合成边测序原理,不仅可实现一次并行对几十万到几百万条DNA分子进行序列测定,而且在测序速度和测序通量上都有进一步提升,可以测定微生物从门、纲、目、科、属各个水平上的构成及丰度,具有测序深度高、利于鉴定低丰度群落物种的特点,已成为研究细菌和真菌群落多样性的首选之策[7, 8],目前此平台已在微生物多样性群落结构研究方面受到了广大学者的认可。然而截至目前,有关利用MiSeq高通量全基因组测序技术研究玉米秸秆青贮菌群群落及丰度的研究鲜有报道。本研究拟对玉米秸秆青贮前后品质及细菌群落进行系统分析,探明青贮发酵过程对玉米秸秆品质及细菌群落的影响,并分析青贮品质及细菌群落变化的关系,为微生物接种剂的研发及利用生物手段调控青贮发酵过程提供理论依据。
1 材料与方法 1.1 试验材料玉米秸秆(corn straw)取自河北省保定市,品种为三北21,于2014年9月30日蜡熟期摘穗后部分叶片仍然青绿时,立即刈割。
1.2 试验设计本试验共设置青贮前(pre-ensiling)和青贮后(post-ensiling)2个组,每组3个重复,各样品编号见表1。玉米秸秆刈割后,用青贮切碎揉搓机切短至1~2 cm,将蒸馏水均匀喷洒在粉碎玉米秸秆上,将水分调节至65%~70%,取原料样品后,另取样品装入聚乙烯袋(24 cm×40 cm),每袋1 kg,用真空包装机(DZ-280/2SD)抽真空并封口。原料样品置于冰盒中,迅速带回实验室,-20 ℃贮藏,青贮样品室温条件下(25~37 ℃)贮藏,室温贮藏45 d后开封取样,立即于-80 ℃保存,待检。
| 表1 试验组设计及样品编号 Table 1 The design of experiment groups and the number of samples |
按德国农业协会(DLG)感官青贮评分标准及等级评定方法进行综合评定[9, 10]。
1.3.2 发酵品质及营养成分的测定取玉米秸秆青贮前及青贮后样品20 g,加入180 mL蒸馏水,搅拌均匀,用组织捣碎机搅碎1 min,先后用4层纱布和定性滤纸过滤,滤出草渣得到浸出液,再用pH测定仪测青贮料浸出液的pH[11];采用苯酚-次氯酸钠比色法测定氨态氮(ammonia nitrogen,NH3-N)含量[12];采用烘箱干燥法测定干物质(dry matter,DM)含量;采用凯氏定氮法测定粗蛋白质(crude protein,CP)和总氮(total nitrogen,TN)含量[13];采用范氏洗涤纤维法测定中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)含量[13];采用蒽酮分光光度法测定可溶性糖(water soluble carbohydrates,WSC)含量[14];使用SHIMADZE-10A型高效液相色谱分析乳酸(lactic acid,LA)、乙酸(acetic acid,AA)、丙酸(propionic acid,PA)、丁酸(butyric acid,BA)含量,色谱柱:Shodex Rspak KC-811 S-DVB gel Column 30 mm×8 mm,检测器:SPD-M10AVP,流动相:3 mmol/L高氯酸,流速:1 mL/min;柱温50 ℃,检测波长210 nm,进样量5 μL[10]。
1.3.3 微生物种类及丰度的测定 1.3.3.1 DNA的提取青贮原料及样品DNA的提取采用十二烷基苯磺酸钠(SDS)法[15]。称取0.5 g青贮原料及样品,加3 mL磷酸盐缓冲液(PBS)(8 g NaCl,0.2 g KCL,2.8 g Na2HPO4·12H2O,0.2 g KH2PO4,加蒸馏水定容至1 L,pH 7.0~7.4),涡旋15 min,1 790×g室温离心5 min,弃上清,向沉淀中再加入3 mL PBS,重复上述步骤2次。向沉淀中加1 mL抽提缓冲液(50 mmol/L Tris-HCl,5 mmol/L EDTA,3% SDS,pH 8.0),16 000×g、4 ℃离心5 min,取上清加入等体积异丙醇,-20 ℃沉淀l h,12 000 r/min、4 ℃离心20 min,弃上清,加入70%乙醇洗涤沉淀,室温干燥沉淀5 min,加入30 μL蒸馏水重溶核酸,-20 ℃保存备用。采用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样品于离心管中,使用无菌水稀释样品至1 ng/μL。
1.3.3.2 定量PCR检测PCR扩增:稀释后的基因组DNA为模板;测序区域16S V4区,引物为515F 5′-GTGCCAGCMGCCGCGG-3′和806R 5′-GGACTACHVGGGTWTCTAAT-3′ [16]。PCR反应体系为30 μL:Phusion 高保真PCR mix(New England Biolabs)15 μL,上、下游引物各0.2 μmol/L以及10 ng的DNA模板,加去离子水至终体积为30 μL[17]。PCR反应程序为:98 ℃预变性1 min,98 ℃变性10 s,30个循环,50 ℃退火30 s,72 ℃延伸60 s,72 ℃延伸5 min。
PCR产物的混样和纯化:PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等浓度混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,使用Thermo Scientific公司的Gene JET胶回收试剂盒回收产物[18]。
1.3.3.3 文库构建和测序由北京诺禾致源生物信息科技有限公司测定。使用New England Biolabs公司的NEB Next UltraTM DNA Library Prep Kit for Illumina建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测,合格后,使用MiSeq高通量测序技术进行上机测序[7, 8]。
1.3.3.4 信息分析流程使用CLUSTALW软件分析,序列相似性大于97%时定义为相同的操作分类单元(operational taxonomic units,OTUs)。测序得到的原始数据(raw data),存在一定比例的干扰数据(dirty data),为了使信息分析的结果更加准确、可靠,首先对原始数据进行拼接、过滤,得到有效数据(clean data)。然后基于有效数据进行OTUs聚类和物种分类分析,并将OTUs和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果。再对OTUs进行丰度、多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析[8]。
1.4 数据统计分析试验数据采用SPSS 19.0软件分析。玉米秸秆各样品的相异系数使用ANOVA程序进行差异显著性分析,门、纲、目、科和属各个水平上菌群丰度,玉米秸秆发酵品质和营养成分指标使用独立样本t-test过程进行平均值差异显著性分析,P<0.05为差异显著。
2 结果与分析 2.1 玉米秸秆青贮饲料感官评定青贮发酵45 d后的玉米秸秆青贮饲料3个重复的样品均呈黄绿色,在色泽上无明显差别;无霉变情况发生;质地较好,无粘手现象,呈酸香味。各样品的感官评定质量均达到了优良等级。
2.2 玉米秸秆青贮前后发酵品质及营养成分由表2可知,青贮发酵作用能够使玉米秸秆pH迅速降低(P<0.05),乳酸含量显著增加(P<0.05),NDF、ADF及CP含量有下降趋势(P>0.05),而DM含量在青贮前后差异不显著(P>0.05),另外可知青贮发酵过程会消耗玉米秸秆中的WSC含量。
2.3 玉米秸秆青贮前后微生物种类及丰度变化 2.3.1 测序质量经过过滤后6个样品得到总拼接序列数(total tags)为490 251条,用于构建OTUs并且活动分类信息的Tags数目(taxon tags)为476 217条,有效Tags数目达到97.14%。序列相似性大于97%的水平上,总检测到OTUs数为7 258个。由图1可知,各样品的稀释曲线均已趋于平坦,说明测序深度基本可以反映样品中绝大多数的微生物信息。相同序列数时,青贮前玉米秸秆 OTU数量高于青贮后样品,说明青贮发酵能够降低玉米秸秆菌群多样性。
| 表2 玉米秸秆青贮前后发酵品质及营养成分 Table 2 The fermentation quality and nutrient composition of corn stalk of pre-ensiling and post-ensiling |
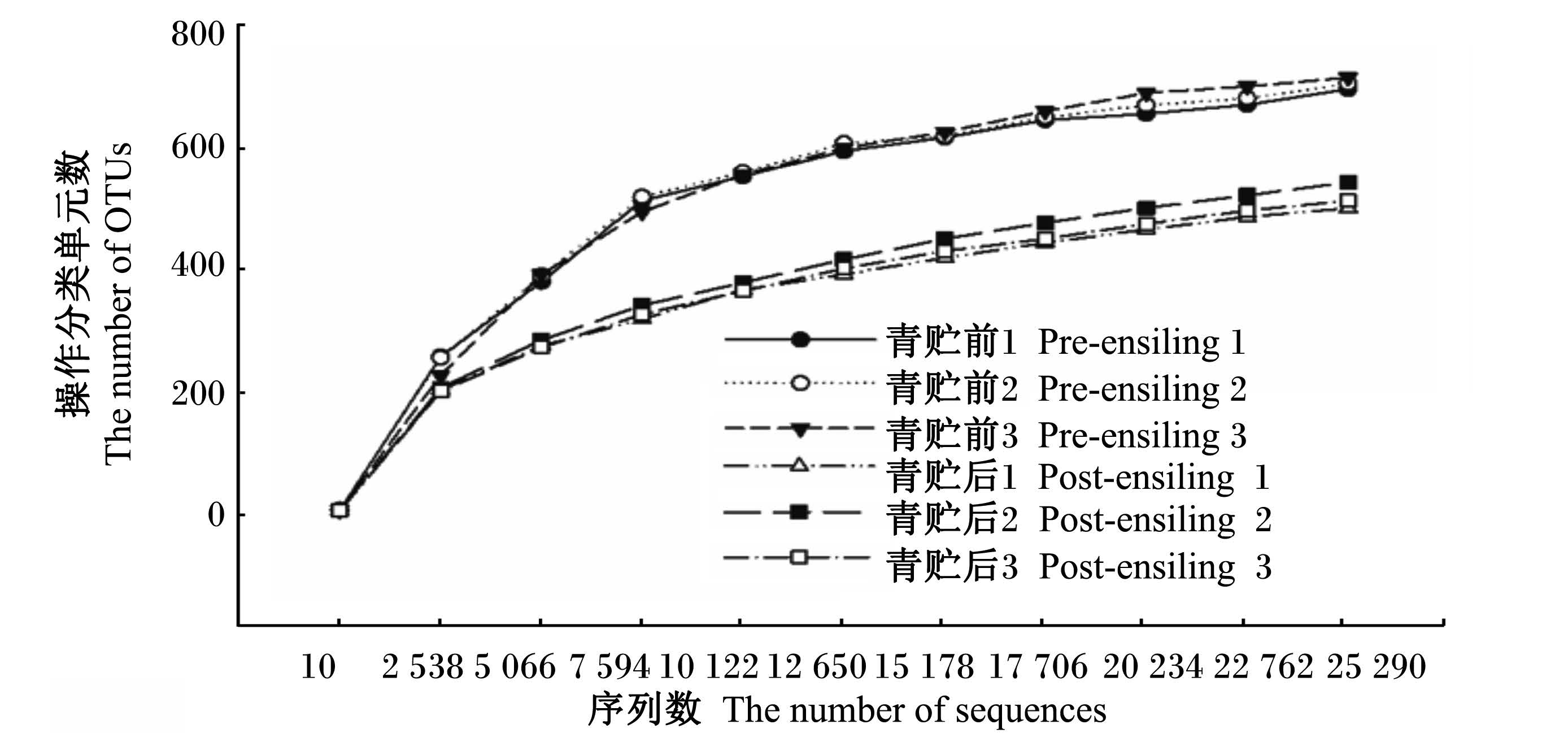 | 图1 青贮前后玉米秸秆菌群稀释曲线 Fig. 1 Rarefaction cure of corn stalk microflora of pre-ensiling and post-ensiling |
由图2可知,青贮前和青贮后玉米秸秆共有OTUs数为575个,青贮前特有OTUs数为832个,青贮后特有OTUs数为161个,说明青贮前后菌群构成同时具有特异性和相似性。由表3可知,玉米秸秆青贮前和青贮后2个组组内样品差异系数小,组间差异系数大,说明组样品重复性好,青贮前后玉米秸秆物种多样性存在明显差异。
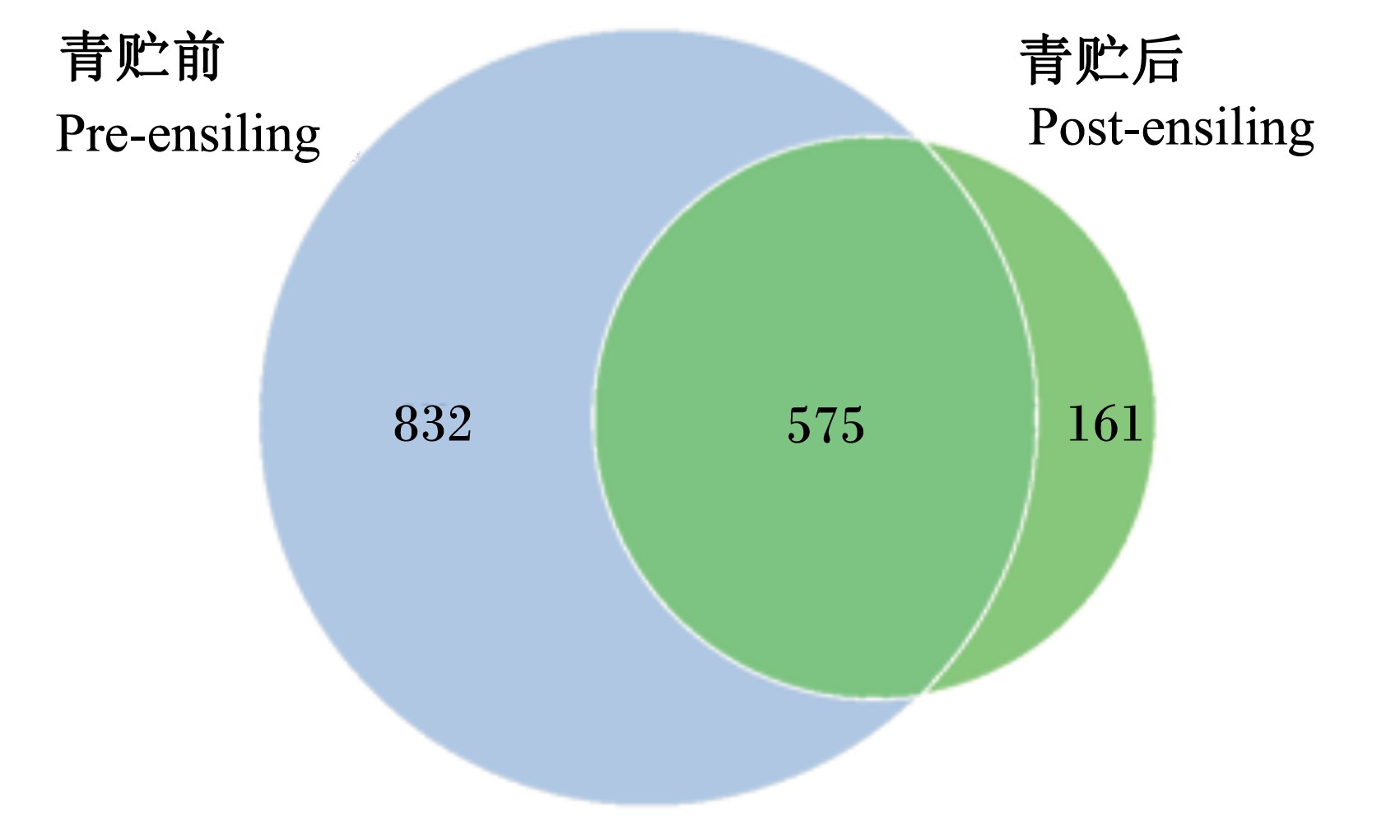 | 图2 青贮前后玉米秸秆OTUs韦恩图 Fig. 2 Venn graph of corn stalk OTUs of pre-ensiling and post-ensiling |
| 表3 玉米秸秆青贮前后菌落多样性相异系数 Table 3 Coefficient of dissimilar in corn stalk microflora diversity of pre-ensiling and post-ensiling |
由表4可知,在门水平上,玉米秸秆中变形菌门(Proteobacteria)和厚壁菌门(Fimicules)菌群数量在青贮前占优势地位。青贮45 d后,变形菌门 菌群数量显著降低(P<0.05),由78.08%降低至50.90%,厚壁菌门菌群数量显著增加(P<0.05),由18.76%增加至44.06%。
| 表4 青贮前后玉米秸秆门水平上菌群结构 Table 4 Bacterial composition of pre-ensiling and post-ensiling corn stalk by phylum |
由表5可知,在纲水平上,γ-变形菌纲(Gammaproteobacteria)、芽孢杆菌纲(Bacilli)和α-变形菌纲(Alphaproteobacteria)菌群数量在青贮前玉米秸秆中占据前3位。青贮45 d后,γ-变形菌纲菌群数量显著降低(P<0.05),由67.72%降低到35.66%;芽孢杆菌纲菌群数量显著增加(P<0.05),由18.68%增加至43.94%;α-变形菌纲菌群数量由8.98%增加至13.39%,显著上升(P<0.05)。
由表6可知,在目水平上,玉米秸秆青贮前肠杆菌目(Enterobacteriales)和乳杆菌目(Lactobacillales)菌群数量占据优势地位。青贮45 d后,肠杆菌目菌群数量显著降低(P<0.05),乳杆菌目菌群数量显著增加(P<0.05)。
由表7可知,在科水平上,青贮前玉米秸秆中菌群数量占前3位的分别是肠杆菌科(Enterobacteriaceae)、明串珠菌科(Leuconostocaceae)和假单胞菌科(Pseudomonadaceae),青贮45 d后,菌群数量占前3位的分别为乳杆菌科(Lactobacillaceae)、肠杆菌科和明串珠菌科。肠杆菌科和明串珠菌科菌群数量显著降低(P<0.05),乳杆菌科菌群数量显著增加(P<0.05)。
| 表5 青贮前后玉米秸秆纲水平上菌群结构 Table 5 Bacterial composition of pre-ensiling and post-ensiling corn stalk by class |
| 表6 青贮前后玉米秸秆目水平上菌群结构 Table 6 Bacterial composition of pre-ensiling and post-ensiling corn stalk by order |
| 表7 青贮前后玉米秸秆科水平上菌群结构 Table 7 Bacterial composition of pre-ensiling and post-ensiling corn stalk by family |
由表8可知,在属水平上,青贮前玉米秸秆中菌群数量占前3位的分别是魏斯氏菌(Weissella)、鞘氨醇菌(Sphingomonas)和Swaminathania属,分别为16.92%、2.26%和2.22%。青贮45 d后菌群数量占前3位的分别为片球菌(Pediococcus)、魏 斯氏菌和乳杆菌属(Lactobacillus),分别为22.65%、9.98%和9.74%。青贮后片球菌和乳杆菌菌群数量显著增加(P<0.05),魏斯氏菌属菌群数量显著降低(P<0.05)。
| 表8 青贮前后玉米秸秆属水平上菌群结构 Table 8 Bacterial composition of pre-ensiling and post-ensiling corn stalk by genus |
我国是世界上农作物秸秆生产量最大的国家之一,2010年全国秸秆理论资源量为8.4亿t,可收集资源量约为7亿t,其中,玉米秸秆资源量最大,约为2.43亿t,占秸秆可收集资源量的34.7%[19]。有研究报道玉米秸秆经过青贮处理后,不仅能保持青绿饲料的青鲜状态,具有明显的酸甜芳香气味,与玉米秸秆相比饲料中的CP含量可增加3.3%~16.4%,粗纤维含量降低5%~15%[20, 21]。本研究发现,经过青贮发酵45 d后的玉米秸秆青贮饲料均呈黄绿色,在色泽上无明显差别,无霉变情况发生,质地较好,无粘手现象,呈酸香味。另外,青贮发酵作用能够使玉米秸秆NDF及ADF含量有下降趋势,与其相符。而本研究中,玉米秸秆青贮后CP含量有下降趋势,与其不符,原因可能是玉米秸秆青贮后NH3-N含量由14.98 g/kg上升到61.19 g/kg,从而消耗了部分CP。
本研究通过MiSeq高通量测序发现,玉米秸秆在青贮后,菌落种类仅为青贮前的52.31%,其中共有菌种仅占玉米秸秆青贮前菌种数量的40.87%。青贮发酵能够改变青贮饲料中群落结构及丰度,原因可能是青贮制作时会将空气排出形成一个封闭系统,为菌落的繁殖提供无氧环境,另外玉米秸秆中所含的可溶性糖等物质能够为菌落的繁殖提供底物,使得有益细菌迅速繁殖,降低青贮料pH,从而影响青贮过程中细菌群落的构成[22]。青贮发酵不仅改变了玉米秸秆的品质,同时改变了其菌落构成,这说明二者之间存在着巨大的相关性。
玉米秸秆中菌群数量占绝对优势的2个门为厚壁菌门和变形菌门。经过青贮发酵后,厚壁菌门菌群数量由18.76%增加至44.06%,厚壁菌门是原核生物系统进化树低GC含量的革兰氏阳性菌,主要有产芽孢、非产芽孢和支原体菌群,很多芽孢杆菌可以降解多种大分子化合物,如纤维素、淀粉、蛋白质等[2]。而玉米秸秆青贮后NDF、ADF及CP含量均有下降趋势,由此可推断青贮饲料中纤维素及蛋白质等营养物质含量的部分变化可能是由厚壁菌门细菌引起的。变形菌门是革兰氏阴性细菌,是细菌中最大的一门,包括很多病原菌,如大肠杆菌、沙门氏菌、弧菌和螺杆菌等种类[23]。青贮饲料中的肠道细菌尽管被认为不属于致病菌,但因其会与乳酸菌竞争性利用糖类物质,同时降解蛋白质,产生影响青贮口味的毒素生物胺,并阻碍青贮饲料pH的降低。另外在青贮环境下肠道细菌还能将硝酸盐转化为亚硝酸盐[24]。而经过青贮发酵变形菌门菌群数量显著降低,由此可见,玉米秸秆中WSC含量显著降低除部分被乳酸菌所利用外,有部分是被变形菌门细菌所利用,而青贮后CP含量的下降趋势和NH3-N含量的增加也与其有着密不可分的关系。另外,在纲、目和科水平上,同样发现青贮前玉米秸秆中占据绝对优势地位的含致病菌较多的γ-变形菌纲、肠杆菌目和肠杆菌科菌群数量均显著降低,而经过青贮发酵后芽孢杆菌纲、乳杆菌目和乳杆菌科菌群数量显著增加,这说明青贮过程改善玉米秸秆颜色、气味、质地、发酵品质以及营养成分的同时,可以有效降低有害细菌的数量,增加有益菌的数量,从而可以降低致病菌对家畜健康存在的潜在风险,改善家畜健康。
Cai等[25]从各个时期的水稻青贮中分离到了161株乳酸菌,根据形态和DNA序列分析,将这些菌株分类为乳球菌属、乳杆菌属、明串珠菌属、肠球菌属、片球菌属和魏斯氏菌属,这些菌株主要为同型发酵乳酸菌,占总数的66%。Dunière等[3]认为,玉米青贮中主要的细菌种类分别为类芽孢杆菌(Paenibacillus)、黄杆菌(Flavobacteriaceae)、鞘氨醇单胞菌、微小杆菌(Exiguobacterium)、根瘤菌、不动杆菌(Acinetobacter)和Buchnera菌。在本试验中,青贮后玉米秸秆上菌群数量为前10位的,分别是片球菌、魏斯氏菌、乳杆菌属、鞘氨醇菌属、嗜菌属(Stenotrophomonas)、Swaminathania属、不动杆菌、假单胞菌属(Pseudomonas)、Hymenobacter属和欧文氏菌属(Erwinia)。研究结果的差异可能是由于细菌种类检测手段、试验样品、发酵时间和发酵方式等不同造成的。前人研究发现,青贮饲料发酵初期,片球菌起着非常重要的作用,植物原料在收获制作成青贮饲料后,最先进行发酵的是粪链球菌(Streptococcus faecalis)和肠膜明串珠菌(Leuconostoc mesenteroides),接着被更耐酸的菌株,如植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(Lactobacillus brevis)和布氏乳杆菌(Lactobacillus buchneri)等取代[26]。张想峰等[27]认为在青贮发酵后期起主要作用的是乳酸杆菌。杨杨等[28]认为,魏斯氏菌在青贮饲料发酵初期起重要作用,且在提高青贮饲料品质方而作用较小。本研究发现,玉米秸秆青贮45 d后,片球菌菌群数量由1.05%增加至22.65%,魏斯氏菌属菌群数量由16.92%降低到9.98%,乳杆菌属菌群数量由0.07%增加至9.74%,这说明片球菌和乳杆菌在青贮过程中繁殖迅速,发挥着重要作用。而魏斯氏菌属菌群数量青贮初期较高,青贮后期数量下降,说明其可能是在青贮初期发挥作用较大,与杨杨等[28]观点一致。与前人研究相比,采用Miseq高通量平台测序不仅能够确定整个菌落的构成,避免传统微生物鉴定方法只能反映出样品少数优势菌的信息,无法对样品中的微生物做到绝对定量的劣势,体现其极大的优越性。本试验仅对Miseq高通量平台测序技术对玉米秸秆青贮饲料青贮前后菌群结构及丰度进行了初步的摸索,而不同处理、品种、青贮时间等因素均可能对微生物种类产生影响,本课题组相关研究正在开展中。
4 结 论① 玉米秸秆经过青贮发酵后颜色黄绿,质量良好,具有酸香味;pH迅速降低,乳酸含量显著增加,NDF及ADF含量有下降趋势。
② 玉米秸秆经过青贮发酵后变形菌门、γ-变形菌纲、肠杆菌目、肠杆菌科、魏斯氏菌属菌群数量显著降低,厚壁菌门、芽孢杆菌纲、乳杆菌目、乳杆菌科、片球菌属和乳杆菌属菌群数量显著增加。
③ 通过实验室检测手段及Miseq高通量测序技术相结合,能够在分析青贮品质的同时, 提供青贮前后整个菌落构成及丰度变化的信息,进而为发酵过程的调控提供依据。
| [1] | 张慧杰.饲草青贮微生物菌群动态变化与乳酸菌的鉴定筛选[D].硕士学位论文.北京:中国农业科学院,2011.( 2) 2) |
| [2] | 杨文琦,龙宣杞,崔卫东.玉米青贮中细菌多样性分析[J].新疆农业科学,2013,50(8):1424-1433.( 3) 3) |
| [3] | DUNIRE L,SINDOU J,CHAUCHEYRAS-DURAND F,et al.Silage processing and strategies to prevent persistence of undesirable microorganisms[J].Animal Feed Science and Technology,2013,182(1/2/3/4):1-15.( 2) 2) |
| [4] | SANTOS A O,ÁVILA C L S,SCHWAN R F.Selection of tropical lactic acid bacteria for enhancing the quality of maize silage[J].Journal of Dairy Science,2013,96(12):7777-7789.( 1) 1) |
| [5] | 程银华,雷雪芹,徐廷生,等.揉丝微贮与传统青贮秸秆的微生物组成与营养成分分析[J].家畜生态学报,2013,34(4):41-44.( 2) 2) |
| [6] | 李旭娇,玉柱.苜蓿青贮饲料中优良乳酸菌菌株的筛选[J].中国奶牛,2014(11/12):37-40.( 2) 2) |
| [7] | DEGNAN P H,OCHMAN H.Illumina-based analysis of microbial community diversity[J].The ISME Journal,2012,6(1):183-194.( 3) 3) |
| [8] | CAPORASO J G,LAUBER C L,WALTERS W A,et al.Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J].The ISME Journal,2012,6(8):1621-1624.( 4) 4) |
| [9] | 张子仪.中国饲料学[M].北京:中国农业出版社,2000:194-201.( 1) 1) |
| [10] | 玉柱,陶莲,陈燕,等.添加玉米秸秆对两种三叶草青贮品质的影响[J].中国奶牛,2009(4):15-18.( 2) 2) |
| [11] | HAN K J,COLLINS M,VANZANT E S,et al.Bale density and moisture effects on alfalfa round bale silage[J].Crop Science,2004,44(3):914-919.( 1) 1) |
| [12] | BRODERICK G A,KANG J H.Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J].Journal of Dairy Science,1980,63(1):64-75.( 1) 1) |
| [13] | 张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2002:53-56,70-74.( 2) 2) |
| [14] | OWENS V N,ALBRECHT K A,MUCK R E,et al.Protein degradation and fermentation characteristics of red clover and alfalfa silage harvested with varying levels of total nonstructural carbohydrates[J].Crop Science,1999,39(6):1873-1880.( 1) 1) |
| [15] | BOKULICH N A,SUBRAMANIAN S,FAITH J J,et al.Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J].Nature Methods,2013,10(1): 57-59.( 1) 1) |
| [16] | YOUSSEF N,SHEIK C S,KRUMHOLZ L R,et al.Comparison of species richness estimates obtained using nearly complete fragments and simulated pyrosequencing-generated fragments in 16S rRNA gene-based environmental surveys[J].Applied and Environmental Microbiology,2009,75(16):5227-5236.( 1) 1) |
| [17] | HESS M,SCZYRBA A,EGAN R,et al.Metagenomic discovery of biomass-degrading genes and genomes from cow rumen[J].Science,2011,331(6016):463-467.( 1) 1) |
| [18] | LUO C,TSEMENTZI D,KYRPIDES N,et al.Direct comparisons of Illumina vs.Roche 454 sequencing technologies on the same microbial community DNA sample[J].PLoS One,2012,7(2):e30087.( 1) 1) |
| [19] | YUAN X F,LI P P,WANG H,et al.Enhancing the anaerobic digestion of corn stalks using composite microbial pretreatment[J].Journal of Microbiology and Biotechnology,2011,21(7):746-752.( 1) 1) |
| [20] | XUE F,ZHOU Z M,REN L P,et al.Influence of rumen-protected lysine supplementation on growth performance and plasma amino acid concentrations in growing cattle offered the maize stalk silage/maize grain-based diet[J].Animal Feed Science and Technology,2011,169(1/2):61-67.( 1) 1) |
| [21] | WANG R J,SUN Y H,ZHANG S T,et al.Two-step pretreatment of corn stalk silage for increasing sugars production and decreasing the amount of catalyst[J].Bioresource Technology,2012,120:290-294.( 1) 1) |
| [22] | 隋鸿园,侯成立,周雨霞.适合作青贮接种剂植物乳杆菌的筛选[J].饲料研究,2012(12):68-69.( 1) 1) |
| [23] | 闫绍鹏,杨瑞华,冷淑娇,等.高通量测序技术及其在农业科学研究中的应用[J].中国农学通报,2012,28(30):171-176.( 1) 1) |
| [24] | 李泽青,闫峻,张永芳,等.青贮发酵过程中主要微生物的活动规律及控制[J].广东畜牧兽医科技,2011,36(6):12-15.( 1) 1) |
| [25] | CAI Y M,SUYANANDANA P,SAMAN P,et al.Classification and characterization of lactic acid bacteria isolated from the intestines of common carp and freshwater prawns[J].Journal of General and Applied Microbiology,1999,45(4):177-184.( 1) 1) |
| [26] | ENNAHAR S,CAI Y M,FUJITA Y.Phylogenetic diversity of lactic acid bacteria associated with paddy rice silage as determined by 16S ribosomal DNA analysis[J].Applied and Environmental Microbiology,2003,69(1):444-451.( 1) 1) |
| [27] | 张想峰,艾尼瓦尔·艾山,买热木尼沙·吾甫尔,等.新疆小芦苇青贮中乳酸杆菌的分离鉴定[J].新疆农业科学,2009,46(6):1327-1331.( 1) 1) |
| [28] | 杨杨,石超,郭旭生.高寒草甸魏斯氏乳酸菌的分离鉴定及理化特性研究[J].草业学报,2014,23(1):266-275.( 2) 2) |




