2. 成都华罗生物科技有限公司, 成都 610062
2. Chengdu Hualuo Bio-Tech Co., Ltd., Chengdu 610062, China
近50年来,抗生素用于动物生产,给畜牧生产者带来了巨大的经济效益,但近20年来,随着科学技术的发展和生活水平的提高,人们逐渐认识到抗生素会在畜产品中残留及产生抗药性等负面作用。因此,寻求绿色、高效、无污染和无残留的抗生素替代品显得尤为迫切。近年来,抗菌肽作为一种潜在的饲用抗生素替代品越来越受到研究者的青睐。Schneider等[1]报道,在2005年通过分析腐生子囊菌分泌蛋白的cDNA库,找到了与动物防御素相似的片段,并命名为菌丝霉素。金黄色葡萄球菌在保育猪舍发病率高达15%,仔猪感染后死亡率达到70%,这对畜牧业生产带来了巨大的危害[2]。与此同时,抗生素的滥用也给养殖业带来了严重的危害。目前国内外都在寻找替代抗生素的新型饲料添加剂。本实验室在前期的研究中将菌丝霉素基因克隆进入毕赤酵母中,得到一株毕赤酵母基因工程菌(PPle),其分泌的重组菌丝霉素可用于金黄色葡萄球菌感染的预防和治疗。研究表明,重组菌丝霉素无细胞毒性,无溶血性,可作为一种潜在的非抗生素类饲料添加剂使用[3]。许多动物防御素类抗菌肽需要在很低的离子浓度情况下才能发挥其抗菌作用,而菌丝霉素作为被筛选得到的首例真菌类防御素,在生理离子浓度下就能发挥杀菌作用,且对金黄色葡萄球菌和猪链球菌等革兰氏阳性菌有着很强的抑制作用[1]。目前菌丝霉素主要从天然微生物中获得,产量低且分离纯化困难。本实验室在前期研究中成功构建了一株能分泌重组菌丝霉素的PPle,不仅实现了高水平分泌表达,且表达产物纯度较高。为进一步降低其生产成本,本试验在30 L液体发酵罐中比较了低盐等3种不同培养基对PPle菌丝霉素表达水平的影响;在此基础上,评估了重组菌丝霉素在断奶仔猪上的应用效果,以期为抗菌肽重组菌丝霉素在饲料工业上的推广应用积累资料。
1 材料与方法 1.1 试验材料重组菌丝霉素基因工程菌PPle,本实验室构建。
重组菌丝霉素:粉状制剂,由本试验发酵制得,有效含量为30 mg/kg。
硫酸黏菌素:粉状制剂,有效含量为20 mg/kg,购自四川恒通公司。
微生态制剂:粉状制剂,枯草芽孢杆菌≥109 CFU/g,地衣芽孢杆菌≥109 CFU/g,活菌总数≥2×109 CFU/g,购自蔚蓝生物集团。
1.2 发酵罐培养与产物检测 1.2.1 发酵罐培养发酵罐灭菌:将培养基倒入发酵罐中加水至20 L进行灭菌,升温至120 ℃灭菌30 min,待冷却至30 ℃后设置为恒温,用氨水溶液将pH调至5.5,通过空气压缩机通入空气,打开搅动阀。
发酵罐接种:采用火焰接种法,将2级种子接种到发酵罐中。
碳源补料:先预培养2 h,根据溶氧(DO)值来控制碳源的流加速度,当溶氧值升高时,碳源流加速度应当提高,反之亦然。
甲醇诱导:当碳源消耗殆尽后,溶氧值会迅速升高,此时进行碳源饥饿1 h。然后采用变速流加的补料方式。当pH变化不大的时候,开始诱导。诱导过程应通过开度和周期的调节将溶氧控制在在20%~30%,确保甲醇流加量和消耗量相平衡。
甲醇补料速度:共3个阶段,34、51、68 mL/h。
1.2.2 发酵产物检测发酵结束后,离心收集发酵上清液进行纯化。将含有菌丝霉素的发酵上清液通过His亲和层析纯化,-20 ℃短期贮存备用。采用考马斯亮蓝法检测发酵上清液总蛋白,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测重组菌丝霉素的表达效果。将金黄色葡萄球菌ATCC 25923接种于50 mL MHB培养基中,37 ℃摇床培养过夜;将事先准备好灭菌的42 ℃ MHA培养基,倒入培养皿中,待培养基凝固后,涂抹上述菌液200 μL,并在无菌孔中依次加入经2 500 U胃蛋白酶、甘氨酸-氢氧化钠(glycine-NaOH)缓冲液(pH=10.0)和pH为2.0的甘氨酸-盐酸(glycine-HCl)缓冲液处理4 h后的重组菌丝霉素,将平板正面向上37 ℃培养18~24 h,观察抑菌效果。
1.3 动物试验设计试验选用30头24日龄健康“杜长大”(DLY)的断奶仔猪,按照体重一致原则分配到5个组:对照组(CON组,基础饲粮)、硫酸黏菌素组(CS组,基础饲粮+0.3%硫酸黏杆菌素)、抗菌肽组(AP组,基础饲粮+0.2%重组菌丝霉素)、微生态制剂组(PB组,基础饲粮+0.1%微生态制剂)和联合应用组(PPB组,基础饲粮+0.2%重组菌丝霉素+0.1%微生态制剂),每个组6个重复,每个重复1头猪,试验期21 d。于试验第21天空腹称重,并记录日采食量;并于试验第17~21天,采用内源指示剂收粪法,进行消化试验。
1.3.1 试验饲粮试验采用玉米-豆粕型饲粮作为基础饲粮,参考NRC(2012)猪营养需要配制,基础饲粮组成及营养水平见表1。
1.3.2 饲养管理本试验在四川农业大学(动物营养所科研试验基地仔猪舍)进行。试验前对猪舍进行彻底的消毒,并清洗料槽、水槽。对试验仔猪进行常规免疫与驱虫。每日饲喂4次(08:00、12:00、16:00、20:00),少喂勤添,自由饮水,每个处理饲养管理条件一致。圈舍内温度保持在24~26 ℃,相对湿度控制在70%~85%。保持圈舍清洁,环境舒适,每天晚上结算余料并做相应记录。
| 表1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验期间记录仔猪的采食量,并计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
在试验的第17~21天样品收集粪便,共4 d。将收集的粪便经充分混合,置于烘箱,60~65 ℃烘2 d。样品干燥后用粉碎机粉碎,过40目筛,收集到样品袋中,用于测定养分(干物质、粗蛋白质、粗脂肪、粗灰分、能量、钙、磷)表观消化率。
每天记录腹泻情况,并计算腹泻率。
粪便中DNA的提取按照Omega公司的DNA提取试剂盒的操作方法进行,随后进行荧光定量PCR检测,测定回肠和盲肠食糜中的总菌(total bacteria)、乳酸杆菌(Lactobacillus)、芽孢杆菌(Bacillus)、双歧杆菌(Bifidobacterium)和大肠杆菌(Escherichia coli)的数量。引物和探针序列(表2)参考Qi等[4]。
1.5 数据统计与分析所有试验结果均用平均值和标准误表示,先用Excel 2010作初步统计,再采用SAS 9.1软件进行单因素方差分析,并采用Duncan氏法进行多重比较和显著性分析检验,P<0.05表示差异显著,P<0.01表示差异极显著,0.05<P<0.10表示有趋势。
2 结 果 2.1 不同培养基对重组毕赤酵母生长和重组蛋白分泌的影响由图1可知,菌体在进罐18 h内增长非常缓慢。不同培养基对菌体生长过程有不同的影响。前期低盐组菌体湿重增长速率较基础甘油组和基础可溶性淀粉组更快。发酵到114 h,低盐组、基 础甘油组和基础可溶性淀粉组菌体湿重达到最高,分别为450、402、277 g/L。菌体生长在98 h后进入稳定期。发酵114 h,即诱导72 h后开始放罐。取菌液离心收集上清液后,做上清液总蛋白检测,测得低盐组上清液蛋白总浓度0.38 g/L,基础甘油组3.94 g/L,基础可溶性淀粉组5.63 g/L。综合发酵曲线数据,最终选择基础甘油组发酵上清液进行SDS-PAGE检测以及体外抑菌试验。
由图2可知,基础甘油组诱导24、48、72、96 h后,均在41 ku左右出现了特异性条带。
| 表2 荧光定量PCR特异性引物序列及探针 Table 2 Specific primes sequences and probes for RT-PCR |
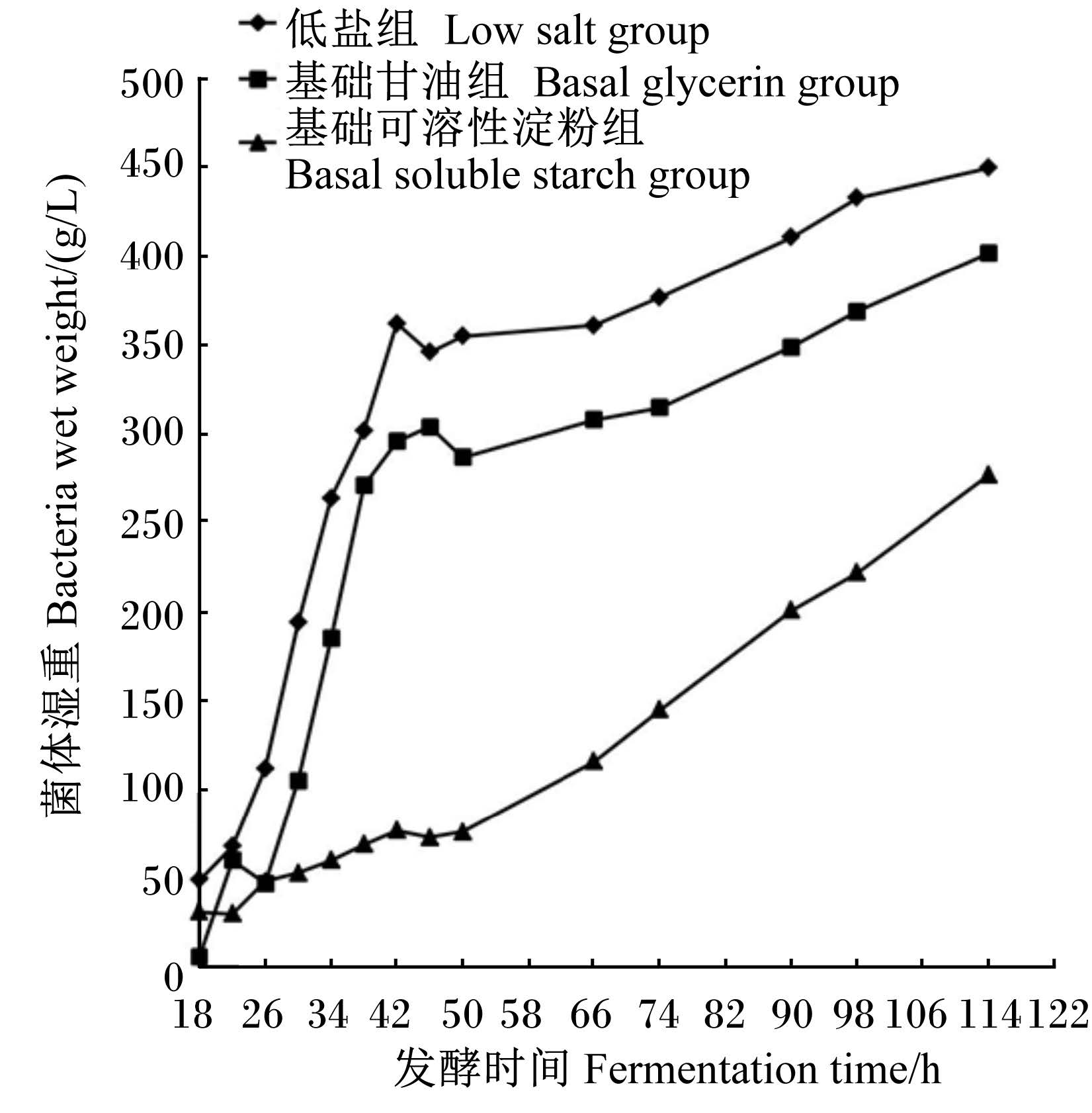 | 图1 不同培养基对毕赤酵母基因工程菌生物量的影响 Fig. 1 Effect of different culture mediums on biomass of PPle |
由图3可知,重组菌丝霉素经glycine-HCl缓冲液(pH=2.0)、glycine-NaOH缓冲液(pH=10.0)和2 500 U的胃蛋白酶处理4 h后,其对金黄色葡萄球菌仍有强烈抑菌效果。其中胃蛋白酶处理之后抑菌效果与对照组相似,表明该重组菌丝霉素对胃蛋白酶耐受能力较强,进入胃后不易被降解,稳定性较好。
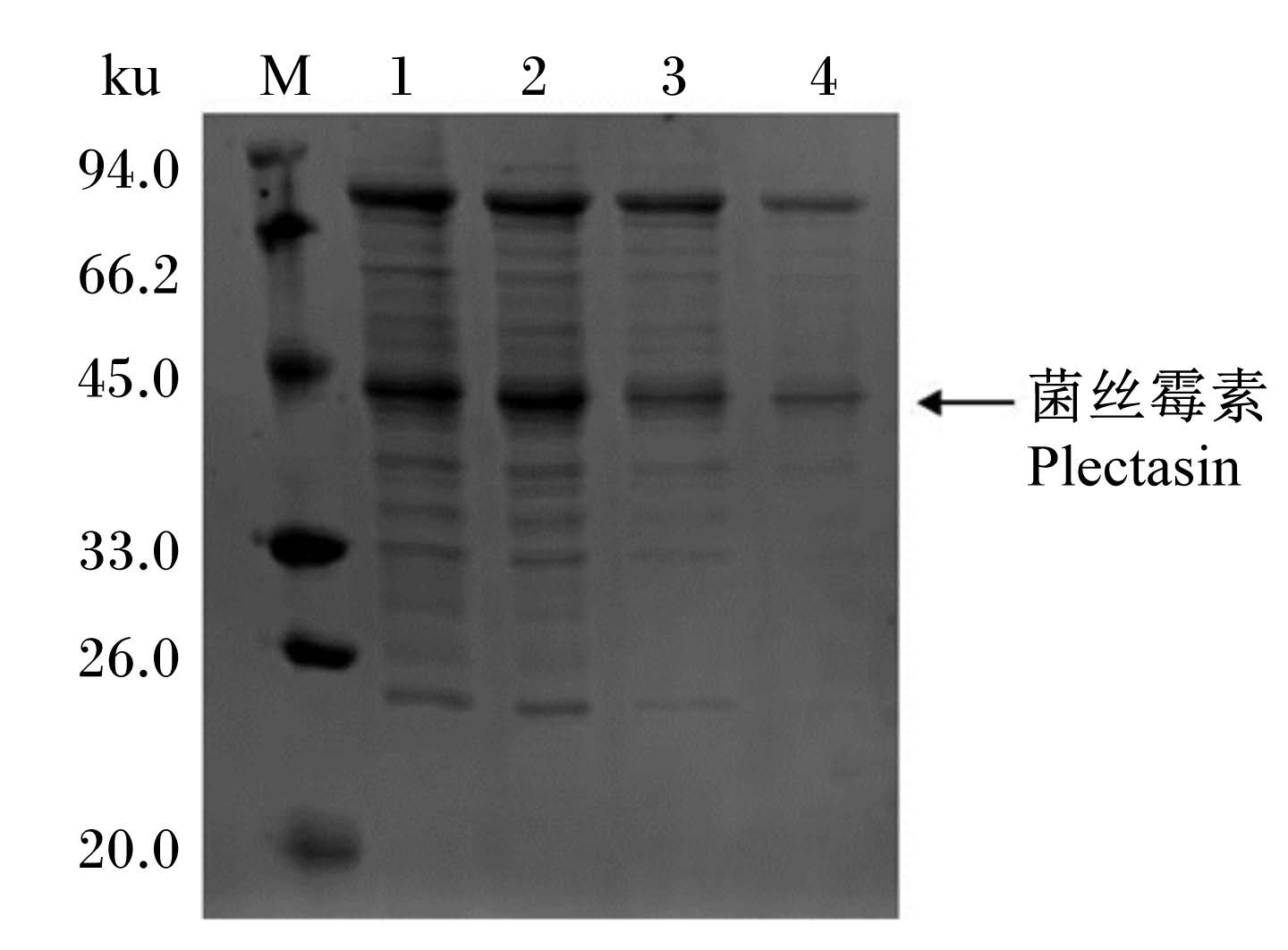 | m:标记,1:诱导96 h,2:诱导72 h,3:诱导48 h,4:诱导24 h。 M:marker,1: induction 96 h, 2: induction 72 h, 3: induction 48 h, 4: induction 24 h. 图2 重组菌丝霉素SDS-PAGE图片 Fig. 2 SDS-PAGE picture of the recombinant plectasin |
如表3所示,与CON组相比,CS组和AP组显著增加了ADFI(P<0.05)。CS、AP和PPB组与CON组相比极显著提高了ADG(P<0.01),以及极显著降低了F/G(P<0.01)。与CON组相比,CS组和AP组有降低腹泻率的趋势(0.05<P<0.10)。
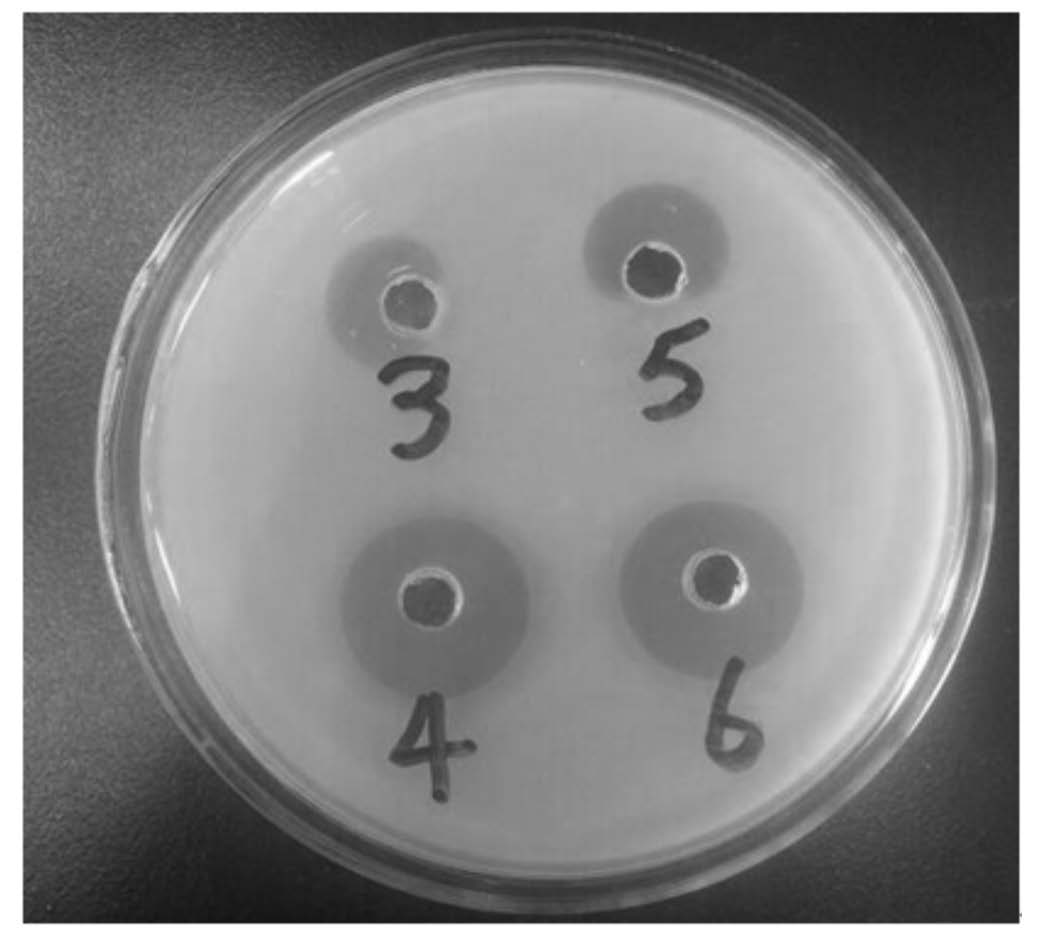 | 3:胃蛋白酶处理,4:甘氨酸-盐酸缓冲液处理,5:甘氨酸-氢氧化钠缓冲液处理,6:对照。 3: pepsin treatment, 4: glycine⁃HCl buffer treatment, 5: glycine⁃NaOH buffer treatment, 6: control. 图3 重组菌丝霉素抑菌图(处理4 h) Fig. 3 Antibacterial picture of the recombinant plectasin (treatment for 4 h) |
由表4可知,与CON组和AP组相比,其余3 个组显著提高了粗灰分的表观消化率(P<0.05),但CON组和AP组之间差异不显著(P>0.05)。PB组磷的表观消化率极显著高于其余4个组(P<0.01)。CON组粗脂肪的表观消化率显著低于其余4个组(P<0.05)。CON组在能量和干物质的表观消化率上有低于其余4个组的趋势(0.05<P<0.10)。
2.5 重组菌丝霉素对断奶仔猪肠道微生物菌群的影响从图4可知,与其余各组相比,AP组显著提高了回肠食糜双歧杆菌的数量(P<0.05),PB组显著提高了回肠食糜乳酸杆菌的数量(P<0.05)。
由图5可知,与CON组相比,AP组显著降低了盲肠食糜中大肠杆菌的数量(P<0.05),PB组显著提高了盲肠食糜中芽孢杆菌的数量(P<0.05)。
| 表3 不同处理对断奶仔猪生长性能的影响 Table 3 Effects of different treatments on growth performance in weaning piglets |
| 表4 不同处理对断奶仔猪养分消化率的影响 Table 4 Effects of different treatments on nutrient digestibility in weaning piglets |
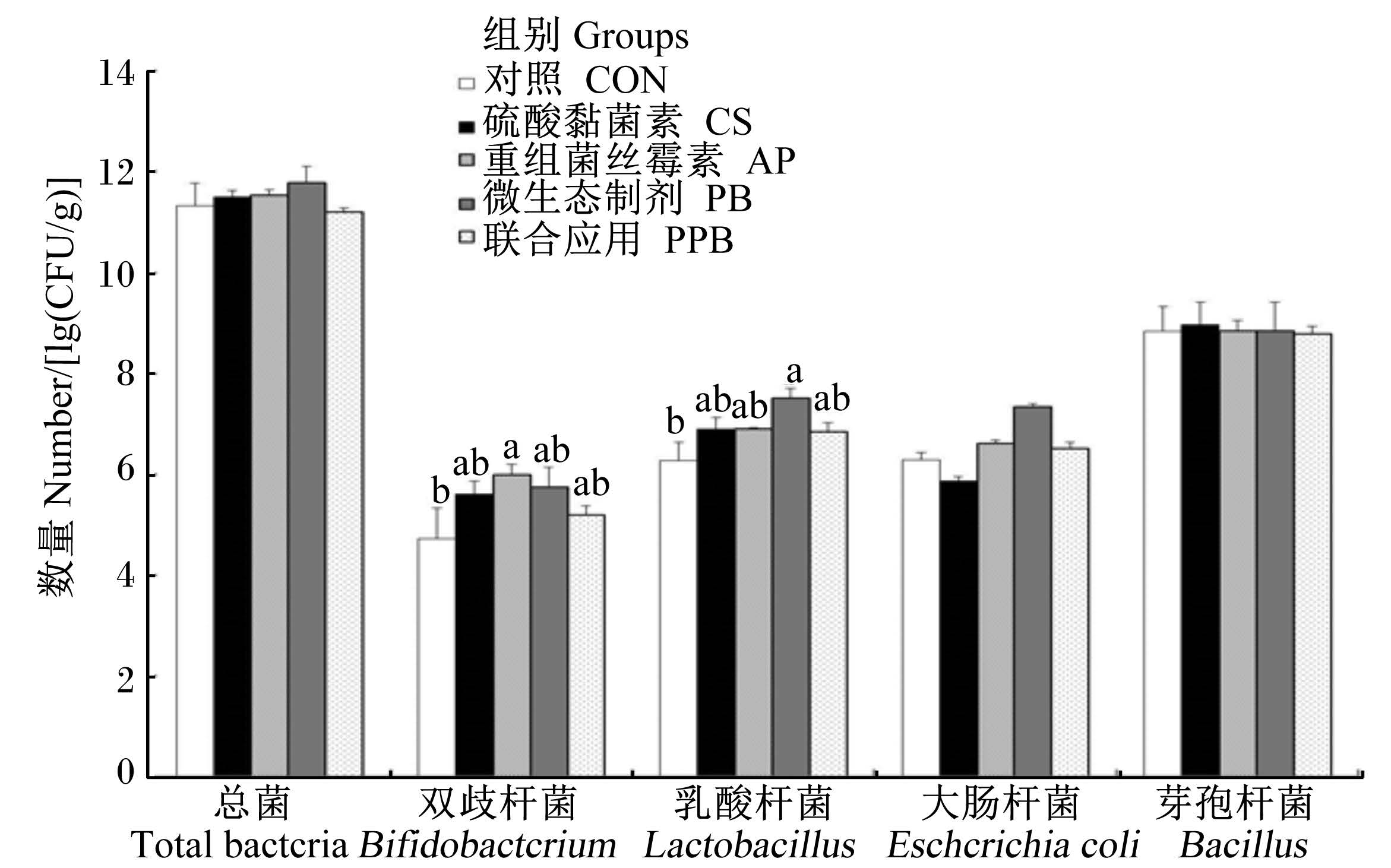 | 数据柱形标注不同小写字母表示差异显著(P<0.05)。图5 同。 Value columns with different small letters mean significant difference (P<0.05). The same as Fig. 5. 图4 不同处理对断奶仔猪回肠微生物的影响(PCR结果) Fig. 4 Effects of different treatments on ileum microflora of weaning piglets (PCR results) |
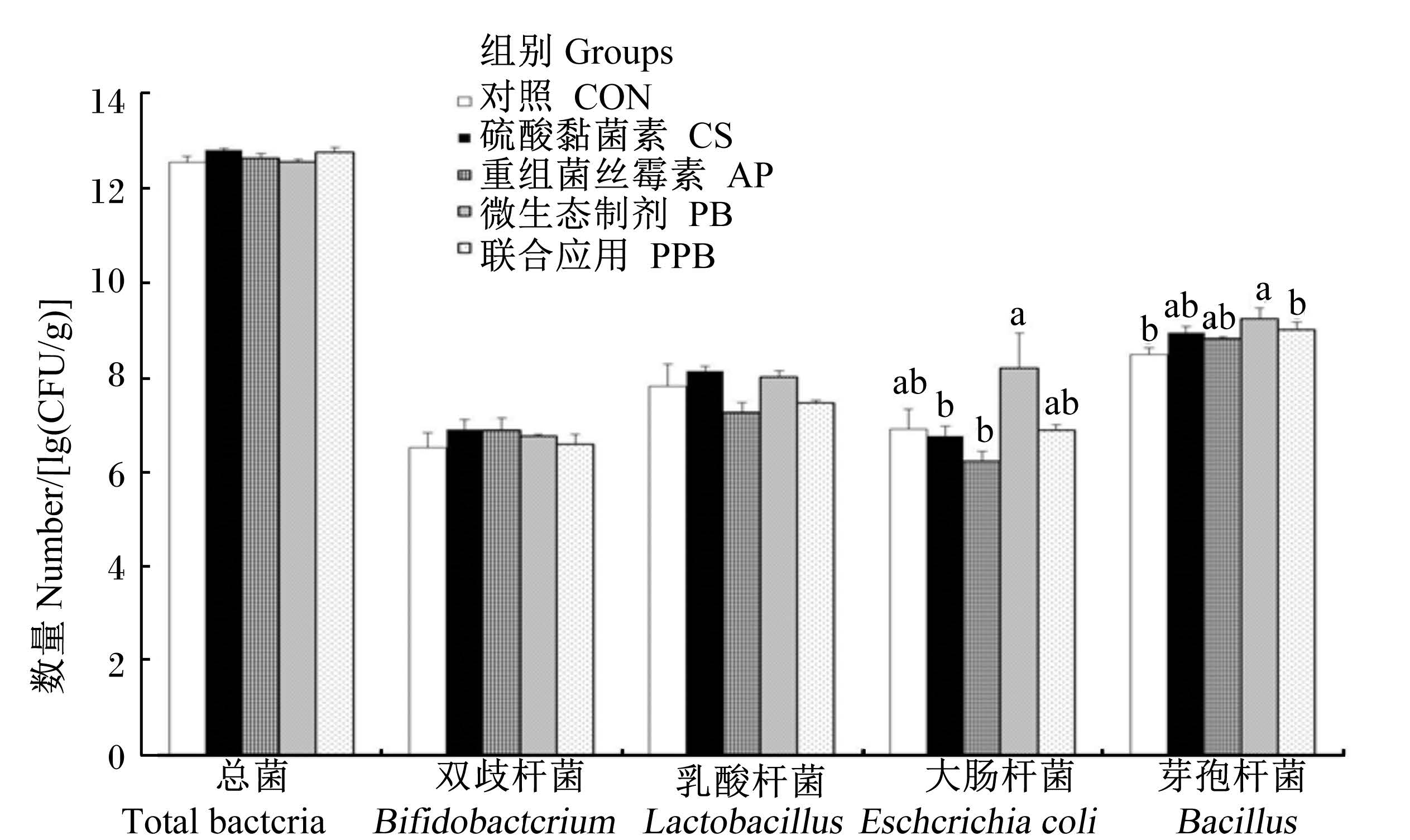 | 图5 不同处理对断奶仔猪盲肠微生物的影响(PCR结果) Fig. 5 Effects of different treatments on cecum microflora of weaning piglets (PCR results) |
发酵过程中培养基的质量在很大程度上决定了菌种的生长速度和生物量[5]。甘油是毕赤酵母生长过程中使用最普遍的碳源,甘油的浓度决定了菌体生长的好坏。文献中有报道将葡萄糖作为碳源其性价比优于甘油[6]。而可溶性淀粉因其价格便宜,经过高温可水解成麦芽糖和葡萄糖,故选择可溶性淀粉作为碳源可大大节约生产成本。
由于BSM基础盐培养基成本低,组成简单,能满足毕赤酵母生长所需的养分,且能使毕赤酵母成功分泌外源蛋白,在工业化培养中应用很广[7, 8, 9]。毕赤酵母外源基因表达既可在胞内也可分泌到胞外。由于发酵培养基中无外源蛋白,且毕赤酵母自身所分泌的内生蛋白少,故对发酵产物的后续纯化带来便利。
刘斌[10]选择pH、温度和甲醇添加量为自变量因素,通过响应面法,使得重组人源胶原蛋白表达量达到19.49 g/L。Zhao等[11]通过降低25%的BSM盐浓度,将人血清蛋白干扰素表达量提高到215 mg/L。即使是同一表达系统,但对于不同的外源蛋白,其表达量存在很大差异。这可能是由于外源基因自身序列和表达条件的不同所造成。
毕赤酵母的生长和表达主要分为2个阶段。第1阶段为以甘油等碳源为主的生长期,此时期主要以积累菌体为目的,待到碳源耗尽,开始进入第2阶段的诱导表达。第2阶段主要通过流加甲醇作为其分泌表达的碳源。江学斌[12]通过比较间歇流加、恒速流加和指数流加对毕赤酵母生长和表达规律的影响,发现分段控制工艺发酵效果最好,发酵菌体湿重达到415 g/L,这与本试验结果一致。发酵过程中pH的控制是通过补加氨水来实现的。氨水既能调节酸碱平衡,也能为毕赤酵母生长提供氮源。有研究报道,pH在3~7之间,毕赤酵母均能良好生长,且pH恒定在5时,外源蛋白分泌量最高[13]。发酵过程中pH主要影响毕赤酵母中酶的活性、细胞膜通透性以及中间代谢产物的离解。本研究表明,pH在5.5时重组菌丝霉素分泌量最高。毕赤酵母分泌表达产物活性高低与发酵温度也密切相关。温度升高,毕赤酵母代谢速率加快,诱导表达期提前到来,但温度过高又会导致酶失活,菌体出现衰老,发酵周期缩短,影响诱导表达产量。研究报道,毕赤酵母生长最适温度为28 ℃,诱导表达最适温度为30 ℃,诱导期温度过高容易导致酵母细胞死亡[14]。本研究发现,发酵温度在30 ℃,菌体生长良好,诱导表达结果比较理想。本实验室前期摇瓶试验发现,重组菌丝霉素的表达量仅达到143 mg/L,可能原因是摇瓶无法控制温度、pH和溶氧,且无法控制甲醇的流加速度。根据毕赤酵母生长特点,结合分批-补料发酵技术,分别补加生长期碳源(甘油),诱导表达期碳源(甲醇)和氮源(氨水),通过溶氧情况来调节补加速度。当溶氧出现迅速上升后开始补加碳源,直至溶氧值控制在20%左右。
本试验菌体在进罐18 h内增长非常缓慢,可能原因是接种量小,菌体密度低。开始流加甲醇时,初期溶氧迅速下降,故需注意流加速度。虽然基础可溶性淀粉组测得蛋白总浓度最高,但通过SDS-PAGE检测发现目的蛋白几乎没有,加之其菌体生长曲线不符合毕赤酵母生长规律,推测发酵过程中由于淀粉类物质不易被酵母细胞所利用,导致大部分酵母细胞发生菌体自容现象,从而导致菌体总蛋白浓度偏高。综合考虑菌体生长曲线,筛选出最适培养基为基础甘油组。
通过SDS-PAGE检测,由图可以看出基础甘油组发酵上清液中杂蛋白少,目的条带清晰,说明诱导表达产物纯度较高。通过酸、碱和胃蛋白酶处理4 h后,重组菌丝霉素抗菌肽对金黄色葡萄球菌依然有强烈抑菌效果,可能是由于重组菌丝霉素分子里含有3个二硫键,使其结构稳定,不易被降解。
目前,饲粮中添加抗菌肽对断奶仔猪生长性能的影响报道较多。抗菌肽由于其抗菌谱广,耐药性低,抗菌作用迅速而备受关注。Yoon等[15]通过比较饲粮中添加阿泊拉霉素和不同剂量抗菌肽A3,结果发现,随着抗菌肽A3添加剂量的增多,能显著提高断奶仔猪ADG,但对ADFI无影响;添加抗菌肽A3后,能显著提高粗蛋白质和干物质的消化率。Xiong等[16]研究发现,在保育料中添加复合抗菌肽可极显著提高ADG和ADFI,极显著降低F/G,对断奶仔猪的生长性能起到了较好的改善作用。Wang等[17]在饲粮中添加乳铁蛋白抗菌肽,结果发现与对照组(无抗生素的基础饲粮)相比,抗菌肽组极显著提高了断奶仔猪的ADG,增幅达到了41.8%,显著降低了F/G。本试验研究结果表明,与CON组相比,AP组显著提高了ADG和ADFI,显著降低了F/G,有提高能量、粗脂肪、干物质等养分消化率的趋势,以及降低断奶仔猪腹泻率的趋势。AP组与CS组相比,差异不显著,说明在生长性能方面,菌丝霉素能起到与抗生素相类似的效果。但是也存在不一致的报道。Shan等[18]和Wu等[19]研究发现,饲粮中添加复合抗菌肽对断奶仔猪ADFI无影响,这可能是由于断奶日龄和体重的不同所造成。菌丝霉素通过与带负电荷的微生物细胞膜结合并插入膜内,导致细胞膜空洞的形成,细胞内容物渗漏,从而杀灭病原菌。大肠杆菌产生内毒素引起炎症反应,导致仔猪腹泻,是一类有害菌。乳酸杆菌是研究报道中较为常见的一类有益菌,在消化道内乳酸杆菌能产生乳酸,消耗氧气,与病原菌抢占肠黏膜结合位点来抑制病原菌的生长繁殖,乳酸杆菌还能抑制细菌细胞膜的生成。芽孢杆菌能产生多种消化代谢的酶,分解饲料中的抗营养因子,提高饲料利用率。双歧杆菌能辅助治疗慢性腹泻和便秘,是一类有益菌[20]。本研究结果表明,添加重组菌丝霉素后能显著提高回肠食糜中双歧杆菌的数量,显著降低盲肠食糜中大肠杆菌的数量。菌丝霉素能杀灭有害菌,减少有害菌对肠道黏膜结合位点的竞争,促进有益菌的生长繁殖,从而维持动物肠道微生物菌群的平衡。由于抗生素对肠道内菌群的杀灭是广谱的,杀灭有害菌的同时也会减少肠道内有益菌的数量,不利于微生物菌群的平衡。由此可见,应用菌丝霉素替代抗生素,可有效维护肠道微生物菌群的平衡。重组菌丝霉素进入体内后,通过抑制肠道内有害微生物的生长,给有益微生物提供了良好的生存空间,更多的有益微生物能促进肠道对营养物质的吸收,从而改善仔猪生长性能,提高养分消化率。
4 结 论该研究结果证实了本实验室发酵产品重组菌丝霉素在饲料添加剂行业中具有较大的应用价值及开发前景,在断奶仔猪饲粮中添加重组菌丝霉素能改善断奶仔猪生长性能,提高养分表观消化率,维护肠道微生物菌群的平衡。在今后的研究中还应对发酵条件进一步优化,同时完善该抗菌肽产品的加工工艺,使之更符合动物生理特点。
| [1] | SCHNEIDER T,KRUSE T,WIMMER R,et al.Plectasin,a fungal defensin,targets the bacterial cell wall precursor lipid Ⅱ[J].Science,2010,328(5982):1168-1172.( 2) 2) |
| [2] | 马卫明,佘锐萍,靳红,等.猪小肠抗菌肽的抗菌作用研究[J].中国兽医杂志,2005,41(1):3-7.( 1) 1) |
| [3] | 万津,陈代文,余冰,等.重组菌丝霉素高密度发酵制备及其功效研究[J].农业生物技术学报,2015,23(12):1625-1631.( 1) 1) |
| [4] | QI H W,XIANG Z T,HAN G Q,et al.Effects of different dietary protein sources on cecal microflora in rats[J].African Journal of Biotechnology,2011,10(19):3704-3708.( 1) 1) |
| [5] | 胡爱红.重组毕赤酵母产木聚糖酶发酵条件及其酶学性质的研究[D].硕士学位论文.西安:西北大学,2009.( 1) 1) |
| [6] | 洒荣波,石贵阳,王正祥,等.基因工程菌Pichia pastoris高密度培养条件的摇瓶研究[J].食品研究与开发,2005,26(2):52-57.( 1) 1) |
| [7] | KOBAYASHI K,KUWAE S,OHYA T,et al.High-level expression of recombinant human serum albumin from the methylotrophic yeast Pichia pastoris with minimal protease production and activation[J].Journal of Bioscience and Bioengineering,2000,89(1):55-61.( 1) 1) |
| [8] | XIONG A S,YAO Q H,PENG R H,et al.High level expression of a synthetic gene encoding Peniophora lycii phytase in methylotrophic yeast Pichia pastoris[J].Applied Microbiology and Biotechnology,2006,72(5):1039-1047.( 1) 1) |
| [9] | ZHANG J G,WANG X D,ZHENG Y,et al.Enhancing yield of S-adenosylmethionine in Pichia pastoris by controlling NH+4 concentration[J].Bioprocess and Biosystems Engineering,2008,31(2):63-67.( 1) 1) |
| [10] | 刘斌.巴氏毕赤酵母基因工程菌高密度发酵表达重组人源胶原蛋白[D].博士学位论文.南京:南京理工大学,2012.( 1) 1) |
| [11] | ZHAO H L,XUE C,WANG Y,et al.Increasing the cell viability and heterologous protein expression of Pichia pastoris mutant deficient in PMR1 gene by culture condition optimization[J].Applied Microbiology and Biotechnology,2008,81(2):235-241.( 1) 1) |
| [12] | 江学斌.基于工业化生产的毕赤酵母高效表达木聚糖酶XYL1的研究[D].博士学位论文.广州:华南理工大学,2013.( 1) 1) |
| [13] | CEREGHINO J L,CREGG J M.Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J].FEMS Microbiology Reviews,2000,24(1):45-66.( 1) 1) |
| [14] | 唐浩.毕赤酵母表达基因工程抗体高效发酵及纯化工艺研究[D].硕士学位论文.西安:第四军医大学,2007.( 1) 1) |
| [15] | YOON J H,INGALE S L,KIM J S,et al.Effects of dietary supplementation of antimicrobial peptide-A3 on growth performance,nutrient digestibility,intestinal and fecal microflora and intestinal morphology in weanling pigs[J].Animal Feed Science and Technology,2012,177(1/2):98-107.( 1) 1) |
| [16] | XIONG X,YANG H S,LI L,et al.Effects of antimicrobial peptides in nursery diets on growth performance of pigs reared on five different farms[J].Livestock Science,2014,167:206-210.( 1) 1) |
| [17] | WANG Y,SHAN T,XU Z,et al.Effect of lactoferrin on the growth performance,intestinal morphology,and expression of PR-39 and protegrin-1 genes in weaned piglets[J].Journal of Animal Science,2006,84(10):2636-2641.( 1) 1) |
| [18] | SHAN T,WANG Y,LIU J,et al.Effect of dietary lactoferrin on the immune functions and serum iron level of weanling piglets[J].Journal of Animal Science,2007,85(9):2140-2146.( 1) 1) |
| [19] | WU S D,ZHANG F R,HUANG Z M,et al.Effects of the antimicrobial peptide cecropin AD on performance and intestinal health in weaned piglets challenged with Escherichia coli[J].Peptides,2012,35(2):225-230.( 1) 1) |
| [20] | 刁慧.苯甲酸和百里香酚对断奶仔猪生长性能和肠道健康的影响[D].硕士学位论文.雅安:四川农业大学,2013.( 1) 1) |




