据估计,反刍动物吸收能量的70%~80%由挥发性脂肪酸(VFA)提供[1],研究表明,反刍动物瘤胃内乙酸和丁酸主要用于合成脂肪酸,丙酸则是葡萄糖合成的前体。因此,瘤胃内的各种VFA含量和组成对评定反刍动物瘤胃的能量利用都是十分重要的[2]。Dijkstra等[3]建立了一种模拟反刍动物瘤胃消化、吸收的动态模型,但为提高预测的精确度需要了解瘤胃内营养的消化吸收情况。Friggens等[4]根据经验研究了绵羊瘤胃发酵参数和饲粮化学组成的关系得到了预测瘤胃液VFA含量的方程,研究发现瘤胃液VFA含量与饲料的化学成分有关,但是将试验饲粮因素加入到回归方程,并没有提高预测方程的精确度。Rymer等[5]发现体外产气速率与瘤胃内的乙酸和丁酸的含量呈负相关而与丙酸和戊酸的含量成正相关。然而,Brown等[6]却得到体外产气率与乙酸和丁酸含量负相关,与丙酸的含量呈正相关。目前,为了准确测定瘤胃VFA含量需要对动物进行手术安装瘘管或是通过食道插管取样,这样在试验过程中会对动物体造成伤害产生应激,使试验结果产生误差,也不符合动物福利的要求,因此选择一种新的非侵害的方法研究瘤胃的发酵是非常必要的。乳脂作为非常容易获得的样本已经被用于动物体健康和营养研究[7, 8]。其中的奇数和支链脂肪酸(odd- and branched-chain fatty acids,OBCFA)主要来源于离开瘤胃细菌的脂质,而且内源合成的量十分有限[9],研究发现不同的瘤胃细菌的OBCFA组成不同,可以用于瘤胃微生物种群组成和变化的评估。Vlaeminck等[10]通过体外试验得到瘤胃液中OBCFA含量与乙酸、丙酸和丁酸含量相关性高。之后,他们在研究乳脂OBCFA与瘤胃液VFA含量关系时也得到了相似的结果[11]。本试验中为了消除产奶不同时期对试验数据的影响,分别采集了处于不同产奶时期奶牛的试验样本。本试验的目地是研究乳脂OBCFA含量与瘤胃液VFA的关系,并利用乳脂OBCFA建立瘤胃液VFA含量预测的回归方程。
1 材料与方法 1.1 试验设计试验在黑龙江省哈尔滨市对青山镇完达山奶牛场进行,选择第1胎次体重[(650±33) kg]相近的健康荷斯坦奶牛,处于产奶初期、中期和晚期的各3头(同一时期奶牛产奶量相近)。产奶初期、中期和晚期的产奶量分别为(35.44±2.63) kg/d、(37.62±2.85) kg/d和(26.98±2.79) kg/d。饲养管理按照牛场高产奶牛常规进行,06:00和18:00投放高产奶牛全混合日粮(TMR),为奶牛场常规饲粮,自由采食和饮水,其组成及营养水平见表1。TMR的主要营养水平测定方法如下:样品经过(60±5) ℃干燥处理后测定干物质(DM)含量[12],氮含量利用凯氏定氮方法测定[12],粗蛋白质含量为氮含量的6.25倍;酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)含量测定参照Soest等[13]的方法,使用热稳定的α-淀粉酶(α-amylase)用Ankom 220纤维分析仪测定;钙(Ca)和总磷(TP)含量的测定方法参照杨胜[14]提供的方法。产奶净能依据《奶牛营养需要和饲料成分》[15]中的方法计算。
| 表1 全混合日粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the TMR (air-dry basis) |
采集奶样和瘤胃液,各约100 mL,-20 ℃保存。奶样采集利用阿菲金自动挤奶机取样,每头牛每天02:00、10:00和16:00取样约200 mL按照4 ∶ 3 ∶ 3的比例混合后取5 mL,-20 ℃保存,共27个样本。使用胃管式瘤胃液采集器(武汉市科立博器材有限公司)采集瘤胃液。为避免给试验动物造成伤害,产生应激反应,采集08:00—20:00 12 h每隔2 h的样品,分3 d进行,采样时间点如下:第1天,08:00、14:00、20:00;第2天,12:00、18:00;第3天,10:00、16:00,采集的瘤胃液经4层纱布过滤后,取5 mL按20%的比例加入15%(m/V)的偏磷酸保护液后,-20 ℃保存,共63个样本。
1.2 样品处理与分析采集的瘤胃液按照Li等[16]提供的方法处理,瘤胃液解冻后1 000×g离心15 min后取上清,然后上清经12 000×g离心15 min后用0.22 μm滤膜过滤后用气相色谱仪(GC-2010,Tokyo,日本)使用FFAP色谱柱(HP-INNOWAX,30 m×0.25 mm×0.2 μm)测定每种VFA含量。乳脂处理参照Vlaeminck等[7]的方法,使用气相色谱仪(GC-2010,Tokyo,日本)测定各种OBCFA含量,色谱柱为SP-2560TM(100 m×0.25 mm×0.2 μm)。具体方法:取2 mL乳样加入到25 mL的带有螺旋盖的耐高温离心管中,然后加入2.5 mL甲醇、1.25 mL氯仿,涡旋混匀。室温放置1 h,每隔10 min涡旋1次。1 h后,加入1.25 mL氯仿、1.15 mL水、0.1 mL 3 mol/L的HCl,室温下1 200×g离心3 min;底层的氯仿层经无水硫酸钠上干燥,过滤,上层再加入1.25 mL的氯仿萃取1次,室温下1 200×g离心3 min后,取底层溶液经无水硫酸钠上干燥,过滤;收集2次滤液到离心管中,氮气吹干,加入3滴苯,涡旋混匀;在离心管中加入200 μL氢氧化钠醇溶液(0.2 mg NaOH溶解到甲醇中)使脂肪甲基化,室温静置25 min后,加入11 mL甲醇化的硫酸(2.8 mL 96%的硫酸加入到100 mL甲醇中),振荡混匀后,50 ℃水浴15 min,-20 ℃保存3 min;加入1.0 mL水和1.0 mL己烷,涡旋混匀,室温下1 200×g离心3 min,取上层经0.22 μm滤膜过滤后用于测定。气相色谱测定的条件:进样口温度为240 ℃,压力为266.9 kPa,载气为高纯氮气。柱温箱采用逐阶段升温程序,初始温度为170 ℃维持30 min,再以1.5 ℃/min升到200 ℃维持20 min,最后以5 ℃/min升高到230 ℃维持5 min。
1.3 数据分析瘤胃液VFA含量采用各种VFA占总VFA的比例(%),总VFA浓度是乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸浓度的总和。乳脂OBCFA含量为各种OBCFA占总脂肪酸的含量的比例(%)。数据分析均使用SAS 9.2软件进行,相关和回归分析以乳脂OBCFA含量为自变量,瘤胃液VFA含量为因变量,每个奶牛个体的每个时间点的瘤胃液VFA数据与采集瘤胃液当天乳脂OBCFA的数据相对应进行分析。相关分析使用PROC CORR过程,分析结果通过Pearson方法进行检验,0.05<P≤0.10表示趋于相关,P≤0.05表示显著相关,P≤0.01表示极显著相关。回归分析采用PROC REG过程的STEPWISE进行多元逐步回归分析,模型采用线性混合模型[17]并利用最小二乘法进行参数估计,回归方程使用均方根误差(RMSE)、变异系数(CV)和决定系数(R2)进行检验。RMSE计算公式如下:
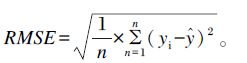
式中:n为样本量,yi和${\hat y_i}$分别为观测值和预测值。
将测定的乳脂OBCFA含量代入回归方程得到瘤胃液VFA含量的预测结果与实测的结果使用CORR过程进行相关分析,结果通过Pearson方法进行检验,并计算两者相对偏差,得到预测结果与实测结果的残差图。
2 结果与分析 2.1 瘤胃液各种VFA含量与乳脂OBCFA含量的 关系由表2可见,从各瘤胃发酵参数的结果显示乙酸、丙酸和丁酸含量多且变异系数较小,而异丁酸、异戊酸和戊酸含量较少且变异系数较大。瘤胃液中的乙酸含量最多,其次是丙酸和丁酸,其他几种酸含量较少。乳脂中的各种OBCFA含量不同,线性奇数脂肪酸含量较多,反式异构的支链脂肪酸较少。OBCFA中反式异构十七烷酸(antisoC17 ∶ 0)含量和十五烷酸(C15 ∶ 0)含量较多,其次是异构十七烷酸(isoC17 ∶ 0)、十七烷酸(C17 ∶ 0)和反式异构十五烷酸(antisoC15 ∶ 0)。反式异构和线性奇数脂肪酸含量变异系数较小,而异构脂肪酸含量的变异系数较大。
| 表2 用于预测模型的数据统计结果 Table 2 Statistical results of data used for prediction model |
各种VFA含量与各种OBCFA含量的相关关系结果见表3。瘤胃液中各种VFA含量均能找到与之显著或极显著相关的OBCFA含量(P≤0.05或P≤0.01)。十一烷酸(C11 ∶ 0)含量与乙酸和戊酸含量相关性高。异构十五烷酸(isoC15 ∶ 0)与异戊酸含量相关性趋于显著(0.05<P≤0.10)。C15 ∶ 0含量与乙酸和丙酸含量相关性较高。异构棕榈酸(isoC16 ∶ 0)含量与除丙酸和丁酸外的其他几种VFA含量的相关性都较高。isoC17 ∶ 0含量与异戊酸和戊酸含量相关性高。C17 ∶ 0含量与各种VFA含量相关性都较高,与乙酸含量呈正相关,而与其他VFA含量呈负相关。
| 表3 瘤胃液挥发性脂肪酸含量与乳脂奇数和支链脂肪酸含量的相关关系 Table 3 Correlation between contents of rumen fluid VFAs and milk fat OBCFAs (n=63) |
由表4可见,各参数检验P值都小于0.05。瘤胃液乙酸、丙酸和丁酸回归方程的RMSE分别为1.57、1.06和0.33,异丁酸、异戊酸和戊酸回归方程的RMSE均为0.13。各方程的决定系数都在0.4以上,其中乙酸和丁酸的在0.6以上。
| 表4 用乳脂奇数和支链脂肪酸含量估测瘤胃液挥发性脂肪酸含量的方程 Table 4 Equations to predict rumen contents of rumen fluid VFAs from milk fat OBCFAs |
由表5可见,通过对实测值和回归方程估测值的相关分析得到实测值与估测值之间均极显著相关(P≤0.01),异丁酸和异戊酸的预测值与实测值的相关性较高(r>0.5),其他的较低。统计相对 偏差在≤10%范围内,乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸的数值个数分别占数值总数的90.48%、85.71%、55.56%、90.48%、68.25%和71.43%。
| 表5 利用回归方程估测瘤胃液挥发性脂肪酸含量的结果 Table 5 Estimated results of rumen fluid VFA contents using regression equations |
以表3得到的回归方程的预测值为横坐标,实测值和预测值的残差为纵坐标所做的残差图(图1)显示,各数据点随机平均分配在X轴上下。
3 讨 论 3.1 瘤胃液VFA含量与乳脂OBCFA含量的关系Sutton等[18]研究发现瘤胃液中VFA的含量对于评定瘤胃吸收VFA更有价值,也更准确。因此,瘤胃液VFA的含量能够为动物营养利用提供更有价值的信息。本试验中使用的数据即是瘤胃内各种VFA占总VFA的比例。瘤胃液中的各种 VFA的含量和乳脂中的OBCFA含量与其他试验得到的结果相近[15]。
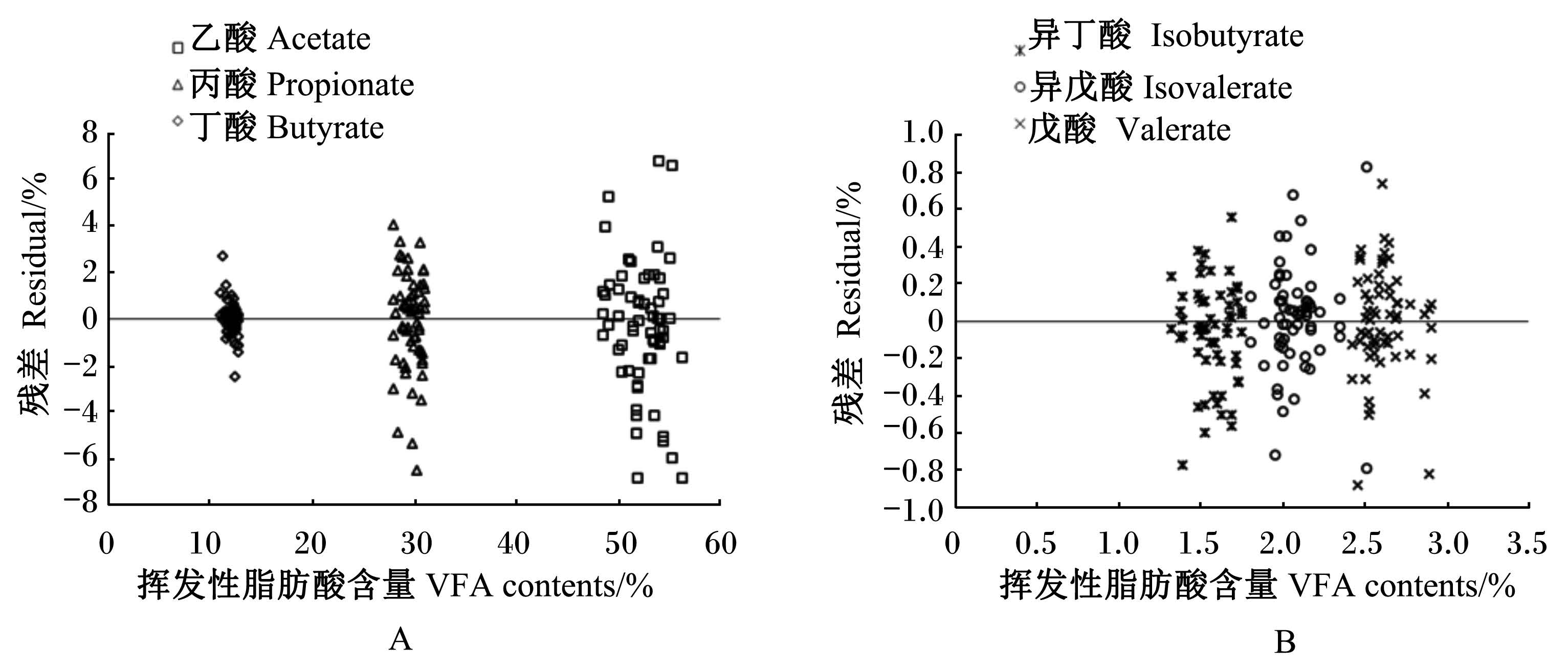 | 图1 瘤胃液挥发性脂肪酸含量估测值与实测值的残差图 Fig. 1 Residual plots of estimated and measured values of the rumen fluid VFA contents |
瘤胃微生物在脂肪酸合成酶作用下,以VFA为前体合成饱和脂肪酸。丙酸和戊酸延长形成奇数线性脂肪酸[19],而支链脂肪酸以支链的氨基酸(亮氨酸、异亮氨酸和缬氨酸)和支链短的VFA(异丁酸和异戊酸)为前体合成[20]。本试验得到乳脂C15 ∶ 0含量与瘤胃液中的乙酸和丙酸含量的相关系数大,乳脂C17 ∶ 0含量与瘤胃液中的乙酸、丙酸和丁酸含量相关性较大,此结果与Vlaeminck等[11]研究乳脂OBCFA含量与瘤胃发酵参数关系得到的结果一致。另外,Vlaeminck等[11]还得到乳脂异构豆蔻酸(isoC14 ∶ 0)和isoC15 ∶ 0含量与瘤胃液乙酸含量呈正相关。本试验得到乳脂isoC16 ∶ 0含量与瘤胃液乙酸含量呈负相关的结果。产生这一结果的原因可能是由于瘤胃细菌合成不同异构脂肪酸的过程不同造成的[19];另外,Dijkstra[21]指出相比于淀粉,瘤胃可发酵纤维会产生较多的乙酸和较少的丙酸和丁酸,物质不同的发酵方式也可能是原因之一。本试验结果显示,瘤胃液乙酸含量与乳脂中C15 ∶ 0含量呈正相关。Vlaeminck等[11]在研究乳脂OBCFA含量与瘤胃发酵参数关系中也得到了相似的结果。本试验中瘤胃液丙酸含量与乳脂C15 ∶ 0和C17 ∶ 0含量存在负相关关系。研究表明,乳腺组织能够合成丙酰辅酶A用于线性奇数脂肪酸的合成。French等[22]向瘤胃内灌注丙酸发现瘤胃内丙酸含量没有显著提高,而乳脂中的C15 ∶ 0和C17 ∶ 0含量有显著提高;丙酸在瘤胃中被吸收的速率加快[23],这些都是导致这一结果的原因。本试验中丁酸的含量与乳脂中的C17 ∶ 0含量呈负相关。丁酸与乙酸一样可用于脂肪组织和乳腺的脂肪酸合成,乙酸和丁酸之间还可以相互转化[18]。除此之外,丁酸在瘤胃内吸收速率[23]和代谢途径[24]也与乙酸有很大的不同,因此两者与乳脂脂肪酸的关系存在差异。
异位酸是一些瘤胃细菌尤其是纤维分解菌消化和合成蛋白质所必需的营养因子[25]。Liu等[26]研究得到饲粮补充异位酸有利于瘤胃微生物蛋白合成,植物细胞壁发酵和干物质的消化。本试验发现异丁酸、异戊酸和戊酸含量与乳脂isoC16 ∶ 0含量呈正相关,与乳脂C17 ∶ 0含量呈负相关,瘤胃液异戊酸含量与乳脂isoC15 ∶ 0含量呈正相关。瘤胃微生物一方面分解饲粮中的支链氨基酸产生异位酸,另一方面利用异位酸合成微生物体自身支链氨基酸[27]。因此,瘤胃液异位酸含量影响瘤胃微生物生长还与饲粮蛋白质有关。Cabrita等[28]antisoC17 ∶ 0含量与瘤胃液氨态氮含量相关,建议可以作为瘤胃内蛋白质早期获得或缺陷的标记物质。
3.2 多元回归方程的建立及其估测值与实测值的比较从表4中得到以乳脂的OBCFA含量为自变量建立的估测瘤胃液中VFA含量的回归方程是可靠的。RMSE能够说明预测方程的可靠性,值越低说明回归方程的越可靠。Bannink等[29]总结得到各种瘤胃液VFA含量的预测模型的RMSE,乙酸在0.89~5.00之间,丙酸在4.55~9.70之间,丁酸在1.50~5.32之间。Vlaeminck等[11]得到的瘤胃液VFA含量的预测方程的乙酸、丙酸和丁酸RMSE分别为2.05、1.77和1.07。本试验得到的回归方程的RMSE比较小,说明得到的回归方程的可靠性较高,可以用于实际应用。一般认为决定系数小于0.5时,所得的回归直线很难说明变量之间的依赖关系。在本试验中乙酸和丁酸的预测方程的决定系数(>0.5)较高,估测值的变异系数较小,说明预测方程的可靠性较高。
3.3 多元回归方程估测瘤胃液VFA的预测值与实测值的比较各回归方程的预测值与实测值差异不显著,而且2组数值均极显著相关,相对误差在≤10%范围的数值个数在50%以上。这些结果表明,用于预测瘤胃液VFA含量的方程有一定的准确性。乙酸和丁酸的相对误差在≤10%范围的数值个数在90%以上,说明这2个预测方程的评定结果更为准确。
由于瘤胃液VFA含量会受到瘤胃发酵模式的影响,饲粮的精粗比及油脂添加情况等都会对瘤胃发酵产生影响,导致回归方程预测值的偏差。有研究表明,饲粮中高含量的瘤胃可消化淀粉会使乙酸的预测值偏低,丙酸的预测值偏高[30]。奶牛饲粮中较多粗饲料会导致乙酸模型的预测值高于实测值,而使丙酸预测值略低于实测值[31]。饲粮内的亚麻籽油在瘤胃内被消化,产生乙酸,会影响乙酸含量的预测的准确性[32]。因此,为了提高预测方程的准确性,饲粮因素也需要考虑到回归方程中,另外,各种OBCFA在体内的转运过程和对于乳脂OBCFA的贡献,特别是导致负能量平衡的部分还需要进一步的研究。
4 结 论乳脂OBCFA含量与瘤胃内各种VFA的含量存在着相关关系,以乳脂OBCFA建立的瘤胃液各种VFA含量的回归方程准确性较高,尤其是乙酸和丙酸含量的预测方程,可以应用于实际的试验研究及生产。
| [1] | VAN HOUTERT M.Challenging the retinal for altering VFA ratios in growing ruminates[J].Feed Mix,1996,4(1):514-525.( 1) 1) |
| [2] | SUTTON J D.Digestion and absorption of energy substrates in the lactating cow[J].Journal of Dairy Science,1985,68(12):3376-3393.( 1) 1) |
| [3] | DIJKSTRA J,NEALH D S C,BEEVER,D E,et al.Simulation of nutrient digestion,absorption and outflow in the rumen:model description[J].The Journal of Nutrition,1992,122(11):2239-2295.( 1) 1) |
| [4] | FRIGGENS N C,OLDHAM J D,DEWHURST R J,et al.Proportions of volatile fatty acids in relation to the chemical composition of feeds based on grass silage[J].Journal of Dairy Science,1998,81(5):1331-1344.( 1) 1) |
| [5] | RYMER C,GIVENS D I.Relationships between patterns of rumen fermentation measured in sheep and in situ degradability and the in vitro gas production profile of the diet[J].Animal Feed Science and Technology,2002,101(1/2/3/4):31-44.( 1) 1) |
| [6] | BROWN V E,RYMER C,AGNEW R E,et al.Relationship between in vitro gas production profiles of forages and in vivo rumen fermentation patterns in beef steers fed those forages[J].Animal Feed Science and Technology,2002,98(1/2):13-24.( 1) 1) |
| [7] | VLAEMINCK B,DUFOUR C,VAN VUUREN A M,et al.Use of odd and branched-chain fatty acids in rumen contents and milk as a potential microbial marker[J].Journal of Dairy Science,2005,88(3):1031-1042.( 2) 2) |
| [8] | MOTTRAM T.Automatic monitoring of the health and metabolic status of dairy cows[J].Livestock Production Science,1997,48(3):209-217.( 1) 1) |
| [9] | KEENEY M,KATZ I,ALLISON M J.On the probable origin of some milk fat acids in rumen microbial lipids[J].Journal of the American Oil Chemists Society,1962,39(4):198-201.( 1) 1) |
| [10] | VLAEMINCK B,FIEVEZ V,VAN LAAR H,et al.Rumen odd and branched chain fatty acids in relation to in vitro rumen volatile fatty acid productions and dietary characteristics of incubated substrates[J].Journal of Animal Physiology and Animal Nutrition,2004,88(11/12):401-411.( 1) 1) |
| [11] | VLAEMINCK B,FIEVEZ V,TAMMINGA S,et al.Milk odd- and branched-chain fatty acids in relation to the rumen fermentation pattern[J].Journal of Dairy Science,2006,89(10):3954-3964.( 5) 5) |
| [12] | AOAC.Official methods of analysis[M].15th ed.Arlington,Virginia,USA:Association of Official Analytical Chemists,1990.( 1) 1) |
| [13] | VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74(10):3583-3597.( 1) 1) |
| [14] | 杨胜.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,1993:28-32.( 1) 1) |
| [15] | 冯仰廉,陆治年.奶牛营养需要和饲料成分[M].北京:中国农业出版社,2007:1-2.( 4) 4) |
| [16] | LI Y,MENG Q.Effect of different types of fibre supplemented with sunflower oil on ruminal fermentation and production of conjugated linoleic acids in vitro[J].Archives of Animal Nutrition,2006,60(5):402-411.( 1) 1) |
| [17] | ST-PIERRE N R.Invited review:integrating quantitative findings from multiple studies using mixed model methodology[J].Journal of Dairy Science,2001,84(4):741-755.( 1) 1) |
| [18] | SUTTON J D,DHANOA M S,MORANT S V,et al.Rates of production of acetate,propionate,and butyrate in the rumen of lactating dairy cows given normal and low-roughage diets[J].Journal of Dairy Science,2003,86(11):3620-3633.( 1) 1) |
| [19] | VLAEMINCK B,FIEVEZ V,CABRITA A R J,et al.Factors affecting odd- and branched-chain fatty acids in milk:a review[J].Animal Feed Science and Technology,2006,131(3/4):389-417.( 2) 2) |
| [20] | KANEDA T.Iso- and anteiso-fatty acids in bacteria:biosynthesis,function,and taxonomic significance[J].Microbiology and Molecular Biology Reviews,1991,55(2):288-302.( 1) 1) |
| [21] | DIJKSTRA J.Production and absorption of volatile fatty acids in the rumen[J].Livestock Production Science,1994,39(1):61-69.( 1) 1) |
| [22] | FRENCH E A,BERTICS S J,ARMENTANO L E.Rumen and milk odd- and branched-chain fatty acid proportions are minimally influenced by ruminal volatile fatty acid infusions[J].Journal of Dairy Science,2012,95(4):2015-2026.( 1) 1) |
| [23] | DIJKSTRA J,BOER H,VAN BRUCHEM J,et al.Absorption of volatile fatty acids from the rumen of lactating dairy cows as influenced by volatile fatty acids concentration,pH and rumen liquid volume[J].British Journal of Nutrition,1993,69(2):385-396.( 1) 1) |
| [24] | 杜瑞平.绵羊瘤胃乙酸和丁酸的产生、吸收和利用规律及可代谢生脂物质(MLS)的测定[D].硕士学位论文.呼和浩特:内蒙古农业大学,2006.( 1) 1) |
| [25] | ALLISON M J,BRYANT M P.Biosynthesis of branched-chain amino acids from branched-chain fatty acids by rumen bacteria[J].Archives of Biochemistry and Biophysics,1963,101(2):269-277.( 1) 1) |
| [26] | LIU Q,WANG C,YANG W Z,et al.Effects of isobutyrate on rumen fermentation,lactation performance and plasma characteristics in dairy cows[J].Animal Feed Science and Technology,2009,154(1/2):58-67.( 1) 1) |
| [27] | ANDRIES J I,BUYSSE F X,DE BRABANDER D L,et al.Isoacids in ruminant nutrition:their role in ruminal and intermediary metabolism and possible influences on performances-a review[J].Animal Feed Science and Technology,1987,18(3):169-180.( 1) 1) |
| [28] | CABRITA A R J,FONSECA A J M,DEWHURST R J,et al.Nitrogen supplementation of corn silages.2.Assessing rumen function using fatty acid profiles of bovine milk[J].Journal of Dairy Science,2003,86(12):4020-4032.( 1) 1) |
| [29] | BANNINK A,DE VISSER H,VAN VUUREN A M.Comparison and evaluation of mechanistic rumen models[J].The British Journal of Nutrition,1997,78(4):563-581.( 1) 1) |
| [30] | VAN NESPEN T,VLAEMINCK B,WANZELE W,et al.Use of specific milk fatty acids as diagnostic tool for rumen acidosis in dairy cows[J].Communications in Agricultural and Applied Biological Sciences,2005,70(2):277-280.( 1) 1) |
| [31] | KRAFT J,COLLOMB M,MÖCKEL P,et al.Differences in CLA isomer distribution of cow's milk lipids[J].Lipids,2003,38(6):657-664.( 1) 1) |
| [32] | LOOR J J,FERLAY A,OLLIER A,et al.Relationship among trans and conjugated fatty acids and bovine milk fat yield due to dietary concentrate and linseed oil[J].Journal of Dairy Science,2005,88(2):726-740.( 1) 1) |




