2. 通威股份有限公司, 成都 610041;
3. 上海海洋大学农业部淡水水产种质资源重点实验室, 上海 201306;
4. 上海市水产养殖 工程技术研究中心, 上海 201306;
5. 水产动物遗传育种中心 上海市协同创新中心, 上海 201306
2. Tongwei Co., Ltd., Chengdu 610041, China;
3. Key Laboratory of Freshwater Fishery Germplasm Resources, Ministry of Aquaculture, Shanghai 201306, China;
4. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China;
5. Shanghai Collaborative Innovation Collaborative Innovation Center for Aquatic Animal Genetics and Breeding, Shanghai 201306, China
铜是鱼类所必需的一种微量元素,在机体生命活动中起着重要的作用。铜作为细胞色素C氧化酶(CCO)、单胺氧化酶(MAO)和铜锌-超氧化物歧化酶(Cu,Zn-SOD)等的辅助因子,参与造血、自由基防御、结缔组织生物合成、细胞呼吸等生理活动[1]。NRC(2011)[2]推荐的鲤鱼、斑点叉尾 、大西洋鲑等的铜需要量分别为3、5、5~10 mg/kg。当饲料中缺乏铜时,会导致鲤鱼[3]、石斑鱼[4]生长缓慢,斑点叉尾 [5]心脏中细胞色素C氧化酶和超氧化物歧化酶的活性降低,此外,在患有冷水病(又称“Hitra病”)的大西洋鲑肝脏中铜含量明显降低[6]。然而,摄入过量的铜也会降低鱼类的生长速度、饲料的利用效率,导致肝脏中铜积累量增加等[5, 7, 8, 9],水体中高浓度的铜则会导致鱼体体表如鳍条基部、尾部和鳃出血,肝胰脏坏死等症状[10],但摄入过量的铜还未出现过这种中毒现象,这可能是由于肠道黏膜对有毒的金属起到了屏障作用[11]。
斑点叉尾 ,亦称沟鲶,属于鲶形目 科鱼类,原产于北美洲,其生长快、食性广、肉质鲜美,由于肌肉中没有肌间刺,适合鱼片的生产加工,目前已成为我国重要的淡水养殖品种。近年来,在养殖生产中,斑点叉尾 时常出现体色异常的现象,其原因是多方面的。考虑到铜离子是酪氨酸酶的辅酶,而酪氨酸酶是调控黑色素生成的关键酶,养殖生产中出现的斑点叉尾 体色异常现象是否与铜的缺乏或过量有关?为此,本试验以斑点叉尾 为研究对象,在实用饲料中补充不同水平铜,考察铜对斑点叉尾 生长和体色的影响。
1 材料与方法 1.1 试验设计和试验饲料以鱼粉、豆粕、菜籽粕、棉籽粕、次粉、麦麸等为主要原料配制粗蛋白质水平为31%的实用型基础饲料,在基础饲料中分别添加0(对照)、5、10、20和40 mg/kg铜[以五水硫酸铜(CuSO4·5H2O)形式],共制成5种试验饲料,试验饲料铜含量实测值分别为11.1、16.0、20.2、28.9和44.2 mg/kg。饲料原料经粉碎过40目筛,充分混合混匀后,用膨化机(SLP-45,中国水产科学研究院渔业机械仪器研究所研制)制粒[制粒温度为(110±5) ℃]形成直径2 mm的浮性膨化饲料,晾干后置于4 ℃冰箱内保存备用。基础饲料组成及营养水平见表1。
1.2 试验用鱼及饲养管理养殖试验在上海海洋大学特种水产养殖基地进行,试验用鱼购于安徽巢湖水产养殖场,试验开始前用基础饲料驯养斑点叉尾 1周。挑选体格健壮、平均体重为(98.1±0.5) g的300尾斑点叉尾 ,随机分配于15口网箱(长2.5 m,宽1.2 m,高1.0 m)中,网目大小为5 mm×5 mm,网箱位于同一室内水泥池中,每组3个重复(网箱),每个重复放养20尾鱼。日投喂3次(08:00、12:00、17:00),投饲量为体重的3%~5%,并根据鱼的生长情况和摄食情况适当调整投饲量,各网箱基本保持一致的摄食水平。饲养期间,每2 d换水1/3(水源为过滤后的池塘水),水温24~28 ℃,pH 7~8,溶氧浓度>6.0 mg/L,氨氮浓度<0.2 mg/L。养殖试验共进行6周。
| 表1 基础饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
养殖试验结束后,鱼体饥饿24 h,统计每口网箱内的鱼尾数并称总重,计算增重率(WGR)、饲料系数(FCR)、存活率(SR);每个网箱随机取出3尾鱼,测量鱼体长和体重,解剖后称量其内脏重、肝脏重,计算肝体指数(HSI)、脏体指数(VSI)及肥满度(CF)。
饲料系数=总投喂量(g)/[终末体重(g)-初始体重(g)];
存活率(%)=100×终末鱼总数(尾)/初始鱼总数(尾);
肝体指数(%)=100×肝脏重(g)/体重(g);
脏体指数(%)=100×内脏重(g)/体重(g);
肥满度(g/cm3)=100×体重(g)/体长(cm)3。
养殖试验结束后,每口网箱随机取3尾鱼,取背鳍下方侧线以上的背部肌肉,置于-20 ℃冰箱中冻存,用于肌肉常规成分分析。饲料、肌肉样品水分含量的测定采用105 ℃烘干失水法(GB/T 5009.3—2003);粗蛋白质含量的测定采用凯氏定氮法(GB/T 5009.5—2003);粗脂肪含量的测定参照Folch等[12]的氯仿甲醇抽提法;粗灰分含量测定采用马福炉灰化法(GB/T 5009.4—2003)。
1.3.3 皮肤、肌肉色度值测定养殖试验结束后,随机从每口网箱取3尾鱼,用吸水纸将鱼体表面水分吸干,将色差计(WSC-S型色差计,上海精密科学仪器有限公司物理光学仪器厂)的探头紧贴鱼体侧线以上的背部皮肤,测量背部皮肤色度值,之后剥去皮肤,将探头紧贴在侧线以上的背部肌肉上,测量肌肉色度值,记录亮度(L*)、红绿度(a*)、黄蓝度(b*)值。
1.3.4 皮肤、肌肉总叶黄素含量测定上述皮肤、肌肉测定色度值后,各取2~3 g,参考Quackenbush等[13]的分析法进行总叶黄素含量的测定,具体方法如下:将样品剪碎,装入25 mL棕色容量瓶中,加入7.5 mL提取液(正己烷 ∶ 丙酮 ∶ 无水乙醇 ∶ 甲苯=10 ∶ 7 ∶ 6 ∶ 7),塞上塞子旋转振摇1 min,加入1 mL 40%氢氧化钾-甲醇溶液,旋转摇匀1 min,于55.5 ℃水浴加热20 min(注意冷却容量瓶颈部以防止溶剂损失),冷却样品,放置暗处1 h,加入7.5 mL正己烷,旋转振摇1 min,以10%硫酸钠溶液定容至25 mL,猛烈振摇1 min,于暗处放置1 h后,将上层液用分光光度计于474 nm处测定其吸光度值,根据标准曲线计算其总叶黄素含量。
1.3.5 背部皮肤酪氨酸酶活性测定取1 g左右背部皮肤,按1 ∶ 5比例用67 mmol/L pH 6.8的磷酸缓冲液匀浆(冰水浴),在4 ℃下离心25 min (8 000 r/min),取上清液参照丁玉庭等[14]的方法测定其中酪氨酸酶活性,具体方法如下:取3 mg/mL L-多巴0.5 mL,加入28 ℃预热的2 mL上述上清液,总反应体积为2.5 mL,混合后立即室温下用分光光度计于475 nm处测定其吸光度值(OD0),10 min后再次测定吸光度值(OD10)。
酪氨酸酶活性按照下述公式计算:
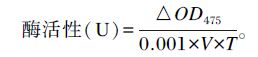
式中:△OD475为2次测定吸光度值的差值,即△OD475=OD10-OD0;V为样品体积;T为2次测定间隔时间。
1.3.6 血清生化指标测定养殖试验结束后,每口网箱随机取3尾鱼,尾静脉取血,离心(3 000 r/min,15 min),取血清于-80 ℃冷冻保存。分别测定血清天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)活性及总胆红素(T-Bil)含量,均采用迈瑞BS-200全自动生化分析仪测定。血清Cu,Zn-SOD活性采用南京建成生物工程研究所提供的试剂盒进行测定。
1.3.7 组织(肌肉、肝脏、脊椎骨)铜含量测定组织铜含量的测定参考张韵华[15]的方法,采用原子吸收法,具体方法如下:准确称取样品1 g,置于坩埚中,先在电炉上炭化至不再冒烟为止,然后移入550 ℃的马福炉中灰化6 h;取出,冷却至室温,加入硝酸与高氯酸的混合酸(4 ∶ 1)10 mL;放置5 h以上;然后在电炉上小心加热,使灰化样品溶解(黑色炭粒消失),直到溶液接近蒸干为止;用1%的盐酸溶液溶解析出的晶体,再转移到25 mL的容量瓶定容、待测。以不加样品,用同样方法获得的试液作为空白对照。采用TAS-900原子吸收分光光度计(北京普析通用公司)测定铜含量。
1.4 数据分析试验结果采用SPSS 17.0统计软件进行处理分析,数据以平均值±标准差(mean±SD)表示,采用单因素方差分析(one-way ANOVA),用Duncan氏法进行多重比较,P<0.05为差异显著。
2 结 果 2.1 生长与形体指标经过6周的养殖,各组斑点叉尾 的生长与形体指标见表2。随铜添加量的增加,斑点叉尾 的增重率表现出先增加后降低的趋势,其中 10 mg/kg铜添加组的鱼体增重率显著高于对照 组(P<0.05),同时饲料系数显著低于对照组(P<0.05);40 mg/kg铜添加组的终末体重、增重率均较10 mg/kg铜添加组显著降低(P<0.05),同时饲料系数显著升高(P<0.05);各组存活率无显著差异(P>0.05),均为100%。在形体指标方面,各组之间无显著差异(P>0.05)。
| 表2 饲料中铜添加量对斑点叉尾 生长与形体指标的影响 Table 2 Effects of dietary copper supplemental level on growth and morphological indices of channel catfish |
由表3可见,肌肉水分、粗蛋白质、粗脂肪及粗灰分含量在各组间无显著差异(P>0.05)。
2.3 背部皮肤、肌肉色度值和总叶黄素含量及背部皮肤酪氨酸酶活性由表4可见,各组背部皮肤、肌肉的色度值和总叶黄素含量及背部皮肤酪氨酸酶活性均无显著差异(P>0.05)。
2.4 血清生化指标由表5可见,各组血清AST、ALT活性和T-Bil含量无显著差异(P>0.05);10 mg/kg铜添加组具有最高的血清Cu,Zn-SOD活性,与其他各组差异显著(P<0.05),而其他组间则无显著差异(P>0.05)。
| 表3 饲料铜添加量对斑点叉尾 肌肉常规成分的影响(鲜重基础) Table 3 Effects of dietary copper supplemental level on muscle conventional components of channel catfish (wet weight basis) |
| 表4 饲料中铜添加量对斑点叉尾 背部皮肤、肌肉色度值和总叶黄素含量及背部皮肤酪氨酸酶活性的影响 Table 4 Effects of dietary copper supplemental level on chroma values and total xanthophylls content of dorsal skin,muscle and tyrosinase activity of dorsal skin of channel catfish |
| 表5 饲料中铜添加量对斑点叉尾 血清生化指标的影响 Table 5 Effects of dietary copper supplemental level on serum biochemical indices of channel catfish |
由表6可见,各组肌肉铜含量无显著差异(P>0.05);肝脏、骨骼铜含量随饲料铜添加量的增加 而增加,其中20、40 mg/kg铜添加组的肝脏铜含 量显著高于对照组和5 mg/kg铜添加组(P<0.05),40 mg/kg铜添加组的骨骼铜含量也显著高于对照组(P<0.05)。
| 表6 饲料中铜添加量对斑点叉尾 组织铜含量的影响 Table 6 Effects of dietary copper supplemental level on tissue copper content of channel catfish |
Gatlin等[16]在精制饲料中添加不同水平铜,研究了(83±3) g斑点叉尾 对铜的需求量,结果表明,当饲料中铜添加量大于4 mg/kg时,心脏细胞色素C氧化酶和超氧化物歧化酶活性显著高于铜添加量为0、2 mg/kg时,但生长指标无显著差异,从而推荐斑点叉尾 对饲料铜的最小需求量为5 mg/kg,这也是NRC(2011)中推荐的铜需求量标准。本试验中,当实用饲料中不添加铜时,斑点叉尾 的生长较慢,添加10 mg/kg铜时,显著提高了鱼体的生长性能,但当铜添加量为40 mg/kg时,鱼体生长性能则出现下降,同时当饲料铜添加量为10 mg/kg时血清Cu,Zn-SOD的活性最大。Cu,Zn-SOD是机体的一种抗氧化酶,可以保护细胞免受自由基的损害[17]。Wang等[18]用含不同铜含量(1.08、3.76、6.54、14.80、26.84和109.41 mg/kg)的饲料饲喂皱纹盘鲍24周,发现随着饲料铜含量的增加,肝脏、血清中Cu,Zn-SOD活性呈先增大后减小的趋势;在Gatlin等[16]对斑点叉尾 铜需求量的研究中,肝脏Cu,Zn-SOD的活性也呈现出随着饲料铜含量的增加先增大后减小的现象,类似的结果也见于种香玉等[19]对斑点叉尾 的研究和Lin等[4]对石斑鱼的研究。Lin等[4]认为,机体内游离的铜会破坏超氧化物歧化酶,这可能是采食高含量铜饲料导致鱼类血清Cu,Zn-SOD活性降低的原因。
根据生长试验的结果,本试验中,斑点叉尾 实用饲料中铜的适宜添加量为10 mg/kg,此时饲料铜含量实测值为20.2 mg/kg,远高于NRC(2011)的推荐量。这可能是因为,在Gatlin等[16]的试验中,基础饲料是精制饲料(铜含量0.89 mg/kg),而在本试验中,基础饲料为实用饲料,虽含铜11.1 mg/kg,但多以结合态存在,利用率低,不能满足生长所需,当饲料中添加10 mg/kg无机铜后,则改善了生长性能,由于实用饲料中存在的植酸等抗营养因子,在一定程度影响了所添加的无机铜的利用,故导致了斑点叉尾 对实用饲料中铜的需求量高于NRC(2011)的推荐量。
Murai等[20]分别以含铜16和32 mg/kg的饲料饲喂(14.5±1.4) g的斑点叉尾 ,16周后增重率和饲料转化率显著降低,而Gatlin等[16]用含铜40 mg/kg的饲料饲喂(83±3) g的斑点叉尾 ,13周并未出现明显的生长抑制现象。这可能与试验用鱼的大小不同有关,体重较轻的鱼,对高铜的耐受性也较低。虹鳟摄食含铜700 mg/kg的饲料后,出现生长减慢,其主要原因是高铜降低了其摄食量[21];在大西洋鲑的试验中,高铜(35 mg/kg)饲料虽未降低采食量,但刺激了肠细胞,导致消化吸收能力减弱,从而降低了生长性能[22]。De Boeck等[5]认为,高铜的摄入使得鲤鱼用于维持正常代谢所需的能量增加,而用于生长的能量减少,从而影响了生长。本试验中,当铜添加量为40 mg/kg时,斑点叉尾 的生长性能也表现出下降趋势,但无明显中毒症状出现,采食量也没有受到显著影响,可能40 mg/kg的铜添加量尚不足以对斑点叉尾 产生典型的铜中毒现象。
Baker等[23]用含铜2 400 mg/kg的饲料饲喂鲻鱼10周,发现肝体比和肥满度显著降低,这可能是高含量的铜导致肝脏损伤和萎缩,生长性能严重下降所致;用含铜5~1 750 mg/kg的饲料饲喂大西洋鲑3个月,只有在铜含量超过900 mg/kg时鱼体肥满度才出现显著降低[8],这表明肥满度不是机体对饲料铜含量反应的一个敏感指标。本试验中,饲料中铜的添加范围为0~40 mg/kg,远低于上述报道中的铜添加量,未观察到铜对斑点叉尾 形体指标的影响。
3.2 饲料中铜添加量对斑点叉尾 体色的影响对胡子鲶的研究表明,随饲料铜添加量从3.5 mg/kg增加到9.5 mg/kg,背部皮肤类胡萝卜素和叶黄素含量有增加的趋势[24]。本试验中,饲料中铜含量对斑点叉尾 背部皮肤、肌肉色度值和总叶黄素含量均没有产生显著影响。与前人研究出现不同结果的原因可能与这2种鱼在自然状态下具有不同的体色有关,斑点叉尾 体色通常是灰黑色,肌肉为白色,而胡子鲶体色多呈黄色、黄褐色。
生物体内黑色素的生成是以酪氨酸为底物,在酪氨酸酶的催化下,经过一系列复杂的生化反应完成的。诸葛燕等[25]认为鱼体的体色是黑色素和类胡卜素等色素综合表现的结果,其中黑色的深浅与酪氨酸酶活性直接相关。许兰娇等[26]用不同铜含量的饲料饲喂泰和乌骨鸡,发现组织中酪氨酸酶的活性随着饲粮中铜添加量的增加而表现出先升高后降低的趋势。在鱼类上,关于高铜对黑色素影响的研究甚少。本试验在饲料中添加0~40 mg/kg的铜,未对斑点叉尾 背部皮肤中酪氨酸酶的活性产生显著影响。
3.3 饲料中铜添加量对斑点叉尾 血清生化指标的 影响ALT、AST、T-Bil是临床上最常用的判断肝功能的指标,血清ALT和AST活性主要反映肝细胞的受损程度,血清T-Bill含量主要反映肝胆排泄、分泌及解毒功能[27]。用含铜50~500 mg/kg的饲料饲喂许氏平 ,在30 d的时间内血清AST和ALT活性未出现显著变化,但60 d后AST和ALT活性均显著增加[28]。鲤鱼摄食含铜250~1 000 mg/kg的饲料60 d后,血清AST和ALT活性也显著增加[29]。本试验中,斑点叉尾 血清AST、ALT活性及T-Bill含量不受饲料铜添加量的影响,可能与铜添加量不高和试验周期不长有关。
3.4 饲料中铜添加量对斑点叉尾 组织中铜含量的 影响Lorentze等[30]认为,肝脏中铜的蓄积量是评价机体铜状况最敏感的指标。分别用含铜5、35、700 mg/kg饲料饲喂大西洋鲑4周,发现肝脏铜含量显著升高[22];在鲤鱼的研究中,肝脏铜含量随饲料铜含量(0~1 000 mg/kg)的增加而增加,而肌肉铜含量只有在饲料铜含量达到500 mg/kg后才显著升高[29];De Boeck等[5]在鲤鱼上也有类似报道;此外,乔永刚[31]对军曹鱼的研究发现,铜在骨骼中的沉积随饲料铜含量的增加而增加。本试验中,肝脏、骨骼铜含量随饲料铜添加量的增加而增加,但肌肉铜含量则保持基本稳定。
4 结 论本试验条件下,在实用饲料中添加0~40 mg/kg铜,对斑点叉尾 体色和肉色以及肌肉铜含量未产生显著影响,肝脏、骨骼铜含量随着铜添加量增加而增加;当饲料中铜添加量为10 mg/kg时,可显著提高斑点叉尾 的增重率,降低饲料系数,且具有最高的血清Cu,Zn-SOD活性。因此,斑点叉尾 实用饲料中铜的添加量建议为10 mg/kg(饲料铜含量实测值为20.2 mg/kg)。
| [1] | 姜云霞.微量元素铜的研究进展及其对动物健康的影响[J].微量元素与健康研究,2007,24(5):58-61.( 1) 1) |
| [2] | NRC.Nutrient requirements of fish and shrimp[S].Washington,D.C.:National Academy Press,2011.( 1) 1) |
| [3] | OGINO C,YANG G Y.Requirements of carp and rainbow trout for dietary manganese and copper[J].Bulletin of the Japanese Society of Scientific Fisheries,1980,46(4):455-458.( 1) 1) |
| [4] | LIN Y H,SHIE Y Y,SHIAU S Y.Dietary copper requirements of juvenile grouper,Epinephelus malabaricus[J].Aquaculture,2008,274(1):161-165.( 2) 2) |
| [5] | DE BOECK G,VLAEMINCK A,BLUST R.Effects of sublethal copper exposure on copper accumulation,food consumption,growth,energy stores,and nucleic acid content in common carp[J].Archives of Environmental Contamination and Toxicology,1997,33(4):415-422.( 3) 3) |
| [6] | POPPE,T T,HÅSTEIN T,FRØSLIE A,et al.Nutritional aspects of haemorrhagic syndrome ('Hitra disease') in farmed Atlantic salmon,Salmo salar[J].Diseases of Aquatic Organisms,1986,1(3):152-162.( 1) 1) |
| [7] | SHAW B J,HANDY R D.Dietary copper exposure and recovery in Nile tilapia,Oreochromis niloticus[J].Aquatic Toxicology,2006,76(2):111-121.( 1) 1) |
| [8] | BERNTSSEN M H G,LUNDEBYE A K,MAAGE A.Effects of elevated dietary copper concentrations on growth,feed utilisation and nutritional status of Atlantic salmon (Salmo salar L.) fry[J].Aquaculture,1999,174(1/2):167-181.( 2) 2) |
| [9] | LANNO R P,SLINGER S J,HILTON J W.Maximum tolerable and toxicity levels of dietary copper in rainbow trout (Salmo gairdneri Richardson)[J].Aquaculture,1985,49(3/4):257-268.( 1) 1) |
| [10] | 黄斌,别立洁.铜(Cu2+)对麦穗鱼苗的急性毒性与非生物因子的相关性研究[J].淡水渔业,2006,36(2):34-38.( 1) 1) |
| [11] | HANDY R D.The effect of acute exposure to dietary Cd and Cu on organ toxicant concentrations in rainbow trout,Oncorhynchus mykiss[J].Aquatic Toxicology,1993,27(1/2):1-14.( 1) 1) |
| [12] | FOLCH J,LEES M,SLOANE STANLEY G H.A simple method for the isolation and purification of total lipides from animal tissues[J].The Journal of Biological Chemistry,1957,226(1):497-509.( 1) 1) |
| [13] | QUACKENBUSH F W,MILLER S L.Composition and analysis of the carotenoids in marigold petals[J].Journal-Association of Official Analytical Chemists,1972,55(3):617-621.( 1) 1) |
| [14] | 丁玉庭,杨更生.外加因子对黑豚皮酪氨酸酶活性的影响[J].食品科学,1999,20(4):12-14.( 1) 1) |
| [15] | 张韵华.原子吸收法测定重金属的预处理方法讨论[J].云南环境科学,2004,23(增刊):213-214.( 1) 1) |
| [16] | GATLIN D M,WILSON R P.Dietary copper requirement of fingerling channel catfish[J].Aquaculture,1986,54(4):277-285.( 4) 4) |
| [17] | FANG Y Z,YANG S,WU G Y.Free radicals,antioxidants,and nutrition[J].Nutrition,2002,18(10):872-879.( 1) 1) |
| [18] | WANG W F,MAI K S,ZHANG W B,et al.Effects of dietary copper on survival,growth and immune response of juvenile abalone,Haliotis discus hannai Ino[J].Aquaculture,2009,297(1/2/3/4):122-127.( 1) 1) |
| [19] | 种香玉,周立志,韩冬,等.饲料中铜浓度对异育银鲫和斑点叉尾 的影响[J].水生生物学报,2014,38(4):751-763.( 1) 1) |
| [20] | MURAI T,ANDREWS J W,SMITH R G,Jr.Effects of dietary copper on channel catfish[J].Aquaculture,1981,22:353-357.( 1) 1) |
| [21] | LANNO R P,SLINGER S J,HILTON J W.Effect of ascorbic acid on dietary copper toxicity in rainbow trout (Salmo gairdneri Richardson)[J].Aquaculture,1985,49(3/4):269-287.( 1) 1) |
| [22] | BERNTSSEN M H G,HYLLAND K,BONGA S E W,et al.Toxic levels of dietary copper in Atlantic salmon (Salmo salar L.) parr[J].Aquatic Toxicology,1999,46(2):87-99.( 2) 2) |
| [23] | BAKER R T M,HANDY R D,DAVIES S J,et al.Chronic dietary exposure to copper affects growth,tissue lipid peroxidation,and metal composition of the grey mullet,Chelon labrosus[J].Marine Environmental Research,1998,45(4/5):357-365.( 1) 1) |
| [24] | 唐精,叶元土.四种微量元素对胡子鲶体表色素含量的影响[J].饲料工业,2007,28(24):27-30.( 1) 1) |
| [25] | 诸葛燕,叶元土,高艳玲,等.七种淡水鱼类色素含量和酪氨酸酶活力的比较研究[J].上海海洋大学学报,2007,16(5):431-436.( 1) 1) |
| [26] | 许兰娇,万根,黎观红,等.饲粮铜添加水平对9-12周龄泰和乌骨鸡生产性能及组织黑色素含量的影响[J].动物营养学报,2014,26(4):1061-1067.( 1) 1) |
| [27] | 罗育春,陈大兰.肝硬化患者血清谷丙转氨酶、谷草转氨酶和总胆红素与肝纤维化标志物的相关性研究[J].实用预防医学,2011,18(8):1542-1544.( 1) 1) |
| [28] | KIM S G,KANG J C.Effect of dietary copper exposure on accumulation,growth and hematological parameters of the juvenile rockfish,Sebastes schlegeli[J].Marine Environmental Research,2004,58(1):65-68.( 1) 1) |
| [29] | AL-AKEL A S,AL-BALAWI H F A,AL-MISNED F,et al.Effects of dietary copper exposure on accumulation,growth,and hematological parameters in Cyprinus carpio[J].Toxicological and Environmental Chemistry,2010,92(10):1865-1878.( 2) 2) |
| [30] | LORENTZEN M,MAAGE A,JULSHAMN K.Supplementing copper to a fish meal based diet fed to Atlantic salmon parr affects liver copper and selenium concentrations[J].Aquaculture Nutrition,1998,4(1):67-72.( 1) 1) |
| [31] | 乔永刚.军曹鱼微量元素锌、铁、铜营养生理的研究[D].博士学位论文.青岛:中国海洋大学,2007:69-81.( 1) 1) |




