蜜蜂是一种典型的社会性经济昆虫,属于节肢动物门(Arthropoda),昆虫纲(Insecta),膜翅目(Hymenoptera),蜜蜂总科(Apoidea),蜜蜂科(Apidae),蜜蜂属(Apis)[1],其作为生态系统中的重要成员,对生物多样性的促进和生态平衡的维持具有重要意义。但自从2006年冬季以来,蜂群崩溃失调病(colony collapse disorder,CCD)席卷了美国、法国、瑞典、德国和澳大利亚等国,致使当地蜂农蜂群损失达50%~90%。CCD的症状为蜂群中大量的成年工蜂短时间内突然消失在巢外,没有发现尸体,只剩下蜂王、卵、一些未成年的工蜂和大量蜜粉残留于巢脾里。诱发CCD的因素可能是疾病、农药、气候、营养等[2, 3, 4],但还没有确定的答案。营养可能是CCD发生的主要因素之一,营养不良会影响蜜蜂的机体发育,甚至影响蜜蜂的归巢能力和记忆相关基因的表达,从而导致蜜蜂迷失方向并消失在巢外。但关于蜜蜂学习记忆相关基因表达的报道较少,科研人员通过克隆等试验推测西方蜜蜂的酪胺受体(tyramine receptor)1型基因(Tyr1)、N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor)1型基因(Nmdar1)以及谷氨酸受体(glutamate receptor)A型基因(GluRA)是参与西方蜜蜂学习记忆的重要基因[5, 6, 7]。近年来,蜜蜂蛋白质营养需要研究取得了阶段性成果,研究发现饲粮蛋白质水平会影响卵的孵化率、幼虫化蛹率和机体抗氧化活性等[8, 9, 10, 11, 12],但还没有关于饲粮蛋白质水平是否会影响蜜蜂的归巢能力及记忆相关基因表达的报道。基于此,本试验拟研究饲粮蛋白质水平对蜜蜂归巢能力及记忆相关基因表达的影响,为探索CCD致病因素提供一些依据。
1 材料与方法 1.1 试验动物试验动物为江西农业大学蜜蜂研究所饲养的本地意大利蜜蜂(Apis mellifera ligustica),简称意蜂。
1.2 主要试剂及器材人工代用花粉(不同蛋白质水平的饲粮,由山东农业大学提供),油菜蜜,蜜蜂无线射频识别(RFID)记录系统(广州市远望谷信息技术有限公司),GPS全球定位仪(eTrex Vista HCX),Trizol总RNA提取试剂盒和RNA酶抑制剂(北京全式金公司),dNTP Mixture和Oligo(dT)由上海英杰公司合成,M-MLV反转录酶和荧光染料SYBR Premix Ex TaqTM Ⅱ购自TaKaRa公司,自制小木箱(25 cm×25 cm×20 cm),定量聚合酶链式反应(PCR)仪(iQTM2型,Bio-Rad公司),核酸蛋白测定仪(NanoPhotometerTM P300,IMPLEN)。
1.3 试验设计 1.3.1 蜂群的选择与饲养管理选取群势相当的本地意大利蜜蜂(群内无花粉脾)9群,随机分为3组,每组设3个重复。试验开始前将各试验组蜂群群势调整至5足框,之后每组分别饲喂蛋白质水平为15%、25%、35%的试验饲粮,具体饲粮配方参照文献[10]。因试验期间外界有粉源,所以整个试验期间试验蜂群安装脱粉器,并奖励饲喂糖水。将3种不同蛋白质水平的人工配合饲料分别按人工配合饲料 ∶ 糖 ∶ 蜜=2 ∶ 3 ∶ 1的比例混匀后加入适量水,反复揉搓,直到攥成团状为止。将饲粮制成饼状,每群每次饲喂400 g,放置在梁框上供蜜蜂采食,每3 d更换1次饲粮。连续饲喂45 d后进行后期的检测试验。
1.3.2 饲粮蛋白质水平对采集蜂归巢能力的影响用吸蜂机在巢门口抓取带花粉的采集蜂,参照何旭江[13]的试验方法对采集蜂进行电子标记,利用GPS全球定位仪分别在距离蜂巢1 000、2 000 m处进行精确定位,将带标签且采食足量糖水的蜜蜂带至目的地点放飞,利用蜜蜂RFID记录系统对其回巢情况进行记录,重复6次。
放飞蜜蜂有效数:在5 min之内蜜蜂起飞归巢的数量,剔除未能进行正常飞行的蜜蜂。
采取每群刚出房、10日龄和20日龄工蜂各20只,分别装入1.5 mL RNase-free的EP管,迅速放入液氮中,用于后续检测。
1.3.3.2 RNA的提取与cDNA的合成取3只同一蜂群、同一日龄的蜜蜂头部混合为1个样品,放入含液氮的研钵内,研磨至粉末状后移置加有1 mL Trizol的1.5 mL EP管中。参考秦秋红[14]试验方法对样本RNA进行提取。最后所得总RNA通过琼脂糖凝胶电泳评估RNA完整性。用核酸蛋白测定仪测定260和280 nm处吸光度值(OD),计算二者的比值(OD260/280)(1.9~2.1之间符合标准),每个样品测定3次,取平均值。
用反转录试剂盒对总RNA进行反转录,反应体系为50 μL,包含:8 μL总RNA,10 μL Buffer,8 μL dNTP Mixture,1.5 μL M-MLV,3 μL Oligo(dT),1 μL RNA酶抑制剂,18.5 μL焦碳酸二乙酯(DEPC)水。反转录反应条件如下:体系混匀后,42 ℃反应60 min,75 ℃灭活5 min。反转录产物保存于-80 ℃。
1.3.3.3 荧光定量PCR引物的设计及荧光定量PCR根据美国国立生物技术信息中心(NCBI)网站上所示西方蜜蜂基因组序列,用Primer 5.0软件设计引物序列(表1)。因甘油醛-3-磷酸脱氢酶基因(GAPDH)在蜜蜂发育过程中表达较稳定[15],所以本试验以GAPDH作为内参基因。
荧光定量PCR反应体系(10 μL):cDNA 1 μL,SYBR Premix Ex TaqTM Ⅱ 5 μL,上游与下游引物各0.4 μL,超纯灭菌水3.2 μL,混匀,离心,放入定量PCR仪中进行扩增。荧光定量PCR反应条件:95 ℃预变性30 s;40个PCR循环(95 ℃,10 s;60 ℃,1 min)。扩增反应结束后从55 ℃缓慢加热至95 ℃(每10 s升高0.5 ℃),建立熔解曲线。每个cDNA重复3孔,并参考Huang等[15]的方法计算各个目的基因的相对表达量。
| 表1 荧光定量PCR引物序列 Table 1 Primer sequences used in real time quantitative PCR |
采用StatView软件“ANOVA and t-test”中的“ANOVA or ANCOVA”对试验数据进行统计分析。
2 结 果 2.1 饲粮蛋白质水平对采集蜂归巢能力的影响由表2可知,Ⅱ组和Ⅲ组采集蜂在1 000、2 000 m处的回归率均显著高于Ⅰ组(P<0.05),但Ⅱ组与Ⅲ组之间差异不显著(P>0.05)。
| 表2 饲粮蛋白质水平对意大利蜜蜂回归率的影响 Table 2 Effects of dietary protein level on homing rate of foragers |
试验结果如图1所示。各试验组刚出房工蜂的GluRA相对表达量差异不显著(P>0.05)。Ⅲ组10和20日龄工蜂的GluRA相对表达量显著高于Ⅱ组和Ⅰ组(P<0.05),同时Ⅱ组也显著高于Ⅰ组(P<0.05)。
2.3 饲粮蛋白质水平对工蜂Nmdar1相对表达量的 影响试验结果如图2所示。各试验组刚出房工蜂的Nmdar1相对表达量差异不显著(P>0.05)。Ⅱ组和Ⅲ组10和20日龄工蜂的Nmdar1相对表达量显著高于Ⅰ组(P<0.05),但Ⅱ组与Ⅲ组之间差异不显著(P>0.05)。
2.4 饲粮蛋白质水平对工蜂Tyr1相对表达量的影响试验结果如图3所示。各试验组刚出房和20日龄工蜂的Tyr1相对表达量差异均不显著(P>0.05)。Ⅱ组和Ⅲ组10日龄工蜂的Tyr1相对表达量显著高于Ⅰ组(P<0.05),但Ⅱ组与Ⅲ组之间差异不显著(P>0.05)。
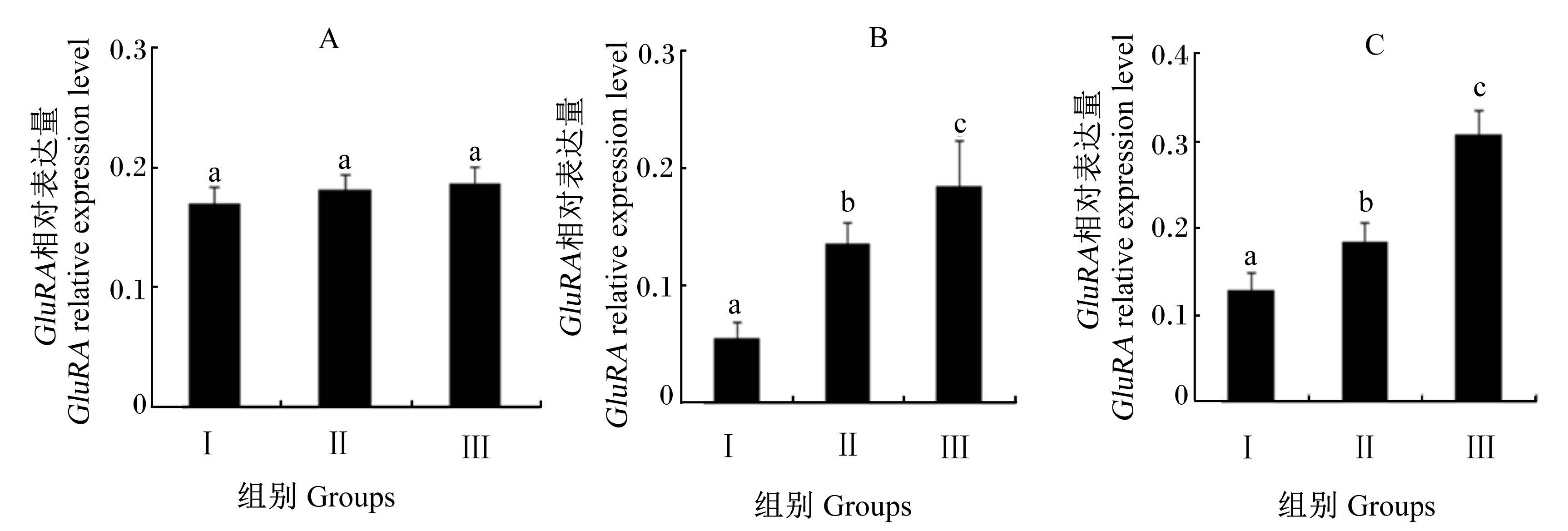 | 数据柱标注相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05);图A、B、C 分别表示为刚出房工
蜂、10 日龄工蜂、20 日龄工蜂。下图同。 Date columns with the same letters mean no significant difference (P> 0.05), while with different letters mean significant difference (P<0.05); the figures of A, B, C mean newly emerged bee, 10⁃day⁃old bee and 20⁃day⁃old bee. The same as below. 图1 饲粮蛋白质水平对工蜂GluRA相对表达量的影响 Fig. 1 Effects of dietary protein level on the relative expression level of GluRA of worker bees |
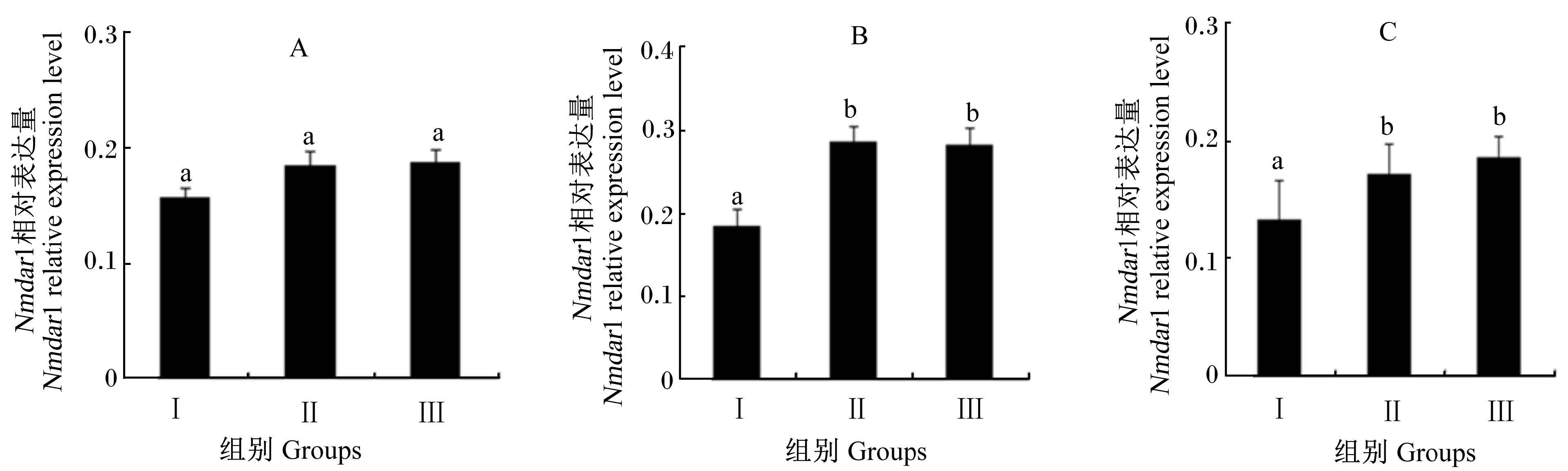 | 图2 饲粮蛋白质水平对工蜂Nmdar1相对表达量的影响 Fig. 2 Effects of dietary protein level on the relative expression level of Nmdar1 of worker bees |
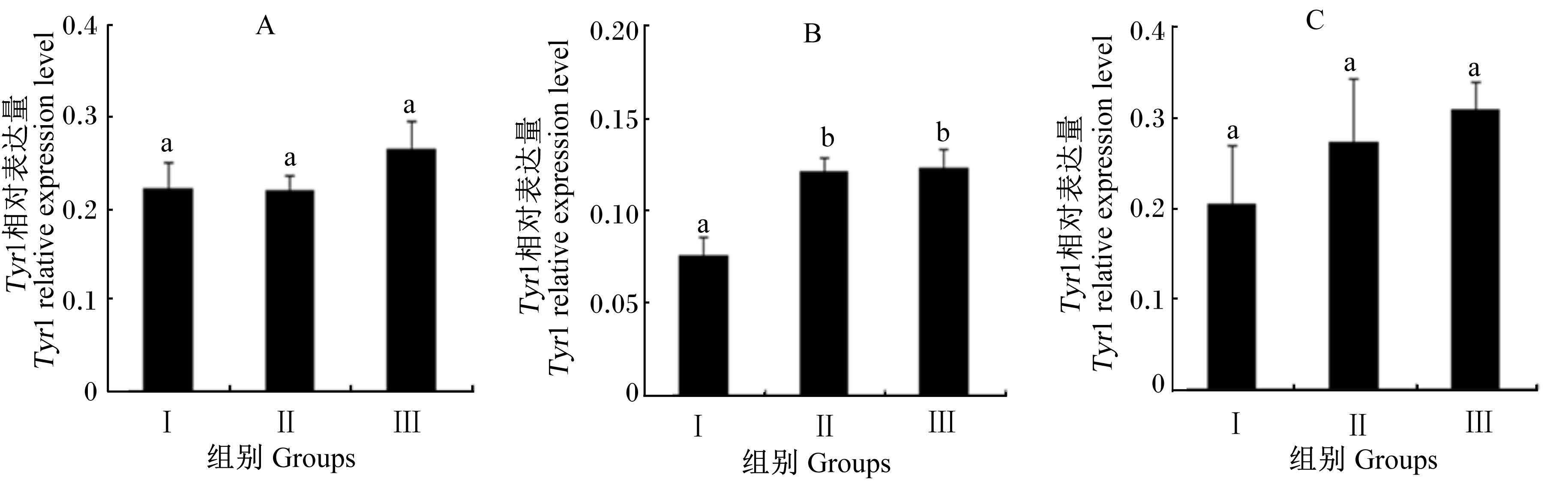 | 图3 饲粮蛋白质水平对工蜂Tyr1相对表达量的影响 Fig. 3 Effects of dietary protein level on the relative expression level of Tyr1 of worker bees |
蜜蜂是一种全变态昆虫,个体发育要经过卵、幼虫、蛹和成虫4个阶段,其中幼虫阶段和成虫阶段需要进食、消化与吸收营养食物。成虫阶段蜜蜂(工蜂)进食的天然食物主要是花粉和蜂蜜。幼虫阶段的前期主要由工蜂分泌蜂王浆进行饲喂,其蜂王浆的营养成分与工蜂进食的食物有关。幼虫阶段的后期由工蜂饲喂蜂粮,即花粉和蜂蜜的混合发酵物。然而,在外界缺少蜜粉源的早春,养蜂生产者常常使用花粉代用品(蛋白质饲粮)和糖水。不同蛋白质水平的花粉代用品对蜜蜂个体体重、咽下腺发育以及抗氧化性能具有明显的影响[8, 9, 10, 11, 12],从而影响着蜂群的群势和产浆性能等。本试验发现,Ⅱ组和Ⅲ组采集蜂在1 000、2 000 m处的回归率均显著高于Ⅰ组,但Ⅱ组与Ⅲ组之间差异不显著。这说明蜜蜂饲粮中蛋白质水平过低会影响采集蜂的归巢能力。其主要原因在于刚出生的工蜂在后期发育时需要大量蛋白质来使自身机体进一步发育成熟,过低的蛋白质水平会影响工蜂的后期发育,从而使其生理机能下降,导致其归巢能力降低。
GluRA广泛存在于中枢神经系统内,在西方蜜蜂中被认为是一种促代谢性的谷氨酸受体基因,并影响着蜜蜂的长期学习记忆能力,是蜜蜂学习记忆生理过程的关键神经递质[7]。本试验发现,Ⅲ组10和20日龄工蜂的GluRA相对表达量均显著高于Ⅱ组和Ⅰ组,且Ⅱ组10和20日龄工蜂的GluRA相对表达量也显著高于Ⅰ组。这说明饲粮蛋白质水平显著影响10和20日龄工蜂的GluRA的表达。工蜂刚出房后需要采集高蛋白质水平饲粮使其自身内部器官得到进一步发育,从而完善其机体机能,特别是为了后期采集花粉、花蜜,需要良好的长期记忆能力,从而提高采集归巢能力。
Nmdar1与西方蜜蜂学习记忆有关,并广泛存于蜜蜂大脑的蘑菇体凯恩细胞和其他神经器官中[6]。本试验发现,Ⅱ组和Ⅲ组10和20日龄工蜂的Nmdar1相对表达量显著高于Ⅰ组,但Ⅱ组与Ⅲ组之间差异不显著。这说明饲粮蛋白质水平过低影响着工蜂脑部神经器官的发育,从而降低了记忆相关基因的表达,进而影响蜜蜂的归巢能力,这与蜜蜂放飞归巢试验结果一致。
Tyr1是昆虫体内重要的神经递质,调控昆虫飞行以及学习与记忆等生理行为[16, 17],也是一种参与西方蜜蜂学习记忆的重要基因[5]。本试验发现,Ⅱ组和Ⅲ组10日龄工蜂的Tyr1相对表达量显著高于Ⅰ组,但Ⅱ组与Ⅲ组之间差异不显著。这说明不同蛋白质水平饲粮对工蜂Tyr1表达有一定的影响,过低的蛋白质水平影响着工蜂的记忆能力。然而,饲粮蛋白质水平对20日龄工蜂的Tyr1相对表达量的影响不显著,主要原因可能是Tyr1与调节蜜蜂短时记忆有关,如蜜蜂认巢试飞,而与蜜蜂采集时的长期记忆无关。何旭江[13]研究发现,蜜蜂的首次认巢认飞活动主要集中在7~11日龄,即此日龄段需要较高的Tyr1,具体原因有待于进一步研究与分析。
另外,本试验还发现,刚出房工蜂的GluRA、Nmdar1和Tyr1相对表达量各试验组之间差异不显著,可能是因为工蜂采食不同蛋白质水平饲粮后,其分泌的蜂王浆中的一些主要活性因子差异不显著,如10-羟基-2-癸烯酸(10-HDA,又称王浆酸)[18],对蜜蜂幼虫发育影响较小,具体原因有待于进一步深入研究。
4 结 论饲粮蛋白质水平影响意大利蜜蜂记忆相关基因的表达,进而影响其归巢能力。在日常饲喂蜂群时,饲粮蛋白质水平不应低于25%。
致谢:感谢山东农业大学胥保华教授团队提供试验蛋白质饲粮!
| [1] | 曾志将.养蜂学[M].2版.北京:中国农业出版社,2009.( 1) 1) |
| [2] | COX-FOSTER D L,CONLAN S,HOLMES E C,et al.A metagenomic survey of microbes in honey bee colony collapse disorder[J].Science,2007,318(5848):283-287.( 1) 1) |
| [3] | OLDROYD B P.What's killing American honey bees?[J]PLoS Biology,2007,5(6):e168.( 1) 1) |
| [4] | 陈盛禄.中国蜜蜂学[M].北京:中国农业出版社,2001.( 1) 1) |
| [5] | BLENAU W,BALFANZ S,BAUMANN A.Amtyr1:characterization of a gene from honeybee (Apis mellifera) brain encoding a functional tyramine receptor[J].Journal of Neurochemistry,2000,74(3):900-908.( 2) 2) |
| [6] | ZACHEPILO T G,LL'INYKH Y F,LOPATINA N G,et al.Comparative analysis of the locations of the NR1 and NR2 NMDA receptor subunits in honeybee (Apis mellifera) and fruit fly (Drosophila melanogaster,Canton-S wild-type) cerebral ganglia[J].Neuroscience and Behavioral Physiology,2008,38(4):369-372.( 2) 2) |
| [7] | KUCHARSKI R,MITRI C,GRAU Y,et al.Characterization of a metabotropic glutamate receptor in the honeybee (Apis mellifera):implications for memory formation[J].Invertebrate Neuroscience,2007,7(2):99-108.( 2) 2) |
| [8] | 王改英,吴在富,杨维仁,等.饲粮蛋白质水平对意大利蜜蜂咽下腺发育及产浆量的影响[J].动物营养学报,2011,23(7):1147-1152.( 2) 2) |
| [9] | 王改英,李振,杨维仁,等.日粮蛋白质水平对浙农大1号意大利蜜蜂产浆及咽下腺发育的影响[J].江西农业大学学报,2011,33(6):1176-1180.( 2) 2) |
| [10] | 李成成,杨维仁,胥保华,等.意大利蜜蜂生长发育适宜蛋白供给水平及其对幼虫抗氧化活性的影响[J].中国农业科学,2011,44(22):4714-4720.( 3) 3) |
| [11] | 王改英,杨维仁,胥保华.饲粮蛋白质水平对蜂群繁殖性能的影响[J].应用昆虫学报,2012,49(2):486-489.( 2) 2) |
| [12] | 刘俊峰,吴小波,颜伟玉,等.饲粮蛋白水平对中华蜜蜂春繁性能及幼虫抗氧化性能的影响[J].江西农业大学学报,2011,33(5):960-964.( 2) 2) |
| [13] | 何旭江.蜜蜂RFID技术及中蜂与意蜂学习记忆比较[D].硕士学位论文.南昌:江西农业大学,2011.( 2) 2) |
| [14] | 秦秋红.东方蜜蜂与西方蜜蜂学习记忆比较及蜜蜂学习记忆相关分子机理分析[D].硕士学位论文.南昌:江西农业大学,2013.( 1) 1) |
| [15] | HUANG Q,KRYGER P,LE CONTE Y,et al.Survival and immune response of drones of a Nosemosis tolerant honey bee strain towards N.ceranae infections[J].Journal of Invertebrate Pathology,2012,109(3):297-302.( 2) 2) |
| [16] | ROEDER T.Tyramine and octopamine:ruling behavior and metabolism[J].Annual Review of Entomology,2005,50:447-477.( 1) 1) |
| [17] | ROEDER T.Octopamine in invertebrates[J].Progress in Neurobiology,1999,59(5):533-561.( 1) 1) |
| [18] | 赵发,孙阳恩,王改英,等.不同蛋白水平的饲粮对蜂王浆品质的影响[J].中国蜂业,2011,62:14-17.( 1) 1) |




