2. 南京农业大学无锡渔业学院, 无锡 214081
2. Wuxi Fishery College, Nanjing Agricultural University, Wuxi 214081, China
随着高密度集约化养殖快速发展,养殖水环境日益恶化,从而导致养殖动物的疾病暴发甚至大规模死亡。鉴于传统的抗菌药物具有在动物体内残留、引起病原菌的耐药性等缺点,国内外学者纷纷致力于各种抗菌药物替代品的研究,故此,益生菌作为抗生素时代之后的一种新型饲料添加剂得到广泛关注并成为研究热点[1, 2]。在养殖鱼类上应用的益生菌是指添加到饲料或应用于养殖水体中在一定程度上改善养殖鱼类的水环境或肠道内微生物平衡,从而对寄主产生包括刺激免疫、改善胃肠道形态、促进生长和饲料利用、提高鱼肉品质等有利影响的微生物细胞[3]。与其他益生菌相比,枯草芽孢杆菌(Bacillus subtilis)具有稳定性好、抗性强、耐高温、耐酸碱和产酶丰富等优势。已有研究表明,饲料中添加枯草芽孢杆菌不仅能促进水生动物的生长,提高消化酶活性和非特异性免疫力,而且还能够改善其肠道菌群结构[4, 5, 6, 7, 8, 9, 10]。
团头鲂(Megalobrama amblycephala),隶属于硬骨鱼纲(Osteichthyes),鲤形目(Cypriniformes),鲤科(Cyprinidae),鳊亚科(Abramidinae),鲂属(Megalobrama),其肉质鲜美、生长快、经济价值高,为我国目前主要养殖鱼类之一[11, 12]。随着集约化养殖模式的扩大和推广,因高密度养殖、投饲频率增加以及水体污染等问题导致团头鲂的病害和重大疫病频发,而营养素是影响水生动物抗病力最重要且最易于调控的因子之一,但有关枯草芽孢杆菌在团头鲂幼鱼饲料中的应用研究鲜有报道。本研究旨在探讨饲料中添加枯草芽孢杆菌对团头鲂幼鱼生长性能、肝脏抗氧化指标、肠道菌群结构和抗病力的影响,为枯草芽孢杆菌在团头鲂养殖中的应用提供科学依据。
1 材料与方法 1.1 枯草芽孢杆菌制剂试验用枯草芽孢杆菌制剂为枯草芽孢杆菌B115菌株,由浙江省淡水水产研究所鱼病室提供,经30 ℃、180 r/min振荡培养后制成含不同浓度枯草芽孢杆菌的菌液,使用前用平板计数法测定制剂中细菌数量。
1.2 试验饲料以鱼粉、豆粕、菜籽粕、棉籽粕和小麦粉等为主要原料配制基础饲料,其组成及营养水平见表1。用含不同浓度枯草芽孢杆菌的菌液替代基础饲料中的空白菌液,配制3种试验饲料。基础饲料中枯草芽孢杆菌的浓度为0(T0组,作为对照组),3种试验饲料中枯草芽孢杆菌的浓度分别为2×107(T1组)、2×108(T2组)、2×109 CFU/g(T3组)。饲料原料经过粉碎过60目孔径分筛,按表1配比混合均匀,少量的组分采用逐级扩大法混合,加入枯草芽孢杆菌菌液,再次充分混匀后,用SLP-45型制粒机(中国水产科学研究院渔业机械仪器研究所研制)制成粒径为2.0 mm的沉性颗粒饲料,50 ℃烘干后于4 ℃冰箱中保存备用。
1.3 饲养管理试验用团头鲂幼鱼由中国水产科学研究院淡水渔业研究中心苗种基地提供,试验鱼被放入有温控系统的循环流水养殖圆形桶(规格为直径820 mm,高700 mm)内养殖。选取健康、初始均重为(1.81±0.01) g的团头鲂幼鱼360尾,随机分为4组,每组3个重复,每个重复30尾鱼。试验前2周使用不含枯草芽孢杆菌的对照组饲料进行驯化,待团头鲂幼鱼表现出主动抢食为止,随后开始以组为单位随机投喂不同枯草芽孢杆菌添加量的试验饲料。每天投喂4次,分别于08:00—8:30、11:00—11:30、14:00—14:30、17:00—17:30进行投喂,达饱食水平,日投喂量为鱼体重的2%~4%,并根据摄食和生长情况作适当调整。试验期为8周,8周后对各组试验鱼进行称重及采样。养殖期间水温为26~30 ℃,pH为7.0~8.0,溶氧浓度大于5 mg/L,氨氮浓度小于0.4 mg/L,亚硝酸盐氮浓度小于0.06 mg/L。
| 表1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验结束后,禁食24 h后,统计每组存活尾数,养殖鱼全部称量体重和测量体长。每组随机取3尾鱼立即剖开腹部,剥离出肝脏并称重,将剥离出的肝脏置于离心管内于-80 ℃超低温冰箱中保存,用于测定丙二醛(MDA)含量以及超氧化歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)活性;分离出肠道置于无菌离心管中,并转入-80 ℃超低温冰箱中保存,用于测定肠道菌群结构。每组取3尾鱼进行全鱼营养成分分析。
1.4.2 肝脏抗氧化指标的测定肝脏中MDA含量以及SOD、CAT和GSH-Px活性均采用南京建成生物工程研究所的试剂盒进行测定,具体的测定方法按照试剂盒的说明进行操作,肝脏中蛋白质含量的测定采用考马斯亮蓝法。
1.4.3 全鱼营养成分的测定采用常压干燥法在105 ℃的烘箱中烘至恒重来计算干物质含量;采用凯氏定氮法(GB/T 6432—1994)测定粗蛋白质含量;采用索氏抽提法(GB/T 6432—1994)测定粗脂肪含量;采用560 ℃灼烧法(GB/T 6438—1992)测定粗灰分含量。
1.4.4 肠道菌群结构的测定肠道菌群通过变性梯度凝胶电泳(DGGE)进行分离及后续克隆测序。采用带GC夹细菌通用引物518R和341F[13]进行细菌基因组DNA的扩增,扩增片段为细菌的16S rDNA的V3可变区,扩增产物用1%琼脂糖凝胶电泳检测。使用大连宝生物工程公司的胶回收纯化试剂盒(KAPA 2G Robust PCR Kit)从1%琼脂糖凝胶中回收纯化PCR产物,按试剂盒中的使用说明进行操作。将PCR扩增产物通过DGGE进行分离,采用的凝胶变性梯度为35%~55%,聚丙烯酰胺凝胶浓度为8%(化学变性剂为100%尿素7 mol/L和40%的丙烯酰胺),在1×TAE缓冲液中150 V、60 ℃下电泳5 h,电泳完毕后采用银染的方法进行染色,银染结束后利用凝胶成像仪观察并记录结果[14]。
1.4.5 生长性能的测定主要生长性能指标用以下公式求得:
增重率(WGR,%)=100×(终末均重-初始均重)/初始均重;
特定生长率(SGR,%/d)=100×(ln终末均重-ln初始均重)/养殖天数;
饲料系数(FCR)=摄入饲料干重/(终末体重-初始体重);
存活率(SR,%)=100×终末尾数/初始尾数。
1.5 攻毒试验采样结束后,继续投喂各组剩下的团头鲂,稳定1周后,进行嗜水气单胞菌(Aeromonas hydrophila)的攻毒试验。攻毒试验期间停止投喂饲料。攻毒试验前以不同浓度梯度的嗜水气单胞菌菌液做预试验,依据预试验筛选出的半致死浓度(LD50)进行攻毒试验,按照50 g体重腹腔注射0.5 mL生理盐水悬浮的嗜水气单胞菌(浓度为5×107 CFU/mL),注射96 h后统计各组死亡鱼的数量。
1.6 数据分析试验数据用SPSS 16.0统计软件包中的单因素方差分析(one-way ANOVA)进行统计,若差异显著,再进行Tukey’s多重比较,差异显著水平为P<0.05,所有结果均以平均值±标准误(mean±SE)表示。
2 结果与分析 2.1 生长性能由表2可知,T1组和T2组的终末体重、增重率和特定生长率显著高于不添加枯草芽孢杆菌的对照组(P<0.05),且T1组的饲料系数显著低于对照组(P<0.05)。然而,枯草芽孢杆菌添加量最高的T3组在增重率、特定生长率方面均低于T1组(P<0.05)、T2组(P<0.05)以及对照组(P>0.05),说明饲料中过量添加枯草芽孢杆菌对团头鲂幼鱼的生长有一定的抑制作用。
2.2 体成分由表3可知,团头鲂幼鱼摄食添加不同剂量枯草芽孢杆菌的饲料与摄食不添加枯草芽孢杆菌的饲料相比,其全鱼水分、粗蛋白质、粗脂肪和粗灰分含量均无显著差异(P>0.05)。
| 表2 饲料中添加枯草芽孢杆菌对团头鲂幼鱼生长性能的影响 Table 2 Effects of dietary Bacillus subtilis on growth performance of juvenile blunt snout bream (Megalobrama amblycephala) |
| 表3 饲料中添加枯草芽孢杆菌对团头鲂幼鱼体成分的影响 Table 3 Effects of dietary Bacillus subtilis on body composition of juvenile blunt snout bream (Megalobrama amblycephala) |
由表4可知,T1组的SOD、CAT和GSH-Px活性均显著高于对照组(P<0.05),且T1组的MDA含量显著低于对照组(P<0.05),说明饲料中添加适量的枯草芽孢杆菌能提高团头鲂幼鱼肝脏中抗氧化酶活性并降低MDA的积累。T2组和T3组与对照组相比,SOD、CAT、GSH-Px活性及MDA含量均没有显著差异(P>0.05)。
| 表4 饲料中添加枯草芽孢杆菌对团头鲂幼鱼肝脏抗氧化指标的影响 Table 4 Effects of dietary Bacillus subtilis on liver antioxidant indices of juvenile blunt snout bream (Megalobrama amblycephala) |
由图1可知,DGGE分离图谱及聚类分析相似性范围为0.38~0.80,对照组与3个试验组(T1组、T2组和T3组)的相似性较低,表明摄食含枯草芽孢杆菌饲料的团头鲂幼鱼肠道菌群结构发生了明显变化。
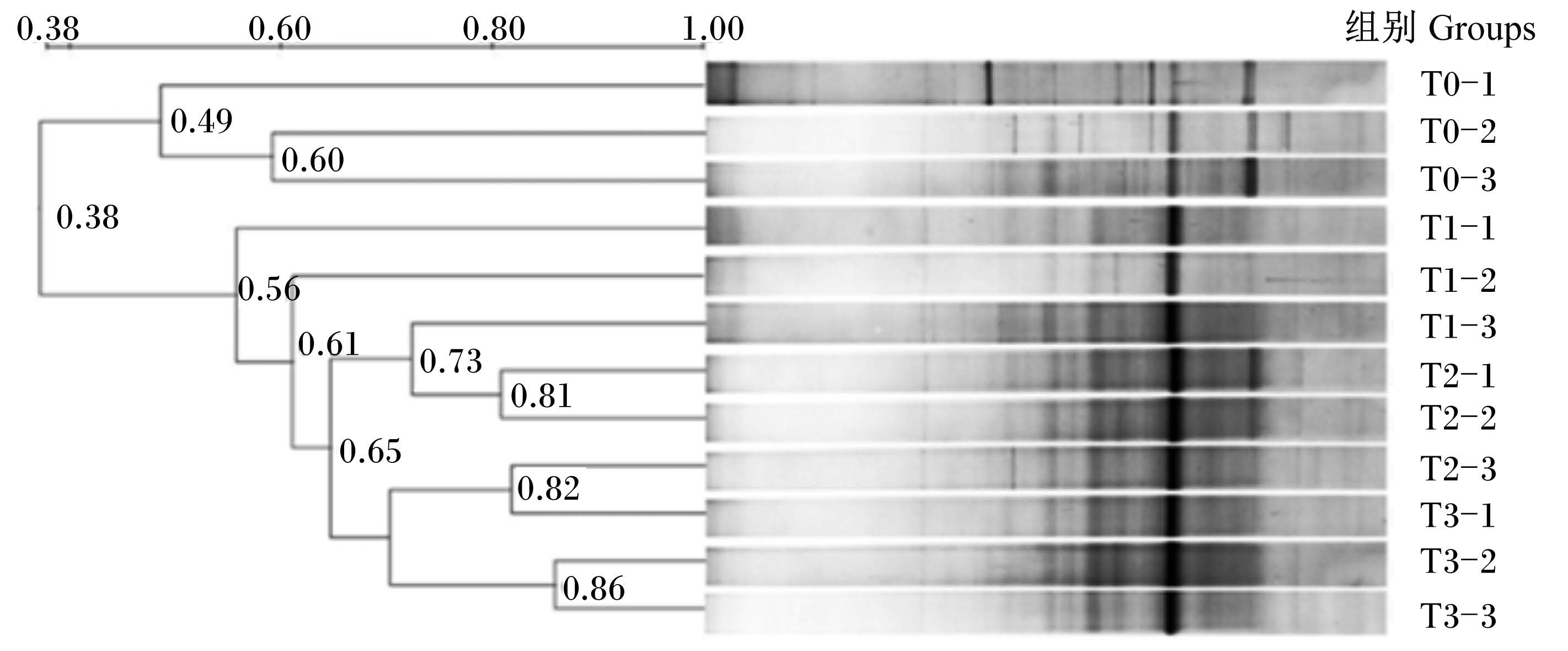 | 图1 各组团头鲂幼鱼肠道细菌的DGGE图谱及聚类分析 Fig. 1 DGGE image and cluster analysis for intestinal bacteria of juvenile blunt snout bream (Megalobrama amblycephala) in different groups |
由表5可知,各组团头鲂幼鱼腹腔注射嗜水气单胞菌96 h后的累积死亡率均在50%以上,对 照组、T1组、T2组和T3组的累积死亡率分别为 61.7%、51.7%、53.3%和58.3%,T1组和T2组的累积死亡率低于对照组和T3组,但组间没有显著差异(P>0.05)。
| 表5 嗜水气单胞菌攻毒后团头鲂幼鱼的累积死亡率 Table 5 Post-infection cumulative mortality of juvenile blunt snout bream (Megalobrama amblycephala) challenged with Aeromonas hydrophila |
相关研究表明枯草芽孢杆菌对鱼类肠道菌群的结构组成有重要的影响[15, 16, 17],益生菌对仔鱼健康稳定的肠道菌群系的构建有重要的意义。有研究指出,多种枯草芽孢杆菌菌株被添加至仔鱼的饲料中均取得了良好的效果,枯草芽孢杆菌的添加对仔鱼的生长有良好的促进作用[18, 19]。本试验研究发现,在饲料中添加适量枯草芽孢杆菌能提高团头鲂幼鱼的增重率、特定生长率并降低其饲料系数,说明饲料中添加适量的枯草芽孢杆菌对团头鲂幼鱼的生长有促进作用,这与在罗非鱼(Oreochromis niloticus)[20, 21]、凡纳滨对虾(Litopenaeus vannamei)[22]以及肉鸡(Gus gallus)[23]上的研究结果相一致。本研究发现,饲料中添加过量枯草芽孢杆菌对团头鲂幼鱼的生长有一定的抑制作用,符合高权新等[17]对益生菌使用量的有关说明,这主要有2个方面原因:一方面,芽孢杆菌产生过量的酶有可能抑制动物体内内源酶的活性,降低内源酶对营养物质的分解;另一方面,饲料中过量添加枯草芽孢杆菌可导致鱼体内菌群比例失调,进而影响其生长性能。
3.2 饲料中添加枯草芽孢杆菌对团头鲂幼鱼肝脏抗氧化指标的影响SOD在团头鲂乃至其他水产动物体内的抗氧化酶系统中起着重要的作用[24],鱼体内过多的超氧阴离子自由基的清除需要由抗氧化酶系统中的SOD、CAT等来完成,主要是通过SOD的歧化反应把自由基转化为过氧化氢(H2O2),然后通过CAT和GSH-Px把H2O2分解为对机体无害的水(H2O),从而阻止了自由基积累对鱼体的毒害[25, 26]。本研究表明,饲料中添加2×107 CFU/g枯草芽孢杆菌对团头鲂幼鱼的抗氧化酶活性有显著的提高作用,同时还能显著降低脂质过氧化产物MDA的含量。
3.3 饲料中添加枯草芽孢杆菌对团头鲂幼鱼肠道菌群结构的影响本试验发现不同添加量的枯草芽孢杆菌对团头鲂幼鱼肠道菌群结构有一定的影响。DGGE图谱中的条带表示的是一个可能的优势细菌类群或可操作分类单元(OTU)[27],本研究中对照组的条带数均值高于3个试验组,表明饲料中添加枯草芽孢杆菌降低了肠道菌群结构的多样性,故此聚类分析图中对照组与3个试验组的相似性较低,表明摄食含枯草芽孢杆菌饲料的团头鲂肠道菌群结构发生了明显变化。
3.4 饲料中添加枯草芽孢杆菌对团头鲂幼鱼抗病力的影响嗜水气单胞菌是团头鲂以及其他淡水鱼类的主要致病菌之一,本试验中给试验鱼腹腔注射一定剂量的嗜水气单胞菌,96 h后T1、T2组的累积死亡率低于对照组,而T3组的累积死亡率是最高的,该结果表明饲料中添加适量枯草芽孢杆菌对团头鲂幼鱼的抗病力有所提高,这与在条纹鲈[28]和尼罗罗非鱼[29]上所得结果相一致。由前面得出的适量枯草芽孢杆菌的添加对鱼体的抗氧化能力有促进作用,并结合枯草芽孢杆菌的添加对鱼类肠道菌群结构的改善,本试验推测饲料中添加适量的益生菌将提高肠道原有有益菌群的消化能力[30],强化鱼体的抗氧化系统,从而提高鱼体的免疫力和抗病力。
4 结 论① 饲料中添加适量枯草芽孢杆菌能够提高团头鲂幼鱼的生长性能、抗氧化能力,并改变肠道菌群结构。
② 团头鲂幼鱼饲料中枯草芽孢杆菌的适宜添加量为2×107 CFU/g。
| [1] | 孙云章,杨红玲,马如龙,等.斜带石斑鱼消化道乳酸菌在模拟胃肠道环境中的存活[J]. 中国水产科学,2010,17(1):128-135. ( 1) 1)
|
| [2] | 曾东,王益平,倪学勤,等.鲤益生菌筛选及部分菌株对鲤前肠黏液的体外黏附作用[J]. 中国水产科学,2009,16(3):427-433. ( 1) 1)
|
| [3] | MERRIFIELD D L,DIMITROGLOU A,FOEY A,et al.The current status and future focus of probiotic and prebiotic applications for salmonids[J]. Aquaculture,2010,302(1/2):1-18. ( 1) 1)
|
| [4] | 江永明,付天玺,张丽,等.微生物制剂对奥尼罗非鱼生长及消化酶活性的影响[J]. 水生生物学报,2011,35(6):998-1004. ( 1) 1)
|
| [5] | 刘晓勇,张颖,齐茜,等.枯草芽孢杆菌对杂交鲟幼鱼生长性能、消化酶活性及非特异性免疫的影响[J]. 中国水产科学,2011,18(6):1315-1320. ( 1) 1)
|
| [6] | 程远,黄凯,黄秀芸,等.饲料中添加枯草芽孢杆菌对吉富罗非鱼幼鱼生长性能、免疫力和抗氧化功能的影响[J]. 动物营养学报,2014,26(6):1503-1512. ( 1) 1)
|
| [7] | 殷海成,赵红月,黄进,等.枯草芽孢杆菌对免疫和未免疫黄河鲤免疫功能和抗病力的影响[J]. 动物营养学报,2013,25(7):1559-1567. ( 1) 1)
|
| [8] | ALY S M,AHMED Y A G,AHAREEB A A A,et al.Studies on Bacillus subtilis and Lactobacillus acidophilus,as potential probiotics,on the immune response and resistance of tilapia nilotica (Oreochromis niloticus) to challenge infections[J]. Fish & Shellfish Immunology,2008,25(1/2):128-136. ( 1) 1)
|
| [9] | AI Q H,XU H G,MAI K S,et al.Effects of dietary supplementation of Bacillus subtilis and fructooligosaccharide on growth performance,survival,non-specific immune response and disease resistance of juvenile large yellow croaker,Larimichthys crocea[J]. Aquaculture,2011,317(1/2/3/4):155-161. ( 1) 1)
|
| [10] | SHEN W Y,FU L L,LI W F,et al.Effect of dietary supplementation with Bacillus subtilis on the growth,performance,immune response and antioxidant activities of the shrimp (Litopenaeus vannamei)[J]. Aquaculture Research,2010,41(11):1691-1698. ( 1) 1)
|
| [11] | 王为民.团头鲂养殖产业现状[J]. 科学养鱼,2009(4):44-45. ( 1) 1)
|
| [12] | 蒋阳阳,李向飞,刘文斌,等.不同蛋白质和脂肪水平对1龄团头鲂生长性能和体组成的影响[J]. 水生生物学报,2012,36(5):826-836. ( 1) 1)
|
| [13] | 李晓,李冰,董玉峰,等.精养团头鲂池塘沉积物微生物群落的结构特征及组成多样性分析[J]. 水产学报,2014,28(2):218-227. ( 1) 1)
|
| [14] | 孙盛明,朱健,戈贤平,等.零换水条件下养殖水体中碳氮比对生物絮团形成及团头鲂肠道菌群结构的影响[J]. 动物营养学报,2015,27(3):948-955. ( 1) 1)
|
| [15] | AVELLA M A,OLIVOTTO I,SILVI S,et al.Effect of dietary probiotics on clownfish:a molecular approach to define how lactic acid bacteria modulate development in a marine fish[J]. Regulatory,Integrative and Comparative Physiology,2010,298(2):R359-R371. ( 1) 1)
|
| [16] | SUZER C,ÇOBAN D,KAMACI H O,et al.Lactobacillus spp.bacteria as probiotics in gilthead sea bream (Sparus aurata,L.) larvae:effects on growth performance and digestive enzyme activities[J]. Aquaculture,2008,280(1/2/3/4):140-145. ( 1) 1)
|
| [17] | 高权新,施兆鸿,彭士明.益生菌在水产养殖中的研究进展[J]. 海洋渔业,2013,35(3):364-372. ( 2) 2)
|
| [18] | FARAMARZI M,JAFARYAN H,FARAHI A,et al.The effects on growth and survival of probiotic Bacillus spp.fed to Persian sturgeon (Acipencer persicus) larvae[J]. Aquaculture,Aquarium,Conservation & Legislation International Journal of the Bioflux Society,2011,4(1):10-14. ( 1) 1)
|
| [19] | MANDIKI S,MILLA S,WANG N,et al.Effects of probiotic bacteria on growth parameters and immune defence in Eurasian perch Perca fluviatilis L.larvae under intensive culture conditions[J]. Aquaculture Research,2011,42(5):693-703. ( 1) 1)
|
| [20] | WANG Y B,LI J R,LIN J.Probiotics in aquaculture:challenges and outlook[J]. Aquaculture,2008,281(1/2/3/4):1-4. ( 1) 1)
|
| [21] | HASSAAN M S,SOLTAN M A,GHONEMY M M R.Effect of synbiotics between Bacillus licheniformis and yeast extract on growth,hematological and biochemical indices of the Nile tilapia (Oreochromis niloticus)[J]. The Egyptian Journal of Aquatic Research,2014,40(2):199-208. ( 1) 1)
|
| [22] | ZOKAEIFAR H,BALCÁZAR J L,SAAD C R,et al.Effects of Bacillus subtilis on the growth performance,digestive enzymes,immune gene expression and disease resistance of white shrimp,Litopenaeus vannamei[J]. Fish & Shellfish Immunology,2012,33(4):683-689. ( 1) 1)
|
| [23] | ZHANG Z F,CHO J H,KIM I H.Effects of Bacillus subtilis UBT-MO2 on growth performance,relative immune organ weight,gas concentration in excreta,and intestinal microbial shedding in broiler chickens[J]. Livestock Science,2013,55(2/3):343-347. ( 1) 1)
|
| [24] | LIN Y H,SHIE Y Y,SHIAU S Y.Dietary copper requirements of juvenile grouper,Epinephelus malabaricus[J]. Aquaculture,2008,274(1):161-165. ( 1) 1)
|
| [25] | XIE J,LIU B,ZHOU Q L,et al.Effects of anthraquinone extract from rhubarb Rheum officinale Bail on the crowding stress response and growth of common carp Cyprinus carpio var.Jian[J]. Aquaculture,2008(1):5-11. ( 1) 1)
|
| [26] | FATTMAN C L,SCHAEFER L M,OURY T D.Extracellular superoxide dismutase in biology and medicine[J]. Free Radical Biology and Medicine,2003,35(3):236-256. ( 1) 1)
|
| [27] | 姚延丹,李谷,陶玲,等.复合人工湿地-池塘养殖生态系统细菌多样性研究[J]. 环境科学与技术,2011,34(7):50-55. ( 1) 1)
|
| [28] | LI P,DELBERT M,GATLIN III.Dietary brewers yeast and the prebiotic GrobioticTMAE influence growth performance,immune responses and resistance of hybrid striped bass (Morone chrysops×M.saxatilis) to Streptococcus iniae infection[J]. Aquaculture,2004,231(1/2/3/4):445-456. ( 1) 1)
|
| [29] | ABDEL-TAWWAB M,ABDEL-RAHMAN A M,ISMAEL N E M.Evaluation of commercial live bakers' yeast,Saccharomyces cerevisiae as a growth and immunity promoter for fry Nile tilapia,Oreochromis niloticus (L.) challenged in situ with Aeromonas hydrophila[J]. Aquaculture,2008,280(1/2/3/4):185-189. ( 1) 1)
|
| [30] | TIMMERMAN H M,KONING C J M,MULDER L,et al.Monostrain,multistrain and multispecies probiotics-a comparison of functionality and efficacy[J]. International Journal of Food Microbiology,2004,96(3):219-233. ( 1) 1)
|




