2. 东北农业大学动物医学学院, 哈尔滨 150030;
3. 黑龙江省动物疫病预防与控制中心, 哈尔滨 150069
2. College of Veterinary Medicine, Northeast Agricultural University, Harbin 150030, China;
3. Heilongjiang Province Animal Epidemic Prevention and Control Center, Harbin 150069, China
谷氨酸(Glu)作为动物黏膜主要的能源物质之一,是仔猪断奶时的条件性必需氨基酸[1],对仔猪生长发育及肠道黏膜生长和修复起关键作用。谷氨酸在肠道中不能被动吸收,必须依靠转运载体进行主动运输。兴奋性氨基酸转运体家族(excitatory amino acid transporters,EAATs)是钠离子(Na+)依赖的高亲和力的谷氨酸转运载体[2],对维持神经系统中的谷氨酸平衡起重要作用。其中的兴奋性氨基酸转运载体1(excitatory amino acid carrier 1,EAAC1)是EAATs家族中最重要的一个谷氨酸转运载体,不仅因为EAAC1在神经系统中转运谷氨酸的速度是其他转运载体转运速度的近10倍[3],而且EAAC1不是神经系统特异的,也存在于一些非神经组织中,如小肠等。EAAC1的表达受到谷氨酸转运联合蛋白(glutamate transporter associate protein 3-18,GTRAP3-18)的负调节作用。在人类的癌症和癫痫病中发现,GTRAP3-18通过与EAAC1的C末端连接以抑制EAAC1对谷氨酸的转运,造成神经系统中谷氨酸中毒[4]。且GTRAP3-18仅与EAAC1结合并对其调节,与其他EAATs不发生作用[5]。EAAC1的表达受到GTRAP3-18表达量的调节。多数关于EAAC1的研究集中在神经系统中,肠道中的研究较少。有研究显示EAAC1基因缺失小鼠表现出年龄依赖性黑质多巴胺能神经元的损失和氧化应激的增加[6],且在阿尔茨海默氏病患者海马神经元中发现异常EAAC1积聚[7]。Fu等[8]2012年首次克隆哺乳仔猪空肠EAAC1,并确定在哺乳仔猪空肠中,EAAC1的表达量是变化的,且低初生重的仔猪空肠中EAAC1的表达量很低。以上研究均说明EAAC1的表达量与机体非正常发育或所处的应激及疾病状态息息相关。低的EAAC1表达量将影响谷氨酸的转运效率继而影响仔猪小肠的黏膜发育和吸收功能[8]。断奶是仔猪生理应激过程,失去母源谷氨酸的摄取,小肠中EAAC1的表达变化是怎样的尚不得知。因此,本试验在前人研究的基础上,以哺乳仔猪为对照,通过研究断奶时仔猪回肠和空肠中EAAC1及其调节蛋白GTRAP3-18表达的变化,说明断奶应激对EAAC1表达的影响作用,为进行仔猪断奶时肠黏膜损伤修复机制研究和提高仔猪断奶前后生长质量提供理论基础。
1 材料与方法 1.1 试验动物分组与饲养管理试验于2010年5月在黑龙江省齐齐哈尔市养猪示范基地进行。分别从40头不同母猪的仔猪中各选出平均体重为(4.48±0.26) kg、10日龄的“杜×长×大”三元杂交仔猪1头,共40头仔猪,采用单因素试验设计,随机分为2组,每组20个重复,每个重复1头猪。饲养期10 d。
哺乳组仔猪在哺乳仔猪舍随母猪继续哺乳10 d;断奶仔猪在保育仔猪舍饲养,饲喂玉米-豆粕型商业断奶饲粮10 d,每日早、中、晚饲喂3次,自由饮水。基础饲粮组成及营养水平见表1。
| 表1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
断奶仔猪猪舍为封闭式,通风良好,水泥地面;采用单栏隔离饲养,每栏1头仔猪;栏内一角上方距地面0.8 m处悬挂红外取暖灯,灯下地面铺一块0.5 m×1.0 m的吸热板,以保证仔猪温暖。
1.2 试验样品采集与处理饲养试验结束,第11日清晨,从各组中随机选取12头,共计24头。打开仔猪腹腔,将空肠和回肠取出,立即用冰生理盐水冲洗小肠内部,并从每段肠的中间取样,液氮冷冻保存[5]。冷冻后的肠段样品,用研钵在液氮存在的条件下研磨成粉末状,保存在-80 ℃。
1.3 样品制备组织匀浆:称取约1.3 g粉末状的冷冻的小肠组织样品,按照1 g样品20 mL匀浆缓冲液的比例,用冷藏的含有蛋白酶抑制剂的匀浆缓冲液将样品解冻,并用多层匀浆仪将样品匀浆。匀浆时,每个样品16 000 r/min匀浆3 min,且每隔1 min,停顿20 s。匀浆后的样品,称量并记录匀浆液的总体积,取2 mL匀浆液样品于-80 ℃超低温冷冻保存。
细胞内质:采用镁离子(Mg2+)沉淀反应和4 ℃差异离心的方法制备细胞内质样品[5]。
细胞顶膜:将余下的细胞内质样品继续差异离心制备顶膜样品。
1.4 仔猪谷氨酸转运载体表达的测定 1.4.1 蛋白质表达量的测定[6]蛋白质含量的测定:使用牛血清蛋白(级分Ⅳ)作为蛋白质标准,测定组织匀浆、细胞内质和顶膜样品中蛋白质的含量。
蛋白质印迹法(Western-blot)测定:制得蛋白质含量为1 μg/μL的样品,以肌动蛋白(β-actin)为内参对照进行Western-blot。EAAC1一抗为羊抗人EAAC1多克隆抗体(Sc-7761,圣克鲁斯生物国际有限公司),1 ∶ 2 000稀释;GTRAP3-18一抗为鼠抗人GTRAP3-18多克隆抗体(H00010550-A01,Abnova公司),1 ∶ 2 000稀释;β-actin一抗用鼠抗人单克隆抗体(Bio-rad公司),1 ∶ 10 000稀释;二抗均用兔抗人免疫球蛋白G(IgG)抗体(Bio-rad公司),1 ∶ 10 000稀释。
1.4.2 基因表达量的测定寡聚核苷酸引物的设计:采用Primer 5.0软件对目的基因和持家基因的扩增引物进行设计,基因引物核酸序列参照GenBank cDNA序列(表2),由Invitrogen公司合成。为避免扩增物被非特异性的基因组DNA污染,所有仔猪样品的mRNA序列都用Spidey软件与对应的猪基因序列拟合,并使所有引物含有2个外显子区域。
| 表2 引物序列和产物大小 Table 2 Primer sequence and product size |
RNA的制备:通过TRIzol试剂(Invitrogen公司)提取组织样品中的总RNA[6],经DNA酶(Invitrogen公司)处理后,用iScript cDNA合成试剂盒,根据试剂盒的说明,合成cDNA。
实时荧光定量(RT)-PCR检测:采用25 μL反应体系,体系组成参见iQ SYBR Green Supermix RT-PCR试剂盒(Qiagen有限公司)说明书。
RT-PCR的操作程序为:反转录程序(50 ℃,30 min);蛋白变性程序(95 ℃,15 min);扩增和量化程序,重复45个循环(95 ℃变性15 s,54 ℃退火15 s,72 ℃延伸15 s);熔解曲线程序(60~99 ℃,以0.1 ℃/s的速度加热,且进行荧光测量)。
数据计算:目的基因与持家基因相对表达量比值的计算公式如下。
R=2-Ct(目的基因-持家基因)。
式中:R表示目的基因的相对表达比值,Ct表示阈值的循环数。
在这个循环数下,目的基因和持家基因都被扩增了30个荧光单位以上。最佳的RT-PCR效率是根据公式10(-1/斜率)使得RNA连续的稀释扩增得到的,且该值在目的基因和β-actin上数值是一致的。
1.5 仔猪小肠组织中游离氨基酸含量的测定采用高效液相色谱仪(带二元溶剂洗脱体系和自动进样器)、数据工作站、荧光检测器、分析柱(高效C18)进行测定。
1.6 数据计算与统计分析本试验中蛋白质水平的表达量实际为目的蛋白的相对表达量。经Western blot分析得到的蛋白印迹,通过Quantity One软件(Bio-Rad)进行印迹扫描,将印迹换算成密度值,用目的蛋白/β-actin印迹密度的比值作为目的蛋白的相对含量进行计算。
采用SAS 9.0软件中单因素方差分析(one-way ANOVA)进行分析。试验数据以平均值和标准误或混合平均标准误表示。P < 0.05视为差异显著。结果采用Fig.P曲线拟合软件绘制柱状图和曲线图。
2 结果与分析 2.1 断奶对仔猪生长性能的影响由表3可见,在10 d的饲养试验期间,断奶组仔猪的平均日采食量为(148.50±16.90) g/d,料重 比为3.58±2.34,与哺乳组仔猪相比,断奶组仔猪的末重显著降低(P < 0.05),同时断奶组仔猪的平均日增重极显著降低(P < 0.01)。早期断奶对仔猪的生长性能具有显著的影响。
| 表3 断奶对仔猪生长性能的影响 Table 3 Effect of weaning on growth performance of piglets (n=20) |
采用Western blot分析方法,成功地从仔猪小肠组织匀浆、细胞内质和细胞顶膜中检测到EAAC1蛋白质,并分析其含量,结果检测到EAAC1蛋白质在小肠组织匀浆和细胞内质中的分子质量为57 ku;EAAC1蛋白质在小肠细胞顶膜中的分子质量为73 ku。以β-actin为参照量,与哺乳仔猪相比较,断奶仔猪空肠组织匀浆、细胞内质和细胞顶膜中EAAC1蛋白质含量较哺乳仔猪分别降低了25%、21%和9%,差异显著(P < 0.05),如图1所示。与哺乳组仔猪相比较,断奶组仔猪回肠组织匀浆、细胞内质和细胞顶膜中EAAC1蛋白质含量分别降低了32%、22%和14%,差异显著(P < 0.05),如图2所示。本结果显示,EAAC1蛋白质在仔猪小肠组织中存在,且受早期断奶的影响,含量降低。
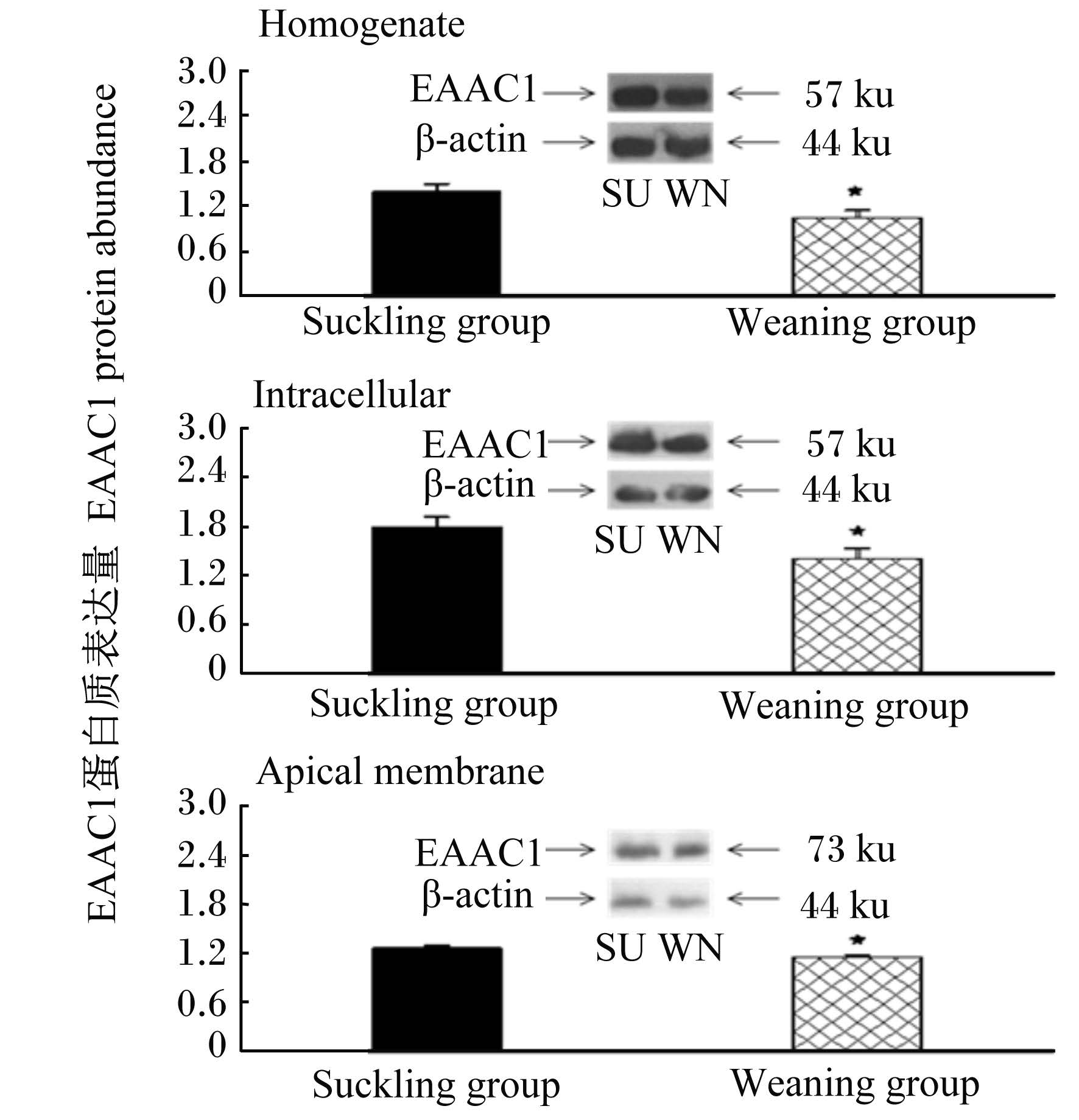 |
Homogenate组织匀浆,Intracellular细胞内质,Apical menbrane细胞顶膜,Suckling group哺乳组,Weaning group断奶组。下图同The same as below。 *表示与哺乳组相比差异显著(P < 0.05)。下图同。 *means significant difference compared with the suck-ling group (P < 0.05).The same as below. 图1 仔猪空肠中EAAC1蛋白质表达量 Fig. 1 EAAC1 protein abundance in jejunum of piglets |
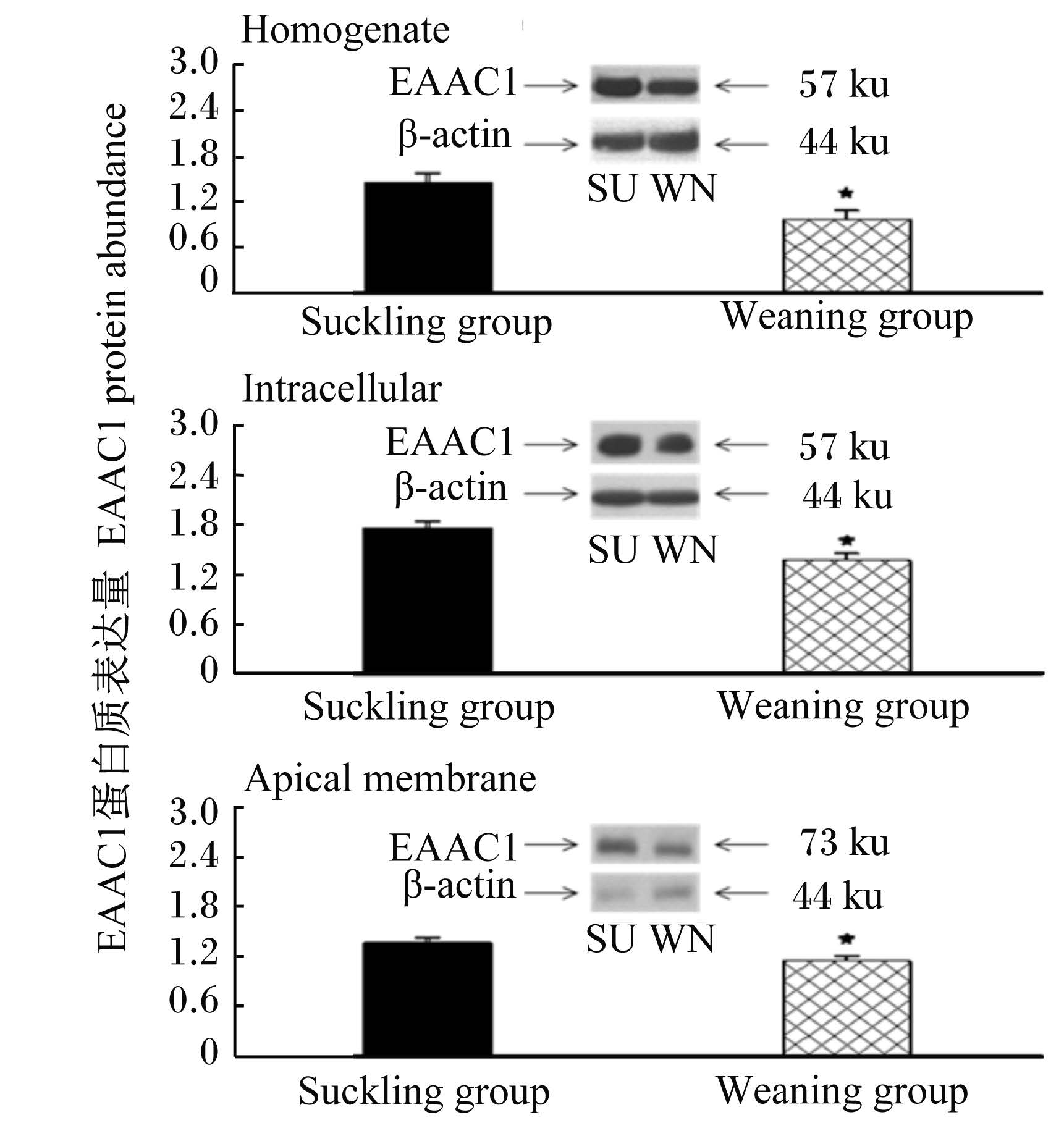 | 图2 仔猪回肠中EAAC1蛋白质表达量 Fig. 2 EAAC1 protein abundance in ileum of piglets |
断奶与哺乳仔猪小肠组织中EAAC1 mRNA表达量分析结果如表4所示。以β-actin为参照量,与哺乳组仔猪相比较,断奶组仔猪空肠中EAAC1 mRNA表达量降低了88%,差异显著(P < 0.05);断奶组仔猪回肠中EAAC1 mRNA表达量降低了73%,差异显著(P < 0.05)。
| 表4 仔猪小肠中EAAC1 mRNA水平 Table 4 Intestinal EAAC1 mRNA aboudance (relative to β-actin) in piglets (n=12) |
Pearson相关分析结果显示,断奶组与哺乳组仔猪空肠组织匀浆(r=0.52,P=0.042,n=24),细胞内质(r=0.56,P=0.021,n=24)和细胞顶膜(r=0.49,P=0.008,n=24)中EAAC1蛋白质含量与空肠组织中EAAC1 mRNA表达量之间呈正向线性关系(P < 0.05);且空肠组织匀浆EAAC1蛋白质与细胞内质EAAC1蛋白质及细胞内质EAAC1蛋白质与细胞顶膜EAAC1蛋白质之间的变化均呈正向线性关系,且差异显著(P < 0.05)。断奶组仔猪与哺乳组仔猪的回肠组织匀浆(r=0.51,P=0.021,n=24)、细胞内质(r=0.51,P=0.016,n=24)、细胞顶膜(r=0.41,P=0.016,n=24)中EAAC1蛋白质含量与回肠组织中EAAC1 mRNA表达量之间呈正向线性关系(P < 0.05)。且回肠组织匀浆EAAC1蛋白质与细胞内质EAAC1蛋白质及细胞内质EAAC1蛋白质与细胞顶膜EAAC1蛋白质之间的变化均成正向线性关系,且差异显著(P < 0.05)。
2.3 早期断奶对仔猪小肠GTRAP3-18蛋白质及mRNA表达量的影响 2.3.1 早期断奶对仔猪小肠GTRAP3-18蛋白质表达量的影响在空肠和回肠组织匀浆、细胞内质和细胞顶膜中检测到分子质量为50 ku的GTRAP3-18蛋白质,如图4和图5所示。以β-actin为参照量,与哺乳组仔猪相比较,断奶仔猪空肠组织匀浆、细胞内质和细胞顶膜中GTRAP3-18蛋白质含量分别降低了15%、28%和55%,差异显著(P < 0.05);与哺乳组仔猪相比较,断奶组仔猪回肠组织匀浆、细胞内质和细胞顶膜中GTRAP3-18蛋白质含量分别降低了16%、7%和27%,差异显著(P < 0.05)。
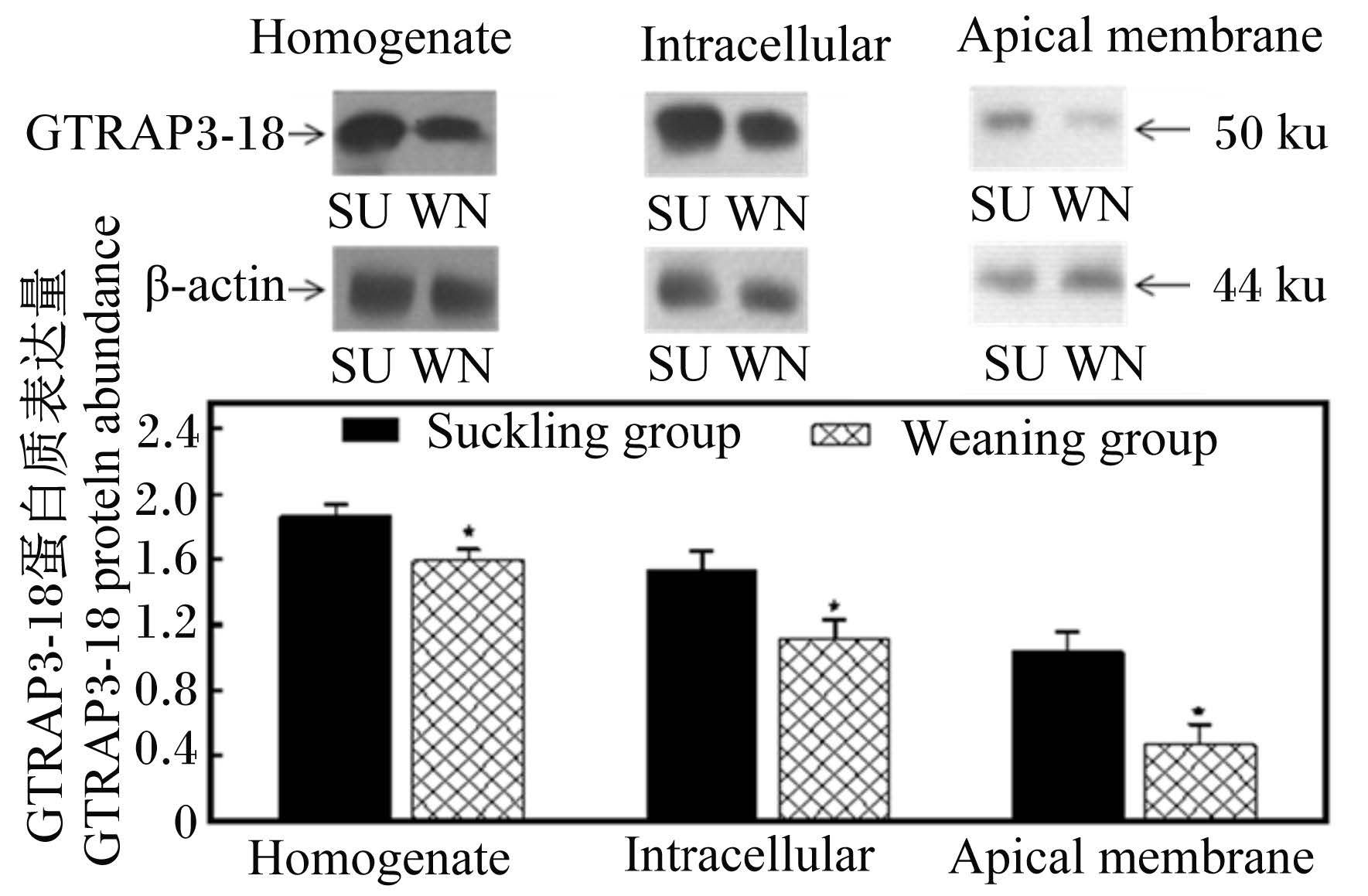 | 图3 仔猪空肠中GTRAP3-18的蛋白质表达量 Fig. 3 GTRAP3-18 protein abundance in jejunum of piglets |
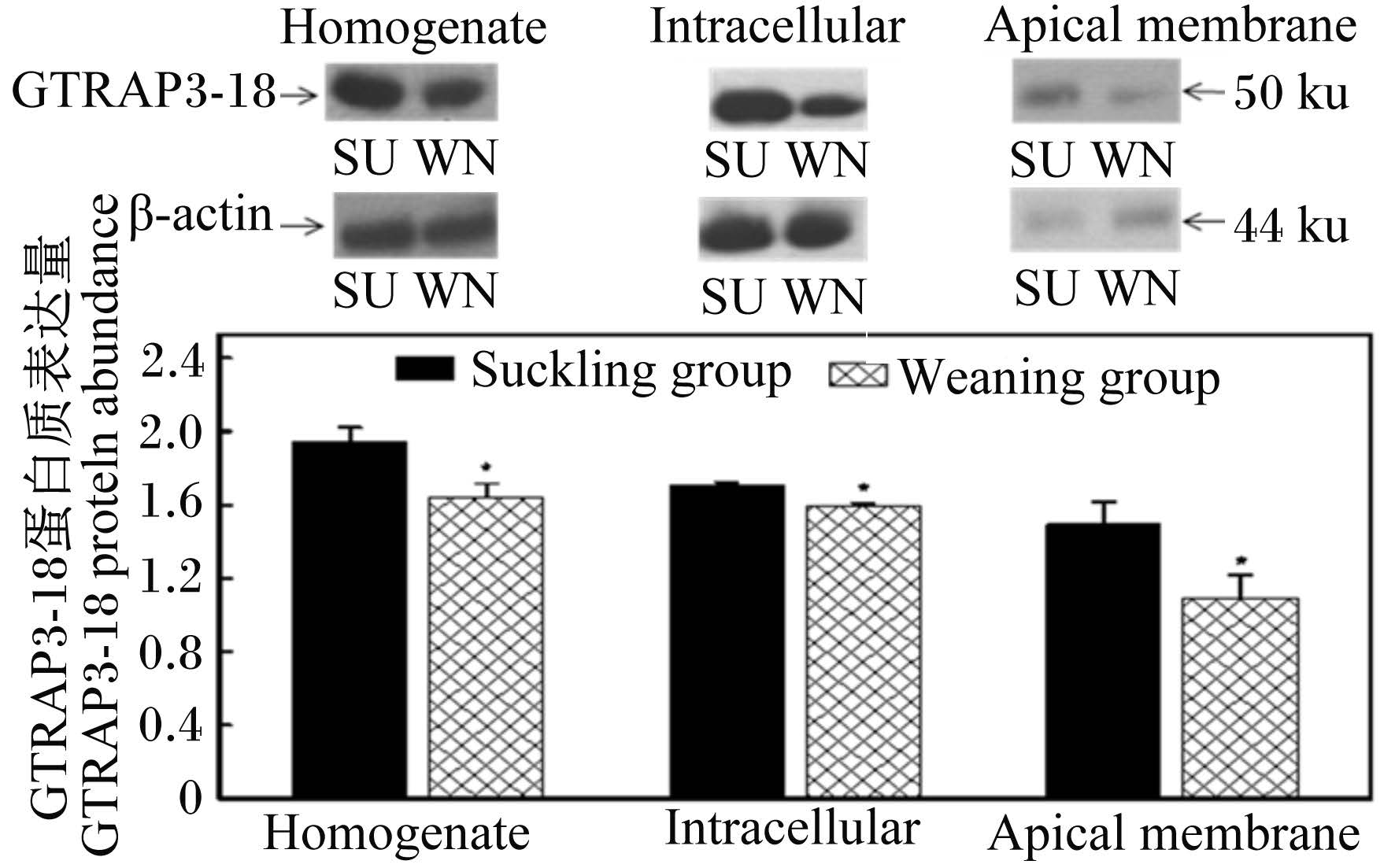 | 图4 仔猪回肠中GTRAP3-18蛋白质表达量 Fig. 4 GTRAP3-18 protein abundance in ileum of piglets |
断奶与哺乳仔猪小肠组织中GTRAP3-18 mRNA表达量分析结果如表5所示。以β-actin为参照量,与哺乳组仔猪相比较,断奶组仔猪空肠中GTRAP3-18 mRNA表达量降低了70%,差异显著(P < 0.05);回肠中GTRAP3-18 mRNA表达量降低了52%,差异显著(P < 0.05)。
| 表5 仔猪小肠中GTRAP3-18 mRNA表达量 Table 5 Intestinal GTRAP3-18 mRNA aboudance in piglets (n=12) |
Pearson相关分析结果显示,断奶组仔猪和哺乳组仔猪空肠组织匀浆(r=0.33,P=0.027,n=24)、细胞内质(r=0.54,P=0.019,n=24)、细胞顶膜(r=0.56,P=0.028,n=24)的GTRAP3-18蛋白 质表达量与空肠中GTRAP3-18 mRNA表达量之间呈正向线性关系(P < 0.05);且空肠组织匀浆GTRAP3-18蛋白质与细胞内质和细胞顶膜GTRAP3-18蛋白质及细胞内质GTRAP3-18蛋白质与细胞顶膜GTRAP3-18蛋白质表达量之间均呈正向线性关系,且差异显著(P < 0.05)。回肠组织匀浆(r=0.42,P=0.014,n=24)、细胞内质(r=0.42,P=0.047,n=24)、细胞顶膜(r=0.15,P=0.029,n=24)GTRAP3-18蛋白质表达量与回肠中GTRAP3-18 mRNA表达量之间呈正向线性关系(P < 0.05)。且回肠组织匀浆GTRAP3-18蛋白质与细胞内质和细胞顶膜GTRAP3-18蛋白质及细胞内质GTRAP3-18蛋白质与细胞顶膜GTRAP3-18蛋白质表达量之间均成正向线性关系,且差异显著(P < 0.05)。
2.4 早期断奶对仔猪游离氨基酸含量的影响 2.4.1 早期断奶对仔猪空肠中游离氨基酸含量的影响与哺乳组仔猪相比较,作为EAAC1蛋白质的底物氨基酸,断奶组仔猪空肠中谷氨酸含量提高了26%,差异显著(P < 0.05);作为抗系统ASC氨基酸转运蛋白2(ASCT2)蛋白质的底物氨基酸,谷氨酰胺含量没有显著变化(P>0.05),其他游离氨基酸,苏氨酸、甘氨酸和鸟氨酸含量分别提高了57%、88%和53%,差异显著(P < 0.05)(图5)。
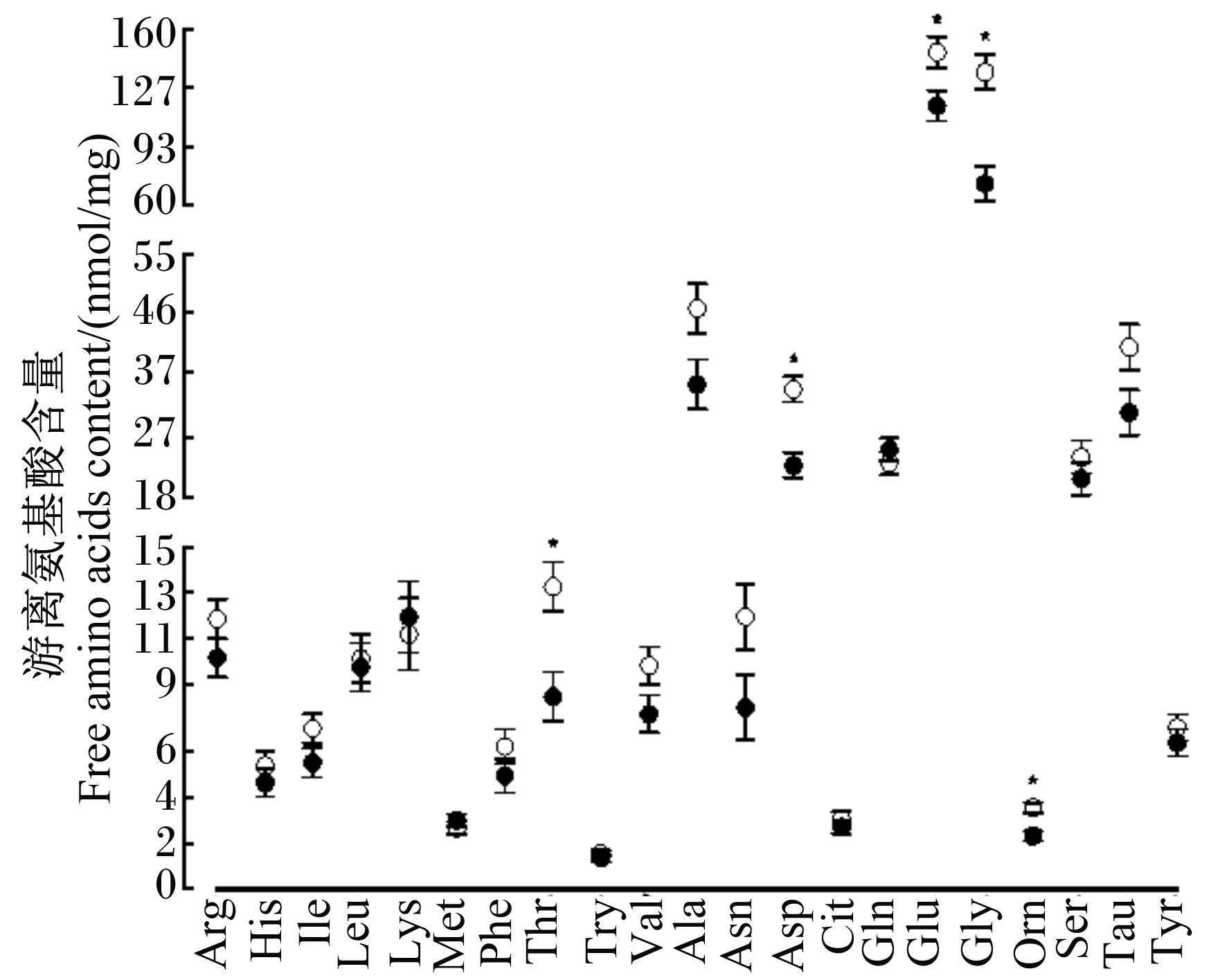 |
●:哺乳组;○:断奶组。下图同。 ●:suckling group;○:weaning group.The same as below. 图5 断奶对仔猪空肠中游离氨基酸含量的影响 Fig. 5 Effects of weaning on free amino acids content in jejunum of piglets |
与哺乳组仔猪相比较,断奶组仔猪回肠中游离氨基酸含量的变化趋势与空肠中游离氨基酸含量的变化趋势相反。作为EAAC1转运蛋白的底物氨基酸,与哺乳组仔猪相比,谷氨酸降低了43%,差异显著(P < 0.05);ASCT2转运蛋白的底物氨基酸谷氨酰胺降低了52%,显著低于哺乳组(P < 0.05);其他氨基酸,赖氨酸、蛋氨酸、苯丙氨酸、色氨酸、精氨酸、牛磺酸和酪氨酸含量都降低了42%以上,差异显著(P < 0.05)(图6)。
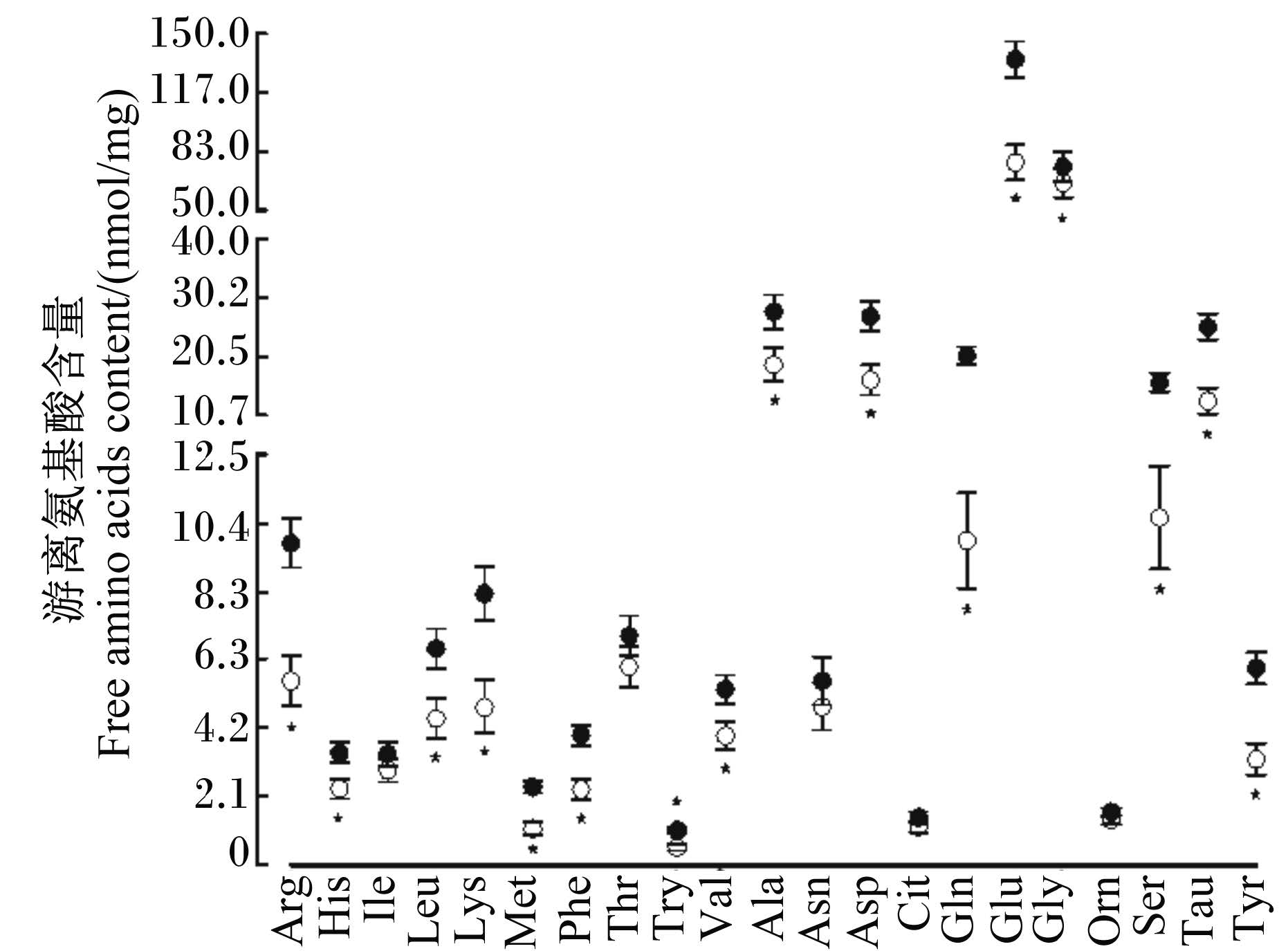 | 图6 断奶对仔猪回肠中游离氨基酸含量的影响 Fig. 6 Effects of weaning on free amino acids content in ileum of piglets |
仔猪断奶诱发了复杂的形态和功能变化,涉及营养、消化代谢[9]、应激、神经内分泌[10]、基因功能等。断奶后日增重是仔猪生长的一个重要表观指标,与哺乳仔猪相比,若未受到断奶影响,则说明饲粮营养供给足够仔猪需要,仔猪适应从母乳到饲料的变化,并且肠道发育也适应饲料采食。但在实际生产中,断奶时有10%的仔猪死于这种生理应激,一方面离开母猪的外环境应激,另一方面就是从母乳到饲料对肠道内环境和黏膜发育的应激。断奶应激不仅引起胃肠道功能的改变,而且还会影响到脑-肠轴功能的调节[11]。仔猪在断奶过程中,由于营养条件和环境的改变,引起仔猪的采食量下降。因此与正常哺乳的幼畜相比,由于仔猪胃肠道未发育成熟,断奶会导致仔猪生长性能降低。在本研究中,早期断奶仔猪显示出明显的断奶应激症状,断奶仔猪的平均日采食量为148.5 g,明显低于NRC(1998)饲养标准中240 g/d的平均日采食量,断奶仔猪的平均日增重显著低于同期哺乳组仔猪。Gu等[12]研究表明仔猪在断奶时,断奶应激引起肠道结构和功能的巨大变化,直接影响着仔猪肠道的消化与吸收功能,进而影响仔猪的生长发育。
EAAC1是最主要的谷氨酸转运载体,它广泛地分布于整个细胞体。目前为止,很多的研究都集中EAAC1在中枢神经系统的谷氨酸转运上,很少有EAAC1在仔猪小肠黏膜表达的研究报道。本试验通过研究早期断奶仔猪肠道组织EAAC1蛋白质表达量及其mRNA水平的变化,揭示断奶对谷氨酸转运的影响。试验结果显示,早期断奶显著降低了仔猪小肠EAAC1蛋白质和mRNA表达量。Watabe等[13]用HEK293细胞为模式研究并证明, GTRAP3-18反向调节EAAC1的活性和细胞内谷胱甘肽的含量,并顺次影响对氧化应激的易感性。分化、热应激和氧化应激都会提高人体内GTRAP3-18蛋白质的分离[12],即GTRAP3-18蛋白质或mRNA表达量在遇到氧化应激时都应该升高,而不是降低。本试验结果显示,早期断奶降低了GTRAP3-18在仔猪空肠和回肠组织中的蛋白质及其mRNA表达量,也就是说,断奶应激在仔猪肠道组织中表现的反应结果与热应激等氧化应激不一致。断奶仔猪遭受生理应激,需要从饲粮中摄取更多的保护肠黏膜的谷氨酸。有研究显示,谷氨酸摄取效率提高时会引起GTRAP3-18蛋白质表达量的降低[14]。本试验结果显示,断奶仔猪空肠中谷氨酸浓度升高,同时伴随断奶仔猪空肠GTRAP3-18蛋白质表达量降低,与Lin等[14]的研究结论一致;然而断奶仔猪回肠中谷氨酸含量却降低,GTRAP3-18表达量也降低,关于GTRAP3-18在应激或疾病中起的具体作用及机制还不明确,有待进一步研究[5]。
谷氨酸为兴奋性氨基酸,可被EAAC1转运。本试验结果显示,早期断奶仔猪回肠组织中游离谷氨酸含量明显降低,与此相反,游离谷氨酸含量在空肠组织中却明显增加。有研究显示,EAAC1在小肠中的表达主要是在空肠中[15],而且小肠中谷氨酸跨膜转运的效率和能力由EAAC1表达的变化进行调控[16]。因此我们推测,断奶仔猪空肠组织中大量的EAAC1转运游离谷氨酸,以提高机体对谷氨酸的摄取量,与此同时EAAC1被消耗,表达量降低;而回肠组织中EAAC1表达量少,对谷氨酸转运效率相对低,因此与哺乳仔猪相比,断奶仔猪回肠中游离谷氨酸降低。当然谷氨酸含量的变化不仅与其转运相关,同时还受到谷氨酸-谷氨酰胺循环的影响。
4 结论总的来说,受到早期断奶应激,仔猪空肠组织膜上EAAC1表达量降低,消耗的EAAC1提高了对断奶仔猪空肠中谷氨酸的转运,提高了空肠中谷氨酸等游离氨基酸的含量,并伴随了EAAC1调节蛋白GTRAP3-18表达量的降低;而断奶仔猪回肠组织膜上EAAC1表达量降低的同时,其对谷氨酸转运的效率和能力也降低,导致回肠谷氨酸等游离氨基酸含量下降。
| [1] | RUTH M R,FIELD C J.The immune modifying effects of amino acids on gut-associated lymphoid tissue[J]. Journal of Animal Science and Biotechnology,2013,4:27. ( 1) 1)
|
| [2] | BIANCHI M G,BARDELLI D,CHIU M,et al.Changes in the expression of the glutamate transporter EAAT3/EAAC1 in health and disease[J]. Cellular and Molecular Life Sciences,2014,71(11):2001-2015. ( 1) 1)
|
| [3] | AOYAMA K,NAKAKI T.Neuroprotective properties of the excitatory amino acid carrier 1(EAAC1)[J]. Amino Acids,2013,45(1):133-142. ( 1) 1)
|
| [4] | BUTCHBACH M E R,LAI L,LIN C L G.Molecular cloning,gene structure,expression profile and functional characterization of the mouse glutamate transporter (eAAT3) interacting protein GTRAP3-18[J]. Gene,2002,292(1/2):81-90. ( 1) 1)
|
| [5] | AOYAMA K,NAKAKI T.Inhibition of GTRAP3-18 may increase neuroprotective glutathione (GSH) synthesis[J]. International Journal of Molecular Sciences,2012,13(9):12017-12035. ( 4) 4)
|
| [6] | BERMAN A E,CHAN W Y,BRENNAN A M,et al.N-acetylcysteine prevents loss of dopaminergic neurons in the EAAC1-/- mouse[J]. Annals of Neurology,2011,69(3):509-520. ( 3) 3)
|
| [7] | DUERSON K,WOLTJER R L,MOOKHERJEE P,et al.Detergent-insoluble EAAC1/EAAT3 aberrantly accumulates in hippocampal neurons of Alzheimer's disease patients[J]. Brain Pathology,2009,19(2):267-278. ( 1) 1)
|
| [8] | FU D Z,YANG H S,KONG X F,et al.Molecular cloning and expression profiling of excitatory amino acid carrier 1 in suckling Huanjiang mini-piglets with large or small body weight at birth[J]. Molecular Biology Reports,2013,40(4):3341-3350. ( 2) 2)
|
| [9] | TAKITA M,KIKUSUI T.Early weaning influences short-term synaptic plasticity in the medial prefrontal-anterior basolateral amygdala pathway[J]. Neuroscience Research,2015,doi:10.1016/j.neures.2015.08.003.in press( 1) 1)
|
| [10] | XIONG X,YANG H S,TAN B,et al.Differential expression of proteins involved in energy production along the crypt-villus axis in early-weaning pig small intestine[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology,2015,309(4):G229-G237. ( 1) 1)
|
| [11] | CANDEIAS E M,SEBASTIÃO I C,CARDOSO S M,et al.Gut-brain connection:the neuroprotective effects of the anti-diabetic drug liraglutide[J]. World Journal of Diabetes,2015,6(6):807-827. ( 1) 1)
|
| [12] | GU X H,LI D F,SHE R P.Effect of weaning on small intestinal structure and function in the piglet[J]. Archiv für Tierernaehrung,2002,56(4):275-286. ( 2) 2)
|
| [13] | WATABE M,AOYAMA K,NAKAKI T.A dominant role of GTRAP3-18 in neuronal glutathione synthesis[J]. The Journal of Neuroscience,2008,28(38):9404-9413. ( 1) 1)
|
| [14] | LIN C I,ORLOV I,RUGGIERO A M,et al.Modulation of the neuronal glutamate transporter EAAC1 by the interacting protein GTRAP3-18[J]. Nature,2001,410(6824):84-88. ( 2) 2)
|
| [15] | BURRIN D G,Stoll B.Metabolic fate and function of dietary glutamate in the gut[J]. American Journal of Clinical Nutrition,2009,90(3):850S-856S. ( 1) 1)
|
| [16] | FAN M Z,MATTHEWS J C,ETIENNE N M P,et al.Expression of apical membrane L-glutamate transporters in neonatal porcine epithelial cells along the small intestinal crypt-villus axis[J]. American Journal of Physiology Gastrointestinal and Liver Physiology,2004,287(2):G385-G398. ( 1) 1)
|




