2. 海南大学农学院, 海口 570228
2. College of Agriculture, Hainan University, Haikou 570228, China
在现代养猪生产中,仔猪早期断奶是普遍采用的先进技术之一。然而,在断奶期,生理、营养和环境的突然改变、断奶应激及病原微生物侵袭,均会引起断奶仔猪采食量下降、生长阻滞和腹泻、肠道绒毛萎缩和隐窝增生、免疫功能降低等,即“早期断奶综合征”[1]。产生这一后果的主要原因是断奶应激使肠道屏障受到损伤,进而导致腹泻,这不仅显著降低了仔猪的生产性能,而且严重威胁着仔猪的生命健康,成为制约养猪业发展的一个重要因素。因此,如何有效地降低仔猪早期断奶后腹泻的发生,使仔猪顺利渡过断奶关,一直是国内外研究的热点。
饲用抗生素如喹烯酮、金霉素等在预防病菌感染和促进动物生长方面的作用效果已被人们所认可,但饲用抗生素也为畜牧生产带来了如细菌耐药性、抗生素药物残留等一系列危害。因此,研制和开发安全、无污染、无残留的绿色饲料添加剂来替代抗生素成为目前动物营养学领域研究的热点和焦点。近年来,国内外研究在揭示早期断奶仔猪肠黏膜屏障损伤机制方面取得了很大进展,为开发新的饲料添加剂预防肠道相关疾病奠定了基础。姜黄素是一种天然植物提取物,在我国资源丰富,具有良好的抗炎、抗氧化、抗感染、抗肿瘤和降脂等广泛的药理作用,且毒副作用很低[2, 3],这为其在饲料中的应用创造了良好的条件。宋卫兵[4]报道姜黄素对甲氨蝶呤(MTX)诱导的小肠炎大鼠肠黏膜的通透性有保护作用,且具有抗氧化作用。王改[5]研究发现姜黄素可改善过氧化氢(H2O2)介导的紧密连接和肠黏膜屏障功能受损,降低闭锁蛋白(occludin)和闭锁小带蛋白(ZO-1)表达。另外,研究还发现,姜黄素通过抑制促炎因子——肿瘤坏死因子-α(TNF-α)及炎性介质环氧酶2(COX-2)的表达,增加白细胞介素-10(IL-10)的表达,对新生大鼠坏死性小肠结肠炎起到保护作用[6, 7]。侯洪涛[8]报道姜黄素通过抑制核转录因子(NF-κB)及TNF-α的表达,减少梗阻性黄疸时炎症因子TNF-α、白细胞介素-6(IL-6)的表达,对大鼠小肠黏膜屏障起到保护作用。
目前,关于姜黄素对肠黏膜屏障保护作用的研究,大多集中在对大鼠和小鼠抗炎的药理基础方面,尚未发现姜黄素对畜禽肠道黏膜屏障保护作用及其分子机制的相关报道。本研究通过大肠杆菌(Escherichia coli)攻毒断奶仔猪,使受试仔猪处于腹泻状态,建立应激模型,研究姜黄素对断奶仔猪回肠黏膜形态、紧密连接蛋白和炎性因子基因表达以及血清免疫球蛋白水平的影响,探讨姜黄素作为抗生素替代品应用于饲料添加剂的可行性,并摸索适合的添加量,为猪绿色饲料添加剂的研制和开发应用提供科学依据。
1 材料与方法 1.1 试验设计选取50头胎次、体重相近的21日龄“杜×长×大”健康断奶仔猪,公母各占1/2,随机分为5组,每组10个重复,每个重复1头猪。试验分对照组(A组)、喹烯酮组(B组)和3个姜黄素组(C组、D组和E组),分别饲喂基础饲粮、在基础饲粮中添加50 mg/kg喹烯酮及200、300和400 mg/kg姜黄素的饲粮。基础饲粮组成及营养水平见表1。预试期7 d,于第4天接种大肠杆菌(菌种在LB液体培养基中振荡培养12 h后,测定其浓度,按每头猪总大肠杆菌1×109 CFU分早晚2次给服);正试期21 d。
| 表1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
姜黄素选购于美国Sigma公司,喹烯酮购于大连容海生物科技有限公司,试验攻毒用大肠杆菌选购于国家兽医微生物菌种保藏管理中心。伊红染色液购自碧云天生物有限公司,RNAiso Plus试剂盒、反转录试剂盒、实时荧光定量PCR试剂盒购自TaKaRa公司,血清免疫球蛋白检测试剂盒购自南京建成生物工程研究所。
1.3 样品采集饲养试验结束后,所有受试仔猪空腹从前腔静脉采血10 mL于真空采血管中,冰浴静置30 min,3 000 r/min离心10 min,置于-20 ℃冰箱保存备用,用于测定血清生化指标。
饲养试验结束前12 h停止饲喂仔猪,试验结束后每组随机取6头仔猪颈静脉放血处死,打开腹腔,取出回肠,取中间5~10 cm,用冰浴的生理盐水洗净外壁及内容物,滤纸吸干,剪开肠管,用经焦碳酸二乙酯(DEPC)处理过的载玻片轻轻刮取肠黏膜,取约0.5 g肠黏膜放入2 mL离心管中,保存于-80 ℃,用于检测跨膜蛋白-1(claudin-1)、occludin、ZO-1、白细胞介素-1β(IL-1β)、IL-6、IL-10、TNF-α、Toll样受体4(TLR4)mRNA相对表 达量。另取回肠中段约5 cm的肠段,用生理盐水洗去内容物后放入4%多聚甲醛固定液固定肠管。
1.4 肠黏膜形态测定经多聚甲醛固定肠管,再经修块、脱水、透明、浸蜡、包埋、切片等处理后,切片进行苏木精-伊红(HE)染色,每张切片选取5个视野拍照,每张照片中选取2根最长、绒毛完整且走向平整的肠绒毛,分析绒毛高度、绒毛宽度及隐窝深度,并计算绒毛高度/隐窝深度(V/C)值。
1.5 紧密连接蛋白和炎性因子基因相对表达量的检测 1.5.1 引物设计从NCBI下载已登录的猪持家基因甘油醛-3-磷酸脱氢酶(GAPDH)、猪claudin-1、occludin、ZO-1、IL-1β、IL-6、IL-10、TNF-α、TLR4 mRNA的基因序列,用Primer Premier 5.0软件设计引物。引物序列见表2。
| 表2 实时荧光定量PCR引物序列 Table 2 Primer sequences for fluorescence-based quantitative real-time PCR |
采用RNAiso Plus试剂盒提取肠黏膜组织总RNA,用变性琼脂糖凝胶电泳鉴定RNA品质,并用核酸蛋白测定仪测定其浓度。cDNA合成按反转录试剂盒操作,反转录后的cDNA于-80 ℃保存备用。
1.5.3 实时荧光定量PCR每个样品做3个重复。反应体系(20 μL):SYBR Premix Ex TaqTM(2×),10 μL;PCR Forward Primer (10 μmol/L),0.4 μL;PCR Reverse Primer (10 μmol/L),0.4 μL;cDNA,2.0 μL;ddH2O,7.2 μL。Occludin、ZO-1和claudin基因反应程序:95 ℃ 1 min,95 ℃ 5 s,60 ℃ 30 s,45个循环;IL-1β、IL-6、IL-10、TNF-α、TLR4 基因反应程序:95 ℃ 10 s,95 ℃ 10 s,62 ℃ 20 s,40个循环。扩增完后添加1个循环的熔解曲线检测发现熔解曲线为单峰,说明扩增特异性高。
1.6 血清免疫球蛋白指标采用免疫比浊法检测血清免疫球蛋白G(IgG)和免疫球蛋白M(IgM)水平。
1.7 数据处理采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准,结果用“平均值±标准差”表示。
目的基因的相对表达量采用-ΔΔCT法获得,ΔΔCT为每个试验组的ΔCT与对照组的相对数值,目的基因的相对表达量用2-ΔΔCT表示。
2 结果与分析 2.1 姜黄素对断奶仔猪回肠黏膜形态的影响通过对回肠肠道组织切片光学显微镜观察发现,A组仔猪回肠绒毛萎缩、脱落、排列紊乱,且有折断、扭曲与变形现象,而D组、E组与A组、B组和C组相比, 肠黏膜结构完整,层次分明,肠绒毛排列较整齐、密集,形状规则(图1)。由表3可知,D组、E组回肠绒毛高度和V/C值显著高于A组、B组和C组(P<0.05),E组显著高于D组(P<0.05);B组、D组、E组回肠绒毛宽度均显著降低(P<0.05);D组、E组回肠隐窝深度显著低于A组、B组和C组(P<0.05);A组、B组、C组之间绒毛高度、隐窝深度和V/C值无显著差异(P>0.05)。
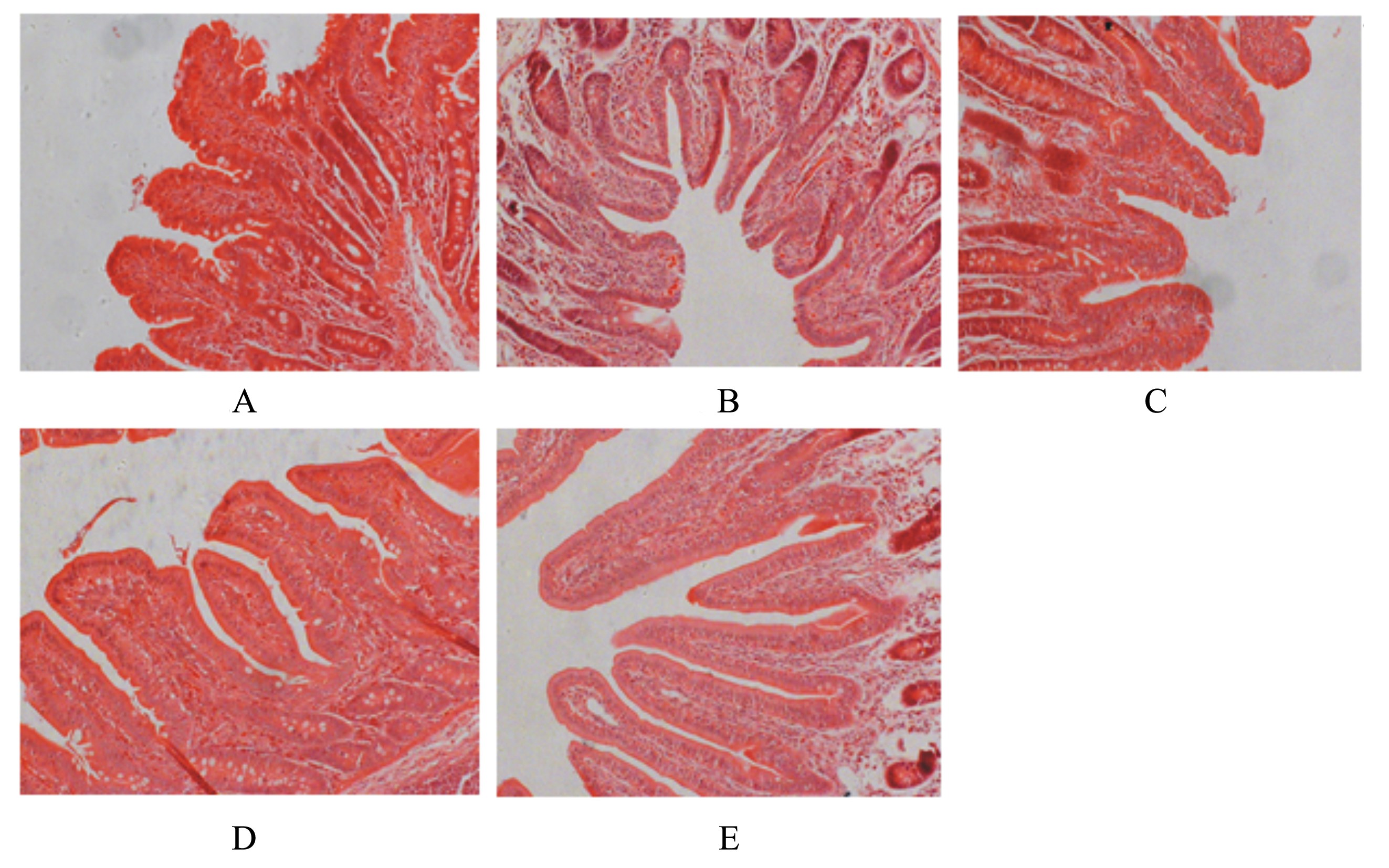 | 图1 不同组间回肠黏膜形态 Fig. 1 Ileal mucosal morphology in different groups (200×) |
| 表3 断奶仔猪回肠黏膜上皮形态分析 Table 3 Morphological analysis of ileum mucosa epithelium of weaning piglets |
由表4可知,各组间claudin-1 mRNA表达差异不显著(P>0.05);D组、E组occludin、ZO-1 mRNA相对表达量显著高于A组、B组(P<0.05),A组、B组和C组间差异不显著(P>0.05)。
| 表4 姜黄素对断奶仔猪回肠黏膜claudin-1、occludin和ZO-1 mRNA相对表达量的影响 Table 4 Effects of curcumin on the relative expression levels of claudin-1,occludin and ZO-1 mRNA in the ileum mucosa of weanling piglets |
由表5可知,与A组相比,D组、E组回肠黏膜IL-1β、TNF-α、IL-6 mRNA相对表达量显著降低(P<0.05),IL-10 mRNA相对表达量显著提高(P< 0.05),A组、B组和C组间差异不显著(P>0.05);B组、D组、E组TLR4 mRNA相对表达量显著低于A组(P<0.05),C组与A组差异不显著(P>0.05)。
| 表5 姜黄素对断奶仔猪回肠黏膜炎性因子和TLR4 mRNA相对表达量的影响 Table 5 Effects of curcumin on the relative expression levels of inflammatory cytokines and TLR4 mRNA in the ileum mucosa of weanling piglets |
由表6可知,D组、E组血清IgG和IgM水平显著高于A组、B组和C组(P<0.05),C组血清IgG水平显著高于A组(P<0.05)、IgM水平与A组差异不显著(P>0.05),B组血清IgG和IgM水平与A组相比均有不同程度提高,但差异不显著(P>0.05)。
| 表6 姜黄素对断奶仔猪血清免疫球蛋白水平的影响 Table 6 Effects of curcumin on serum immunoglobulin levels of weanling piglets mg/mL |
小肠是营养物质吸收和转运的主要部位,其功能单位是小肠绒毛,而小肠绒毛高度、绒毛宽度、隐窝深度及V/C是直接反映小肠黏膜结构与功能完整性的重要指标[9]。绒毛高度反映小肠对营养物质的吸收能力;隐窝深度反映小肠黏膜上皮细胞的成熟率;V/C则体现了小肠的吸收能力,比值越大吸收能力越强[10]。早期断奶可使绒毛高度大幅度降低、隐窝加深,从而引起消化吸收能力下降、腹泻和生长阻滞[11]。本试验结果表明,饲粮中添加姜黄素显著提高回肠绒毛高度和V/C值,降低回肠绒毛宽度和隐窝深度,其中以添加300或400 mg/kg姜黄素较为显著,其作用效果优于喹烯酮。这与姜黄素促进仔猪生长性能的结果相一致[12],说明姜黄素可改善回肠黏膜上皮形态,从而提高对营养物质的消化吸收能力,达到对机体的促生长作用。
3.2 姜黄素对断奶仔猪回肠黏膜紧密连接蛋白和炎性因子基因表达的影响紧密连接是肠黏膜机械屏障的重要组成部分,主要包括occludin、claudin、ZO-1和连接黏附分子等多种蛋白[13]。ZO-1在维持和调节紧密连接复合体的完整性方面发挥重要作用。Occludin作为紧密连接中最重要的结构蛋白之一,可与ZO-1等蛋白结合,共同构成紧密连接的骨架部分。Occludin一旦进入紧密连接,将使与其连接的膜通透性降低,进而达到保护肠黏膜屏障的作用。Claudin也在调节细胞连接和黏附中发挥着重要作用。紧密连接的破坏常常伴随着紧密连接蛋白表达和分布的改变[14]。王改[5]研究发现,姜黄素可改善H2O2介导的紧密连接和肠黏膜屏障功能受损,上调occludin和ZO-1表达。本试验结果显示,饲粮中添加300或400 mg/kg姜黄素可显著提高回肠黏膜occludin和ZO-1 mRNA相对表达量,表明姜黄素可以调节肠上皮细胞紧密连接蛋白occludin和ZO-1的表达。这与姜黄素可显著降低大肠杆菌攻毒仔猪血浆二胺氧化酶(DAO)活性和D-乳酸含量的结果相一致[12],进一步表明姜黄素可减轻大肠杆菌对肠黏膜屏障的损伤,有效促进细胞间紧密连接结构的形成,进而降低早期断奶仔猪肠黏膜通透性,增强肠黏膜机械屏障功能。这与汪潞等[15]认为姜黄素可明显改善大鼠小肠组织结构及病理损伤程度,降低肠黏膜通透性,维持肠黏膜机械屏障功能的完整性的研究结果相似。
3.3 姜黄素对断奶仔猪血清免疫球蛋白水平的影响血清免疫球蛋白浓度或效价高低是反映机体体液免疫水平的重要指标。IgM是初次免疫应答的主要抗体;IgG是介导体液免疫应答的主要抗体,在抗细菌、抗病毒等防御机制中起着重要作用[16]。本研究表明,随着姜黄素添加浓度增大,血清IgG和IgM水平有上升趋势,并且300或400 mg/kg姜黄素组显著高于对照组和喹烯酮组,这说明姜黄素可以增强断奶仔猪免疫功能。
消化道黏膜免疫系统在抵御病原菌的入侵、维护机体健康方面发挥重要作用。Toll样受体(TLRs)是近年来发现的与免疫相关的模式识别受体家族,TLR4作为家族主要成员之一,可以识别特定微生物的保守成分,激活NF-κB和丝裂原活化蛋白激酶(MAPKs)信号转导通路,从而诱导各种细胞炎性因子表达[17, 18]。细胞因子IL-1β、IL-6和TNF-α作为炎性因子,主要通过促进炎症应答反应而提高机体抗感染作用[19]。IL-10是一种由淋巴T细胞、B细胞等分泌抑制炎症应答的免疫抑制细胞因子,其主要作用是抗感染和维持肠道免疫稳态[20]。目前,姜黄素对肠黏膜的抗炎作用已在许多研究中得到证实。姜黄素能抑制NF-κB和p38的活性,进而降低MTX诱导的小肠炎大鼠肠上皮细胞炎性因子TNF-α和IL-1β表达,增加抗炎因子IL-10表达[21]。侯洪涛[8]研究发现姜黄素通过抑制NF-κB及TNF-α的表达,减少梗阻性黄疸时炎性因子TNF-α、IL-6表达,对大鼠小肠黏膜屏障起到保护作用。此外,Zeng等[22]报道姜黄素是通过抑制TLR4/NF-κB信号通路和肠上皮细胞白细胞介素-27(IL-27)表达来发挥对结肠炎大鼠的抗炎作用。本试验结果显示,添加300或400 mg/kg姜黄素可显著下调断奶仔猪回肠黏膜IL-1β、IL-6、TNF-α和TLR4 mRNA表达,上调IL-10 mRNA表达,说明姜黄素可提高肠黏膜的免疫屏障功能,缓解大肠杆菌对肠黏膜造成的损伤。由此推测,姜黄素对大肠杆菌攻毒仔猪回肠上皮细胞炎症反应的保护作用可能通过抑制NF-κB和MAPKs信号转导通路,降低炎性因子表达和增强抗炎因子表达来发挥作用的,其作用机理将进一步研究证实。
4 结 论① 添加300或400 mg/kg姜黄素可显著提高断奶仔猪回肠绒毛高度和V/C值,降低回肠绒毛宽度和隐窝深度,增强回肠黏膜occludin、ZO-1 mRNA表达,说明姜黄素可改善回肠黏膜上皮形态,促进细胞间紧密连接结构的形成,维持肠黏膜机械屏障功能的完整性,
② 添加300或400 mg/kg姜黄素可显著提高断奶仔猪血清IgG和IgM水平,下调炎性因子IL-1β、IL-6、TNF-α和TLR4 mRNA表达,上调抗炎因子IL-10 mRNA表达,有效刺激仔猪非特异性免疫,从而增强机体免疫力,其作用效果优于喹烯酮。
| [1] | BAGCHI M,MILNES M,WILLIAMS C,et al.Acute and chronic stress-induced oxidative gastrointestinal injury in rats,and the protective ability of a novel grape seed proanthocyanidin extract[J]. Nutrition Research,2000,19(8):1189-1199. ( 1) 1)
|
| [2] | BOWER M R,AIYER H S,LI Y,et al.Chemoprotective effects of curcumin in esophageal epithelial cells exposed to bile acids[J]. World Journal of Gastroenterology,2010,16(33):4152-4158. ( 1) 1)
|
| [3] | GLAUERT H P,CALFEE-MASON K,STEMM D N,et al.Dietary antioxidants in the prevention of hepatocarcinogenesis:a review[J]. Molecular Nutrition & Food Research,2010,54(7):875-896. ( 1) 1)
|
| [4] | 宋卫兵.姜黄素对肠黏膜屏障保护作用的实验研究[D]. 博士学位论文.广州:南方医科大学,2008:35-42. ( 1) 1)
|
| [5] | 王改.姜黄素对肠单层上皮氧化应激损伤的保护作用[D]. 硕士学位论文.石家庄:河北医科大学,2010:23-35. ( 2) 2)
|
| [6] | ZHANG M,DENG C S,ZHENG J J,et al.Curcumin regulated shift from Th1 to Th2 in trinitrobenzene sulphonic acid-induced chronic colitis[J]. Acta Pharmacologica Sinica,2006,27(8):1071-1077. ( 1) 1)
|
| [7] | 贾盛华.新生大鼠坏死性小肠结肠炎模型建立及姜黄素对其防治机制的研究[D]. 硕士学位论文.重庆:重庆医科大学,2010:22-33. ( 1) 1)
|
| [8] | 侯洪涛.姜黄素对梗阻性黄疸大鼠肠黏膜屏障保护作用的实验研究[D]. 硕士学位论文.石家庄:河北医科大学,2009:11-32. ( 2) 2)
|
| [9] | 杨凤娟,曾祥芳,谯仕彦.罗伊氏乳杆菌I5007对新生仔猪肠道形态、二糖酶活性和紧密连接蛋白表达的影响[J]. 中国农业科学,2014,47(22):4506-4515. ( 1) 1)
|
| [10] | 杨海英,杨在宾,杨维仁,等.益生素和低聚木糖对断奶仔猪生产性能和肠道形态学影响研究[J]. 中国粮油学报,2008,23(1):116-120. ( 1) 1)
|
| [11] | CERA K R,MAHAN D C,CROSS R F,et al.Effect of age,weaning and postweaning diet on small intestinal growth and jejunal morphology in young swine[J]. Journal of Animal Science,1988,66(2):574-584. ( 1) 1)
|
| [12] | XUN W J,SHI L G,ZHOU H L,et al.Effects of curcumin on growth performance,jejunal mucosal membrane integrity,morphology and immune status in weaned piglets challenged with enterotoxigenic Escherichia coli[J]. International Immunopharmacology,2015,27(1):46-52. ( 2) 2)
|
| [13] | FURUSE M,SASAKI H,FUJIMOTO K,et al.A single gene product,claudin-1 or -2,reconstitutes tight junction strands and recruits occludin in fibroblasts[J]. The Journal of Cell Biology,1998,143(2):391-401. ( 1) 1)
|
| [14] | BERKES J,VISWANATHAN V K,SAVKOVIC S D,et al.Intestinal epithelial responses to enteric pathogens:effects on the tight junction barrier,ion transport,and inflammation[J]. Gut,2003,52(3):439-451. ( 1) 1)
|
| [15] | 汪潞,傅婷,来岳标,等.姜黄素对5-Fu化疗大鼠肠黏膜屏障保护作用的实验研究[J]. 中华中医药学刊,2014,32(10):2478-2480. ( 1) 1)
|
| [16] | 崔治中,崔保安.兽医免疫学[M]. 北京:中国农业出版社,2004:42-44. ( 1) 1)
|
| [17] | YAN Z Q.Regulation of TLR4 expression is a tale about tail[J]. Arteriosclerosis,Thrombosis,and Vascular Biology,2006,26(12):2582-2584. ( 1) 1)
|
| [18] | TRINCHIERI G,SHER A.Cooperation of toll-like receptor signals in innate immune defence[J]. Nature Reviews Immunology,2007,7(3):179-190. ( 1) 1)
|
| [19] | STEPTOE A,HAMER M,CHIDA Y.The effects of acute psychological stress on circulating inflammatory factors in humans:a review and meta-analysis[J]. Brain,Behavior,and Immunity,2007,21(7):901-912. ( 1) 1)
|
| [20] | SARAIVA M,O'GARRA A.The regulation of IL-10 production by immune cells[J]. Nature Reviews Immunology,2010,10(3):170-181. ( 1) 1)
|
| [21] | SONG W B,WANG Y Y,MENG F S,et al.Curcumin protects intestinal mucosal barrier function of rat enteritis via activation of MKP-1 and attenuation of p38 and NF-κB activation[J]. PLoS One,2010,5(9):e12969. ( 1) 1)
|
| [22] | ZENG Z,ZHAN L,LIAO H,et al.Curcumin improves TNBS-induced colitis in rats by inhibiting IL-27 expression via the TLR4/NF-κB signaling pathway[J]. Planta Medica,2013,79(2):102-109. ( 1) 1)
|




