有机酸如醋酸、苹果酸、柠檬酸及其钠盐等作为食品添加剂和调味剂应用已经十分普遍[1, 2, 3],在单胃动物中也得到广泛应用[4, 5],但作为反刍动物的饲料添加剂还比较少见[6, 7]。最新研究表明,延胡索酸等有机酸可改善反刍动物瘤胃发酵[8],促进乳酸利用菌生长,降低乳酸产量,最终提高瘤胃液pH,缓解营养性代谢病,如瘤胃酸中毒[8]。同时,在奶牛上的研究还表明,使用延胡索酸可促进纤维素分解菌生长,提高瘤胃内纤维素的消化 率[9, 10]。这些结果显示,延胡索酸及其钠盐可能 有用做反刍动物饲料添加剂的潜力。然而,以前有关延胡索酸及其钠盐的研究主要集中在成年反刍动物如泌乳奶牛及肉羊,延胡索酸二钠(disodium fumarate,DF)对早期断奶羔羊生长性能及消化系统发育有何影响,目前并不清楚。为阐明DF对早期断奶羔羊生长发育的作用效果,本研究通过在饲粮中添加DF,研究了其对早期断奶羔羊生长性能及不同肠段发育的影响,拟为DF作为饲料添加剂在羔羊饲粮中的应用提供科学的理论依据。
1 材料方法 1.1 试验材料与试验地点DF(陕西交大瑞森渭南化学工业有限责任公司,2014)纯度≥98%。试验地点为新湖总场大西北畜牧有限公司种羊场。
1.2 试验设计选取体况、体重及年龄相近的萨福克和与德美杂交1代羔羊30只,于(50±5)日龄左右断奶,将其随机分为3组,1个对照组和2个试验组,每 组10只,试验期为70 d。饲粮为全混合日粮,每日于10:00和18:00饲喂2次,自由饮用清洁水。对照组饲喂基础饲粮,2个试验组在对照组饲粮的基础上分别添加0.5% 和1.0% DF(风干基础)。利用张丽英[11]介绍的凯氏定氮法测定饲粮的粗蛋白质含量,高锰酸钾法测定钙含量,磷钼蓝光度法测定总磷含量,索氏抽提法测定粗脂肪含量,范氏纤维测定法分析中性洗涤纤维和酸性洗涤纤维含量。基础饲粮组成及营养水平见表1。
| 表1 基础饲粮组成及营养水平 Table 1 Composition and nutrient levels of basal diets |
每日收集每组剩余饲粮量称重,并分别于试验第1(初重)和70天(末重)早晨空腹称重,用于测定羔羊生长性能及计算料重比。第70天早晨饲喂前,每组随机选择4只,共计12只试验羔羊,颈静脉放血处死。迅速在十二指肠近端(5 cm处)、空肠近端1/4处和空肠远端1/4处中间段、回肠中段分别取出约2 cm的肠管,使用0.9%的生理盐水轻轻冲洗干净后,分别保存在4%的多聚甲醛溶液中固定,用于测定不同肠段绒毛高度、隐窝深度、肌层厚度及黏膜层厚度[12]。采集瘤胃背囊顶部1块直径为2 cm×3 cm面积的瘤胃壁,置于4%多聚甲醛溶液中,用于测定瘤胃壁上乳头的高度和密度。
屠宰羔羊的瘤胃液混匀后用4层纱布过滤,立即用便携式酸度计测定瘤胃液pH(PHB-4酸度计)。取3份2 mL过滤瘤胃液,1份加25%偏磷酸和巴豆酸(内标法,100 mL偏磷酸溶液中含巴豆酸0.646 4 g)混合液0.4 mL,-20 ℃冰箱保存,利用气相色谱仪(Agilent 7890B气相色谱仪)测定挥发性脂肪酸浓度[13];另取1份样品与0.2 mol/L盐酸等体积混合,-20 ℃冰箱保存用于氨态氮浓度测定[13];第3份瘤胃液-20 ℃冰箱保存,使用试剂盒测定乳酸浓度(乳酸测定试剂盒A019-2,南京建成生物工程研究所)。
1.3.2 胃肠道发育的测定肠道组织用乙醇逐级脱水,二甲苯透明,石蜡包埋切片(6~8 μm厚),苏木素-伊红(HE)染色,树胶封片,各段小肠取5张切片,每张切片选5个视野拍照,利用Motic-Image-Advanced 3.2图像分析软件计算每张照片5根最长的肠绒毛(以肠腺绒毛连接处到绒毛顶端为准)、最深的隐窝(以肠腺绒毛连接处到肠腺基部为准)和最厚的黏膜层(以肠腺绒毛连接处到黏膜下层为准)以及最厚的肌层(由内环与外纵2层平滑肌组成的,以黏膜下层到浆膜层上层的连线为准)[14],测定方法见图1。
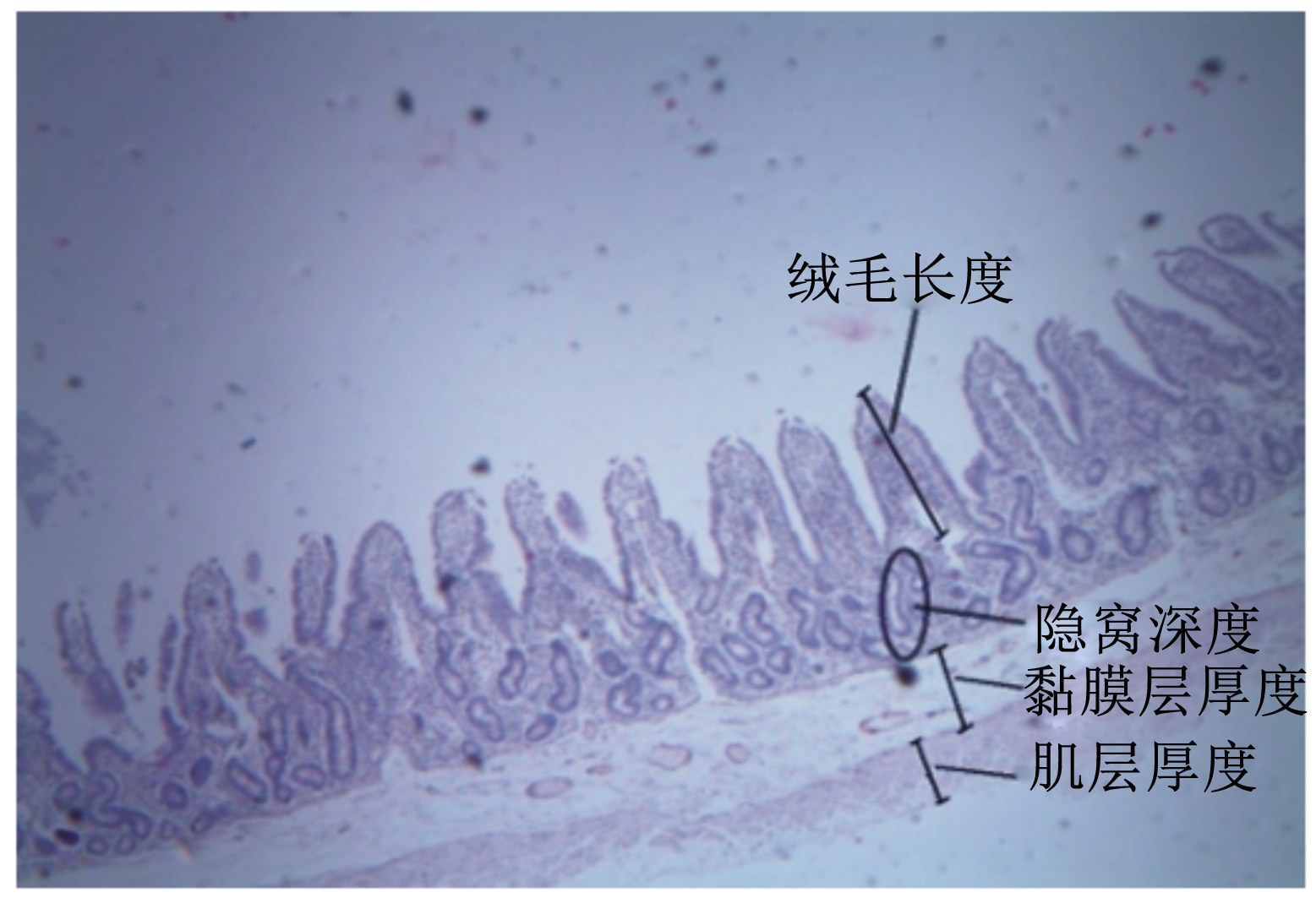 | 图1 小肠结构示意图 Fig. 1 Photograph of small intestinal structure |
将瘤胃组织样制成石蜡切片,采用HE染色。每只羔羊的瘤胃组织样切片的选择,均从背囊和尾腹盲囊区域的1块组织样切片中挑选4片制作完整清晰的切片,用Motic-Image-advanced 3.2图像分析软件测定其中5枚乳头状突起的高度,平均值为乳头高度。使用体视显微镜观察测定1 cm2视野范围内瘤胃乳头状突起的数量,测定方法见图2。
1.4 数据处理分析所得数据使用Excel进行整理,再使用SPSS 13.0软件进行one-way ANOVA统计分析,结果以平均值±标准误表示,P<0.05为差异显著,P<0.01为差异极显著。结果差异显著,采用Duncan氏法进行多重比较。
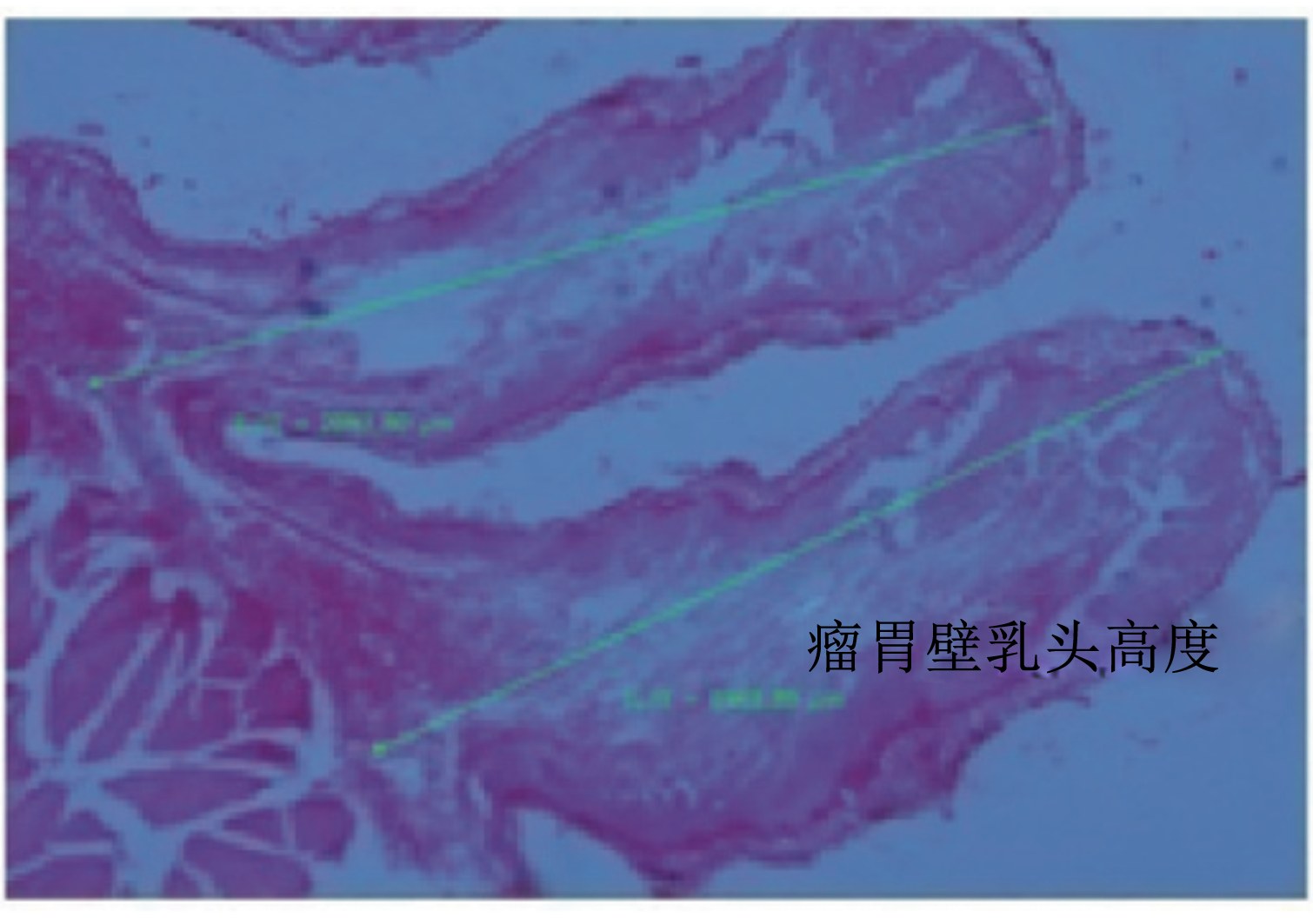 | 图2 瘤胃壁乳头结构示意图 Fig. 2 Photograph of ruminal wall papilla |
表2结果显示,0.5%和1.0%组平均日增重分别比对照组提高3.14和55.44 g,其中1.0%组羔羊平均日增重显著高于对照组(P<0.05)。
2.2 瘤胃发酵指标表3结果显示,饲粮中添加DF并未显著影响羔羊瘤胃液pH(P>0.05),而显著降低了氨态氮浓度(P<0.05)。添加DF极显著降低了瘤胃液乳酸浓度(P<0.01)。1.0%组总挥发性脂肪酸、乙酸和丙酸浓度显著高于对照组(P<0.05)。与对照组比较,试验组丁酸浓度和乙酸/丙酸未发生显著变化(P>0.05)。
2.3 消化道发育表4结果显示,与对照组比较,0.5%和1.0%组羔羊瘤胃壁乳头高度分别增加139.51和156.74 μm,分别提高8.2%和9.2%,但差异不显著(P>0.05);0.5%组羔羊瘤胃壁乳头密度与对照组接近,而1.0%组羔羊瘤胃壁乳头密度较对照组下降,组间差异均不显著(P>0.05)。
0.5%和1.0%组羔羊十二指肠绒毛高度显著高于对照组(P<0.05),其中0.5%组羔羊肠绒毛高度较对照组增加了30.3%;与对照组比较,1.0%组羔羊的十二指肠隐窝深度显著下降(P<0.05),隐窝深度减少了18.5%,而0.5%组无显著变化(P>0.05);0.5%和1.0%组的十二指肠绒毛高度/隐窝深度(V/C)极显著高于对照组(P<0.01);与对照组比较,0.5%组的肌层厚度增加了9.2%(P<0.05),但0.5%和1.0%组十二指肠的黏膜层厚度 与对照组比较并无显著性差异(P>0.05)。
| 表2 延胡索酸二钠对羔羊生长性能的影响 Table 2 Effects of DF on growth performance of lambs |
| 表3 延胡索酸二钠对断奶羔羊瘤胃发酵指标的影响 Table 3 Effects of DF on ruminal fermentation parameters of weaning lambs |
0.5%和1.0%组羔羊空肠绒毛高度显著高于对照组(P<0.05),其中0.5%组空肠肠绒毛高度增加了30.6%;与对照组比较,0.5%组的羔羊空肠隐窝深度显著下降(P<0.05),减少了25.6%,而1.0%组空肠隐窝深度与对照组比较差异不显著(P>0.05);与对照组比较,0.5%组羔羊的V/C显著增加(P<0.05);1.0%组的羔羊空肠肌层厚度显著高于对照组(P<0.05),增加了56.9%;试验组空肠的黏膜层厚度与对照组比较无显著性差异(P>0.05)。
与对照组比较,0.5%组羔羊回肠绒毛高度显著提高(P<0.05),增加了46.1%;0.5%和1.0%组羔羊回肠隐窝深度与对照组比较无显著差异(P>0.05),但0.5%组的回肠隐窝深度比对照组减少17.9%;0.5%和1.0%组羔羊回肠V/C与对照组比较差异不显著(P>0.05);与对照组比较,0.5%组羔羊回肠肌层厚度显著增加了10.4%(P<0.05),1.0%组羔羊回肠肌层厚度与对照组相比差异不显著(P>0.05);0.5%和1.0%组羔羊回肠的黏膜层厚度与对照组比较无显著性差异(P>0.05)。
3 讨 论本研究中DF提高了断奶羔羊的生长性能,其中1.0%组显著提高断奶羔羊的平均日增重。这是由于添加DF降低了瘤胃乳酸的浓度,与毛胜勇[15]研究结果相一致。同时DF在瘤胃中结合氢离子(H+)被还原为延胡索酸,使瘤胃液保持正常的pH,有利于瘤胃微生物的饲料降解[8]。本研究中添加DF提高羔羊瘤胃液总挥发性脂肪酸、乙酸和丙酸浓度,此结果与毛胜勇[15]在山羊饲粮中添加DF能够提高挥发性脂肪酸浓度的结果相似,而挥发性脂肪酸是动物合成体组织及重要的能量来源物质[16]。同时被还原成的延胡索酸是三羧酸循环中的中间代谢产物,可转变为谷氨酰胺进而促 进肠道发育,也有利于饲粮营养物质在瘤胃中的 消化和吸收[17],从而提高动物的生长性能。
| 表4 延胡索酸二钠对羔羊瘤胃及小肠发育的影响 Table 4 Effects of DF on development of rumen and small intestine of lambs |
小肠绒毛长度、隐窝深度、V/C等指标被认为是衡量小肠消化吸收功能的重要指标[18]。肠绒毛是由肠上皮和固有层共同向肠腔突出形成的细小突起,长约0.35~1.00 mm,可使肠腔表面积扩大约10倍,绒毛多呈柱状、叶状或指状等[19]。肠绒毛高度的增加能够使小肠吸收营养物质的面积增大,促进营养物质的吸收及动物的生长。本研究的结果显示,试验组的肠绒毛高度有显著性的增加,降低了十二指肠和空肠隐窝深度,促进了小肠对肠道中养分的吸收。这可能是饲粮中添加一定量的DF,被还原成延胡索酸,而延胡索酸是三羧酸循环的中间产物,可以代谢为α-酮戊二酸,而α-酮戊二酸是谷氨酰胺合成的前体物,最终使谷氨酰胺的合成增加,从而促进肠道上皮细胞的分化和发育,这与Souba[20]和Reeds等[21]报道的谷氨酰胺是快速生长和分化细胞如淋巴细胞、肠黏膜上皮细胞的重要能量底物的研究结果相一致。
Buddle等[22]认为绒毛高度/隐窝深度的高低反映了肠道绒毛上皮细胞吸收功能和隐窝上皮细胞分泌功能。本研究中试验组的V/C均有提高,这一结果与晏家友[23]使用复合酸化剂提高断奶仔猪V/C的结果相一致。同时有研究指出,小肠的黏膜和肌层与小肠的节律性收缩运动和食糜的机械消化效率密切相关[24],同时它也是维持小肠正常消化与吸收功能的重要保障[25]。本研究结果表明,试验组的小肠黏膜厚度与肌层厚度较对照组均有提高,这充分说明了DF能够改善和维护羔羊小肠黏膜的正常结构,能提高羔羊小肠的消化吸收功能。
瘤胃发育是羔羊实现从非反刍动物向反刍动物转变的最重要生理变化,饲粮的物理形态、类型及动物日龄等诸多因素,对瘤胃发育有直接或间接作用[26, 27]。Lesmeister等[28]研究结果表明,瘤胃乳头高度可以较好地反映幼龄反刍动物的瘤胃发育情况,而单位面积的乳头数量不应作为评定瘤胃发育的指标。本研究中,饲粮中添加DF提高了羔羊瘤胃壁上乳头高度。这一结果与已报道的结果相一致[29, 30],饲粮碳水化合物和蛋白质的微生物发酵产生的挥发性脂肪酸可刺激前胃的发育,可以为胃黏膜生长提供能量,促进胃肠上皮增殖分化。本研究中,由于DF可被肠道微生物还原成丙酸,同时也提高了其他挥发性脂肪酸的浓度,短链脂肪酸是结肠黏膜上皮细胞的主要供能物质,能显著促进结肠黏膜上皮细胞的增殖和分化。
4 结 论① 饲粮中添加1.0% DF显著提高了羔羊的平均日增重。
② 饲粮中添加1.0% DF极显著降低了羔羊瘤胃液乳酸浓度,显著提高了羔羊瘤胃液总挥发性脂肪酸、丙酸及乙酸浓度。
③ 饲粮中添加DF提高了小肠绒毛高度,显著提高了十二指肠绒毛高度/隐窝深度。
④ 饲粮中添加DF有提高瘤胃壁上乳头高度的趋势。
| [1] | MAJZOOBI M,KAVEH Z,FARAHNAKY A.Effect of acetic acid on physical properties of pregelatinized wheat and corn starch gels[J]. Food Chemistry,2016,196:720-725. ( 1) 1)
|
| [2] | AMER M A,NOVOA-DÍAZ D,PUIG-PUJOL A,et al.Ultrasonic velocity of water-ethanol-malic acid-lactic acid mixtures during the malolactic fermentation process[J]. Journal of Food Engineering,2015,149:61-69. ( 1) 1)
|
| [3] | PORNSUKSOMBOON K,HOLLÓ B B,SZÉCSÉNYI K M,et al.Properties of baked foams from citric acid modified cassava starch and native cassava starch blends[J]. Carbohydrate Polymers,2016,136:107-112. ( 1) 1)
|
| [4] | LIU S T,HOU W X,CHENG S Y,et al.Effects of dietary citric acid on performance,digestibility of calcium and phosphorus,milk composition and immunoglobulin in sows during late gestation and lactation[J]. Animal Feed Science and Technology,2014,191:67-75. ( 1) 1)
|
| [5] | DEHGHANI-TAFTI N,JAHANIAN R.Effect of supplemental organic acids on performance,carcass characteristics,and serum biochemical metabolites in broilers fed diets containing different crude protein levels[J]. Animal Feed Science and Technology,2016,211:109-116. ( 1) 1)
|
| [6] | FOLEY P A,KENNY D A,LOVETT D K,et al.Effect of DL-malic acid supplementation on feed intake,methane emissions,and performance of lactating dairy cows at pasture[J]. Journal of Dairy Science,2009,92(7):3258-3264. ( 1) 1)
|
| [7] | CASTILLO C,BENEDITO J L,PEREIRA V,et al.Malic acid supplementation in growing/finishing feedlot bull calves:Influence of chemical form on blood acid-base balance and productive performance[J]. Animal Feed Science and Technology,2007,135(3/4):222-235. ( 1) 1)
|
| [8] | MAO S Y,ZHANG G,ZHU WY.Effect of disodium fumarate on ruminal metabolism and rumen bacterial communities as revealed by denaturing gradient gel electrophoresis analysis of 16S ribosomal DNA[J]. Animal Feed Science and Technology,2008,140(3/4):293-306. ( 3) 3)
|
| [9] | 尹文新,李香子,金哲勇,等.延胡索酸对延边黄牛瘤胃发酵及养分降解率的影响[J]. 畜牧与兽医,2010,42(12):34-37. ( 1) 1)
|
| [10] | 杨承剑.延胡索酸二钠对山羊瘤胃甲烷生成的调控研究及相关瘤胃微生物菌群分析[D]. 博士学位论文.南京:南京农业大学,2011. ( 1) 1)
|
| [11] | 张丽英.饲料分析及饲料质量检测技术[M]. 3版.北京:中国农业大学出版社,2007. ( 1) 1)
|
| [12] | 张军民,高振川,王连娣,等.谷氨酰胺对饲喂生大豆的仔猪抗氧化能力和肝、肠组织中γ-谷氨酰转肽酶活性的影响[J]. 中国农业科学,2003,36(5):567-572. ( 1) 1)
|
| [13] | 王新峰.绞股蓝皂甙对山羊瘤胃菌群及微生物发酵特性和甲烷产量的影响[D]. 博士学位论文.南京:南京农业大学,2009. ( 1) 1)
|
| [14] | 蔻慧娟.酵母培养物对羔羊生产性能、营养物质消化率及瘤胃发育的影响[D]. 硕士学位论文.西安:西北农林科技大学,2011. ( 1) 1)
|
| [15] | 毛胜勇.延胡索酸及其钠盐对瘤胃发酵特性及瘤胃细菌菌群的影响[D]. 博士学位论文.南京:南京农业大学,2006. ( 2) 2)
|
| [16] | 邹思湘.动物生物化学[M]. 4版.北京:中国农业出版社,2011. ( 1) 1)
|
| [17] | 代兵,邹思湘,陈够芬,等.谷氨酰胺对早期断奶仔猪生长性能及肠道形态发育的影响[J]. 畜牧与兽医,2011,43(11):7-11. ( 1) 1)
|
| [18] | SAMANYA M,YAMAUCHI K E.Histological alterations of intestinal villi in chickens fed dried Bacillus subtilis var.natto[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2002,133(1):95-104. ( 1) 1)
|
| [19] | 王书平,刘俊华.谷氨酰胺体内代谢过程及其调控机制[J]. 畜牧与饲料科学,2009,30(4):28-30. ( 1) 1)
|
| [20] | SOUBA W W.Intestinal glutamine metabolism and nutrition[J]. The Journal of Nutritional Biochemistry,1993,4(1):2-9. ( 1) 1)
|
| [21] | REEDS P J,BURRIN D G,JAHOOR F,et al.Enteral glutamate is almost completely metabolized in first pass by the gastrointestinal tract of infant pigs[J]. The American Journal of Physiology,1996,270(3 Pt 1):E413-E418. ( 1) 1)
|
| [22] | BUDDLE J R,BOLTON J R.The pathophysiology of diarrhea in pigs[J]. Pig News and Information,1992,13(1):41-45. ( 1) 1)
|
| [23] | 晏家友.缓释复合酸化剂对断奶仔猪消化道酸度及肠道形态和功能的影响[D]. 硕士学位论文.雅安:四川农业大学,2009. ( 1) 1)
|
| [24] | ANDERSON T A.Histological and cytological structure of the gastrointestinal tract of the luderick,Girella tricuspidata (pisces,kyphosidae),in relation to diet[J]. Journal of Morphology,1986,190(1):109-119. ( 1) 1)
|
| [25] | 张玉仙,王文利,陈耀星,等.不同浓度的大蒜溶液对小鼠小肠黏膜结构的影响[J]. 中国兽医杂志,2008,44(5):12-13. ( 1) 1)
|
| [26] | GREENWOOD R H,MORRILL J L,TITGEMEYER E C,et al.A new method of measuring diet abrasion and its effect on the development of the forestomach[J]. Journal of Dairy Science,1997,80(10):2534-2541. ( 1) 1)
|
| [27] | NOCEK J E,WILLIAM HEALD C,POLAN C E.Influence of ration physical form and nitrogen availability on ruminal morphology of growing bull calves[J]. Journal of Dairy Science,1984,67(2):334-343. ( 1) 1)
|
| [28] | LESMEISTER K E,TOZER P R,HEINRICHS A J.Development and analysis of a rumen tissue sampling procedure[J]. Journal of Dairy Science,2004,87(5):1336-1344. ( 1) 1)
|
| [29] | VELÁZQUES O C,LEDERER H M,RONBEAU J L.Butyrate and the colonocyte:implications for neoplasia[J]. Digestive Diseases and Sciences,1996,41(4):727-739. ( 1) 1)
|
| [30] | MCGAVIN M D,MORRILL J L.Scanning electron microscopy of ruminal papillae in calves fed various amounts and forms of roughage[J]. American Journal of Veterinary Research,1976,37(5):497-508. ( 1) 1)
|
小肠绒毛长度、隐窝深度、V/C等指标被认为是衡量小肠消化吸收功能的重要指标[18] ...
Buddle等[22]认为绒毛高度/隐窝深度的高低反映了肠道绒毛上皮细胞吸收功能和隐窝上皮细胞分泌功能 ...




