2. 深圳市慢性病防治中心分子生物学实验室, 深圳 518020
2. Molecular Biology Lab, Shenzhen Center for chronic Disease Control, Shenzhen 518020, China
硒(Se)是哺乳动物新陈代谢所必需的基本微量元素,其在动物的健康生长、繁殖等方面起着重要作用。Se在动物体内主要以硒蛋白的形式来发挥其多种生理功能,而硒蛋白又是一种特殊的蛋白质,它是Se以硒代半胱氨酸(selenocysteine,Sec)形式结合到蛋白质上的形成存在。Sec是第21种氨基酸,它由密码子UGA编码,而UGA在生物系统中是一终止密码子,其识别需要特殊的机制。将UGA识别为指导Sec合成的密码子,需要特殊因子的参与,如硒蛋白mRNA自身3′-非编码区(3′-UTR)的Sec插入稳定的茎-环结构硒代半胱氨酸插入序列(seleno cysteine insertion sequence,SECIS)[1, 2]。在人体中分离得到了25种硒蛋白[3],它们很多是作为细胞重要的抗氧化防御系统,起着清除氧自由基的作用,具有保护生物膜完整、解毒和增强机体免疫等功能[4]。硒蛋白P(SelP)是其中一种较为特殊的硒蛋白,它主要是由肝脏分泌到血浆中的一种含硒分泌性糖蛋白,人体血浆中约50%的Se是以SelP的形式存在[5]。高等哺乳动物中硒蛋白一般只有一个Sec残基,而SelP是目前在高等生物中发现的唯一含多个Sec残基的硒蛋白[6, 7]。SelP被认为在生物体内起转运和储存硒的作用[8]。
目前,虽然在人和鼠中已经通过试验探索了部分SelP的功能,但对SelP而言,在以人为模型的研究中由于不易获得有效的研究材料,使得其功能及其在代谢中的作用机理尚没有精确的科学阐明,其生物学功能也还有待于进一步的深入研究;猪与人类在营养代谢、生理结构和功能、基因同源性等方面具有较高的相似性,它已成为研究人类医学问题的一种理想模型。因此,以猪为模型研究SelP的生物学功能具有重要意义,然而猪中完整的硒蛋白P基因(Sepp1)序列还未见报道。本试验拟克隆猪Sepp1,对其基因序列进行生物信息学分析,并对其mRNA在猪不同组织中的分布情况进行分析,为进一步以猪为模型研究SelP的生物学功能奠定基础。
1 材料与方法 1.1 主要仪器设备Tetrad 2梯度PCR仪(Bio-Rad)、5804R台式高速冷冻离心机(Eppendorf)、Milli Q Plus超级纯水仪(Millipore)、凝胶成像系统GelDoc XR(Bio-Rad)、电泳仪及水平电泳槽(Bio-Rad)、Nanodrop2000微量核酸分析仪(Thermo)、7900HT荧光定量PCR仪(ABI),文中提及的其他设备、器械均为国产。
1.2 主要试剂、克隆菌株及质粒主要试剂:TRIzol Reagent购自Invitrogen公司;PrimeScriptTM逆转录试剂盒、TaqDNA聚合酶、DNA分子量标准均购自大连宝生物工程有限公司;One-step SYBR Green荧光定量试剂盒购自QIAGEN公司;引物由上海生工生物公司合成;DNA凝胶回收试剂盒、快速质粒小量提取试剂盒均购自OMEGA Bio-Tek公司。
克隆菌株及质粒:大肠杆菌(Escherichia coli)TOP10为本实验室保存,克隆载体pMD19-T购自大连宝生物工程有限公司。
1.3 Sepp1的克隆与分析通过NCBI GenBank数据库查询猪表达序列标签(expressed sequence tag,EST),获得1段疑似Sepp1的序列片段(GenBank登录号:CX065456.1),根据该片段设计Sepp1快速克隆的上游引物F1:ATCAACAAGAAGAAAACCAAACAGA,下游引物:3′-site adapter primer,采用cDNA末端快速克隆(3′-RACE)技术扩增含完整3′-端全长的Sepp1。采集新鲜“杜×长×大”(DLY)猪肝脏组织,采用TRIzol法提取总RNA,通过琼脂糖凝胶电泳和核酸测定仪检测其质量。以质量合格的总RNA为模板,以Oligo (dT)- 3′-site primer为引物,按逆转录试剂盒说明书操作合成第1链cDNA。然后以cDNA为模板,以F1和3′-site adapter primer引物对扩增获得含完整开放阅读框(ORF)至polyA的Sepp1序列。PCR反应条件为94 ℃变性5 min,35个循环(94 ℃ 30 s,57 ℃ 30 s,72 ℃ 2 min),然后72 ℃延伸10 min,4 ℃保存。对PCR产物进行1.5%的琼脂糖凝胶电泳,对目的片段进行胶回收(具体步骤按胶回收试剂盒说明书操作),然后将回收片段连接到pMD19-T载体上(具体步骤按克隆试剂盒说明书操作),转入TOP10感受态细胞,然后涂布含Amp的LB平板,37 ℃倒置培养过夜。通过PCR对转化子进行阳性鉴定,对阳性转化子进行划线纯化并摇菌,再送上海英骏生物技术有限公司测序。利用NCBI Blast、SCEISearch 2.18等在线分析软件对克隆的基因序列进行分析并与EST序列进行拼接,确认后提交NCBI GenBank。
1.4 Sepp1在猪不同组织中的相对表达量分析DLY公猪(体重约60 kg)6只,屠宰后新鲜收集肝脏、肾脏、肌肉、甲状腺、垂体、下丘脑、心脏、睾丸、脾脏等组织,切割成1 g左右大小,装入1.5 mL离心管中(无RNA酶,Axygen,USA),液氮中保存待测。采用TRIzol法提取总RNA,用于定量分析。采用ABI Primer Express 3.0软件设计定量引物对,Sepp1定量引物对为:AACCAGAAGCGCCAGACACT和TGCTGGCATATCTCAGTTCTCAGA,看家基因Actb定量引物对为:CCCAAAGCCAACCGTGAGAA和CCACGTACATGGCTGGGGTG。引物送上海生工生物公司合成。
采用QIAGENT公司One-step SYBR Green RT-PCR Kit进行一步法实时荧光定量分析(ABI 7900HT),荧光定量PCR反应体系为10 μL,包含5.0 μL 2×SYBR Green Mix (含RT-mix)、总RNA 100 ng、上及下游引物混合液各1 μL(2 μmol/L),每个样重复2次。RT-PCR反应条件为95 ℃变性30 s,48 ℃反转录40 min,40个循环(95 ℃ 5 s,60 ℃ 34 s),溶解曲线(95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s)。本试验采用ΔCt相对定量方法来对不同组织基因表达量进行分析,具体方法为:以看家基因Actb作为参比基因,每一个样品中,ΔCt值是目标基因和参比基因Ct值的差值(ΔCt=Cttarget-Ctreference),以肾脏组织中目标基因表达量为标准,假定其表达量为1,其ΔCt值定为ΔCtR,其他组织样品中目标基因ΔCt值减去ΔCtR值的差值即为ΔΔCt(ΔCt-ΔCtR),根据基因PCR扩增是2n扩增的原理,则目标基因在其组织样品中的相对表达量为2-ΔΔCt。数据以平均值±标准误表示。
2 结果与分析 2.1 Sepp1的克隆与分子生物学分析以猪肝脏总RNA为模板,反转录合成第1链cDNA,利用F1和3′-RACE的方法扩增获得了1条1 700 bp左右的目的条带(图1-A)。该片段经TA克隆到pMD19-T载体后,送上海英俊公司测序确定,然后与EST序列进行拼接,获得一段2 109 bp的cDNA序列,其含有完整的ORF和polyA结构,经分析确定其为猪Sepp1,然后提交NCBI GenBank数据库,序列号为:EF113596.2。Sepp1经SECISearch 2.18软件分析,具有典型的硒蛋白特有的3′-UTR SECIS发夹结构(图1-B)。经NCBI Blast比对分析该基因的ORF区长1 170 bp,编码390个氨基酸,含有14个Sec残基,分别位于第59、267、286、309、311、327、339、352、354、361、376、378、385和387位,其中大部分位于C端。人SelP(NP-005401)含10个Sec,小鼠SelP(AAA42129.2)含10个Sec,牛SelP(BAA84781.1)含12个Sec,这几个物种SelP的Sec大部分(90%以上)都分布在C-端[3, 6, 7]。采用SingalP 3.0 server在线软件(www.cbs.dtu.dk/services/singalP/)对猪SelP进行信号肽预测,结果显示其在21和22位氨基酸有可能的信号肽切割位点(图1-C)。猪Sepp1的ORF编码区与人、小鼠、牛Sepp1的ORF区的同源性分别为:83.72%、76.31%、87.02%。猪SelP的氨基酸序列与人、小鼠、牛SelP的氨基酸序列的同源性分别为:76.15%、68.70%、82.14%,序列比对见图2。
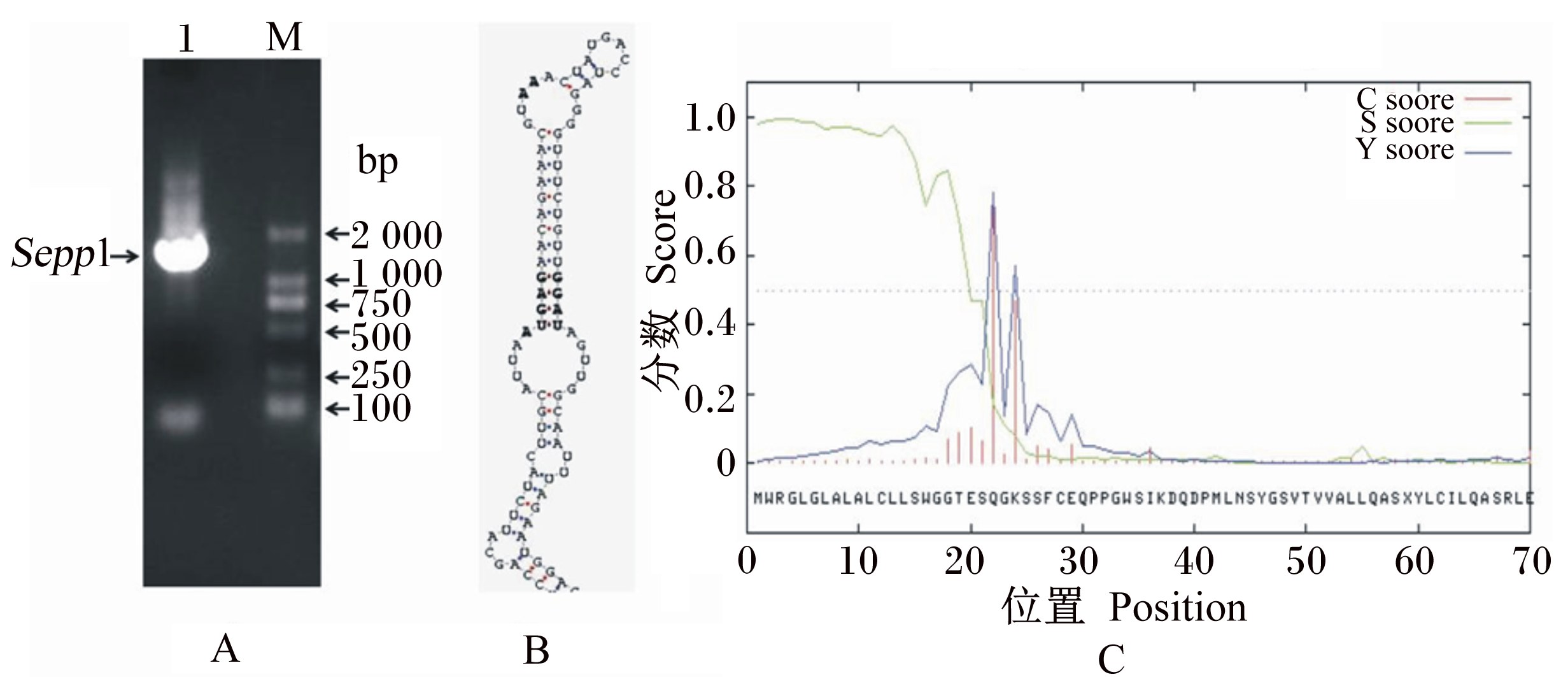 |
A. 猪Sepp1 RT⁃PCR 分析(M:DNA 分子量标准,1:PCR 扩增产物)。B. 猪Sepp1 3′⁃UTR SECIS 发夹结构分析。C.
SelP 蛋白信号肽预测。 A. RT⁃PCR analysis of porcine Sepp1 (M: DNA molecular weight marker, lane 1: RT⁃PCR product). B. SECIS hairpin structure analysis of 3′⁃UTR of Sepp1 of pig. C. Potential signal peptide predicted of SelP protein.图1 猪Sepp1的克隆及基因序列分析 Fig. 1 Cloning and gene sequence analysis of porcine Sepp1 |
采用RT-PCR对猪肝脏、肾脏、肌肉、甲状腺、垂体、下丘脑、心脏、睾丸、脾脏共9个组织进行了Sepp1的相对表达量分析,以肾脏组织的表达量为1,其他组织相对肾脏组织的相对表达量分析结果见图3。Sepp1在猪9个组织中均有mRNA表达,在肝脏中相对表达量最高,其次是甲状腺;在肝脏和甲状腺中的相对表达量均高于肾脏组织,分别是肾脏组织的6.8倍和1.7倍;在其余几个组织中的相对表达量均低于肾脏组织,在肌肉中的相对表达量最低,只有肾脏组织中相对表达量的0.01。Sepp1在猪9个组织中的相对表达量依次是肝脏>甲状腺>肾脏>睾丸>下丘脑>脾脏>垂体>心脏>肌肉。
 | 图2 猪、牛、人、小鼠SelP氨基酸序列比对 Fig. 2 Alignment of the amino acid sequence of SelP among cattle,human,mouse and pig |
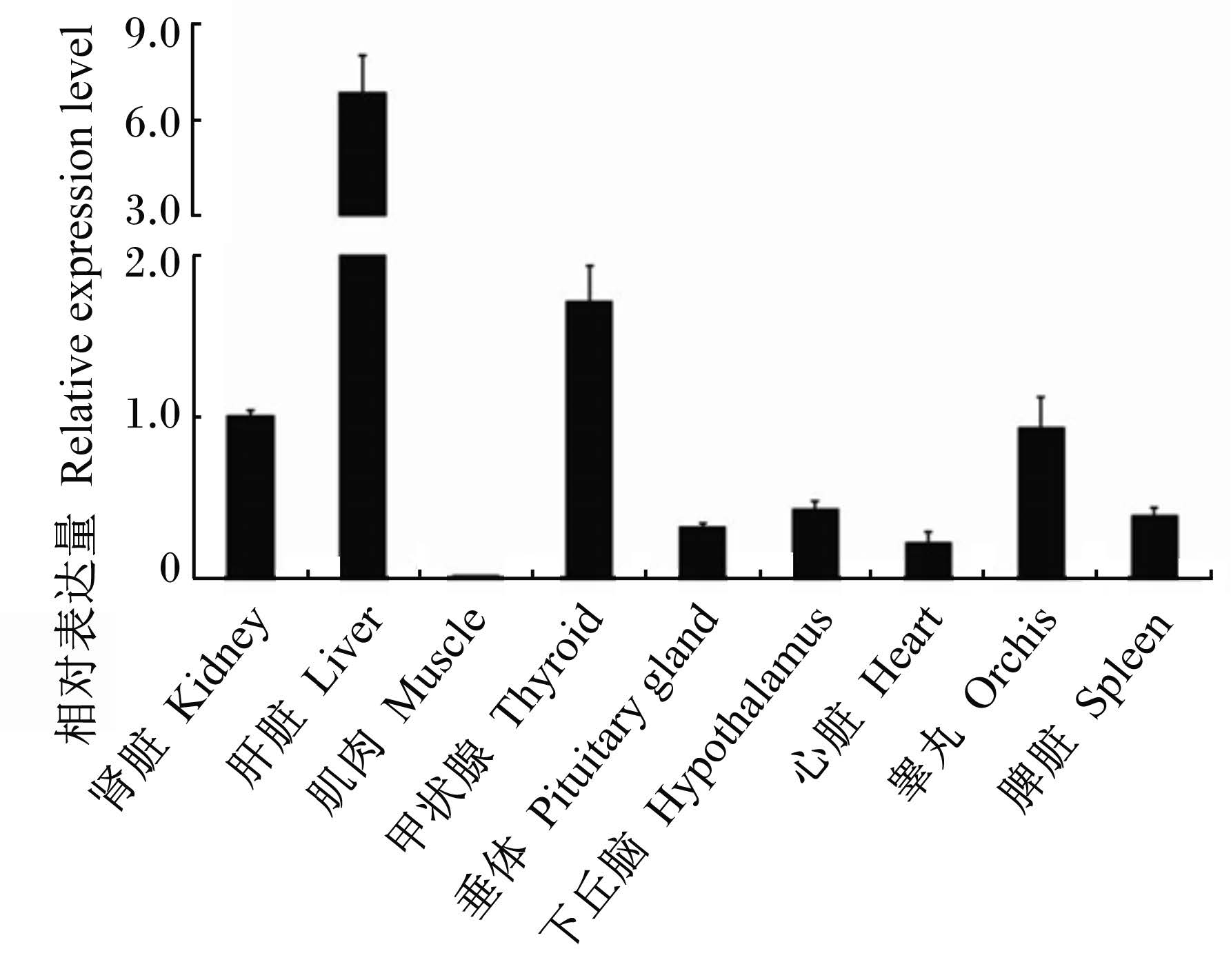 | 图3 猪Sepp1在猪不同组织中的相对表达量 Fig. 3 The relative expression level of Sepp1 in various tissues of pigs |
未知序列基因的克隆可根据其在不同物种间序列同源性比较,选择同源性较高的序列片段设计兼并引物,PCR扩增获得部分片段并测序分析,然后根据获得的部分基因片段信息,设计引物,采用5′-RACE和3′-RACE等方法,获得基因的完整序列。随着猪表达序列标签数据库等生物信息数据库的急剧丰富,利用在线生物信息学软件查询获得目标基因EST序列片段,特别是5′-EST序列信息,在此基础上设计引物,采用传统5′-RACE和3′-RACE等方法克隆获得基因片段并进行序列鉴定和分析,成为克隆猪硒蛋白基因的强有力手段。本试验采用传统PCR方法结合EST生物信息学分析等技术手段克隆并鉴定猪中的Sepp1,并将其提交NCBI GenBank数据库,序列号为:EF113596.2。分析猪Sepp1 CDS编码区和人Sepp1 CDS区有83.72%的同源性。经SECISearch 2.18软件分析,猪Sepp1具有硒蛋白基因特有的典型3′-UTR SECIS茎-环发夹结构。
硒蛋白是一种特殊蛋白质,是Sec以编码密码子UGA的形式掺入到合成的蛋白质中,即Sec合成进入蛋白质则是由密码子UGA介导的翻译行为,在没有特殊识别因子存在时,UGA是一个终止信号;而在有特殊识别因子时,该密码子则指导Sec合成掺入到蛋白质分子中,故Sec被认为是第21种氨基酸[9]。SelP的氨基酸序列中含有10~17个Sec残基[6, 7],人和小鼠的SelP含有10个Sec残基,牛的含12个Sec残基。本研究中对猪Sepp1编码的氨基酸序列进行分析,发现其含14个Sec残基。SelP是一种胞外糖蛋白,是血浆硒最主要的存在形式,占血浆总硒含量的50%(人)或60%(鼠)[5, 6]。采用SingalP 3.0 server在线软件(www.cbs.dtu.dk/services/singalP/)对猪SelP进行信号肽预测,发现其在21和22位氨基酸之间有可能的信号肽切割位点,说明该蛋白质为分泌性胞外蛋白。
硒蛋白的Sec是由UGA编码的,UGA有双重功能,既可以编码Sec,同时也可以起到终止密码子的作用,使蛋白质翻译终止,2种作用相互竞争[10]。猪SelP存在14个UGA编码的Sec,故理论上应该在任意一个Sec/UGA处翻译终止,产生多个亚型。已有报告发现大鼠SelP有至少4个亚型,蛋白质翻译在第2个、第4个、第7个和第10个Sec/UGA处终止产生的N端相同,C端不同的亚型[11]。人SelP至少也有2种亚型,分别是在第2个Sec处终止只含有1个Sec的小亚型和含有10个Sec的全长SelP[12]。Takahashi等[13]的研究发现,SelP不同亚型之间的功能不一样,仅含1个Sec的小亚型有还原氧化型的低密度脂蛋白,起抗动脉硬化的作用,而位于C端的9个Sec则起转运和储存硒的作用。猪SelP是否也具有多个亚型尚不清楚。
SelP是一种富Se蛋白,它能够结合肝素并通过肝素结合于细胞膜,被广泛认为有运输硒、抗氧化、结合重金属等功能[8, 14]。硒蛋白P主要表达部位是肝脏,但在其他组织部位也有表达[7],由肝脏产生的SelP分泌到血浆中,而由其他组织细胞产生的SelP则分泌到细胞间隙[15]。本研究也发现猪Sepp1的mRNA在肝脏中具有最高丰度,其次为甲状腺和肾脏。
4 结 论① 本试验成功克隆了猪Sepp1,并提交NCBI GenBank数据库,序列号为EF113596.2。
② 猪硒蛋白P为分泌性蛋白,其氨基酸序列中含有14个Sec残基,在21和22位氨基酸位点具有可能的信号肽切割位点。
③ RT-PCR结果显示,Sepp1在猪各种组织中均有表达,其中在肝脏中具有最高的mRNA分布,随后依次是甲状腺>肾脏>睾丸>下丘脑>脾脏>垂体>心脏>肌肉。
| [1] | LOW S C,BERRY M J.Knowing when not to stop:selenocysteine incorporation in eukaryotes[J]. Trends in Biochenmical Sciences,1996,21(6):203-208. ( 1) 1)
|
| [2] | BEHNE D,KYRIAKOPOULOS A.Mammalian selenium-containing proteins[J]. Annual Review of Nutrition,2001,21:453-473 ( 1) 1)
|
| [3] | KRYUKOV G V,CASTELLANO S,NOVOSELOV S V,et al.Characterization of mammalian selenoproteomes[J]. Science,2003,300(5624):1439-1443. ( 2) 2)
|
| [4] | MOGHADASZADEH B,BEGGS A H.Selenoproteins and their impact on human health through diverse physiological pathways[J]. Physiology(Bethesda),2006,21(5):307-315. ( 1) 1)
|
| [5] | SCHOMBURG L,SCHWEIZER U,HOLTMANN B,et al.Gene disruption discloses role of selenoprotein P in selenium delivery to target tissues[J]. The Biochemical Journal,2003,370(2):397-402. ( 2) 2)
|
| [6] | READ R,BELLEW T,YANG J G,et al.Selenium and amino acid composition of selenoprotein P,the major selenoprotein in rat serum[J]. Journal of Biological Chemistry,1990,265(29):17899-17905. ( 4) 4)
|
| [7] | SAIJOH K,SAITO N,LEE M J,et al.Molecular cloning of cDNA encoding a bovine selenoprotein P-like protein containing 12 selenocysteines and a (His-Pro) rich domain insertion,and its regional expression[J]. Molecular Brain Research,1995,30(2):301-311. ( 4) 4)
|
| [8] | FAIRWEATHER-TAIT S J,COLLINGS R,HURST R.Selenium bioavailability:current knowledge and future research requirements[J]. American Journal of Clinical Nutrition,2010,91(5):1484S-1491S. ( 2) 2)
|
| [9] | KVICALA J.Selenium and the organism[J]. Casopis Lekaru Ceskych,1999,138(4):99-106. ( 1) 1)
|
| [10] | GRUNDNER-CULEMANN E,MARTIN G W,TUJEBAJEVA R,et al.Interplay between termination and translation machinery in eukaryotic selenoprotein synthesis[J]. Journal of Molecular Biology,2001,310(4):699-707. ( 1) 1)
|
| [11] | MA S G,HILL K E,CAPRIOLI R M,et al.Mass spectrometric characterization of full-length rat selenoprotein P and three isoforms shortened at the C terminus[J]. Journal of Biological Chemistry,2002,277(15):12749-12754. ( 1) 1)
|
| [12] | ÅKESSON B,BELLEW T,BURK R F.Purification of selenoprotein P from human plasma[J]. Biochimica et Biophysica Acta:Protein Structure and Molecular Enzymology,1994,1204(2):243-249. ( 1) 1)
|
| [13] | TAKAHASHI K,SAITO Y.Structure and function of human selenoprotein P[J]. Seikagaku,2001,73(4):261-264 ( 1) 1)
|
| [14] | HILL K E,WU S,MOTLEY A K,et al.Production of selenoprotein P (Sepp1) by hepatocytes is central to selenium homeostasis[J]. Journal of Biological Chemistry,2012,287(48):40414-40424. ( 1) 1)
|
| [15] | KUROKAWA S,HILL K E,MCDONALD W H,et al.Long isoform mouse selenoprotein P (Sepp1) supplies rat myoblast L8 cells with selenium via endocytosis mediated by heparin binding properties and apolipoprotein E receptor-2 (apoER2)[J]. Journal of Biological Chemistry,2012,287(34):28717-28726. ( 1) 1)
|




