2. 北京市昌平区动物卫生监督管理局沙河防疫站, 北京 102206
2. Shahe Epidemic Prevention Station, Bureau of Animal Health Supervision of Changping District, Beijing 102206, China
断奶后仔猪由于自身系统发育不健全,再加上外界环境因素的变化,容易发生断奶应激。抗生素对应激造成的仔猪早期断奶综合征具有较好的疗效,但过多使用抗生素会导致肠道中细菌的耐药性增强,打破原有的肠道菌群平衡状态,最终会使仔猪产生严重腹泻甚至死亡。因此,寻求绿色环保型添加剂是解决抗生素产生负面影响的有效途径之一。目前,微生态制剂已广泛应用于仔猪饲粮中,对改善仔猪肠道微生态平衡和减缓早期断奶应激具有实用意义。益生菌是能够改善宿主肠道菌群结构并提高宿主健康水平和健康状态的活菌制剂及其代谢产物[1]。近年来有关饲粮中添加单一或复合益生菌对断奶仔猪生长发育影响的研究甚多,但研究结果并非一致。黄金华等[2]研究发现,饲粮中添加复合益生菌制剂能够显著提高断奶仔猪的生长性能、营养物质消化率和免疫功能。但De Moraes等[3]报道认为,饲粮中添加益生菌对断奶仔猪的生长性能无显著影响。董晓丽等[4]研究也发现,饲粮中添加复合益生菌制剂对断奶仔猪的生长性能无显著影响。造成结果差异的原因可能与益生菌菌株及其添加量、饲粮组成、仔猪断奶时间和饲养环境条件等因素不同有关。因此,进一步研究由植物乳杆菌、地衣芽孢杆菌和枯草芽孢杆菌组成的复合益生菌制剂对断奶仔猪生长性能的影响具有重要意义。纤维寡糖是由2~10个葡萄糖分子通过β-1,4糖苷键连接而成的寡糖,是纤维素降解过程的产物[5]。由于纤维寡糖结构中β-1,4糖苷键能作为肠道中有益菌(如双歧杆菌、乳酸杆菌)的碳源,而大肠杆菌和真杆菌对其不能利用或代谢利用率极低。因此,仔猪饲粮中添加纤维寡糖能够刺激仔猪大肠内双歧杆菌增殖,提高乳酸质量浓度,降低结肠部位pH,提高仔猪的生长性能。Otsuka等[6]报道证实,饲粮中添加纤维寡糖能够提高断奶仔猪的生长性能。目前,有关益生菌和纤维寡糖对仔猪生长性能影响的研究主要集中在饲粮中单独添加复合益生菌制剂或纤维寡糖,而有关两者组合使用对仔猪生长性能影响的研究报道甚少。鉴此,本试验研究饲粮中添加复合益生菌和纤维寡糖对断奶仔猪生长性能、粪便微生物及血清指标的影响,为绿色环保型添加剂在断奶仔猪养殖中的应用提供理论依据和实践参考。
1 材料与方法 1.1 试验材料本试验所用复合益生菌制剂,包含植物乳杆菌(≥1×108 CFU/g)、地衣芽孢杆菌(≥1×107 CFU/g)、枯草芽孢杆菌(≥1×107 CFU/g),由中国农业科学院饲料研究所提供。上述菌株分离于北京大兴区种猪场附近土壤中,经体外试验分析,均能抑制革兰氏阳性和革兰氏阴性病原菌的生长,并能抵抗低pH、胆盐,在模拟人工胃肠道环境中可生长,具备益生菌的潜质。
本试验所用纤维寡糖(纯度为98%),由中国农业科学院饲料研究所提供,其中纤维二糖、纤维三糖、纤维四糖的含量约占总糖的75%。纤维寡糖是选择苜蓿干草作为原料,加入β-葡聚糖酶后通过混酸降解法制备所得。由于动物胃肠道内没有可以降解β-1,4糖苷键的消化酶,因而纤维寡糖不被消化吸收而直接进入大肠内,为双歧杆菌所利用,具有肠道调节作用,可作为饲粮添加剂。
1.2 试验设计本试验采用单因素完全随机试验设计,选用(32±4)日龄初始平均体重为(9.72±2.25) kg的“长×大”杂交断奶仔猪120头,随机分为4组,每组3个重复,每个重复10头。4组分别饲喂基础饲粮(对照组,CON组)、基础饲粮+0.30%复合益生菌(A组)、基础饲粮+0.08%纤维寡糖(B组)、基础饲粮+0.30%复合益生菌+0.08%纤维寡糖(C组)。试验预试期4 d,正试期35 d,正试期分为第1阶段(1~14 d)和第2阶段(15~35 d)2个阶段。
1.3 试验饲粮与饲养管理试验仔猪基础饲粮为猪场实际配制饲粮,基础饲粮组成及营养水平见表1。所有试验仔猪于同一猪舍内,每个重复仔猪于同一栏内,采用自由采食和自由饮水方式饲养,室温保持在25 ℃左右,通风良好。每天清粪1次,每周消毒圈舍2~3次。免疫、驱虫等按照猪场常规管理进行。
| 表1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet(DM basis) |
分别于正试试验第1、14、35天早晨以栏为单位空腹称重,记录仔猪体重(body weight,BW),用于计算平均日增重(average daily gain,ADG);正试期每天以栏为单位记录饲粮投喂量,并于次日清晨投喂前称量剩料量,根据饲粮投喂量和剩料量计算平均日采食量(average daily feed intake,ADFI)。然后根据平均日增重和平均日采食量计算料重比(feed/gain,F/G)。计算方法:

每天观察记录所有试验仔猪的腹泻情况。每头仔猪腹泻1 d记为1个腹泻头次,试验结束后计算各组的腹泻率(diarrhea rate,DR)。

采用选择性培养基平板计数法,检测直肠粪便中微生物菌群数量[7]。于正试试验第14、35天早上每栏随机选取1头仔猪,取新鲜粪样,用低温保温盒带回实验室进行微生物培养计数。提前准备好营养琼脂平板、MRS平板、麦康凯琼脂平板,在无菌操作台内操作。称量1.0 g粪便样品于9 mL灭菌生理盐水中,配制成1 ∶ 10样品稀释液(即配制成10-1稀释液),用涡旋振荡器振荡3~5 min。再用微量移液枪准确吸取该稀释液1 mL放到盛有9 mL灭菌生理盐水的试管中,振荡1~2 min,配制成10-2稀释液,同法依次进行10-3~10-8稀释。
将10-2~10-4粪样稀释液涂布于营养肉汤固体培养基中,以计数粪样中芽孢杆菌数量;10-3~10-5稀释液涂布于麦康凯培养基中,以计数粪样中大肠杆菌数量;10-6~10-8稀释液涂布于MRS固体培养基中,以计数粪样中乳酸菌数量。大肠杆菌和芽孢杆菌在37 ℃恒温箱内有氧培养20 h,乳酸菌在37 ℃有氧培养36 h。每个稀释梯度做2个平行试验,最后取2次计数结果的平均值。粪便微生物数量用lg(CFU/g) (即每克粪样中菌落总数的对数)表示[8]。
1.4.4 血清生化指标及免疫指标于正试试验第35天,每栏随机选取1头仔猪于前腔静脉采血10 mL,3 000 r/min离心20 min,分离血清,并于-20 ℃保存,用于测定血清中总蛋白(total protein,TP)、白蛋白(albumin,ALB)、球蛋白(globulin,GLB)的含量和超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活性。TP含量测定方法为双缩脲法,ALB含量测定方法为溴甲酚绿法,SOD活性测定方法为邻苯三酚自氧化法,GSH-Px活性测定方法为化学比色法。测定仪器均为全自动生化分析仪。GLB含量为计算值,计算公式:

血清免疫指标包括血清免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白A(immunoglobulin A,IgA)和免疫球蛋白M(immunoglobulin M,IgM)的含量,测定方法为酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA),测定仪器为酶标仪,试剂盒由北京华英生物技术研究所提供,具体操作按试剂盒说明进行。
1.5 数据处理用Excel软件对试验数据进行初步处理,采用数据统计软件SAS 9.1的单因素方差分析(one-way ANOVA)和Duncan氏法进行差异显著性分析,P<0.05为差异显著。
2 结 果 2.1 复合益生菌和纤维寡糖对断奶仔猪生长性能的 影响如表2所示,各组试验仔猪初始平均体重差异不显著(P>0.05)。在试验1~14 d,各组试验仔猪的平均日采食量、日增重和料重比均无显著差异(P>0.05)。在试验15~35 d,C组试验仔猪的料重比显著低于对照组(P<0.05),平均日采食量、平均日增重比对照组分别提高11.92%、34.31%。在整个试验期(1~35 d),各组试验仔猪的平均日采食量、平均日增重和料重比差异均不显著(P>0.05);但C组试验仔猪的平均日采食量、平均日增重比对照组提高4.38%、13.76%,料重比比对照组降低9.09%。
| 表2 复合益生菌和纤维寡糖对断奶仔猪生长性能的影响 Table 2 Effects of dietary compound probiotics and fiber oligosaccharide on growth performance of weaned piglets |
如表3所示,试验第14、35天时,各组试验仔猪粪便中芽孢杆菌数、乳酸菌数和大肠杆菌数均无显著差异(P>0.05)。试验第14天时,A、B、C 组粪便中芽孢杆菌数分别比对照组提高0.19%、 4.59%、13.77%,而大肠杆菌数分别比对照组降低12.96%、13.29%、15.78%。试验第35天时,A、B组粪便中芽孢杆菌数分别比对照组提高6.95%、13.68%,A、B、C组粪便中大肠杆菌数分别比对照组降低13.05%、14.20%、16.89%。
| 表3 复合益生菌和纤维寡糖对断奶仔猪粪便微生物的影响 Table 3 Effects of dietary compound probiotics and fiber oligosaccharides on fecal microflora of weaned piglets |
如表4所示,在试验1~14 d,A、C组试验仔猪腹泻率显著低于对照组(P<0.05),分别比对照组降低了73.88%、67.28%,B组试验仔猪腹泻率比对照组降低40.90%,但差异不显著(P>0.05)。 在试验15~35 d,A、C组试验仔猪腹泻率分别比对照组降低49.62%和44.36%,但差异不显著(P>0.05)。整个试验期(1~35 d),A、B、C组试验仔猪腹泻率分别比对照组降低71.88%、13.89%、62.91%,但差异不显著(P>0.05)。
| 表4 复合益生菌和纤维寡糖对断奶仔猪腹泻率的影响 Table 4 Effects of dietary compound probiotics and fiber oligosaccharides on diarrhea rate of weaned piglets |
如图1所示,对照组试验仔猪腹泻率高于各试验组,其中A组腹泻率最低;断奶后1~7 d各组试验仔猪腹泻率均不同程度升高,7~19 d呈平稳下降趋势,19 d后,仔猪腹泻鲜有发生。
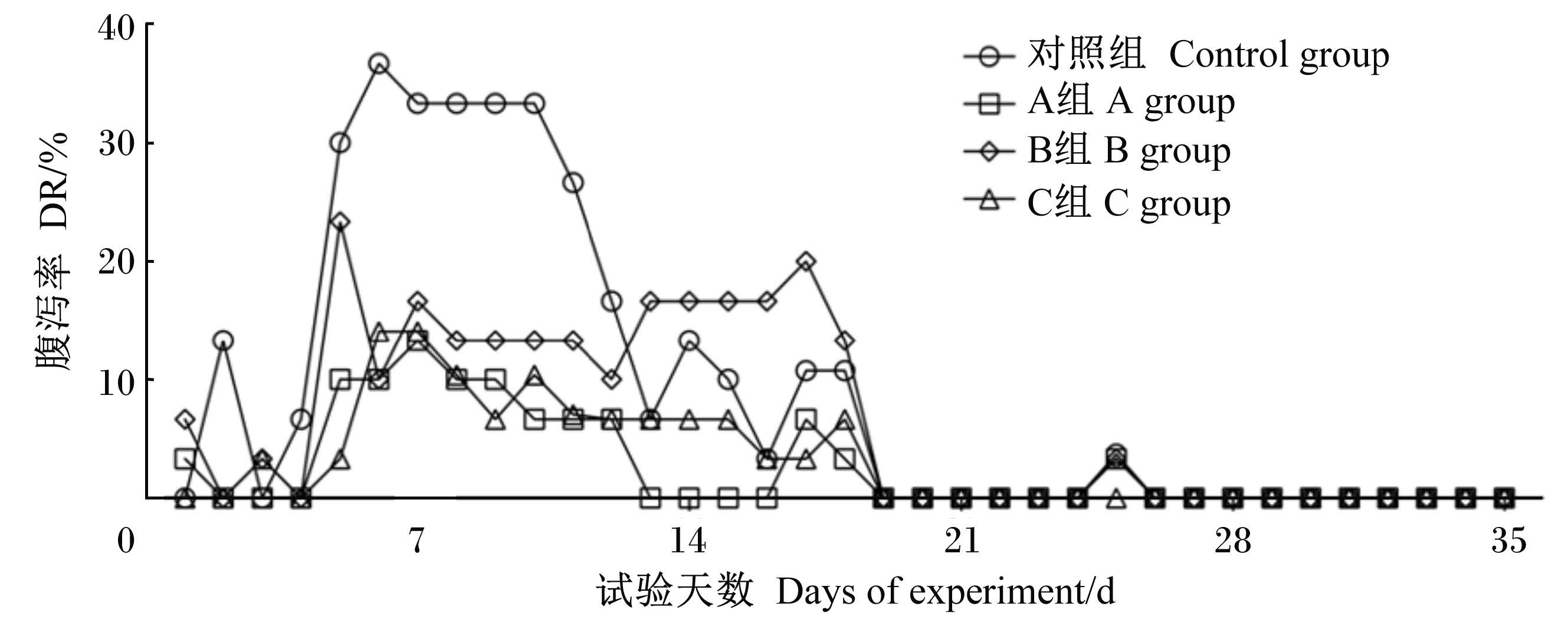 | 图1 各组仔猪腹泻率 Fig. 1 Diarrhea rate of weaned piglets in groups |
如表5所示,各组试验仔猪血清生化指标均无显著差异(P>0.05)。A、B、C组试验仔猪血清TP含量分别比对照组提高1.48%、8.37%、0.17%,ALB含量分别比对照组提高7.07%、16.72%、2.59%,ALB/GLB分别比对照组提高11.26%、16.90%、2.82%;B、C组SOD活性分别比对照组提高15.93%和2.29%,C组GSH-Px活性比对照组提高15.36%。
| 表5 复合益生菌和纤维寡糖对断奶仔猪血清生化指标的影响 Table 5 Effects of dietary compound probiotics and fiber oligosaccharides on serum biochemical parameters of weaned piglets |
如表6所示,各组试验仔猪血清免疫指标均无显著差异(P>0.05)。A、C组试验仔猪血清IgM含量分别比对照组提高4.00%、9.39%;A、B组的IgG含量分别比对照组提高0.46%和0.50%。
| 表6 复合益生菌和纤维寡糖对断奶仔猪血清免疫指标的影响 Table 6 Effects of dietary compound probiotics and fiber oligosaccharides on serum immune parameters of weaned piglets |
断奶应激使仔猪胃肠道微生物区系发生紊乱,最终导致仔猪的生长发育受到抑制。益生菌是一类含有活菌及其代谢产物的生物制剂,通过促进肠道有益菌的定植和优化肠道微生物区系,可有效缓解早期断奶应激引起的仔猪免疫功能下降[9]。纤维寡糖结构中的β-1,4糖苷键可作为肠道有益菌的碳源,肠道有益菌利用纤维寡糖提供的能量进行发酵,分解产生短链脂肪酸,降低肠道内pH,从而抑制肠道有害菌、致病菌的生长繁殖,最终提高猪的生长性能[10]。
目前,关于复合益生菌和纤维寡糖对断奶仔猪生长性能影响的报道结果不一。汪彬等[11]研究发现,饲粮中添加益生菌与寡糖可使断奶仔猪日增重、饲料利用率、采食量分别提高14.17%、8.88%、4.04%,同时使仔猪腹泻率降低42.56%。而史自涛等[12]报道认为,在试验1~14 d时,饲粮中添加粪肠球菌对断奶仔猪的平均日采食量、平均日增重和料重比均无显著影响;虞泽鹏等[13]研究认为饲粮中添加益生菌对断奶仔猪日增重和料重比均无显著影响;Jiao等[14]报道认为饲粮中添加纤维寡糖对断奶仔猪的生长性能并无显著影响。断奶后1~14 d是仔猪逐渐适应断奶的关键时期,也是仔猪肠道微生态区系最不稳定的时期,在这个时期使用益生菌制剂效果最好[15]。本试验1~14 d,各组试验仔猪的平均日采食量、平均日增重和料重比均无显著差异,与汪彬等[11]和Estienne等[15]报道结果不一致。其原因可能为断奶应激造成采食、饮水减少,引起小肠吸收功能下降,进而对仔猪的生长性能产生抑制作用[16];也可能为复合益生菌和纤维寡糖的添加量在仔猪断奶1~14 d时还不足以表现出益生作用;此外,仔猪断奶日龄和饲养管理等因素不同也可能造成试验结果不一致[17]。试验15~35 d,各组试验仔猪平均日采食量、平均日增重均与对照组无显著差异,但C组试验仔猪平均日采食量、平均日增重比对照组分别提高11.92%、34.31%,料重比显著低于对照组。方桂友等[18]报道指出,断奶仔猪饲粮中益生菌和低聚寡糖组合添加比单独添加促生长效果更明显。结果提示,在15~35 d时断奶仔猪胃肠道逐渐适应复合益生菌制剂和纤维寡糖的添加,单独添加或组合添加均对断奶仔猪的生长有促进作用,但复合益生菌制剂和纤维寡糖组合添加效果更好,具有协同互补作用。
3.2 复合益生菌和纤维寡糖对断奶仔猪粪便微生物和腹泻率的影响仔猪哺乳阶段肠道微生物区系保持动态平衡,而在断奶应激条件下肠道乳酸菌数减少,大肠杆菌数增加[19]。Bon等[20]报道认为,饲粮中添加酿酒酵母和乳酸片可显著减少粪便中大肠杆菌的数量,与侯璐[21]和Mallo等[22]研究结果相一致。此外,寡糖可促进动物肠道内有益菌群的增殖,改善肠道微生态环境[23, 24]。杨林[25]报道认为,寡聚果糖、寡聚异麦芽糖、寡聚甘露糖能极显著地促进仔猪肠道双歧杆菌、嗜酸乳杆菌的增殖,并显著抑制大肠埃希菌、葡糖球菌的生长。本试验结果认为,A、B、C组试验仔猪粪便中芽孢杆菌数均高于对照组(除35 d时C组外),而大肠杆菌数量均低于对照组,但差异均不显著。这表明添加益生菌和纤维寡糖对仔猪粪便中芽孢杆菌数、乳酸菌数和大肠杆菌数并未发生显著性改变,与前人研究结果不尽一致,原因可能与复合益生菌的种类、菌种数量、纤维寡糖与益生菌之间的相互作用等因素有关。
仔猪受到心理、饲粮和环境等应激时极易引起肠道微生物区系紊乱,导致有害菌大量繁殖,从而引起腹泻的发生。本试验研究结果认为,在整个试验期(1~35 d),A、B、C组试验仔猪腹泻率分别比对照组降低71.88%、13.89%、62.91%,而各组试验仔猪的平均日采食量、平均日增重和料重比差异较小。王学东等[26]研究表明,地衣芽孢杆菌在一定程度上降低了腹泻率,但在促生长方面并未表现出增长趋势,与董晓丽等[4]的研究结果相似。说明益生菌和寡糖等添加剂对改善猪肠道微生态和健康状况的作用比促生长作用更加明显。乳酸菌和大肠菌群被认为是指示肠道健康的主要菌群[27]。本试验结果表明,益生菌和寡糖的添加对仔猪粪便微生物菌群(芽孢杆菌、乳酸菌和大肠杆菌)无显著影响,但降低了仔猪的腹泻率。说明粪便微生物菌群作为衡量肠道微生物平衡和肠道健康的主要指标还有待于进一步研究确定。
3.3 复合益生菌和纤维寡糖对断奶仔猪血清指标的 影响血液是动物机体内环境的重要组成部分,机体营养物质代谢改变、组织器官机能变化和病理变化往往会引起血清生化指标的改变,所以对血液成分的检测有重要的临床意义[28, 29]。血清TP由血清ALB和血清GLB组成,其含量的高低主要反映动物肝脏蛋白质合成能力的强弱;血清ALB在肝脏的蛋白质代谢中起重要作用;血清GLB随血液中抗体水平的增加而增加,其含量的高低在一定程度上反映了动物的免疫水平及生理状况[30, 31, 32]。ALB/GLB能够衡量机体的免疫水平,比值降低表明GLB的合成增加,机体免疫功能提高。SOD是一种活性物质,它能消除动物机体在新陈代谢过程中产生的有害物质[33]。GSH-Px是动物机体普遍存在的过氧化物分解酶,它能保护细胞膜的结构和功能免受过氧化物的干扰和损害。本试验结果认为,各组试验仔猪血清TP、ALB、GLB含量和SOD、GSH-Px活性均无显著差异,但A、B、C组ALB/GLB均高于对照组,且B、C组SOD活性和C组GSH-Px活性均高于对照组。结果说明,断奶仔猪饲粮中添加复合益生菌制剂和纤维寡糖不仅有利于清除动物生长过程中产生的有害物质,还有助于提高机体的免疫功能,与其他研究结果相一致[34, 35, 36]。
血清免疫球蛋白是体液免疫系统的重要组成成分[37]。IgG是体液免疫反应中的主要抗体;IgM是免疫反应最初阶段产生的抗体;IgA是黏膜免疫的主要抗体,它具有在非特异性免疫防护机制协助下减少病原菌的重要功能[38]。本试验结果表明,A、B、C组仔猪血清IgM、IgG、IgA含量与对照组无显著差异。而游金明等[39]报道认为,丁酸钠与甘露寡糖对断奶仔猪免疫水平有促进作用,尤其以0.10%丁酸钠+0.10%甘露寡糖的组合效果最佳,与本试验结果不一致,原因可能是由于本试验复合益生菌和纤维寡糖的添加量未达到显著影响血清免疫指标的水平。但A、C组仔猪血清IgM含量分别比对照组提高4.00%、9.39%,A、B组仔猪血清IgG含量分别比对照组提高0.46%、0.50%,这可能与乳酸菌在肠道定植后充当免疫佐剂影响非特异性免疫应答和刺激特异性免疫反应有关[40, 41]。
本试验使用的复合益生菌和纤维寡糖均属于微生态制剂,作用是建立健康的肠道菌群平衡系统,进而提高动物的免疫功能,这是一个复杂的生物过程。微生态制剂的促生长作用可能需要一定的时间才能表达出来,可能在更大日龄的动物上才会表现出促进效果。
4 结 论本试验条件下,添加复合益生菌制剂和纤维寡糖对断奶仔猪的平均日采食量、平均日增重、粪便微生物菌群数量和血清指标均无显著影响,但可改善断奶仔猪断奶后1~14 d的腹泻情况,提高断奶仔猪断奶后15~35 d的饲料利用效率。
| [1] | 晏雪勇,杨群,周希平,等.浅谈益生素在动物生产上的应用与研究进展[J]. 江西饲料,2011(4):13-15. ( 1) 1)
|
| [2] | 黄金华,梁珠民,宁国信,等.复合益生菌制剂对断奶仔猪的生长性能、养分消化率和血清生化指标的影响[J]. 饲料工业,2014,35(12):27-31. ( 1) 1)
|
| [3] | DE MORAES K M C M T,BERTO D A,HAUPTLI L,etal.Probiotics for suckling and weaned piglets[J]. Veterinária E Zootecnia,2010,17(4):519-527. ( 1) 1)
|
| [4] | 董晓丽,张乃锋,周盟,等.复合菌制剂对断奶仔猪生长性能、粪便微生物和血清指标的影响[J]. 动物营养学报,2013,25(6):1285-1292. ( 2) 2)
|
| [5] | 郑建仙.功能性低聚糖[M]. 北京:化学工业出版社,2004:395. ( 1) 1)
|
| [6] | OTSUKA M,ISHIDA A,NAKAYAMA Y,et al.Dietary supplementation with cello-oligosaccharide improves growth performance in weanling pigs[J]. Animal Science Journal,2004,75(3):225-229. ( 1) 1)
|
| [7] | GIANG H H,VIET T Q,OGLE B,et al.Growthperformance,digestibility,gut environment and health status in weaned piglets fed a diet supplemented with potentially probiotic complexes of lactic acid bacteria[J]. Livestock Science,2010,129(1/2/3):95-103. ( 1) 1)
|
| [8] | LIU H,JI H F,ZHANG D Y,et al.Effects of Lactobacillus brevis preparation on growth performance,fecalmicroflora and serum profile in weaned pigs[J]. Livestock Science,2015,178:251-254. ( 1) 1)
|
| [9] | 张建梅,李晓颖,谢全喜,等.复合微生态制剂对断奶仔猪生产性能、粪便菌群及血液指标的影响[J]. 中国微生态学杂志,2012,24(9):796-800,804. ( 1) 1)
|
| [10] | HU Y L,DUN Y H,LI S A,et al.Effects of Bacillus subtilis KN-42 on growth performance,diarrhea and faecal bacterial flora of weaned piglets[J]. Asian-Australasian Journal of Animal Sciences,2014,27(8):1131-1140. ( 1) 1)
|
| [11] | 汪彬,李来梅,周映华,等.益生菌、寡糖和酶制剂对断奶仔猪生产性能的影响[J]. 湖南农业科学,2010(15):140-141,144. ( 2) 2)
|
| [12] | 史自涛,姚焰础,江山,等.粪肠球菌替代抗生素对断奶仔猪生长性能、腹泻率、血液生化指标和免疫器官的影响[J]. 动物营养学报,2015,27(6):1832-1840. ( 1) 1)
|
| [13] | 虞泽鹏,谢启轮,唐举,等.益生素对断奶仔猪生产性能的影响[J]. 动物科学与动物医学,2002,19(3):49-50. ( 1) 1)
|
| [14] | JIAO L F,KE Y L,XIAO K,et al.Effects of cello-oligosaccharide on intestinal microbiota and epithelial barrier function of weanling pigs[J]. Journal of Animal Science,2015,93(3):1157-1164. ( 1) 1)
|
| [15] | ESTIENNE M J,HARTSOCK T G,HARPER A F.Effects of antibiotics and probiotics on suckling pig and weaned pig performance[J]. International Journal of Applied Research in Veterinary Medicine,2005,3(4):303-308. ( 2) 2)
|
| [16] | 林彬彬.断奶应激对仔猪肌肉氨基酸及能量代谢的影响研究[D]. 硕士学位论文.长沙:湖南农业大学,2014. ( 1) 1)
|
| [17] | 朱海,谢书宇.仔猪日粮中添加益生菌制剂的应用效果[J]. 河南畜牧兽医:综合版,2013,34(10):10-13. ( 1) 1)
|
| [18] | 方桂友,刘景,邵良平,等.益生素和低聚木糖对仔猪生长性能和肠道菌群的影响[J]. 福建农业学报,2015(1):9-13. ( 1) 1)
|
| [19] | FULLER R.Probiotics in man and animals[J]. The Journal of Applied Bacteriology,1989,66(5):365-378. ( 1) 1)
|
| [20] | BON M L,DAVIES H E,GLYNM C,et al.Influence of probiotics on gut health in the weaned pig[J]. Livestock Science,2010,133(1/2/3):179-181. ( 1) 1)
|
| [21] | 侯璐.猪源粪肠球菌的特性及对仔猪生长性能和免疫力影响的研究[D]. 硕士学位论文.呼和浩特:内蒙古农业大学,2010:40-41. ( 1) 1)
|
| [22] | MALLO J J,RIOPEREZ J,HONRUBIA P.The addition of Enterococcus faecium to diet improves piglet's intestinal microbiota and performance[J]. Livestock Science,2010,133(1/2/3):176-178. ( 1) 1)
|
| [23] | YANG C M,FERKET P R,HONG Q H,et al.Effect of chito-oligosaccharide on growth performance,intestinal barrier function,intestinal morphology and cecalmicroflora in weaned pigs[J]. Journal of Animal Science,2012,90(8):2671-2676. ( 1) 1)
|
| [24] | HERFEL T M,JACOBI S K,LIN X,et al.Polydextrose enrichment of infant formula demonstrates prebiotic characteristics by altering intestinal microbiota,organic acid concentrations,and cytokine expression in suckling piglets[J]. The Journal of Nutrition,2011,141(12):2139-2145. ( 1) 1)
|
| [25] | 杨林.微生态制剂对仔猪肠道非特异性免疫防御机能的影响[D]. 硕士学位论文.哈尔滨:东北农业大学,2001. ( 1) 1)
|
| [26] | 王学东,呙于明,姚娟,等.芽孢杆菌在仔猪日粮中的应用效果初探[J]. 中国畜牧杂志,2008,44(21):46-48. ( 1) 1)
|
| [27] | CASTILLO M,MARTIN-ORŰE S M,MANZANILLA EG,et al.Quantification of total bacteria,enterobacteria and lactobacilli populations in pig digesta by real-time PCR[J]. Veterinary Microbiology,2006,114(1/2):165-170. ( 1) 1)
|
| [28] | WANG J P,YOO J S,KIM H J,et al.Nutrientdigestibility,blood profiles and fecal microbiota are influenced by chitooligosaccharide supplementation of growing pigs[J]. Livestock Science,2009,125(2/3):298-303. ( 1) 1)
|
| [29] | 汪文选,陈琛,卢彤岩,等.恩诺沙星对鲫鱼血液生理生化指标的影响[J]. 水产学杂志,2009,22(4):20-22. ( 1) 1)
|
| [30] | 王士长,陈静,潘健存,等.植物乳杆菌对断奶仔猪生产性能和血液生化指标的影响[J]. 中国畜牧兽医,2006,33(8):67-70. ( 1) 1)
|
| [31] | 余淼,严锦绣,彭忠利,等.微生物发酵饲料对肉牛免疫机能的影响[J]. 中国畜牧兽医,2013,40(4):114-117. ( 1) 1)
|
| [32] | 林谦,戴求仲,宾石玉,等.益生菌与酶制剂对黄羽肉鸡血液生化指标和免疫性能影响的协同效应研究[J]. 饲料工业,2012,33(14):31-36. ( 1) 1)
|
| [33] | 张海燕,姚树欣.自由基新说[J]. 中学生物学,2010,26(9):6-8. ( 1) 1)
|
| [34] | 王娟娟,王顺喜,陆文清,等.无抗生素微生物发酵饲料对仔猪免疫及抗氧化功能的影响[J]. 中国饲料,2011(16):25-27,30. ( 1) 1)
|
| [35] | ŠPERANDA,ŠPERANDA M,DIDARA T,et al.Mannanoligosaccharides raise immune response in weaned piglets[C]//Feed quality and safety: technology, traceability and labeling.Hrvatska znanstvena bibliografija i MZOS-Svibor,2011.( 1) 1)
|
| [36] | 柳成刚,王晓丽,姜德友,等.肝达康对DMN致大鼠肝损伤血清ALT、AST、TBIL、TP及ALB的影响[J]. 中医药信息,2012,29(4):74-76. ( 1) 1)
|
| [37] | WILSON M R,VAN RAVENSTEIN E,MILLER N W,et al.cDNA sequences and organization of IgM heavy chain genes in two holostean fish[J]. Developmental &Comparative Immunology,1995,19(2):153-164. ( 1) 1)
|
| [38] | SUN P,WANG J Q,ZHANG H T.Effects of Bacillus subtilisnatto on performance and immune function of preweaning calves[J]. Journal of Dairy Science,2010,93(12):5851-5855. ( 1) 1)
|
| [39] | 游金明,付建福,王自蕊,等.丁酸钠和甘露寡糖对断奶仔猪生长性能和免疫功能的影响及其互作效应研究[C]//中国畜牧兽医学会养猪分会2009年学术年会暨四届四次常务理事扩大会论文集.合肥:中国畜牧兽医学会,2009:145-153. ( 1) 1)
|
| [40] | 杨静,唐志如.乳酸菌的益生作用机制及其在仔猪生产中的应用[J]. 饲料研究,2012(12):20-22. ( 1) 1)
|
| [41] | GALDEANO C M,DE MORENO DE LEBLANC A,VINDEROLA G,et al.Proposedmodel:mechanisms of immunomodulation induced by probiotic bacteria[J]. Clinical and Vaccine Immunology,2007,14(5):485-492. ( 1) 1)
|




