2. 甘肃农业大学动物科学技术学院, 兰州 730070;
3. 内蒙古农业大学动物科学学院, 呼和浩特 010018
2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China;
3. College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China
对于包括哺乳动物在内的多细胞真核生物,局部环境中的可利用营养物质是细胞生存的主要决定因素,它们通过细胞内多种信号通路被感知,整合进入细胞的合成代谢程序,支持细胞生长和增殖。在多变的环境下,动物通过营养物质感知机制、生长因子调控机制以及激素网络调控系统,调控自身生长发育[1]。
乳腺作为维持哺乳动物生命活动重要的生物工厂,可摄取流经血液中多种小分子营养物质,如葡萄糖、氨基酸,经转运蛋白输入乳腺细胞内,作为乳成分合成前体物合成乳糖、乳脂、乳蛋白等重要乳成分[2]。乳腺是奶牛泌乳期间对氨基酸净利用率最高的组织[3],它可利用摄入的氨基酸为底物,以乳蛋白基因为模板合成组织中90%以上的乳蛋白,如酪蛋白、β-乳球蛋白、α-乳清蛋白[4]。近年来的研究证实,氨基酸不仅是乳蛋白合成最为重要的前体物质,还可以作为一种信号分子,通过乳腺细胞内多种信号级联传导通路[5],调控乳蛋白基因的转录及翻译进程,在转录和翻译2个水平上共同影响乳蛋白合成,其中作用最显著的是酪氨酸蛋白激酶-信号转导子和转录激活子(Janus kinase-signal transducer and activator of transcription,JAK-STAT)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路(图 1)。
1 JAK-STAT通路酪氨酸蛋白激酶(Janus kinase,JAK)是一类与细胞因子受体相连的非受体型胞质酪氨酸蛋白激酶。在哺乳动物中,该家族由Jak1、Jak2、Jak3、Tyk2组成,它们都具有相似的JAK同源结构域(JAK homology domain,JH),主要包括作为激酶区的JH1,具有抑制活性的假激酶区JH2、受体结合区JH6和JH7等[6]。在研究促红细胞生成素受体所介导的信号转导通路时发现,JAK的作用底物中有一类相关基因的转录调节因子——信号转导子和转录激活子(signal transducer and activator of transcription,STAT),在细胞信号级联转导及基因转录激活过程中起关键作用;STAT1、STAT2、STAT3、STAT4、STAT5(STAT5a及STAT5b)、STAT6组成了哺乳动物STAT家族[7]。STAT蛋白一般包括一个对其活化重要的酪氨酸残基、与细胞因子受体结合的SH2结构域、与DNA结合的结构域、转录激活区等重要功能区段[7]。
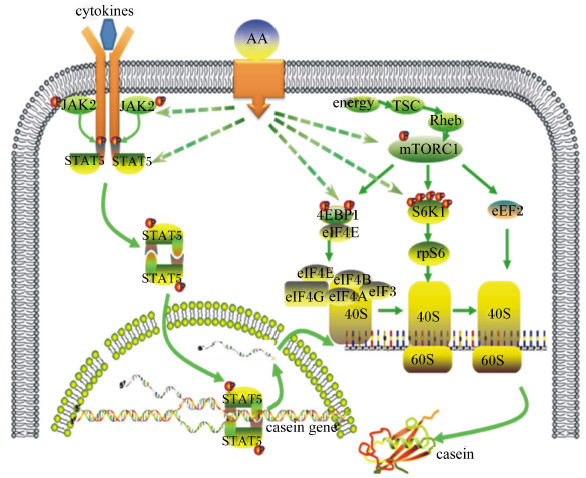 | cytokines:细胞因子;JAK2:酪氨酸蛋白激酶2 Janus kinase 2;STAT5:信号转导子和转录激活子5 signal transducer and activator of transcription 5;AA:氨基酸amino acid;casein gene:酪蛋白基因;casein:酪蛋白;energy:能量;TSC:结节性硬化复合物tuberous sclerosis complex;Rheb:脑内富含的小G 蛋白Ras 同系物Ras homolog enriched in brain;mTORC1:哺乳动物雷帕霉素靶蛋白复合物1 mammalian target of rapamycin complex 1;4EBP1:真核翻译起始因子4E 结合蛋白1 eukaryotic translation initiation factor 4E binding protein;eIF4E:真核翻译起始因子4E eukaryotic translation initiation factor 4E;eIF4G:真核翻译起始因子4G eukaryotic translation initiation factor 4G;eIF4A:真核翻译起始因子4A eukaryotic translation initiation fac-tor 4A;eIF4B:真核翻译起始因子4B eukaryotic translation initiation factor 4B;eIF3:真核翻译起始因子3 eukaryotic translation initiation factor 3;S6K1:核糖体蛋白S6 激酶1 ribosomal protein S6 kinase 1;rpS6:核糖体蛋白S6 ribosomal protein S6;eEF2 真核延伸因子2 eukaryotic elongation factor 2;40S:核糖体40S 小亚基;60S:核糖体60S 大亚基。 图1 氨基酸通过JAK-STAT及mTOR信号通路调节乳蛋白合成 Fig. 1 Regulation of milk protein synthesis by amino acids through JAK-STAT and mTOR signaling pathway |
该通路可以被诸如白介素、干扰素、促红细胞生成素以及催乳素、生长激素等超过50种的细胞因子、生长因子活化[8, 9, 10],介导多种细胞外信号从细胞膜到细胞核传递的级联反应,从而调控核内特定基因的转录,在细胞增殖、分化、迁移、凋亡等过程中都具有重要的调节作用[9](图 1)。其具体作用机制为:信号传导开始于细胞外细胞因子或生长因子与相应的跨膜受体的结合,促使与受体相连的JAK被反式激活:使得JAK空间上相互接近并发生构象改变,使它们的激酶区疏远具有抑制活性的假激酶区;被激活的JAK反过来进一步磷酸化“潜伏”的STAT单体分子,这导致STAT分子的二聚化,并经核转运进入细胞核,与特异DNA序列结合。这些序列有一部分位于转录起始位点附近,但更多的是位于起始位点远端,与一些增强子或者其他的顺式作用元件有关联的序列,较典型的是γ干扰素激活位点(IFN-γ activation site,GAS),STAT二聚体与相应位点的结合可调控核内相应特异基因的转录[9](图 1)。
2 氨基酸通过乳腺JAK2-STAT5通路影响乳蛋白基因转录研究表明,在乳腺中对乳蛋白合成起到重要作用的主要是JAK2和STAT5,以及两者共同构成的信号级联反应通路。体内试验表明:敲除小鼠STAT5a基因,小鼠乳腺腺泡发育不良,第1次妊娠后不泌乳;且STAT5b蛋白浓度降低,酪氨酸磷酸化作用减弱;敲除小鼠STAT5b基因,小鼠乳腺腺泡发育能力也有所降低[11]。JAK2和STAT5基因对于维持妊娠期小鼠乳腺上皮细胞的增殖和分化是必需的[12],缺失JAK2基因的小鼠,分娩时不能形成乳腺分泌腺泡而且由激素处理诱导的乳腺上皮细胞增殖量减少了95%[2]。转基因动物的体内试验表明,β-乳球蛋白基因和乳清酸性蛋白基因中启动子附近含有STAT5的结合位点GAS特异序列,是促进这些乳蛋白分泌所必需的位点[11, 12, 13]。在体外培养奶牛乳腺组织时发现,催乳素可以通过激活STAT5,从而激活β-酪蛋白基因(CSN2)中含有GAS元件的启动子序列,促进β-酪蛋白基因转录[14]。抑制奶牛乳腺上皮细胞STAT5a基因的表达,可降低细胞内β-酪蛋白基因mRNA丰度,STAT5a基因的过表达可提高β-酪蛋白基因mRNA丰度[15]。另外在小鼠乳腺中研究表明,催乳素通过激活JAK2,继而磷酸化STAT5,激活的STAT5可促进多种乳蛋白基因转录,并最终提高乳蛋白分泌量[16]。同时,生长激素及其他泌乳相关因子如胰岛素样生长因子,对奶牛乳腺乳蛋白基因的表达也有类似的作用机制[17]。
近年来,在研究氨基酸影响乳蛋白合成的分子机理时发现,多种氨基酸可通过影响JAK-STAT通路中主要信号分子(JAK2、STAT5)的基因转录水平,调控乳蛋白基因转录,进而影响乳蛋白合成(图 1)。
早期在研究亮氨酸补给对哺乳动物蛋白质合成的影响时发现,给大鼠灌注亮氨酸可以提高骨骼肌蛋白的合成量[18],以不同剂量给泌乳期荷斯坦奶牛十二指肠灌输亮氨酸时,发现40 g/d剂量组显著提高乳中乳蛋白含量,但不添加及低于或高于此添加量的试验组,乳蛋白含量均显著下降。在研究亮氨酸对奶牛乳腺上皮细胞酪蛋白合成的影响及机理时发现,当培养基中添加0.9 mmol/L亮氨酸时可显著提高κ-酪蛋白(CSN3)基因mRNA水平,低于或高于此浓度,这种效果均减弱;不同处理下细胞内JAK2、STAT5基因的mRNA水平变化趋势与酪蛋白基因相似,且均在0.9 mmol/L时达到最大[19]。此外,体内研究表明奶山羊乳腺从血液中摄取的精氨酸的量,远高于所分泌的乳蛋白中精氨酸的含量[20]。随后在体外研究精氨酸对奶牛乳腺上皮细胞泌乳能力的影响时发现,不改变培养基中其他氨基酸含量,仅分别添加0、69.5、139、278 mg/L精氨酸时,随着添加量的增加,细胞内αs2-酪蛋白(CSN1S2)、κ-酪蛋白基因的mRNA丰度有升高的趋势,高浓度添加组(556、1 112、2 224 mg/L),随添加量增大,αs2-酪蛋白、κ-酪蛋白基因mRNA丰度有降低的趋势;当添加556 mg/L时2种酪蛋白合成量均达到最大值,显著高于其他各组;所有精氨酸添加组与未添加组相比均显著上调了乳腺上皮细胞JAK2、STAT5基因的mRNA丰度,且存在随精氨酸浓度增加先升高后降低的趋势,同样在556 mg/L精氨酸添加组达到峰值,说明精氨酸能够通过影响JAK2-STAT5通路调控乳蛋白基因转录[21]。赖氨酸和蛋氨酸被认为是饲喂以秸秆为主要粗料来源的饲粮时奶牛的主要限制性氨基酸[2]。Nan等[22]在研究赖氨酸与蛋氨酸的不同配比对奶牛乳腺上皮细胞乳蛋白合成的影响时指出:赖氨酸、蛋氨酸对奶牛乳腺上皮细胞乳蛋白合成能力的影响同样具有剂量依赖性,随培养基中赖氨酸、蛋氨酸浓度的增加,细胞总酪蛋白分泌量均表现先增加后降低的趋势,分别在以1.2、0.5 mmol/L浓度添加时效果最佳;当分别以2种氨基酸的最佳作用浓度处理细胞时,细胞αs1-酪蛋白(CSN1S1)、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白、JAK2、STAT5基因mRNA水平均显著高于未添加组;随后作者以筛选出的2种氨基酸最佳浓度配比(赖氨酸∶蛋氨酸=3∶1)处理细胞,与对照组相比同样显著促进了JAK2、STAT5基因的转录。Nan等[22]由此认为赖氨酸和蛋氨酸对奶牛泌乳的影响,与JAK2-STAT5通路密切相关。王立娜[15]研究表明氨基酸与STAT5a基因互作共同对奶牛乳腺上皮细胞泌乳发挥调节作用,最佳浓度配比氨基酸能够显著促进JAK2、STAT5a基因转录,显著提高总STAT5a、磷酸化STAT5a蛋白水平,并最终显著提高β-酪蛋白基因转录水平和β-酪蛋白分泌量。还有研究表明以蛋氨酸-蛋氨酸形成的寡肽替代培养基中15%的自由蛋氨酸后,可显著提高所培养的乳腺组织αs1-酪蛋白基因mRNA表达水平及αs1-酪蛋白的合成量,同时使得细胞对培养基中蛋氨酸的吸收量显著增加,且JAK2、STAT5基因的mRNA水平与未替换组相比显著提高,作者认为蛋氨酸寡肽可通过促进细胞内底物的可利用性以及激活乳腺JAK2-STAT5通路促进酪蛋白的合成[23]。除此之外,有报道称氨基酸还可能通过与其他催乳激素的相互作用,共同作用于乳腺JAK2-STAT5通路,调控乳蛋白合成[24]。
3 mTOR信号通路哺乳动物细胞生存环境中生长因子、能量状态、环境压力、氨基酸供应等因素的改变均可调控细胞内mTOR活性,它通常以所组成蛋白磷酸化的形式被激活,然后通过促进下游的多条并行效应通路,促进诸如蛋白质翻译等的合成代谢过程按序进行,并抑制如自噬等的分解代谢,从而避免不对等的合成和降解活动所造成的无效循环,以此调节细胞生长和新陈代谢[1]。mTOR是一个非典型的丝氨酸/苏氨酸激酶,可分别与多种蛋白质组成2个复合物,即mTOR复合物1[含有DEP结构域的mTOR相互作用蛋白(mTOR complex 1,mTORC1)和mTOR复合物2(mTOR complex 2,mTORC2)。mTORC1由支架亚基mTOR调控关联蛋白(regulatory-associated protein of mTOR,raptor)、正向调节蛋白LST8类似物(mammalian ortholog of LST8,mLST8)、2个内源的激酶抑制剂[含有DEP结构域的mTOR相互作用蛋白(DEP-domain-containing mTOR-interacting protein,DEPTOR)和40ku富含脯氨酸的AKT底物(proline-rich AKT substrate 40 ku,PRAS40)]组成[1]。
mTORC1可被脑内富含的小G蛋白Ras同系物(Ras homolog enriched in brain,Rheb)调控[25],Rheb存在于溶酶体表面[26],是mTORC1激酶活性的有效刺激物,可使mTORC1复合物特定位点上的丝氨酸或苏氨酸发生磷酸化,从而被激活。Rheb反过来又被结节性硬化复合物(tuberous sclerosis complex,TSC)负调控,TSC是由TSC1、TSC2及TBC1D7组成的异源三聚体复合物[27]。TSC中的TSC2组件是Rheb的GTP酶活化蛋白,可以使Rheb从活化的GTP结合状态改变成失活的GDP结合状态;TSC复合物在mTORC1上游发挥中央集线器的作用,向细胞内输入包括细胞分裂信号和生长因子、能量水平、氧气可得性、基因毒性压力等信号,它们都可以通过调节TSC复合物的活性共同地影响mTORC1信号通路[1](图 1)。最近的研究表明存在多种上游分子介导氨基酸对mTOR复合物发挥作用,包括SLC38A9、亮氨酰tRNA合成酶、调节子(Ragulator)、Rag GTP酶(Rag GTPase)、GATOR等[25, 26, 27, 28],现处于进一步的研究中。
在研究氨基酸对骨骼肌蛋白合成的效应时发现,氨基酸可刺激大鼠、新生婴儿骨骼肌蛋白的合成,其中作用最突出的就是亮氨酸[28],并且发现该过程是通过mTORC1调节肌蛋白翻译进程实现的[28]。具体机制为:mTORC1复合物被氨基酸激活后主要通过调节包括真核起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein,4EBP1)、核糖体蛋白S6激酶1(ribosomal protein S6 kinase,S6K1)、真核细胞延伸因子2(eukaryotic elongation factor 2,eEF2)等在内的翻译调控因子的磷酸化状态而发挥作用,4EBP1被激活后会释放真核起始因子4E(eukaryotic translation initiation factor 4E,eIF4E)。eIF4E一旦被释放,就会与真核起始因子4G(eukaryotic translation initiation factor 4G,eIF4G),真核起始因子4A(eukaryotic translation initiation factor 4A,eIF4A)及真核起始因子4B(eukaryotic translation initiation factor 4B,eIF4B)形成eIF4F复合物,该复合物会绑定40S核糖体亚基形成43S前体起始复合物,从而起始翻译进程;同时被mTOR磷酸化激活的S6K1反过来磷酸化核糖体蛋白S6(ribosomal protein S6,rpS6),增强rpS6的活动(rpS6是40S复合物的一部分,rpS6活动的增强也会促进40S复合物的活动),并抑制真核生物延伸因子2激酶(eEF2 kinase,eEF2K)活动,阻止eEF2K对eEF2的抑制,进而调节mRNA的翻译进程[24]。
4 氨基酸通过乳腺mTOR通路影响乳蛋白基因转录后翻译过程体内研究表明,mTOR信号通路在奶牛乳蛋白合成翻译过程的起始及延伸阶段均发挥不可替代的作用,并受到氨基酸供给水平的影响:Doepel等[3]称给奶牛皱胃灌输全部必需氨基酸提高了乳产量和乳蛋白产量;Rius等[29]给泌乳期奶牛静脉灌注亮氨酸后,促进了乳腺mTOR、S6K1的磷酸化和乳蛋白的合成;对从孕期到泌乳全期奶牛乳腺的生理变化跟踪研究表明:与孕期相比,泌乳期乳腺氨基酸运载体基因的转录水平显著上调,特别是一些转运必需氨基酸的载体;同时作为奶牛乳腺编码mTOR的基因——FRAP1在整个泌乳期间的表达变化与乳蛋白的分泌曲线相符[24];与妊娠期奶牛乳腺相比,泌乳期乳腺mTOR及其下游eIF4E的表达量显著提高,且在整个泌乳期,核糖体40S、60S亚基mRNA的水平和eEF2基因mRNA水平、蛋白合成量都是上调的[24]。
体外研究氨基酸调控奶牛乳腺上皮细胞泌乳机理时发现,多种氨基酸均可以通过调控mTOR通路主要信号分子(mTOR、4EBP1、S6K1、eEF2)的基因转录水平及蛋白磷酸化水平(图 1),影响乳蛋白合成,且不同的氨基酸类型、不同的氨基酸浓度、不同的氨基酸配比之间存在差异:高海娜等[30]研究表明:添加不同浓度亮氨酸或组氨酸培养奶牛乳腺上皮细胞时,乳蛋白基因及mTOR通路相关基因转录水平存在差异,与空白对照组相比,分别添加0.45~10.80 mmol/L亮氨酸及0.15~4.80 mmol/L组氨酸6 h时,αs1-酪蛋白、κ-酪蛋白基因mRNA丰度均被显著上调;不同亮氨酸及组氨酸添加浓度对mTOR、raptor、GβL、rpS6、4EBP1基因mRNA丰度影响不同;亮氨酸添加浓度为0.45~5.40 mmol/L时,mTOR、raptor、GβL基因mRNA丰度显著高于未添加组,且均在1.35 mmol/L时达到峰值;与阴性对照组相比,raptor、GβL、4EBP1、eEF2、eIF4E和rpS6基因mRNA丰度随着组氨酸浓度(0.15~9.60 mmol/L)的增加而有增加的趋势;添加0.45~10.80 mmol/L亮氨酸显著促进奶牛乳腺上皮细胞总酪蛋白分泌量及mTOR(Ser2 481)、raptor(Ser792)、eEF2(Thr56)、eIF4E(Ser209)磷酸化水平,添加0.15~9.60 mmol/L组氨酸显著促进αs2-酪蛋白、β-酪蛋白、κ-酪蛋白分泌量及mTOR(Ser2 481)、raptor(Ser792)、S6K1(Thr389)、4EBP1(Thr37)、eEF2(Thr56)、eIF4E(Ser209)磷酸化水平[31]。Appuhamy等[32]研究表明,去除奶牛乳腺上皮细胞、乳腺组织切片培养基中的全部必需氨基酸后,细胞及组织mTOR(Ser2 448)、S6K1(Thr389)、4EBP1(Thr37/46)磷酸化水平均显著降低,eEF2(Thr56)磷酸化水平显著增加,mTOR、S6K1、4EBP1磷酸化水平与乳腺组织蛋白质合成率呈正相关,可利用必需氨基酸通过翻译起始和延伸的关键控制点调控乳腺蛋白质合成。Appuhamy等[33]随后又证实了亮氨酸和异亮氨酸可促进体外培养的奶牛乳腺组织、乳腺上皮细胞mTORC1的磷酸化激活,进而促进S6K1和4EBP1的磷酸化激活,从而提高乳腺组织及乳腺上皮细胞乳蛋白合成率;当培养基中不含亮氨酸和异亮氨酸时,所培养乳腺组织分别少合成了59%和61%的乳蛋白,同时mTOR的磷酸化水平均下降了40%以上;而添加mTOR上游通路抑制剂后,显著降低了奶牛乳腺上皮细胞S6K1的磷酸化水平,同时乳蛋白分泌量减少[34]。Nan等[22]在研究赖氨酸与蛋氨酸的不同配比对乳腺上皮细胞合成乳蛋白的影响时指出:当以促进酪蛋白合成的最适浓度赖氨酸(1.2 mmol/L)和蛋氨酸(0.5 mmol/L)处理细胞时,mTOR基因的mRNA丰度显著高于空白对照组,对S6K1基因mRNA丰度影响并不显著,但显著降低了4EBP1基因mRNA表达量;两者以不同比例混合时,对酪蛋白合成的影响不同,存在最佳浓度配比(赖氨酸∶蛋氨酸=3∶1),此配比显著促进了细胞中mTOR、4EBP1基因转录,而且单独添加最适浓度赖氨酸及最佳浓度配比时,细胞内总mTOR蛋白水平及其磷酸化水平均显著被提高,作者认为适宜浓度的赖氨酸、蛋氨酸均可以通过激活乳腺上皮细胞mTOR信号通路,促进乳合成。
5 小 结乳蛋白含量和组成是构成乳重要营养品质的主要物质基础之一。探究以饲粮营养改善乳蛋白含量及组成的方式与机理,并用于指导奶畜高效养殖的思路正在成为反刍动物营养学科研究的前沿,而作为蛋白质基本组成成分的氨基酸,对其代谢效价及营养机制的探究又是分子营养研究的一大亮点。乳蛋白合成过程中,氨基酸不仅可以作为前体营养物,还可以作为一种信号分子,通过细胞内JAK-STAT通路调控乳蛋白基因的转录,通过以mTOR为中心枢纽的多级传导通路调控转录后翻译过程,在时间和空间上相关联的2个水平共同影响乳蛋白合成。但目前关于乳腺JAK-STAT通路的研究还主要集中在细胞因子方面,营养物质对该通路的具体调控机制还需要进一步探究,而且该通路与mTOR通路之间的关联性并不清楚,同时关于乳腺细胞对氨基酸的感知、转运的研究还较少。本综述将有助于进一步开展氨基酸营养在乳腺组织蛋白质合成和调控方面的研究。
| [1] | BAR-PELED L,SABATINI D M.Regulation of mTORC1 by amino acids[J]. Trends in Cell Biology,2014,24(7):400-406. ( 4) 4)
|
| [2] | 李庆章.奶牛乳腺发育与泌乳生物学[M]. 北京:科学出版社,2014:123-124. ( 3) 3)
|
| [3] | DOEPEL L,LAPIERRE H.Changes in production and mammary metabolism of dairy cows in response to essential and nonessential amino acid infusions[J]. Journal of Dairy Science,2010,93(7):3264-3274. ( 2) 2)
|
| [4] | 王俊锋,黄静龙,梁国义.泌乳反刍动物乳蛋白的合成机理及调控途径的研究[J]. 饲料工业,2005,26(7):13-17. ( 1) 1)
|
| [5] | TOERIEN C A,TROUT D R,CANT J P.Nutritional stimulation of milk protein yield of cows is associated with changes in phosphorylation of mammary eukaryotic initiation factor 2 and ribosomal s6 kinase 1[J]. The Journal of Nutrition,2010,140(2):285-292. ( 1) 1)
|
| [6] | LIONGUE C,O'SULLIVAN L A,TRENGOVE M C,et al.Evolution of JAK-STAT pathway components:mechanisms and role in immune system development[J]. PLoS One,2012,7(3):e32777. ( 1) 1)
|
| [7] | WANG Y M,LEVY D E.Comparative evolutionary genomics of the STAT family of transcription factors[J]. JAK-STAT,2012,1(1):23-36. ( 1) 1)
|
| [8] | STARK G R,DARNELL J E,Jr.The JAK-STAT pathway at twenty[J]. Immunity,2012,36(4):503-514. ( 1) 1)
|
| [9] | VILLARINO A V,KANNO Y,FERDINAND J R,et al.Mechanisms of JAK/STAT signaling in immunity and disease[J]. The Journal of Immunology,2015,194(1):21-27. ( 3) 3)
|
| [10] | BROOKS A J,WEI D,O'MARA M L,et al.Mechanism of activation of protein kinase JAK2 by the growth hormone receptor[J]. Science,2014,344(6185):1249783. ( 1) 1)
|
| [11] | LIU X,ROBINSON G W,WAGNER K U,et al.Stat5a is mandatory for adult mammary gland development and lactogenesis[J]. Genes & Development,1997,11(2):179-186. ( 2) 2)
|
| [12] | SHILLINGFORD J M,MIYOSHI K,ROBINSON G W,et al.Jak2 is an essential tyrosine kinase involved in pregnancy-mediated development of mammary secretory epithelium[J]. Molecular Endocrinology,2002,16(3):563-570. ( 2) 2)
|
| [13] | OLIVER C H,WATSON C J.Making milk:a new link between STAT5 and Akt1[J]. JAK-STAT,2013,2(2):e23228. ( 1) 1)
|
| [14] | LIU X,ROBINSON G W,GOUILLEUX F,et al.Cloning and expression of Stat5 and an additional homologue (Stat5b) involved in prolactin signal transduction in mouse mammary tissue[J]. Proceedings of the National Academy of Sciences of the United States of America,1995,92(19):8831-8835. ( 1) 1)
|
| [15] | 王立娜.氨基酸与STAT5A基因互作对奶牛乳腺上皮细胞泌乳的调节作用及机理[D]. 博士学位论文.哈尔滨:东北农业大学,2014:2-61. ( 2) 2)
|
| [16] | WATSON C J,BURDON T G.Prolactin signal transduction mechanisms in the mammary gland:the role of the Jak/Stat pathway[J]. Reviews of Reproduction,1996,1(1):1-5. ( 1) 1)
|
| [17] | YANG J,KENNELLY J J,BARACOS V E.The activity of transcription factor Stat5 responds to prolactin,growth hormone,and IGF-Ⅰ in rat and bovine mammary explant culture[J]. Journal of Animal Science,2000,78(12):3114-3125. ( 1) 1)
|
| [18] | DARDEVET D,SORNET C,BAYLE G,et al.Postprandial stimulation of muscle protein synthesis in old rats can be restored by a leucine-supplemented meal[J]. The Journal of Nutrition,2002,132(1):95-100. ( 1) 1)
|
| [19] | 代文婷,李爱军,郑楠,等.亮氨酸水平对奶牛乳腺上皮细胞增殖及κ-酪蛋白合成相关基因表达的影响[J]. 动物营养学报,2015,27(5):1559-1566. ( 1) 1)
|
| [20] | BEQUETTE B J,BACKWELL F R C,CALDER A G,et al.Application of a U-13C-labeled amino acid tracer in lactating dairy goats for simultaneous measurements of the flux of amino acids in plasma and the partition of amino acids to the mammary gland[J]. Journal of Dairy Science,1997,80(11):2842-2853. ( 1) 1)
|
| [21] | WANG M Z,XU B L,WANG H R,et al.Effects of Arginine concentration on the in vitro expression of Casein and mTOR pathway related genes in mammary epithelial cells from dairy cattle[J]. PLoS One,2014,9(5):e95985. ( 1) 1)
|
| [22] | NAN X M,BU D P,LI X Y,et al.Ratio of lysine to methionine alters expression of genes involved in milk protein transcription and translation and mTOR phosphorylation in bovine mammary cells[J]. Physiological Genomics,2014,46(7):268-275. ( 3) 3)
|
| [23] | YANG J X,WANG C H,XU Q B,et al.Methionyl-Methionine promotes α-s1 casein synthesis in bovine mammary gland explants by enhancing intracellular substrate availability and activating JAK2-STAT5 and mTOR-mediated signaling pathways[J]. The Journal of Nutrition,2015,145(8):1748-1753. ( 1) 1)
|
| [24] | BIONAZ M,LOOR J J.Gene networks driving bovine mammary protein synthesis during the lactation cycle[J]. Bioinformatics and Biology Insights,2011,5:83-98. ( 4) 4)
|
| [25] | HUANG K Z,FINGAR D C.Growing knowledge of the mTOR signaling network[J]. Seminars in Cell & Developmental Biology,2014,36:79-90. ( 2) 2)
|
| [26] | ABRAHAM R T.Making sense of amino acid sensing[J]. Science,2015,347(6218):128-129. ( 2) 2)
|
| [27] | DIBBLE C,ELIS W,MENON S,et al.TBC1D7 is a third subunit of the TSC1-TSC2 complex upstream of mTORC1[J]. Molecular Cell,2012,47(4):535-546. ( 2) 2)
|
| [28] | REBSAMEN M,POCHINI L,STASYK T,et al.SLC38A9 is a component of the lysosomal amino acid sensing machinery that controls mTORC1[J]. Nature,2015,519(7544):477-481. ( 2) 2)
|
| [29] | RIUS A G,APPUHAMY J A D R N,CYRIAC J,et al.Regulation of protein synthesis in mammary glands of lactating dairy cows by starch and amino acids[J]. Journal of Dairy Science,2010,93(7):3114-3127. ( 1) 1)
|
| [30] | 高海娜,胡菡,王加启,等.亮氨酸或组氨酸通过哺乳动物雷帕霉素靶蛋白信号通路影响奶牛乳腺上皮细胞中酪蛋白的合成[J]. 动物营养学报,2015,27(4):1124-1134. ( 1) 1)
|
| [31] | GAO H N,HU H,ZHENG N,et al.Leucine and histidine independently regulate milk protein synthesis in bovine mammary epithelial cells via mTOR signaling pathway[J]. Journal of Zhejiang University Science B,2015,16(6):560-572. ( 1) 1)
|
| [32] | APPUHAMY J A D R N,BELL A L,NAYANANJALIE W A D,et al.Essential amino acids regulate both initiation and elongation of mRNA translation independent of insulin in MAC-T cells and bovine mammary tissue slices[J]. The Journal of Nutrition,2011,141(6):1209-1215. ( 1) 1)
|
| [33] | APPUHAMY J A D R N,KNOEBEL N A,NAYANANJALIE W A D,et al.Isoleucine and leucine independently regulate mTOR signaling and protein synthesis in MAC-T cells and bovine mammary tissue slices[J]. The Journal of Nutrition,2012,142(3):484-491. ( 1) 1)
|
| [34] | KIMBALL S R,JEFFERSON L S.New functions for amino acids:effects on gene transcription and translation[J]. American Journal of Clinical Nutrition,2006,83(2):500S-507S. ( 1) 1)
|




