2. 通威股份有限公司技术中心, 成都 610041;
3. 中国石油大学(华东)化工学院, 青岛 266580
2. Technology Center of Tongwei Co., Ltd., Chengdu 610041, China;
3. Center for Bioengineering and Biotechnology, China University of Petroleum(East China), Qingdao 266580, China
维生素D最重要的种类为维生素D2[又名麦角钙化醇(ergocalciferol)]和维生素D3(又名胆钙化醇(cholecalciferol)]。麦角钙化醇的先体是来自植物的麦角固醇,胆钙化醇的先体是来自动物的7-脱氢胆固醇,先体经紫外线照射而转变成维生素D2和维生素D3。维生素D3不仅是一种营养成分,也是一种激素原,其本身并没有任何内在的生物学活性,只有首先在肝脏中代谢成25-羟维生素D3[25(OH)D3],然后在肾脏中转化为1α,25-二羟基维生素D3[1α,25(OH)2D3]及24R,25-二羟基维生素D3[24R,25(OH)2D3]后才具有生物活性。维生素D能够调节体内的钙磷平衡,影响甲状旁腺激素(parathyroid hormone,PTH)对骨骼的作用[1]。新的研究发现,除调节钙磷平衡外,维生素D可能还在如代谢、细胞增殖与分化、自身免疫、心血管生理功能、神经与肌肉功能及防癌等方面发挥重要生理功能[2]。
目前,有关鱼类对维生素D需求量的报道并不多。相关研究认为,虹鳟对维生素D的需求量为1 600~2 400 IU/kg饲料[3];斑点叉尾对维生素D的需求量为1 000[4]或250 IU/kg饲料[5],而太平洋鲑[6]和黄条 [7]不需要在饲料中额外添加维生素D。维生素D缺乏时,在低钙水域中养殖的动物会出现佝偻病、钙平衡紊乱、白肌痉挛和肌纤维结构的改变[8]。维生素D过量时,溪红点鲑表现出生长缓慢、精神不振、体色变暗等症状[1]。
鲈鱼(Lateolabrax japonicus)属凶猛的肉食性鱼类,其肉质细嫩、味道鲜美,深受人们的喜爱。鲈鱼生长速度快,对盐度和温度的适应范围较广,无需室内越冬,是我国南、北方海水养殖的主要种类之一。目前有关鲈鱼营养学研究已有一些报道,初步确定了鲈鱼的蛋白质以及脂肪的最适需要量[9, 10, 11, 12]。杜震宇等[13]研究了不同脂肪源和降脂因子对鲈鱼生长、组织和血液生化指标的影响。近年来,本实验室也在鲈鱼的适宜氮能比[14]、矿物质需求[15, 16]、外源酶添加[17]等营养生理方面做了大量的研究工作。在维生素方面,本实验室研究了维生素C对鲈鱼生长及免疫的影响[18],但在鲈鱼上关于维生素D需求的研究还未见报道。本试验以鲈鱼幼鱼为研究对象,旨在探讨鲈鱼幼鱼对精制饲料中维生素D的定量需求,同时在此基础之上研究饲料中不同维生素D含量对鲈鱼幼鱼鱼体常规成分、肝脏维生素D含量、血清生理与生化指标以及骨骼矿化和钙、磷含量的影响,以期为鲈鱼人工饲料的开发和利用提供理论依据。
1 材料与方法 1.1 试验饲料制作以酪蛋白和明胶为蛋白质源,豆油和鲱鱼油为脂肪源,糊精为糖源,褐藻酸钠为黏合剂,并添加混合氨基酸模拟鲈鱼鱼体氨基酸模式,配制出精制基础饲料(表 1),在每千克基础饲料中分别添加0、200、400、800、1 600和3 200 IU维生素D3,配制出6种等氮等能的试验饲料,试验饲料中维生素D含量实测值分别为34.2、19.4、393.8、775.9、1 534.1和3 091.2 IU/kg。
| 表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
各种饲料原料分别粉碎后过80目筛网,然后将各种原料混合均匀,再与水和豆油及鲱鱼油充分混匀,用F-26Ⅱ型双螺杆挤条机(华南理工大学科技实业总厂研制)加工成型,制得的饲料在45 ℃烘箱中烘至水分含量达到9%~10%。烘干的饲料破碎过筛后得到2种颗粒大小不同的饲料(1.5 mm×3.0 mm和2.5 mm×4.0 mm),将这2种颗粒饲料分别密封进塑料袋储存在-20 ℃备用。
1.2 饲养管理试验用鲈鱼选用当年同一批海捕鱼苗,于水泥池(3.0 m×2.0 m×1.5 m)中暂养,以基础饲料饱食投喂,使之逐渐适应试验饲料和养殖环境。暂养结束后,试验鱼饥饿24 h,然后称重,挑选出体格健壮、规格一致的鲈鱼[初始体重为(2.26±0.03) g]随机分为6组,每组3个重复,以重复为单位放养于室内流水系统300 L的玻璃纤维桶(水量250 L)内,放养密度为15尾/桶。每天投喂试验饲料2次(07:00、17:00),表观饱食投喂。试验1~4周投喂颗粒大小为1.5 mm×3.0 mm的饲料,5~9周投喂颗粒大小为2.5 mm×4.0 mm的饲料。每次投喂前1 h吸污,投喂后1 h收集残饵,烘干,称重,每天记录投饲量。如有死鱼,记录数量并称重。试验用海水经沉淀、1级砂滤,持续充气,水流量为1 L/min,水温为24.0~27.0 ℃,盐度为28.0‰~29.5‰,pH在8.0~8.1之间,溶解氧含量在7 mg/L左右。饲养9周后,将试验鱼饥饿24 h,计数,并用丁香酚(1∶10 000)(上海试剂厂产品)麻醉。从每桶中随机选取3条鲈鱼,用1 mL的无菌注射器从尾静脉取血,待析出血清后保存备用,其余的鱼全部称重并取样。取样后的鱼体保存于-20 ℃冰箱中,血清保存于-80 ℃冰箱中。
1.3 样品分析测定方法饲料原料、饲料和鱼体常规成分的分析全部采用AOAC(1995)[19]的方法。其中水分含量测定采用105 ℃烘干恒重法,粗蛋白质含量测定采用半微量凯氏定氮法(总氮×6.25),粗脂肪含量测定采用索氏抽提法(乙醚为溶剂),粗灰分含量测定采用马福炉中600 ℃灼烧12 h称重法。肝脏脂肪含量采用Folch等[20]的方法测定。血清碱性磷酸酶(AKP)活性及羟脯氨酸(Hpro)、钙离子(Ca2+)和无机磷(Pi)含量均采用南京建成生物工程研究所生产的试剂盒测定。饲料和肝脏维生素D含量采用高效液相色谱法[21]检测。鲈鱼全鱼氨基酸组成样品处理和测定采用Zhang等[22]方法。鱼体和脊椎骨中钙和磷含量用VISTA-MPX型电感耦合等离子发射光谱(ICP-OES)(瓦里安)测定。每份样品均重复测定3次。
1.4 计算公式增重率(WGR)=100×(Wt-W0)/W0;
特定生长率(SGR)=100×(lnWt-lnW0)/t;
饲料效率(FER)=100×(Wt×Nt-W0×N0)/Id[23];
蛋白质效率(PER)=100×(Wt×Nt-W0×N0)/Ip;
存活率(SR)=100×Nt/N0;
肝体指数(HSI)(%)=100×WL/WB。
式中:W0为初始体重;Wt为终末体重;t为试验天数;Nt为终末尾数;N0为初始尾数;Id饲料摄入量(以干重计);Ip粗蛋白质摄入量(以干重计);WL为肝脏重;WB为体重。
1.5 数据统计分析采用SPSS 16.0统计软件对所得数据进行方差和相关性分析。先对数据进行单因素方差分析(one-way ANOVA),若差异达到显著水平(P<0.05),则采用Tukey’s检验进行多重比较。试验数据用平均值±标准误表示。
2 结 果 2.1 饲料中不同维生素D含量对鲈鱼幼鱼生长指标的影响由表 2可知,饲料中不同维生素D含量对鲈鱼幼鱼的存活率没有产生显著影响(P>0.05),但是显著影响了鲈鱼幼鱼的增重率、特定生长率、饲料效率和蛋白质效率(P<0.05)。饲料中不添加维生素D组(维生素D含量34.2 IU/kg组)鲈鱼幼鱼的存活率(73.3%)最低,但是与其他各组(82.2%~93.3%)差异不显著(P>0.05)。当饲料中维生素D含量在34.2~393.8 IU/kg时,鲈鱼幼鱼的增重率随着饲料中维生素D含量的升高显著上升(P<0.05),但是当饲料中维生素D含量高于393.8 IU/kg 时,鲈鱼幼鱼的增重率变化不显著并且出现平台期(P>0.05)。同样,鲈鱼幼鱼的特定生长率、饲料效率和蛋白质效率均表现出与增重率相似的变化趋势。饲料中维生素D含量(X)与鲈鱼幼鱼增重率(Y)的关系用折线模型表示为:Y=652.5-1.24(431.0-X),此时鲈鱼幼鱼对维生素D的需求量为431.0 IU/kg饲料(图 1)。
| 表 2 饲料中不同维生素D含量对鲈鱼幼鱼生长指标的影响 Table 2 Effects of different dietary vitamin D contents on growth indices of juvenile Japanese seabass |
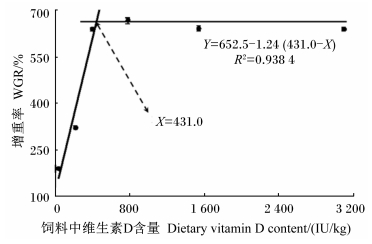 | 图 1 饲料中维生素D含量与鲈鱼幼鱼增重率的关系 Fig. 1 Relationship between dietary vitamin D content and WGR of juvenile Japanese seabass |
由表 3可知,饲料中不同维生素D含量显著影响了鲈鱼幼鱼鱼体粗灰分、钙和磷的含量(P<0.05),但是对粗蛋白质、粗脂肪和水分的含量没有显著影响(P>0.05)。随着饲料中维生素D含量的升高,鲈鱼幼鱼鱼体粗灰分的含量呈增加趋势,且维生素D含量最高组(维生素D含量3 091.2 IU/kg组)显著高于维生素D含量34.2 IU/kg组(P<0.05)。同样,鲈鱼幼鱼鱼体钙和磷的含量与粗灰分含量的变化趋势基本一致,而钙的含量虽然在维生素D含量最高组略低于次 高组(维生素D含量1 534.1 IU/kg组),但是并无显著差异(P>0.05)。
| 表 3 饲料中不同维生素D含量对鲈鱼幼鱼体成分的影响(湿重基础) Table 3 Effects of different dietary vitamin D contents on body composition of juvenile Japanese seabass (wet weight basis) |
由表 4可知,随着饲料中维生素D含量的升高,鲈鱼幼鱼血清碱性磷酸酶的活性及钙离子的含量均表现出先上升后下降的趋势,而血清无机磷的含量则表现出持续升高的趋势。血清羟脯氨酸的含量在不添加维生素D组出现最高值,显著高于维生素D含量为219.4和775.9 IU/kg组(P<0.05),但是与其他各组相比无显著差异(P>0.05)。
| 表 4 饲料中不同维生素D含量对鲈鱼幼鱼血清碱性磷酸酶活性及羟脯氨酸、钙离子和无机磷含量的影响 Table 4 Effects of different dietary vitamin D contents on serum AKP activity, and HPro, Ca2+ and Pi contents of juvenile Japanese seabass |
由表 5可知,饲料中维生素D含量由34.2 IU/kg升至1 534.1 IU/kg时,鲈鱼幼鱼脊椎骨、鳃盖骨、鳞片粗灰分以及脊椎骨钙含量均表现出显著的升高(P<0.05),在维生素D的含量由1 534.1 IU/kg升至3 091.2 IU/kg时虽略有下降,但是差异并不显著(P>0.05)。脊椎骨磷含量与饲料中维生素D含量正相关,随着饲料中维生素D含量的升高表现出上升的趋势,且维生素D含量为1 534.1和3 091.2 IU/kg组显著高于维生素D含量为34.2、219.4和393.8 IU/kg组(P<0.05)。
| 表 5 饲料中不同维生素D含量对鲈鱼幼鱼脊椎骨、鳃盖骨和鳞片粗灰分以及脊椎骨钙和磷含量的影响(干重基础) Table 5 Effects of different dietary vitamin D contents on the contents of ash in vertebra, operculum and scale, and calcium and phosphorus in vertebra of juvenile Japanese seabass (DM basis) |
由表 6可知,饲料中不同维生素D含量显著影响了鲈鱼幼鱼肝体指数及肝脏脂肪和维生素D含量(P<0.05)。随着饲料中维生素D含量的升高,肝体指数和肝脏脂肪含量呈现下降的趋势,而肝脏维生素D含量则呈现升高的趋势,并均在饲料中维生素D含量达到1 534.1 IU/kg时变化趋于平稳。饲料中维生素D含量(X)与鲈鱼幼鱼肝脏维生素D含量(Y)的关系用二次曲线模型表示为:Y=-9E-07X2+0.004 4X+0.881 6,此时鲈鱼幼鱼对维生素D的需求量为2 444.4 IU/kg饲料(图 2)。
| 表 6 饲料中不同维生素D含量对鲈鱼幼鱼肝体指数及肝脏脂肪和维生素D含量的影响(湿重基础) Table 6 Effects of different dietary vitamin D contents on hepatosomatic index, liver lipid and vitamin D contents of juvenile Japanese seabass (wet weight basis) |
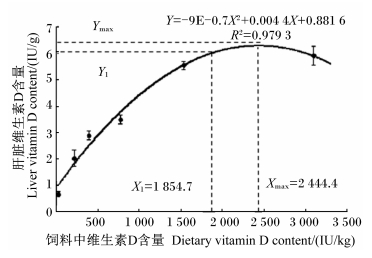 | 图 2 饲料维生素D含量与鲈鱼幼鱼肝脏维生素D含量的关系 Fig. 2 Relationship between dietary vitamin D content and liver vitamin D content of juvenile Japanese seabass |
本试验探讨了精制基础饲料中不同维生素D含量对鲈鱼幼鱼生长指标、体常规组成、肝脏维生素D含量、血清钙磷代谢相关指标以及骨骼矿化和钙、磷含量的影响。以增重率为评价指标时,通过折线模型可以得到鲈鱼幼鱼对维生素D的需求量为431.0 IU/kg饲料(图 1)。这与Lovell等[24]对斑点叉尾 的研究结果(500 IU/kg饲料)差别不大,但是低于Barnett等[3]报道的虹鳟对维生素D的需求量(1 600~2 400 IU/kg饲料)和Andrews等[4]报道的斑点叉尾 对维生素D的需求量(1 000 IU/kg饲料)。鲈鱼幼鱼肝脏维生素D含量的变化与增重率的变化趋势相似,都是随着饲料中维生素D含量的升高而上升并在某一阶段达到峰值,然后变化趋于平稳。当以肝脏维生素D含量为评价指标时,我们发现采用二次曲线模型能比折线模型更好地拟合肝脏维生素D含量和饲料维生素D含量之间的关系(R2最大),因此,采用二次曲线模型可以得到鲈鱼幼鱼对维生素D的需求量为2 444.4 IU/kg饲料(图 2),这与Barnett等[3]报道的虹鳟对维生素D的需求量(1 600~2 400 IU/kg饲料)较为一致。当以肝脏维生素D含量为评价指标时鲈鱼幼鱼对维生素D的需求量要高于以增重率为评价指标时。Woodward[22]指出,当以组织最大累积量为评价指标时,动物对营养素的需求量要比以生长为评价指标时高,这也与本试验结论是一致的。同时,动物对营养物质的需求量与选取的模型也有较大关系,二次曲线模型往往得到比折线模型更高的需求量[26]。在本试验中,通过折线模型拟合肝脏维生素D含量和饲料维生素D含量之间的关系时,得到的鲈鱼幼鱼对维生素D的需求量要比通过二次曲线模型得到的需求量低,但是拟合的精确度却不尽人意。在水产动物营养研究中,有关模型的应用目前尚没有明确、统一的依据,这样显然不利于不同结果间的相互比较。尽快规范不同评价模型的选择依据也是目前水产研究中一个急需解决的问题。不同试验得到的养殖鱼类对维生素D的需求量不尽相同,这可能还与养殖对象的种类、生长阶段、生理状况、维生素D的添加形式、养殖环境和养殖模式等有关。
养殖9周后,饲喂不添加维生素D饲料的鲈鱼的存活率虽然低于其余各组,但未表现出显著差异,并且在养殖后期没有表现出明显的维生素D缺乏症,但是解剖时发现维生素D含量最低组的鲈鱼鳃盖骨脆弱、易碎。与Halver[27]报道的“过量的维生素D会导致养殖鱼类鳃盖脆弱”有所出入,本试验在饲料中维生素D含量最高组并未观 察到类似的症状,经过对鳃盖骨粗灰分含量进行分析,发现维生素D含量最低组鳃盖骨粗灰分含量也最低,并显著低于维生素D含量最高组。至于维生素D含量最高组脊椎骨、鳃盖骨中粗灰分含量仍较高,可能与维生素D含量没有达到鲈鱼承受的极限或养殖周期不够长有关。
随着饲料中维生素D含量的升高,鲈鱼幼鱼血清碱性磷酸酶活性及钙离子和无机磷含量均逐渐升高,但在维生素D含量到达3 091.2 IU/kg时,鲈鱼幼鱼血清碱性磷酸酶活性和钙离子含量停止升高,且出现略微下降。碱性磷酸酶存在于骨、肝脏和肠道等许多组织中,当骨细胞代谢活跃可见血清碱性磷酸酶活性升高,故在人类医学中碱性磷酸酶活性被用作骨更新指标。维生素D3本身虽没有任何内在的生物学活性,但是其在肾脏中的代谢产物1α,25(OH)2D3却是调节骨代谢的主要激素之一(另一种是PTH)。体外试验证明,1α,25(OH)2D3能刺激破骨细胞活性和加速破骨细胞的生成,从而促进溶骨作用。在体内1α,25(OH)2D3则与PTH协同作用,促进破骨细胞增生,并增强其破骨作用。此外,1α,25(OH)2D3还刺激成骨细胞分泌胶原等,促进骨的生成,同时1α,25(OH)2D3通过增加小肠对钙、磷的吸收,又促进钙化。所以,在钙、磷供应充足时,1α,25(OH)2D3主要促进成骨;当血液钙含量降低、肠道钙吸收不足时,1α,25(OH)2D3主要促进溶骨,使血液钙含量升高。在本试验中,随着饲料中维生素D含量的升高加,1α,25(OH)2D3的生成量也逐渐上升,因此导致成骨细胞代谢旺盛,骨中生成的碱性磷酸酶部分进入血液导致血清碱性磷酸酶活性也随之升高。但是我们发现,在维生素D含量最高组血清中碱性磷酸酶活性又有下降的趋势,这是因为维生素D对骨细胞的作用是剂量依赖性的,生理剂量对骨细胞有促进作用,高剂量时则会产生毒性起抑制作用。在维生素D含量最高组,鲈鱼幼鱼血清碱性磷酸酶活性的下降可能与成骨细胞逐渐受到抑制有关。周歧存等[28]报道,饲料中适量的维生素D会显著提高皱纹盘鲍软体部的碱性磷酸酶活性,但过高或过低的添加量均会使碱性磷酸酶活性受到抑制。同样。Shiau等[29]在斑节对虾上也有类似的报道。人类医学大量报道已证明1α,25(OH)2D3可以通过提高肠道对钙、磷的吸收和转运以及促进肾小管上皮对钙、磷的重吸收使血液中钙、磷含量增高,本试验中对血清钙离子和无机磷含量的检测结果也与之一致。随着饲料中维生素D含量的升高,血清钙离子和无机磷含量均呈上升趋势。伴随着血清钙离子和无机磷含量的上升,鲈鱼幼鱼骨骼的矿化能力得到显著的加强,与此相一致的是脊椎骨、鳃盖骨和鳞片中粗灰分含量以及脊椎骨中钙和磷含量均有不同程度的上升。这说明饲料中适量维生素D对骨骼矿化能力的增强是全身性的,而对全鱼的粗灰分含量分析也说明了这一点,这与Lovell等[24]对斑点叉尾 的报道是一致的。骨骼的主要成分是骨盐(钙盐和磷酸盐)和有机基质(Ⅰ型胶原),当机体维生素D缺乏时会导致软骨症或骨质疏松症,这都伴随着骨盐以及有机基质不同程度的减少,对血清羟脯氨酸含量的检测证明了这一点。在维生素D含量最低组血清羟脯氨酸的含量最高,这也说明在维生素D含量最低组骨骼有机质的流失情况最为严重。
在对鲈鱼脊椎骨、鳃盖骨和鳞片粗灰分以及脊椎骨钙含量分析中,我们发现数据的最大值无一例外都出现在维生素D含量次高组(即饲料中维生素含量为1 534.1 IU/kg时),而不是出现在维生素D含量最高组(即饲料中维生素含量为3 091.2 IU/kg时),维生素D含量最高组的数值虽然在统计分析上与次高组没有显著差异,但都有不同程度的降低。人类医学研究表明,过量维生素D导致骨骼广泛脱钙,骨盐含量显著降低,从而容易导致骨折。在本试验虽未观察到骨折现象,但是维生素D含量最高组的骨盐含量已经开始有一定程度的下降,不过下降程度与维生素D含量最低组比起来相差甚远,结合维生素D含量最低组骨骼有机质的流失情况最为严重这一点,也说明了为什么鳃盖骨脆弱、易碎的现象出现在维生素D含量最低组而不是维生素D含量最高组。
鲈鱼幼鱼肝体指数和肝脏脂肪含量的变化趋势一致,维生素D含量最低组表现出最高的肝体指数(2.69%)和肝脏脂肪含量(15.67%),然后随着饲料中维生素D含量的上升而逐渐下降(表 6)。George等[30]研究表明虹鳟摄食维生素D缺乏的饲料表现为生长下降和肝脏脂肪含量增加,这与本试验得到的结论是一致的。但是,本试验中发现鲈鱼幼鱼整个鱼体的脂肪含量却是随着饲料中维生素D含量的上升而逐渐上升,在肝脏脂肪含量最高组却表现出最低的鱼体粗脂肪含量(5.3%)。据此推测:鱼体较高的肝脏脂肪含量应该并不是从外界摄入了更多的脂肪或脂肪合成能力升高的结果,而很可能是因为肝脏中维生素D过量累积造成肝脏磷脂合成障碍或载脂蛋白合成障碍导致甘油三酯难以转运出肝脏,从而在肝脏中大量积累引起病变,与肝脏脂肪含量异常升高相对应的是整个鱼体脂肪含量的下降。
4 结 论当以增重率为评价指标时,鲈鱼幼鱼对维生素D的需求量为431.0 IU/kg饲料,而当以肝脏维生素D含量为评价指标时,鲈鱼对维生素D的需求量为2 444.4 IU/kg饲料。
| [1] | BEATON G H,MCHENRY E W.Nutrition:a comprehensive treatise[M]. New York:Academic Press,1964:11-60. ( 2) 2)
|
| [2] | 许友卿,刘永强,刘阳,等.维生素D3对鱼类的影响及其机理研究进展[J]. 饲料工业,2014,35(16):26-30. ( 1) 1)
|
| [3] | BARNETT B J,CHO C Y,SLINGER S J.Relative biopotency of dietary ergocalciferol and cholecalciferol and the role of and requirement for vitamin D in rainbow trout (Salmo gairdneri)[J]. The Journal of Nutrition,1982,112(11):2011-2019. ( 3) 3)
|
| [4] | ANDREWS J W,MURAI T,PAGE J W P.Effects of dietary cholecalciferol and ergocalciferol on catfish[J]. Aquaculture,1980,19(1):49-54. ( 2) 2)
|
| [5] | BROWN P B.Vitamin D requirement of juvenile channel catfish reared in calcium-free water[D]. Ph.D.Thesis.Texas:A & M University,1988. ( 1) 1)
|
| [6] | HALVER J E.The vitamins[M]//HALVER J E.Fish nutrition.New York:Academic Press,1972:29-103. ( 1) 1)
|
| [7] | SHIMENO S.Yellowtail,Seriola quinqueradiata[M]//WILSON R P.Handbook of nutrient requirements of finfish.Boca Raton,FL:CBC Press,1991:181-191. ( 1) 1)
|
| [8] | HALVER J E.The vitamins[M]//HALVER J E.Fish nutrition.2nd ed.New York:Academic Press,1989:31-109. ( 1) 1)
|
| [9] | 林利民,胡家财,洪惠馨.鲈鱼人工配合饲料中蛋白质最适含量的研究[J]. 厦门水产学院学报,1994,16(1):6-10. ( 1) 1)
|
| [10] | 高淳仁,刘庆慧,梁亚全,等.鲈鱼幼鱼人工配合饲料中蛋白质、脂肪适宜含量的研究[J]. 海洋水产研究,1998,19(1):81-85. ( 1) 1)
|
| [11] | 洪惠馨,林利民,陈学豪,等.鲈鱼人工配合饵料中脂肪的适宜含量研究[J]. 集美大学学报:自然科学版,1999,4(2):41-44. ( 1) 1)
|
| [12] | 潘勇,王福强,刘焕亮.花鲈配合饲料中鱼粉与豆粕适宜比例的研究[J]. 大连水产学院学报,2000,15(3):157-163. ( 1) 1)
|
| [13] | 杜震宇,刘永坚,郑文晖,等.三种脂肪源和两种降脂因子对鲈生长、体营养成分组成和血清生化指标的影响[J]. 水产学报,2002,26(6):542-550. ( 1) 1)
|
| [14] | AI Q H,MAI K S,LI H T,et al.Effects of dietary protein to energy ratios on growth and body composition of juvenile Japanese seabass,Lateolabrax japonicus[J]. Aquaculture,2004,230(1/2/3/4):507-516. ( 1) 1)
|
| [15] | MAI K S,ZHANG L,AI Q H,et al.Dietary lysine requirement of juvenile Japanese seabass,Lateolabrax japonicus[J]. Aquaculture,2006,258(1/2/3/4):535-542. ( 1) 1)
|
| [16] | ZAHNG C X,MAI K S,AI Q H,et al.Dietary phosphorus requirement of juvenile Japanese seabass,Lateolabrax japonicus[J]. Aquaculture,2006,255(1/2/3/4):201-209. ( 1) 1)
|
| [17] | AI Q H,MAI K S,ZHANG W B,et al.Effects of exogenous enzymes (phytase,non-starch polysaccharide enzyme) in diets on growth,feed utilization,nitrogen and phosphorus excretion of Japanese seabass,Lateolabrax japonicus[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2007,147(2):502-508. ( 1) 1)
|
| [18] | AI Q H,MAI K S,ZHANG C X,et al.Effects of dietary vitamin C on growth and immune response of Japanese seabass,Lateolabrax japonicus[J]. Aquaculture,2004,242(1/2/3/4):489-500. ( 1) 1)
|
| [19] | AOAC.Official methods of analysis of official analytical chemists international[S]. 16th ed.Arlington,VA:Association of Official Analytical Chemists,1995. ( 1) 1)
|
| [20] | FOLCH J,LEES M,SLOANE STANLEY G H.A simple method for the isolation and purification of total lipides from animal tissues[J]. Journal of Biological Chemistry,1957,226(1):497-509. ( 1) 1)
|
| [21] | HORVLI O,LIE Ø.Determination of vitamin D3 in fish meals by HPLC[J]. Fiskeridirektoratets Skrifter,Serie Ernæring,1994,6:163-175. ( 1) 1)
|
| [22] | ZHANG L,MAI K S,AI Q H,et al.Use of a compound protein as a replacement for fish meal in diets of large yellow croaker, Pseudosciaena crocea R.[J]. Journal of the World Aquaculture Society,2008,39(1):83-90. ( 2) 2)
|
| [23] | HARDY R W,BARROWS F T.Diet formulation and manufacture[M]//HALVER J E,HARDY R W.Fish nutrition.3rd ed.New York:Academic Press,2002:505-600. ( 1) 1)
|
| [24] | LOVELL R T,LI Y P.Essentiality of vitamin D in diets of channel catfish (Ictalurus punctatus)[J]. Transactions of the American Fisheries Society,1978,107(6):809-811. ( 2) 2)
|
| [25] | WOODWARD B.Riboflavin requirement for growth,tissue saturation and maximal flavin-dependent enzyme activity in young rainbow trout (Salmo gairdneri) at two temperatures[J]. The Journal of Nutrition,1985,115(1):78-84. |
| [26] | BAKER D H.Problems and pitfalls in animal experiments designed to establish dietary requirements for essential nutrients[J]. The Journal of Nutrition,1986,116(12):2339-2349. ( 1) 1)
|
| [27] | HALVER J E.The vitamins[M]//HALVER J E, HARDY R W.Fish nutrition.3rd ed.New York:Academin Press,2002:62-143. ( 1) 1)
|
| [28] | 周歧存,麦康森.皱纹盘鲍维生素D营养需要的研究[J]. 水产学报,2004,28(2):155-160. ( 1) 1)
|
| [29] | SHIAU S Y,HWANG J Y.The dietary requirement of juvenile grass shrimp (Penaeus monodon) for vitamin D[J]. The Journal of Nutrition,1994,124(12):2445-2450. ( 1) 1)
|
| [30] | GEORGE J C,BARNETT B J,CHO C Y,et al.Vitamin D3 and muscle function in the rainbow trout[J]. Cytobios,1981,31:7-18. ( 1) 1)
|




