小肠是机体消化吸收的重要部位,其功能与肠上皮细胞密切相关,单层柱状上皮细胞覆盖在肠腔组成小肠的上皮,上皮弯曲折叠有序地排列成绒毛和隐窝,其中上皮凸向肠腔形成的叶状结构为绒毛,下陷至固有层形成的指套状结构为隐窝[1]。绒毛和隐窝的细胞组成及生理功能不同,分离培养可用于探讨不同的生理问题,如绒毛培养可用于研究小肠物质吸收、转运等功能[2, 3, 4],隐窝培养则可用于研究肠干细胞生理及潘氏细胞免疫功能等[5, 6, 7, 8, 9, 10]。目前国内外分离小肠绒毛和隐窝细胞的方法主要有机械分离法、螯合法、酶消化法[11],其中螯合法应用最广泛,但螯合法也存在分离时间长、隐窝和绒毛分离效果差、细胞活率低等问题。Pothier等[12]使用含1.5 mmol/L乙二胺四乙酸(EDTA)的盐溶液在37 ℃条件下螯合孵育肠组织,分离的绒毛和隐窝细胞互相掺杂,富集率低;Bjerknes等[13]将EDTA浓度提高为30 mmol/L,虽然分离时间缩短且提高了富集率,但对绒毛损伤很大;Ayabe等[14]在此基础上将分离温度降低到室温,虽可提高隐窝的完整性,但无法富集绒毛。Flint等[15]则用二硫苏糖醇(DTT)取代EDTA的螯合作用,并将处理温度进一步降低为4 ℃,可以得到更完整的隐窝细胞团,但对绒毛损伤很大。Fuller等[16]发现,降低EDTA浓度为3 mmol/L并结合2%山梨醇,能有效地降低细胞损伤,但分离时间较长。以上研究均以小鼠或大鼠为试验材料,尚无分离家兔小肠绒毛和隐窝细胞的报道,且不同研究者使用的螯合剂种类、浓度、温度不一致,目前均不能使富集率、完整性、分离纯度、分离时间同时达到理想结果。本研究通过综合分析前人各分离方法的优势与不足,探究不同螯合剂浓度与温度组合对家兔小肠绒毛和隐窝细胞分离效果的影响,筛选出富集率高、细胞活率好、分离时间短的最佳组合,为后续研究家兔小肠不同细胞功能及营养物质吸收及调控机制提供重要手段。
1 材料与方法 1.1 试验设计以健康14日龄新西兰白兔为试验材料。试验采用2×5完全随机试验设计,设计2个温度水平:4 ℃低温(low temperature,LT)和25 ℃室温(room temperature,RT);5个EDTA浓度:5、10、15、20、25 mmol/L。每个处理设3个重复,每个重复采用5 g小肠组织。
1.2 螯合剂的配制参照文献[15]配制D-Hanks液,额外添加0.5 mmol/L DTT、100 U/mL青霉素、100 μg/mL链霉素。螯合剂:1.5 mmol/L KCl、96 mmol/L NaCl、8 mmol/L KH2PO4、5 mmol/L Na2PO4、44 mmol/L蔗糖、55 mmol/L山梨糖醇、5 mmol/L乙二醇二乙醚二胺四乙酸(EGTA),按照试验设计分别添加5个浓度的EDTA。
1.3 小肠绒毛和隐窝细胞的洗脱分离家兔耳缘静脉注射空气处死后,浸泡于75%酒精中3 min,剖腹取下全段小肠,用冰冷的D-Hanks液(含DTT、双抗)冲洗肠腔3遍,将肠段外翻并剪成1~2 cm小段,洗净黏液,均分5 g小肠组织至各处理,各处理加入50倍体积(以下各步骤所加螯合剂体积均为50倍)对应浓度EDTA的螯合剂。LT组和RT组分别在对应温度下操作:1)150 r/min条件下振摇15 min后上下颠倒振摇(≈60次/min)2 min后弃悬液,加入螯合剂,相同条件下振摇5~15 min,至肉眼可见悬液中出现针尖样大小细胞团时弃悬液;2)剩余肠段中加入螯合剂手动上下颠倒振摇3 min后,悬液150×g离心3 min弃上清,此沉淀即为绒毛细胞团;3)剩余肠段中重新加入螯合剂,150 r/min振摇5 min后弃悬液,再加入螯合剂,重复操作3次以去除肠壁上的大部分绒毛;4)重新加入螯合剂,手动轻柔地上下颠倒,每隔2 min收集1次悬液,并加入新的螯合剂,重复4次之后,所得悬液冰上沉淀2 min,去除下层包含绒毛细胞团的沉淀后,悬液300×g离心5 min去上清以去除单个细胞,此时获得的沉淀即为隐窝细胞团。
1.4 绒毛与隐窝细胞富集率、绒毛相对完整率与隐窝细胞相对活率测定在4倍光学显微镜视野下观察绒毛和隐窝细胞团的形态和纯度,要求单个4倍镜视野下绒毛中隐窝细胞团不多于3个,隐窝细胞团内绒毛碎片不多于3个[17]。分别测定各处理富集的绒毛和隐窝细胞重量,细胞重量占5 g小肠组织的百分比为富集率。将各处理绒毛细胞团稀释到相同倍数后,在单个4倍镜视野下统计破损绒毛碎片的数量,每个样品统计30个4倍镜视野。假定每个4倍镜视野下总绒毛数相等,通过公式(绒毛完整率=1-绒毛碎片数/总绒毛数)计算出1个4倍镜视野下的绒毛完整率,再以其中1个处理的绒毛完整率为100%,相比得到各处理的相对完整率。用台盼兰染色法统计单个隐窝细胞团上死亡细胞数量,每个处理统计30个细胞团,按照与绒毛相对完整率相同的算法得到隐窝细胞相对活率。
1.5 基因组DNA与总RNA提取和电泳参照试剂盒操作说明,对分离出的绒毛和隐窝细胞进行基因组DNA与总RNA提取,用以判断细胞核酸完整性,1%琼脂糖凝胶电泳,Biorad成像仪摄像分析。
1.6 隐窝细胞的培养富集的隐窝细胞用DMEM/F-12培养基清洗3次,低速离心去除残余螯合剂后等量接种于细胞培养用6孔板,37 ℃、5% CO2饱和湿度培养箱静置培养,分别于1、3、5、7、9 h后收集细胞,磷酸盐缓冲液(PBS)清洗3次,提取总RNA反转录后,实时荧光定量PCR检测隐窝细胞相关基因表达的变化。
1.7 实时荧光定量PCR方法检测基因表达量利用实时荧光定量PCR方法检测溶菌酶(LYZ)和α-防御素(DEFEN)的表达量,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因[18]。根据GenBank登录的家兔LYZ和DEFEN基因保守区序列设计引物。各基因的扩增引物见表 1。反应体系:10 μL SYBR Premix ExTapTM II (2×),1 μL PCR Forward Primer (10 μmol/L),1 μL PCR Reverse Primer (10 μmol/L),1 μL cDNA,ddH2O补至20 μL。扩增程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环。
| 表 1 各基因实时荧光定量PCR引物序列 Table 1 Primer sequences of genes for real-time qPCR |
数据采用SPSS 20.0软件进行统计分析,表中数据用平均值±标准误表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析 2.1 绒毛和隐窝细胞团的形态和纯度在不同EDTA浓度和温度下,均获得了较完整的绒毛和隐窝细胞团。操作过程中,第2步洗脱绒毛时出现针尖样细胞团所需时间:RT各组(5~9 min)短于LT各组(7~15 min),且EDTA浓度越高所需时间越短。第4步沉淀隐窝时,LT+5 mmol/L EDTA组隐窝洗脱量极低,且参杂大量绒毛,2 min内洗脱物纯化后仅获得5 mg左右隐窝细胞团,远远低于LT+10 mmol/L EDTA组。在光学显微镜4倍镜下观察,LT较RT条件下得到的细胞团形态结构更完整,但富集量小,LT+5 mmol/L EDTA组细胞团结构最完整,但细胞浓度最低(图 1-A、图 1-B);随着温度及EDTA浓度的升高,得到的细胞团结构完整性逐渐降低,但细胞浓度逐渐升高;在RT+25 mmol/L EDTA条件下时,尽管富集量最高,但在绒毛富集物中出现了较多的隐窝细胞团,隐窝富集物中也出现了大量绒毛碎片(图 1-E、图 1-F)。直观可看出,在LT+10~15 mmol/L EDTA条件下分离效果较好(图 1-C、图 1-D)。
 |
图示A与B、C与D、E与F分别为LT+5 mmol/L EDTA、LT+10 mmol/L EDTA、RT+25 mmol/L EDTA条件下分离的绒毛与隐窝细胞团的形态。 This picture showed the morphology of separated villus and crypt cells under LT+5 mmol/L EDTA (A and B), LT+ 10 mmol/L EDTA (C and D) and RT+25 mmol/L EDTA (E and F), respectively. 图 1 绒毛和隐窝细胞富集物的形态学观察 Fig. 1 Morphological observation of villus and crypt enrichments |
由图 2可知,各EDTA浓度条件下,RT组绒毛细胞富集率均极显著高于LT组(P<0.01),且2种温度条件下绒毛细胞富集率均随着EDTA浓度升高而升高。在EDTA浓度小于等于15 mmol/L时,LT组绒毛相对完整率极显著高于RT组(P<0.01),且随着EDTA的浓度升高绒毛相对完整率降低;在EDTA浓度大于等于20 mmol/L时,RT组与LT组绒毛相对完整率差异不显著(P>0.05)。
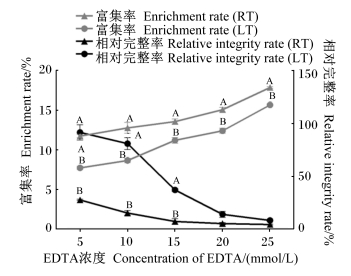 |
同指标同EDTA浓度,数据点标注不同大写字母表示差异极显著(P<0.01),无字母表示差异不显著(P>0.05)。图3同。 In the same index and the same EDTA concentration, value points with different capital letters mean significant difference (P<0.01), while with no letter mean no significant difference (P>0.05). The same as Fig.3. 图 2 各分离条件下绒毛细胞富集率与绒毛相对完整率 Fig. 2 Villus cell enrichment ratio and villus relative integrity rate under different separated conditions |
由图 3可知,各EDTA浓度条件下,RT组隐窝细胞富集率均极显著高于LT组(P<0.01),且2种温度条件下隐窝细胞富集率均随着EDTA浓度升高而升高。当EDTA浓度小于等于10 mmol/L时,LT组隐窝细胞相对活率极显著高于RT组(P<0.01),且随着EDTA的浓度的升高隐窝细胞相对活率逐渐降低;当EDTA浓度大于等于15 mmol/L时,LT组与RT组的隐窝细胞相对活率均极低且2组间差异不显著(P>0.05)。由图可以看出,LT+5~10 mmol/L EDTA组与RT+5 mmol/L EDTA组的隐窝细胞相对活率较高,但LT+5 mmol/L EDTA组的隐窝细胞富集率极低,仅为(1.01±0.02)%。
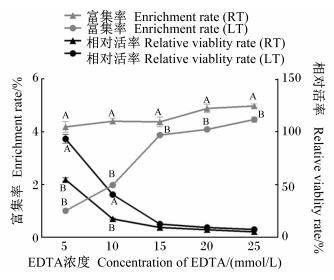 | 图 3 各分离条件下隐窝细胞富集率与相对活率 Fig. 3 Crypt cell enrichment ratio and relative viablity rate under different separated conditions |
富集的细胞团提取DNA、总RNA后用1%琼脂糖凝胶电泳检测完整性,结果如图 4和图 5所示。各处理条件下,细胞基因组DNA完整,未见弥散拖尾现象;总RNA可见28S、18S和5S条带,表明分离过程中细胞处于存活状态。
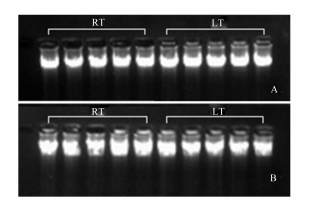 |
A为绒毛细胞,B为隐窝细胞。RT与LT条件下EDTA浓度左起分别为5、10、15、20、25 mmol/L。图5同。 A was villus cell, and B was crypt cell. From left to right, the concentration of EDTA was 5, 10, 15, 20 and 25 mmol/L, respectively. The same as Fig.5. 图 4 绒毛和隐窝富集物基因组DNA电泳 Fig. 4 Electrophoresis of the genome DNA extracted from crypt and villus enrichments |
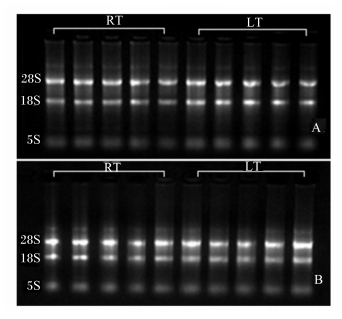 | 图 5 绒毛和隐窝富集物总RNA电泳 Fig. 5 Electrophoresis of the total RNA extracted from crypt and villus enrichments |
根据前述的试验结果,选取了综合分离效果最佳的LT+10 mmol/L EDTA条件下分离的绒毛和隐窝细胞,检测其DEFEN与LYZ的相对表达量,由表 2可知,隐窝富集物中DEFEN与LYZ的相对表达量极显著高于绒毛富集物(P<0.01)。
| 表 2 绒毛、隐窝富集物DEFEN与LYZ的相对表达量 Table 2 DEFEN and LYZ mRNA expression in villus and crypt enrichments |
在LT+10 mmol/L EDTA条件下分离的隐窝细胞经培养1、3、5、7、9 h后,检测了DEFEN与LYZ的相对表达量,结果如图 6。在1~9 h过程中,DEFEN与LYZ的相对表达量均未发生显著变化(P>0.05),但在最初的1 h LYZ与DEFEN的相对表达量有低于3~9 h时的趋势(0.05<P<0.10)。
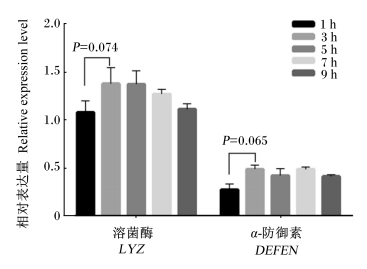 |
数据柱形无字母标注表示差异不显著(P>0.05)。 Value columns with no letter mean no significant difference (P>0.05). 图 6 经细胞培养后隐窝富集物DEFEN与 LYZ的相对表达量 Fig. 6 Relative expression levels of DEFEN and LYZ in crypt enrichments by cell cultured |
小肠上皮细胞体外培养是研究肠道相关生理功能的重要手段,相比于各细胞系而言,原代培养的细胞生理性状与体内状态更接近,在一定程度上能较好地反映小肠的真实生理特征[19]。为更深入的研究肠干细胞生理及潘氏细胞免疫等功能,国内外报道了多种绒毛与隐窝细胞分离方法,常用的螯合剂为EDTA和DTT[20]。EDTA通过螯合作用可以结合并降低组织液中的钙、镁离子,破坏细胞之间的紧密连接,在机械力的作用下使细胞分离,因此可用于纵向分离肠绒毛与隐窝[21]。DTT能够破坏分子间的二硫键,迅速地去除黏液及黏附的细菌,达到分离细胞的目的[14]。螯合剂对细胞有一定的毒害作用,其毒性取决于螯合剂种类、浓度、作用温度与时间[22]。动物的年龄、生理状况、肠段大小和肠道紧密连接状态不同,分离条件也有所不同。
根据各成分作用原理,本研究对沿用次数较多的Flint等[15]的螯合剂配方进行了改良,除加入一定浓度的EDTA外,还加入了5 mmol/L EGTA,并在清洗肠段时加入0.5 mmol/L DTT以快速去除黏液。在分离过程中,使用螯合剂将绒毛和隐窝细胞从小肠组织上分级洗脱下来之后,需要快速去除螯合剂以缩短螯合剂对细胞毒害的时间,且需根据绒毛与隐窝自身沉降系数不同进行富集物的纯化。离心纯化绒毛时需根据试验动物大小确定转速和时间,要求离心力不应过大(<300×g),防止离心力对绒毛结构造成破坏,并能避免将隐窝细胞离心混入绒毛沉淀中[22]。对于较大体型动物的小肠,可使用自然沉降法获得高纯度的绒毛。在隐窝洗脱时不可避免地会混入少量绒毛,需要确定合适的自然沉降时间纯化隐窝细胞。一般以上清液中针尖样大小细胞团即绒毛全部沉入底部时为合理的沉降时间[13]。
本研究结果表明,虽然各分离条件下细胞基因组DNA和总RNA均保存完整,但在不同条件下分离效果存在显著差异。温度越高,螯合剂浓度越大,得到的富集物越多,但细胞团纯度、绒毛完整性和隐窝细胞活率也越差,甚至会对细胞产生一定毒害作用。首先,高EDTA浓度可提高富集率,但同时也是降低隐窝细胞活率和绒毛完整性的主要因素,本研究显示,EDTA浓度高于15 mmol/L时,EDTA浓度对绒毛完整性和隐窝细胞活率的损伤作用远大于温度,作为后续培养的材料,细胞活率和组织完整性是首要考虑的指标,因此,分离时的EDTA浓度不宜高于15 mmol/L。其次,较高的螯合温度可提高富集率,但同时也会降低绒毛完整性和隐窝细胞活率。对绒毛而言,温度越高绒毛碎片越多,即使在最低EDTA浓度 条件下,RT组的绒毛完整性也极显著低于LT组,故分离温度应选择低温;对于隐窝而言,LT+EDTA浓度低于10 mmol/L组和RT+5 mmol/L EDTA组的细胞活率均较好,但LT+5 mmol/L EDTA组隐窝富集率仅有(1.01±0.02)%,细胞量已不能满足后续试验要求。综合考虑绒毛和隐窝细胞的分离效果,本研究选择LT+10 mmol/L EDTA为最适分离条件。
在小肠上皮细胞中,DEFEN和LYZ主要在隐窝的潘氏细胞中表达,因而富集物中这2个基因的差异表达可以有效说明所富集细胞的纯度和分离效果。本试验结果表明,分离的隐窝富集物中DEFEN和LYZ的相对表达量极显著高于绒毛富集物,显示分离的绒毛和隐窝细胞纯度很高,达到预期分离效果。本研究对LT+10 mmol/L EDTA条件下分离的隐窝细胞进行了短时间培养以检测是否达到后续研究的要求。培养3~9 h过程中,隐窝细胞中DEFEN与LYZ的相对表达量均未发生显著变化,表明培养过程中细胞生理状态稳定;在最初的1 h,LYZ与DEFEN的相对表达量有低于3~9 h时的趋势,这可能与分离过程中营养物质缺乏及LT造成了细胞的饥饿和应激有关,但在随后的培养中得到了恢复。这些结果表明,LT+10 mmol/L EDTA条件下分离的小肠绒毛和隐窝细胞可以满足后续研究的要求。
4 结 论① 2个温度和5种EDTA浓度条件下对家兔小肠绒毛和隐窝细胞的分离效果有较大差异,低温螯合时细胞富集率较低,但细胞活率较高,螯合剂中EDTA浓度越高细胞富集率越高,而细胞活率则相应降低。
② 本研究中,LT+10 mmol/L EDTA为最佳分离条件,得到的绒毛和隐窝细胞富集率和纯度较高,形态完整,细胞活率高。
③ 在37 ℃、5% CO2、无血清的生长培养基中培养9 h后的隐窝细胞依然具有较高活力,显示分离的绒毛和隐窝细胞可用于家兔小肠生理特性相关研究。
| [1] | PETERSON L W,ARTIS D.Intestinal epithelial cells:regulators of barrier function and immune homeostasis[J]. Nature Reviews Immunology,2014,14(3):141-153. ( 1) 1)
|
| [2] | HORITA N,TSUCHIYA K,HAYASHI R,et al.Fluorescent labelling of intestinal epithelial cells reveals independent long-lived intestinal stem cells in a crypt[J]. Biochemical and Biophysical Research Communications,2014,454(4):493-499. ( 1) 1)
|
| [3] | BEDFORD A,CHEN T,HUYNH E,et al.Epidermal growth factor containing culture supernatant enhances intestine development of early-weaned pigs in vivo:potential mechanisms involved[J]. Journal of Biotechnology,2015,196-197:9-19. ( 1) 1)
|
| [4] | GRABINGER T,LUKS L,KOSTADINOVA F,et al.Ex vivo culture of intestinal crypt organoids as a model system for assessing cell death induction in intestinal epithelial cells and enteropathy[J]. Cell Death & Disease,2014,5(5):e1228. ( 1) 1)
|
| [5] | VINCENT A,KAZMIERCZAK C,DUCHÊNE B,et al.Cryosectioning the intestinal crypt-villus axis:an ex vivo method to study the dynamics of epigenetic modifications from stem cells to differentiated cells[J]. Stem Cell Research,2015,14(1):105-113. ( 1) 1)
|
| [6] | BERDASCO M,ESTELLER M.DNA methylation in stem cell renewal and multipotency[J]. Stem Cell Research and Therapy,2011,2(5):42. ( 1) 1)
|
| [7] | CLEVERS H.The intestinal crypt,a prototype stem cell compartment[J]. Cell,2013,154(2):274-284. ( 1) 1)
|
| [8] | TANCOS Z,NEMES C,POLGAR Z,et al.Generation of rabbit pluripotent stem cell lines[J]. Theriogenology,2012,78(8):1774-1786. ( 1) 1)
|
| [9] | BEVINS C L,SALZMAN N H.Paneth cells,antimicrobial peptides and maintenance of intestinal homeostasis[J]. Nature Reviews Microbiology,2011,9(5):356-368. ( 1) 1)
|
| [10] | SALZMAN N H.Paneth cell defensins and the regulation of the microbiome:detente at mucosal surfaces[J]. Gut Microbes,2010,1(6):401-406. ( 1) 1)
|
| [11] | EVANS G S,FLINT N,SOMERS A S,et al.The development of a method for the preparation of rat intestinal epithelial cell primary cultures[J]. Journal of Cell Science,1992,101(Pt 1):219-231. ( 1) 1)
|
| [12] | POTHIER P,HUGON J S.Characterization of isolated villus and crypt cells from the small intestine of the adult mouse[J]. Cell and Tissue Research,1980,211(3):405-418. ( 1) 1)
|
| [13] | BJERKNES M,CHENG H.Methods for the isolation of intact epithelium from the mouse intestine[J]. The Anatomical Record,1981,199(4):565-574. ( 2) 2)
|
| [14] | AYABE T,SATCHELL D P,WILSON C L,et al.Secretion of microbicidal α-defensins by intestinal Paneth cells in response to bacteria[J]. Nature Immunology,2000,1(2):113-118. ( 2) 2)
|
| [15] | FLINT N,COVE F L,EVANS G S.A low-temperature method for the isolation of small-intestinal epithelium along the crypt-villus axis[J]. Biochemical Journal,1991,280(2):331-334. ( 3) 3)
|
| [16] | FULLER M K,FAULK D M,SUNDARAM N,et al.Intestinal crypts reproducibly expand in culture[J]. Journal of Surgical Research,2012,178(1):48-54. ( 1) 1)
|
| [17] | 宁宇,王锋超,刘登群,等.在体分离小鼠小肠隐窝绒毛上皮细胞的生化完整性研究[J]. 现代生物医学进展,2009,9(14):2610-2612. ( 1) 1)
|
| [18] | 高博,杨晓农,于学辉,等.家兔GAPDH基因实时荧光定量RT-PCR方法的建立[J]. 中国畜牧兽医,2010,37(1):69-73. ( 1) 1)
|
| [19] | GROSSMANN J,WALTHER K,ARTINGER M,et al.Progress on isolation and short-term ex-vivo culture of highly purified non-apoptotic human intestinal epithelial cells (IEC)[J]. European Journal of Cell Biology,2003,82(5):262-270. ( 1) 1)
|
| [20] | CANO-GAUCI D F,LUALDI J C,OUELLETTE A J,et al.In vitro cDNA amplification from individual intestinal crypts:a novel approach to the study of differential gene expression along the crypt-villus axis[J]. Experimental Cell Research,1993,208(2):344-349. ( 1) 1)
|
| [21] | CHOUGULE P,HERLENIUS G,HERNANDEZ N M,et al.Isolation and characterization of human primary enterocytes from small intestine using a novel method[J]. Scandinavian Journal of Gastroenterology,2012,47(11):1334-1343. ( 1) 1)
|
| [22] | TAUC H M,TASDOGAN A,PANDUR P.Isolating intestinal stem cells from adult Drosophila midguts by FACS to study stem cell behavior during aging[J]. Journal of Visualized Experiments,2014(94):52223. ( 2) 2)
|




