2. 中国农业大学动物科学学院, 北京 100193
2. College of Animal Science and Technology, China Agricultural University, Beijing 100193, China
抗生素在畜禽生产中的应用历史超过50年之久,主要用于减少畜禽发病率、提高生产速度和饲料利用率,然而,滥用抗生素引发众多人畜病原菌产生耐药性,直接危害全球公共健康[1]。研究表明,短期使用低剂量抗生素会造成猪肠道内微生物耐药性基因的数量和多样性增加[2]。研究开发提高动物免疫力和抗病力的策略迫在眉睫,近年发现通过营养调控手段提高畜禽肠道先天性免疫功能成为可行策略之一[3]。
哺乳动物内源合成的抗菌肽(antimicrobial peptide,AMP)具有广谱抗菌作用,其种类多样且功能复杂,参与组成机体先天性免疫系统,微生物对其不易产生抗性[4]。位于肠道表面的上皮细胞可分泌大量多样AMP,以抵挡复杂的微生物环境和病原微生物入侵[4],与肠上皮黏膜表面分泌型免疫球蛋白A(sIgA)共同形成先天免疫屏障[5]。近年关于AMP参与免疫调节的研究日益增多,它们可通过趋化途径和调控Toll样受体(TLR)信号强度发挥免疫调控功能[6]。目前,在猪体内共发现25种AMP,分别为11种cathelicidins、12种防御素、1种saposin和1种cecropin[7]。研究发现,多种因素可影响和调控内源AMP表达,包括发育阶段、损伤、营养物质(如维生素D、短链脂肪酸、氨基酸等)及脂多糖(lipopolysaccharide,LPS)等。前期研究发现异亮氨酸可调控断奶仔猪肠道黏膜免疫功能,并对AMP表达具有一定的促进作用[8]。但关于营养水平对猪肠上皮细胞AMP表达的影响的研究较少,有关AMP诱导表达的分子机制知之甚少。因此,本研究以猪小肠上皮细胞系IPEC-J2为模型,研究营养和细菌应激及不同氨基酸处理对小肠上皮细胞AMP和信号通路蛋白表达的影响,旨在为研究应激和营养素调控内源AMP表达及肠上皮黏膜屏障功能的提高提供借鉴,也为免疫促进功能的营养物质筛选提供理论基础。
1 材料与方法 1.1 细胞培养猪肠上皮细胞系IPEC-J2为本实验室保存,受赠于伍国耀教授(Texas A & M University)。该细胞系分离自新生仔猪空肠上皮,单层贴壁生长,其培养基为含5%(体积分数)胎牛血清(fetal bovine serum,FBS)(Gibco,美国)、1%胰岛素硒(insulin transferrin selenium,ITS)(ScienCell,美国)和1 μg/L内皮生长因子(endothelial growth factor,EGF)(Sigma,美国)的DMEM/F12培养基(Hyclone,中国)。
1.2 试验设计和处理猪小肠上皮细胞IPEC-J2接种于6孔板,加入完全培养基,培养至80%细胞愈合时进行试验。营养与大肠杆菌应激:弃去待处理细胞的细胞液,换新的培养基,其中对照组为DMEM/F12培养基,饥饿组为饥饿培养基(Earle’s盐平衡缓冲液+维生素混合液),大肠杆菌组为DMEM/F12培养基+1×103 CFU/孔大肠杆菌,处理12 h后收集细胞。氨基酸处理:弃去待处理细胞的细胞液,加入以下处理培养基:对照组为饥饿培养基,丙氨酸组为饥饿培养基中添加1.0 mmol/L的丙氨酸(异亮氨酸等氮组),异亮氨酸组为饥饿培养基中添加1.0 mmol/L的异亮氨酸,处理12 h后收集细胞。
1.3 总mRNA提取和反转录参照RNAzol RT(Molecular Research Center,美国)试剂盒说明书提取肠上皮细胞总mRNA。用Nanodrop仪检测mRNA浓度和质量,其中当OD260 nm/OD280 nm在1.8~2.0和OD260 nm/OD230 nm在1.5~2.2时说明RNA质量较好,可用于下一步试验。将mRNA按照反转录试剂盒操作(TaKaRa,中国)反转成cDNA,内参基因β-肌动蛋白(β-actin)PCR检验反转效果,并贮存于-20 ℃,备用。
1.4 基因引物设计内参基因(β-actin)、AMP基因[猪防御素2(pBD-2)、猪防御素3(pBD-3)和猪防御素EP2c(pEP2c)]以及信号通路蛋白基因[沉默信息调节因子2同源蛋白1(Sirt1)、叉头转录因子1(FoxO1)和叉头转录因子4(FoxO4)]引物通过Primer Premier 6.0软件设计,由北京三博志远生物技术有限公司合成。根据梯度PCR和琼脂糖凝胶电泳检测引物的最适退火温度和扩增片段的特异性,无引物二聚体和非特异扩增的引物可用,引物序列见表 1。
| 表1 荧光定量PCR引物序列 Table 1 Primer sequences for real-time quantitative PCR |
将所提cDNA经相应引物PCR扩增后,回收基因片段,按10-1~10-9倍连续稀释,选择10-2~10-9 8个梯度绘制标准曲线,每个梯度3个重复,进行预试验,验证引物扩增效率。将反转的cDNA作为模板进行荧光定量PCR,按照SYBR Green定量PCR试剂盒(TaKaRa,中国)操作,采用10 μL反应体系,其中检测β-actin时cDNA量为1/20,检测目的基因时cDNA量为1/10,荧光定量PCR在ABI7500快速检测系统(Applied Biosystems,美国)中进行。PCR反应程序为:95 ℃ 5 s,60 ℃ 34 s,72 ℃ 10 s,42个循环。
1.6 数据分析根据2-△△CT法分析基因表达情况,以内参基因为参照,获得目的基因相对表达量,每个处理3个重复。相对表达量数值采用SAS 8.1(SAS Institute,Gary,美国)单因子方差分析(one-way ANOVA)模型进行统计分析,若处理间差异显著,用Duncan氏法多重比较进行检验。试验结果均以平均值±标准误表示,P<0.05表示差异显著。
2 结果与分析 2.1 应激和氨基酸处理对IPEC-J2 AMP表达的影响猪小肠上皮细胞系单层贴壁生长(图 1),增长速度快,当细胞愈合至90%以上时生长速率降低。本研究筛选出3种猪AMP基因引物用于荧光定量PCR,均为β防御素,分别为pBD-2、pBD-3和pEP2c。营养和大肠杆菌应激对猪肠上皮细胞系IPEC-J2防御素转录水平的影响见图 2。结果表明,与对照组相比,细胞液中加入1×103 CFU/孔大肠杆菌并未显著影响pBD-2、pBD-3和pEP2c的表达(P>0.05);而饥饿应激则显著降低了防御素的表达(P<0.05),其中pBD-2表达水平降至对照组的47%,pBD-3降至58%,pEP2c降至25%。与对照组相比,丙氨酸和异亮氨酸处理后,发现丙氨酸未显著影响pBD-2和pBD-3表达(P>0.05),但显著提高了pEP2c表达(P<0.05);而异亮氨酸则 显著促进了3种防御素表达(P<0.05),pBD-2表达升高至5.68倍,pBD-3表达升高至9.94倍,pEP2c升高至5.34倍。丙氨酸作为异亮氨酸的等氮对照处理,旨在说明异亮氨酸对防御素的诱导表达是其本身作用还是氮素的作用,以上结果说明氮素的补充可影响防御素pEP2c的表达,但异亮氨酸对防御素表达具有较强的促进作用,此作用与氮素无关。
 | 图1 猪小肠上皮细胞系IPEC-J2 Fig. 1 Porcine intestinal epithelial cell line IPEC-J2 (200×) |
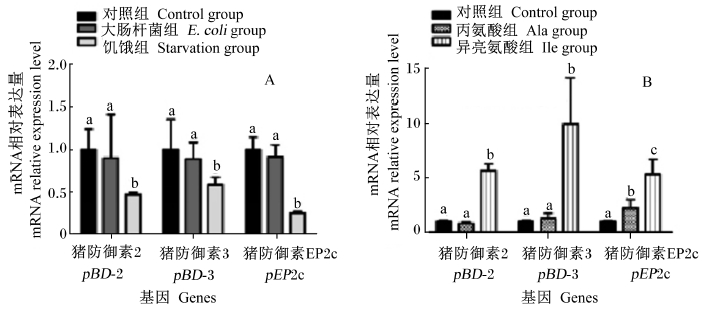 |
同基因数据柱形标注不同小写字母表示差异显著(p<0.05)。下图同。 Value columns of a gene with different small letter superscripts mean significant difference (P<0. 05). The same as below. 图2 应激(A)和氨基酸处理(B)对IPEC-J2细胞中防御素表达的影响 Fig. 2 Effects of stress (A) and amino acid treatments (B) on defensin expression in IPEC-J2 cells |
本试验选用3种信号通路蛋白,分别是Sirt1、FoxO1和FoxO4。结果显示,与对照组相比,饥饿应激显著降低了IPEC-J2细胞内信号通路蛋白的表达(P<0.05),Sirt1表达水平降低至对照组的36%,FoxO1降低至31%,FoxO4降低至39%(图 3)。与对照组相比,丙氨酸和异亮氨酸均不同程度影响信号通路蛋白的转录,其中,丙氨酸显著提高了Sirt1(2.13倍)和FoxO4(3.16倍)的表达水平(P<0.05),异亮氨酸显著促进了Sirt1(30.76倍)、FoxO1(3.45倍)和FoxO4(3.00倍)表达(P<0.05)。
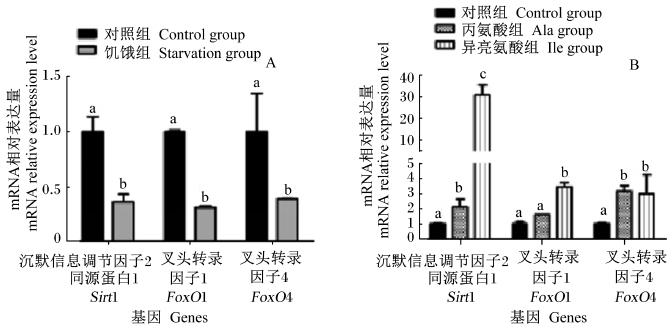 | 图3 营养应激(A)和氨基酸处理(B)对IPEC-J2细胞中信号通路蛋白表达的影响 Fig. 3 Effects of nutritional stress (A) and amino acid treatments (B) on signaling pathway protein expression in IPEC-J2 cells |
动物肠道黏膜面临大量挑战,如维持共生菌群平衡和阻止病原微生物入侵。肠上皮表面的AMP在抵御微生物过程中扮演重要角色,这些“天然抗生素”属于进化古老的先天性免疫效应因子[9]。其中,β防御素是目前研究最为深入和存在最为广泛的AMP之一,它一方面可阻止上皮表面微生物的入侵,另一方面参与机体免疫调节[10]。近年研究表明,猪肠道上皮组织可表达多种β防御素[11]。猪小肠细胞系IPEC-J2是一种未完全分化的肠上皮细胞,分离于初生仔猪空肠上皮组织,其保持了肠道细胞的多种特性,如表达β防御素等[12]。为研究营养和微生物应激以及氨基酸对小肠上皮细胞AMP表达的作用,本试验筛选到IPEC-J2可表达的3种猪源β防御素(即pBD-2、pBD-3和pEP2c)引物。
内源AMP的表达和活性受多种因素调控,如细菌和LPS、营养供给和一些功能性营养物质等。Muturi等[13]和Becker等[14]研究发现饥饿可增加埃及伊蚊和果蝇防御素表达,而Akoda等[15]研究结果表明饥饿未影响舌蝇体内AMP的表达,而大肠杆菌却可刺激其表达。与前人研究结果不同,本试验发现去除培养基中氨基酸对IPEC-J2细胞造成营养应激可显著降低防御素的表达,但大肠杆菌未显著影响防御素表达。本试验中大肠杆菌添加浓度为103 CFU/mL,Akoda等[15]研究添加10 mL OD600 nm为0.5的大肠杆菌菌体,可能是由于添加量上的差异造成上述结果不同。有关饥饿和细菌对哺乳动物细胞AMP作用的研究较为缺乏,因种属、试验对象(体内和体外)和防御素种类的不同造成了以上结果的差异,关于营养和细菌应激对AMP的影响仍需更多的研究。近期研究发现,氨基酸能够促进不同的上皮细胞表达β防御素,Fehlbaum等[16]报道3.12~12.50 μg/mL异亮氨酸可显著促进牛肾上皮细胞中β防御素的表达,但当浓度≥25 μg/mL时这种促进作用明显降低。Sherman等[17]研究发现100~250 μg/mL异亮氨酸能够促进人结肠癌细胞系(HCT-116)中人β防御素1表达,Konno等[18]也报道细胞培养基中添加5~50 μg/mL的异亮氨酸可提高人结肠上皮细胞系Caco-2中人β防御素2的表达。本试验发现,培养基中添加1.0 mmol/L(约131 μg/mL)异亮氨酸可显著促进β防御素的表达,此结果与前人研究一致,而添加等氮量丙氨酸却未见此作用,说明异亮氨酸的作用并非是由于补充氮源而影响防御素的转录。
通过氨基酸饥饿造成的营养应激和氨基酸的补充均属于营养物质调控范畴。研究表明,调节控制动物体内AMP表达的信号通路有核转录因子κB(NF-κB)、细胞外信号调节激酶(ERK)、沉默信息调节因子2同源蛋白(Sirt)和叉头转录因子(FoxO)等[4]。其中,NF-κB信号通路主要是细菌、LPS和感染等影响AMP表达的作用通路[19],本研究结果未发现大肠杆菌对防御素的影响,因此未测定该通路蛋白的变化。氨基酸相关的信号通路主要有丝裂原活化蛋白激酶(MAPK)、Sirt、哺乳动物雷帕霉素靶蛋白(mTOR)、FoxO等[20, 21],由此可见,氨基酸可能是Sirt和FoxO信号通路调控AMP表达。Sirt1是一种烟酰胺腺嘌呤二核苷酸(NAD)依赖去乙酰化酶,它是酿酒酵母沉默信息调节因子2同源蛋白2(Sirt2)基因在哺乳动物体内的同源基因,目前有关其研究主要集中在寿命调控方面[22]。近年,越来越多的研究表明Sirt1还是一种重要的营养物质敏感性生长调节因子[23]。D’Antona等[24]研究发现,支链氨基酸(包括异亮氨酸)可影响大鼠体内Sirt1的表达水平。FoxO是叉头(forkhead)蛋白家族的一个亚群,从蠕虫到人类均有表达,其在哺乳动物细胞中分别由4个基因编码组成:FoxO1、叉头转录因子3(FoxO3)、FoxO4和叉头转录因子6(FoxO6)。作为一种转录因子,FoxO家族参与调控细胞增殖、免疫反应和机体寿命[25]。应激和营养物质可通过FoxO依赖通路调节Sirt1[26],而Sirt1可直接影响防御素的表达[27]。Becker等[14]研究发现,营养应激可影响FoxO的活化程度,进而调节AMP表达。本试验结果发现,营养应激在降低防御素表达的同时也降低了Sirt1和FoxO表达水平,而异亮氨酸则显著促进了防御素以及信号通路蛋白Sirt1和FoxO的表达,其中对Sirt1的促进作用最为强烈,丙氨酸促进了pEP2c以及信号通路蛋白Sirt1和FoxO4的表达,但程度显著低于异亮氨酸,验证了前人研究结果,说明营养应激与氨基酸对防御素表达的调控与Sirt1和FoxO信号通路有关,但信号通路蛋白对不同氨基酸的应答反应程度各不相同,具体调控通路还需进一步的研究。
4 结 论综上,营养应激可降低猪小肠上皮细胞中β防御素的表达,而氨基酸的补充可促进β防御素表达,其中异亮氨酸的促进作用最为显著。营养应激和氨基酸对防御素的调控作用可能与Sirt1和FoxO信号通路蛋白有关。
| [1] | ZHU Y G,JOHNSON T A,SU J Q,et al.Diverse and abundant antibiotic resistance genes in Chinese swine farms[J].Proceeding of the National Academy of Science United States of America,2013,110(9):3435-3440.( 1) 1) |
| [2] | LOOFT T,JOHNSON T A,ALLEN H K,et al.In-feed antibiotic effects on the swine intestinal microbiome[J].Proceeding of the National Academy of Science United States of America,2012,109(5):1691-1696.( 1) 1) |
| [3] | VELDHUIZEN E J A,RIJNDERS M,CLAASSEN E A,et al.Porcine β-defensin 2 displays broad antimicrobial activity against pathogenic intestinal bacteria[J].Molecular Immunology,2008,45(2):386-394.( 1) 1) |
| [4] | GALLO R L,HOOPER L V.Epithelial antimicrobial defence of the skin and intestine[J].Nature Reviews Immunology,2012,12(7):503-516.( 2) 2) |
| [5] | 任曼,霍应峰,杨凤娟,等.仔猪断奶前后肠道形态和相关免疫蛋白基因表达的变化[J].动物营养学报,2014,26(3):614-619.( 1) 1) |
| [6] | DI NARDO A,BRAFF M H,TAYLOR K R,et al.Cathelicidin antimicrobial peptides block dendritic cell TLR4 activation and allergic contact sensitization[J].Journal of Immunology,2007,178(3):1829-1834.( 1) 1) |
| [7] | ZENG X F,SUNKARA L T,JIANG W Y,et al.Induction of porcine host defense peptide gene expression by short-chain fatty acids and their analogs[J].PLoS One,2013,8(8):E72922.( 1) 1) |
| [8] | REN M,ZHANG S H,ZENG X F,et al.Branched-chain amino acids are beneficial to maintain growth performance and intestinal immune-related function in weaned piglets fed protein restricted diet[J].Asian Australasian Journal of Animal Sciences,2015,28(12):1742-1750.( 1) 1) |
| [9] | ZASLOFF M.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415(6870):389-395.( 1) 1) |
| [10] | SANTAOLALLA R,FUKATA M,ABREU M T.Innate immunity in the small intestine[J].Current Opinion in Gastroenterology,2011,27(2):125-131.( 1) 1) |
| [11] | MAO X B,QI S,YU B,et al.Dietary L-arginine supplementation enhances porcine β-defensins gene expression in some tissues of weaned pigs[J].Livestock Science,2012,148(1/2):103-108.( 1) 1) |
| [12] | MAO X B,QI S,YU B,et al.Zn2+ and L-isoleucine induce the expressions of porcine β-defensins in IPEC-J2 cells[J].Molecular Biology Reports,2013,40(2):1547-1552.( 1) 1) |
| [13] | MUTURI E J,KIM C H,ALTO B W,et al.Larval environmental stress alters Aedes aegypti competence for Sindbis virus[J].Tropical Medicine & International Health,2011,16(8):955-964.( 1) 1) |
| [14] | BECKER T,LOCH G,BEYER M,et al.FOXO-dependent regulation of innate immune homeostasis[J].Nature,2010,463(7279):369-373.( 2) 2) |
| [15] | AKODA K,VAN DEN BOSSCHE P,MARCOTTY T,et al.Nutritional stress affects the tsetse fly's immune gene expression[J].Medical and Veterinary Entomology,2009,23(3):195-201.( 2) 2) |
| [16] | FEHLBAUM P,RAO M,ZASLOFF M,et al.An essential amino acid induces epithelial β-defensin expression[J].Proceeding of the National Academy of Science United States of America,2000,97(23):12723-12728.( 1) 1) |
| [17] | SHERMAN H,CHAPNIK N,FROY O.Albumin and amino acids upregulate the expression of human beta-defensin 1[J].Molecular Immunology,2006,43(10):1617-1623.( 1) 1) |
| [18] | KONNO Y,ASHIDA T,INABA Y,et al.Isoleucine,an essential amino acid,induces the expression of human β defensin 2 through the activation of the G-protein coupled receptor-ERK pathway in the intestinal epithelia[J].Food and Nutrition Sciences,2012,3(4):548-555.( 1) 1) |
| [19] | WEHKAMP J,HARDER J,WEHKAMP K,et al.NF-κB- and AP-1-mediated induction of human beta defensin-2 in intestinal epithelial cells by Escherichia coli Nissle 1917:a novel effect of a probiotic bacterium[J].Infection and Immunity,2004,72(10):5750-5758.( 1) 1) |
| [20] | YONEDA J,ANDOU A,TAKEHANA K.Regulatory roles of amino acids in immune response[J].Current Rheumatology Reviews,2009,5(4):252-258.( 1) 1) |
| [21] | DE SIMONED R,VISSICCHIO F,MINGARELLI C,et al.Branched-chain amino acids influence the immune properties of microglial cells and their responsiveness to pro-inflammatory signals[J].Biochimica et Biophysica Acta:Molecular Basis of Disease,2013,1832(5):650-659.( 1) 1) |
| [22] | TANNO M,SAKAMOTO J,MIURA T,et al.Nucleocytoplasmic shuttling of the NAD+-dependent histone deacetylase SIRT1[J].Journal of Biological Chemistry,2006,282(9):6823-6832.( 1) 1) |
| [23] | NARALA S R,ALLSOPP R C,WELLS T B,et al.SIRT1 acts as a nutrient-sensitive growth suppressor and its loss is associated with increased AMPK and telomerase activity[J].Molecular Biology of the Cell,2008,19(3):1210-1219.( 1) 1) |
| [24] | D'ANTONA G,RAGNI M,CARDILE A,et al.Branched-chain amino acid supplementation promotes survival and supports cardiac and skeletal muscle mitochondrial biogenesis in middle-aged mice[J].Cell Metabolism,2010,12(4):362-372.( 1) 1) |
| [25] | JONSSON H,PENG S L.Forkhead transcription factors in immunology[J].Cellular and Molecular Life Sciences,2005,62(4):397-409.( 1) 1) |
| [26] | NEMOTO S,FERGUSSON M M,FINKEL T.Nutrient availability regulates SIRT1 through a forkhead-dependent pathway[J].Science,2004,306(5704):2105-2108.( 1) 1) |
| [27] | LEE S I,MIN K S,BAE W J,et al.Role of SIRT1 in heat stress- and lipopolysaccharide-induced immune and defense gene expression in human dental pulp cells[J].Journal of Endodontics,2011,37(11):1525-1530.( 1) 1) |




