2. 中国农业科学院-世界农用林业中心, 农用林业与可持续畜牧业联合实验室, 北京 100081;
3. 东北农业大学, 食品安全与营养协同创新中心, 哈尔滨 150030
2. CAAS-ICRAF Joint Laboratory on Agroforestry and Sustainable Animal Husbandry, Beijing 100081, China;
3. Synergetic Innovation Center of Food Safety and Nutrition, Harbin 150030, China
热应激可引起牛奶中乳蛋白含量的降低,从而降低夏季牛奶品质[1, 2]。探明由热应激直接引起乳蛋白含量下降的原因,对提升夏季热应激时期的乳品质具有非常重要的意义。奶牛在热应激条件下通过降低干物质采食量(DMI)和驱动机体内分泌激素的平衡以适应热应激状态[3],乳蛋白的合成受到激素的调控和驱动[4],其中主要包括生长激素(growth hormone,GH)、催乳素(prolactin,PRL)、胰岛素(insulin,INS)及类胰岛素样生长因子1(insulin-like growth factors-1,IGF-1)[5],这些激素主要通过Janus激酶(Janus kinase,JAK)-信号转导及转录激活因子(signal transducer and activator of transcription,STAT)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等信号通路作用于转录和翻译的起始和延伸阶段,来调控蛋白质的合成[5]。
热应激能降低细胞的活力,诱导细胞凋亡[6, 7, 8]。通过体外培养乳腺上皮细胞,研究发现高温抑制乳腺上皮细胞正常生长,促使细胞凋亡[7],还发现热应激上调了乳腺细胞中与B淋巴细胞瘤-2相关X蛋白(B-cell lymphoma-2-associated X protein,BAX)基因(促凋亡基因)的表达量,而B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)基因(抑制凋亡基因)先上调后下调[9]。此外,通过设置与热应激组采食量保持一致的配对限饲组排除了热应激时采食量下降对牛奶乳蛋白含量的影响,并且发现热应激时DMI降低只能解释一部分的乳蛋白含量下降,而剩余部分的乳蛋白含量下降由热应激直接引起[10, 11, 12]。
热应激对生产性能、乳成分等方面影响已有大量相关报道。体外培养奶牛乳腺细胞也表明热应激可促进体外培养乳腺细胞的凋亡[7]。但热应激是否通过活体牛乳腺细胞中JAK-STAT和mTOR通路影响乳蛋白的合成,以及热应激是否促进活体牛乳腺细胞的凋亡目前尚未见报道。本试验目的是研究热应激时乳蛋白含量降低与泌乳相关激素、乳蛋白合成相关信号通路及乳腺组织中细胞凋亡的关系,并通过对非热应激牛限饲处理排除热应激时由于DMI下降而造成的间接影响,从中揭示热应激引起乳蛋白下降的直接原因,为缓解热应激时乳蛋白含量下降提供理论依据。
1 材料与方法 1.1 试验设计与饲养管理选取4头泌乳日龄[(101±10) d]、体重[(574±36) kg]、产奶量[(38.0±2.4) kg/d]相近的经产健康荷斯坦奶牛,随机分配到4个大家畜环境控制舱(kooland,北京库蓝科技有限公司;4.0 m×3.0 m×2.5 m;温度15~40 ℃;相对湿度25%~85%;光照0~800 lx,连续可调)。采取2×2交叉试验设计,试验共2期,每期18 d(其中预试期和试验期各9 d),2期之间间隔30 d。预试期4头牛均处于热中性环境[温度20 ℃;相对湿度55%;温湿指数(THI)65.5;12 h光照],且自由采食。试验期试验动物随机分2组(n=2),分别为热应激(HS)组[温度:06:00—18:00,36 ℃,18:00—06:00(次日),32 ℃;相对湿度55%;THI 84.5;12 h光照]和配对限饲(PRF)组(温度20 ℃;相对湿度55%;THI 65.5;12 h光照),其中热应激组为自由采食,且提供足够量的饲粮。配对限饲组的某天饲喂量(采食量)占该组牛预试期DMI平均值百分比与热应激组此前1 d DMI占该组牛预试期DMI平均值百分比(26.8%~61.0%)保持一致,即配对限饲组相对于热应激组错后1 d开始和结束试验以及采集样品,保证试验期内热应激组和配对限饲组每天DMI保持一致。THI设置参考热应激阈值[13]。
试验期间每天早晚饲喂2次(05:00和17:00),饲喂同时挤奶,并记录每头牛产奶量。于第2天晨饲前收集剩料并称重。所有试验动物自由饮水。根据NRC(2001)奶牛营养需要量推荐值[14],配制饲粮,精粗比为50 ∶ 50,其组成及营养水平参见表 1,以全混合日粮(TMR)形式饲喂。代谢室卫生管理按动物营养学国家重点实验室常规程序进行。
| 表 1 饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
预试期和试验期(试验期配对限饲组相对于热应激组错后1 d开始)每天3次(07:00、14:00、22:00)记录每头牛的直肠温度、呼吸频率及每个舱的温度、湿度;预试期和试验期每天采集牛奶样品50 mL(早晚各取25 mL),乳样加重铬酸钾防腐剂(0.6 mg/mL)混合均匀后于4 ℃存放;预试期和试验期第2、4、6、8天采食后2~3 h采集尾动/静脉血液10 mL,静置30 min后4 ℃,1 500×g离心20 min,用1.5 mL EP管收集血清,-20 ℃保存;预试期和试验期第2、4、6、8天采集饲粮样品,于第2天晨饲前采集剩料样品;试验期的第9天活体采集乳腺组织样品,采集方法参考《反刍动物营养学研究方法》[15]。
1.3 指标测定饲粮和剩料样品采集后60 ℃烘干48 h测定水分含量(GB/T 6435—1986,强制对流烘箱UFE400,德国MEMMERT),烘干样品粉碎过40目筛后-20 ℃保存,用于其他指标的测定。饲料常规参照国家标准分析粗灰分(GB/T 6438—1992,箱式电阻炉SRJX-8-13,天津市泰斯特仪器有限公司)、粗脂肪(GB/T 6433—2006,粗脂肪分析仪SoxtecTMAVANTI 2043,丹麦FOSS)、粗蛋白质含量(GB/T 6432—1994,全自动凯氏定氮仪FOSS KJELTEC 2300,丹麦FOSS)。中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量参照Van Soest等[16]的方法测定,称取0.5 g左右样品封装于纤维测定专用滤袋(中国农业大学动物科技学院),使用全自动纤维分析仪(A2000i,美国ANKOM)洗涤,洗涤时滴加2滴淀粉酶处理。
采用红外分光光度法(全自动乳成分分析仪Minor-78110,丹麦FOSS)分析乳蛋白含量。血清中GH、INS、PRL含量采用南京建成生物工程研究所试剂盒测定。血清中IGF-1含量测定采用上海酶联生物科技有限公司试剂盒测定。
1.4 实时定量PCR分析基因表达量 1.4.1 细胞总RNA提取乳腺组织在液氮中研磨后提取乳腺组织总RNA,采用NanoDrop1 000检测RNA纯度及260和280 nm波长下吸光度值的比(OD260 nm/OD280 nm),测定值在1.8~2.0符合反转录要求。浓度调整至500 ng/μL,用于后续反转录。
1.4.2 反转录采用Prime ScriptTM RT reagent Kit With gDNA Erase (日本TaKaRa)试剂盒进行反转录。反转录体系为10 μL:5×Prime Script RT Master Mix 2 μL,总RNA 1 μL,无RNA酶水7 μL。反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃保存,获得cDNA,-20 ℃保存备用。
1.4.3 实时定量RCR以cDNA为模板,参照TaKaRa的SYBR Green说明书进行实时定量RCR,选用广泛表达转录蛋白(UXT)基因为内参。试验中所用基因引物均由华大基因合成,引物序列见表 2。其中催乳素受体(PRLR)、胰岛素受体(INSR)、JAK2、STAT5B、ets结构域转录因子5(ELF5)、mTOR、真核翻译起始因子4E结合蛋白1(eIF4EBP1)、真核翻译起始因子4E 结合蛋白2(eIF4EBP2)、核糖体S6蛋白激酶(ribosomal protein S6 kinase,S6K1)、UXT基因引物序列参见Bionaz等[5];D-冬氨酸特异性半胱氨酸蛋白酶3(CASP3)、环氧合酶-2(COX2)基因引物序列参见De Moraes等[17];脂肪酸合成酶(FAS)、Bcl-2、BAX、D-冬氨酸特异性半胱氨酸蛋白酶8(CASP8)基因引物序列参见Kamemori等[18];肿瘤坏死因子受体1(TNFR1)基因引物序列参见Okuda等[19]。反应体系为20 μL:10 μL SYBR Premix Ex TaqTMⅡ(2×)、0.8 μL上游引物、0.8 μL下游引物、2 μL cDNA、6.4 μL无RNA酶水。反应程序:第1阶段95 ℃ 30 s;第2阶段退火延伸95 ℃ 5 s,60 ℃ 34 s,40个循环。熔解曲线程序为55 ℃ 30 s,41个循环。合成的cDNA贮存于-20 ℃冰箱中,备用。利用IQ5实时定量序列检测软件(Bio-Rad versa Doc,美国Bio-Rad)自动读取循环阈值(Ct),并采用2-∆∆CT法分析基因相对表达量。
| 表 2 引物序列 Table 2 Primer sequence |
每期预试期的呼吸频率、直肠温度、乳蛋白含量、乳蛋白产量、DMI及其他主要营养物质采食量平均值作为该期试验期的协变量,用SAS 9.3中Mixed模型进行方差分析,最小二乘均数法做平均值比较。P<0.01为差异极显著评判标准,P<0.05为差异显著评判标准,0.05≤P<0.10为存在趋势评判标准。
2 结 果 2.1 环境THI及奶牛直肠温度、呼吸频率和采食量由表 3可知,热应激组和配对限饲组THI分别为82.4和64.6,热应激组极显著高于配对限饲组(P<0.01)。与配对限饲组相比,热应激组极显著提高了奶牛的呼吸频率和直肠温度(P<0.01)。由图 1可看出,试验期热应激组THI日平均值均高于72,而预试期和试验期配对限饲组低于72。由表 3和图 2可知,热应激组和配对限饲组DMI及其他主要营养物质采食量无显著差异(P>0.05)。
| 表 3 环境温湿指数及奶牛直肠温度、呼吸频率和采食量 Table 3 Environmental THI and RT, RP and feed intake of cows |
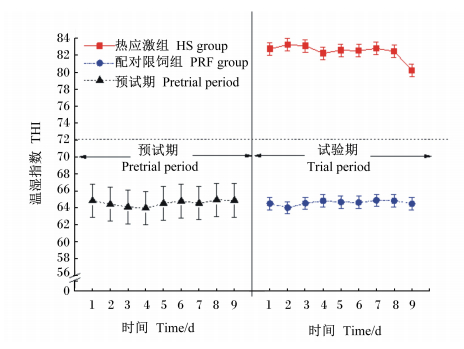 | 图 1 预试期和试验期THI日平均值 Fig. 1 Daily mean of THI during pretrial period and trial period |
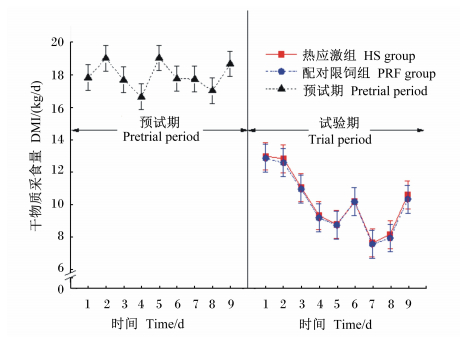 | 图 2 预试期和试验期DMI日平均值 Fig. 2 Daily mean of DMI during pretrial period and trial period |
由表 4可知,与配对限饲组相比,热应激组显著降低了乳蛋白含量和产量(P<0.05)。
| 表 4 热应激对乳蛋白含量和产量的影响 Table 4 Effects of heat stress on milk protein content and yield |
由表 5可知,热应激组奶牛血液中GH、INS、PRL及IGF-1含量与配对限饲组差异不显著(P>0.05)。
| 表 5 热应激对泌乳相关血液激素含量的影响 Table 5 Effects of heat stress on blood hormone contents involved in lactation |
由表 6可知,相对于配对限饲组,热应激组显著提高了PRLR基因表达量(P<0.05),而对INSR基因表达量的影响不显著(P>0.05)。热应激对JAK-STAT通路基因(JAK2、STAT5B、ELF5)表达量的影响不显著(P>0.05),对mTOR通路基因(mTOR、eIF4EBP1、eIF4EBP2、S6K1)中mTOR和S6K1基因表达量有显著的影响(P<0.05)或有显著影响的趋势(0.05≤P<0.10)。与配对限饲组相比,热应激显著提高了mTOR基因表达量(P<0.05),且有提高S6K1基因表达量的趋势(0.05≤P<0.10),对eIF4EBP1及eIF4EBP2的基因表达量没有显著的影响(P>0.05)。
| 表 6 热应激对JAK-STAT和mTOR信号通路基因表达量的影响 Table 6 Effects of heat stress on gene expressions of JAK-STAT and mTOR pathways |
由表 7可知,与配对限饲组相比,热应激组提高了乳腺细胞中CASP3(P<0.05)、COX2(P<0.05)和BAX的基因表达量(0.05≤P<0.10),而对FAS、Bcl-2、TNFR1和CASP8基因表达量影响不显著(P>0.05)。
| 表 7 热应激对细胞凋亡相关基因表达量的影响 Table 7 Effects of heat stress on expression of gene involved in apoptosis |
当THI超过72时奶牛的生产性能开始出现明显下降,故将72作为热应激的THI阈值[13]。然而Zimbleman等[20]研究发现,当THI超过68时高产奶牛已经开始出现热应激反应,且当THI等于68时每24 h产奶量下降2.2 kg。本研究中,试验期热应激组平均THI为82.4,且试验期每天THI平均值均高于72,而预试期和试验期配对限饲组每天THI平均值均低于68,满足热应激组和非热应激组的THI要求。与配对限饲组相比,热应激显著提高了奶牛的呼吸频率和直肠温度。综合以上数据可知,本试验的热应激和非热应激模型构建成功。
大量研究表明,当THI高于72时会引起奶牛DMI的下降[21, 22],同时引起乳蛋白含量下降[23],降低乳品质。进一步的研究发现,热应激时DMI的下降只能解释部分乳蛋白下降[10, 11, 12],剩余部分的乳蛋白下降由热应激直接引起。本研究中热应激组与配对限饲组的乳蛋白含量和产量均随着热应激时间的延长而下降,但配对限饲组的乳蛋白含量在试验期的最后2 d有升高的趋势,这可能与产奶量下降后乳蛋白的浓缩有关。综合以上数据提示,热应激通过DMI下降引起乳蛋白下降的同时还会通过其他途径引起乳蛋白的降低。
乳蛋白的合成受到激素的调控和驱动[4],其中主要包括GH、PRL、INS及IGF-1[5]。GH对促进生长发育及泌乳有重要的作用,主要通过调节机体能量平衡及增加机体蛋白质的合成来产生作用[24]。PRL的主要作用是促进乳腺生长发育、发动和维持泌乳。INS是由胰岛β细胞分泌的一种蛋白质激素,是机体内唯一降低血液GLU的激素,同时促进糖原、脂肪、蛋白质的合成。研究表明,增加血液中INS含量可明显增加乳腺血流量,提高产奶量[25, 26]。IGF-1除可作为GH发挥作用的中介物质以外,还可通过作用于其受体介导的信号通路促进乳腺上皮细胞增殖和腺泡的形成[27]。
目前关于热应激对泌乳相关激素影响的报道不完全一致。宋代军等[28]研究表明,各热应激期泌乳前、中期奶牛血清INS含量有下降的趋势,这与Herbein等[29]的研究结果一致,然而Itoh等[30]研究发现,热应激可显著提高泌乳期奶牛血液INS含量。宋代军等[28]研究表明,泌乳前、中、后期的奶牛在热应激期的血清PRL含量均低于非热应激期,然而朱国标等[31]却得到相反的结果。热应激对GH的影响,目前研究基本一致,热应激可降低奶牛血液中GH含量或有降低的趋势[11, 32, 33]。热应激对IGF-1的影响并没有太多的报道,Rhoads等[11]认为热应激可降低IGF-1含量,而McGuire等[33]研究发现热应激对IGF-1含量并没有显著影响。本研究中,和配对限饲组相比,热应激对血液GH、INS、PRL、IGF-1含量并没有显著影响,这可能与试验动物的数量较少有关。
乳蛋白基因表达的过程主要包括DNA的转录和mRNA的翻译。研究发现,PRL、INS、GH、糖皮质激素、IGF-1等对泌乳有直接或间接的影响,主要通过JAK-STAT和mTOR等信号通路作用于转录和翻译的起始及延伸阶段来调控蛋白质的合成[5]。PRL或GH与相应的受体结合后引起受体分子的二聚体化,这使得与受体偶联的JAK相互接近并通过交互的酪氨酸磷酸化作用而活化。JAK激活后催化受体上的酪氨酸残基发生磷酸化修饰,继而这些磷酸化的酪氨酸位点与周围的氨基酸序列形成“停泊位点(docking site)”,同时STAT5蛋白被招募到这个“停泊位点”。最后,JAK催化结合在受体上的STAT5蛋白发生磷酸化修饰,活化的STAT5以二聚体的形式进入细胞核内与γ干扰素激活序列(GAS)位点结合,诱导ELF5、SOCS1、SOCS2和乳蛋白基因的转录,其中ELF5在调节乳腺中STAT5活性方面发挥着重要作用[34, 35, 36]。mTOR通路中起主要作用的是mTOR复合物1(mTORc1),mTORc1可以磷酸化eIF4EBP的某些位点,使其与真核翻译起始因子(eIF)4E解离,使eIF4E可以与eIF4G和eIF4A结合形成eIF4E·eIF4G·eIF4A复合物。eIF4E·eIF4G·eIF4A复合物被认为对含有5′端非翻译区(5′-UTR)二级结构的mRNA的翻译有重要作用[37],因为eIF4A可使5′-UTR的二级结构解旋,有利于跳读过程的进行,使核糖体能够快速定位到mRNA的起始密码子,从而促进翻译的进行。mTORc1可介导S6K1的磷酸化,S6K1可磷酸化核糖体S6(rpS6)、eIF4B、SKAR(S6K1 Aly/REF-like target)和真核细胞翻译延长因子2(eEF2)激酶,进而影响mRNA翻译的起始和延伸阶段[38]。
热应激对奶牛乳腺细胞中JAK-STAT和mTOR通路的影响目前尚未见报道。Yoshihara等[39]在老鼠上的研究表明热应激对mTOR和eIF4EBP1基因表达量并没有显著的影响。在人肌肉细胞上的研究表明,热应激可增加mTOR、S6K1的磷酸化水平,降低eIF4EBP1的磷酸化水平,但在热应激1 h后eIF4EBP1磷酸化水平恢复到热应激之前的水平[40]。本研究中,热应激对JAK-STAT通路基因表达量并没有显著的影响,但是显著增加了mTOR基因的表达量,并有增加S6K1基因表达量的趋势。本研究中热应激对于CSN3基因的表达量并没有显著的影响,然而胡菡等[9]在体外培养奶牛乳腺上皮细胞上研究发现,热应激可降低乳腺上皮细胞中乳蛋白αS1-酪蛋白和β-酪蛋白的基因的表达量,试验结果的不同可能与体内试验和体外培养细胞的差异以及热应激的程度(胡菡等[9]:42 ℃,本研究:平均直肠温度40.0 ℃)不同造成。综合以上数据,提示热应激可能并没有通过JAK-STAT和mTOR通路影响乳蛋白的合成,且CSN3基因的表达量可能并没有受到热应激的显著影响。
大量研究表明,热应激能降低细胞的活力,诱导细胞凋亡[6, 7, 8]。通过体外培养乳腺细胞,周振峰等[7]发现高温抑制乳腺上皮细胞正常生长,促使细胞凋亡,胡菡等[9]发现热应激上调了乳腺细胞中促凋亡基因BAX的表达量,而抑制凋亡基因Bcl-2先上调后下调。限于无法直接测定活体乳腺组织中乳腺细胞凋亡数量,本研究选择了几个和细胞凋亡相关的基因,通过实时定量PCR分析相关基因表达量来了解热应激对乳腺细胞凋亡的影响。研究发现,热应激显著增加了乳腺细胞中与细胞凋亡相关的基因CASP3、COX2的表达量,且有增加BAX表达量的趋势,而抑制凋亡基因Bcl-2的表达量并未受到影响,提示热应激可能降低了活体乳腺组织中乳腺细胞的活力,促进了乳腺细胞的凋亡。
综合得出,与配对限饲组相比,热应激降低了乳蛋白的含量和产量,而与乳蛋白合成相关的信号通路(JAK-STAT和mTOR通路)的基因表达量并没有下降,提示热应激可能并没有通过JAK-STAT和mTOR通路影响乳腺细胞合成乳蛋白的能力。与体外研究的结果[9]一致的是,热应激增加了活体乳腺细胞中与细胞凋亡相关的基因(CASP3、COX2、BAX)的表达量或有增加的趋势,显示热应激可能诱导了活体乳腺细胞的凋亡。综合考虑,热应激可能并不是通过调控单个乳腺细胞合成乳蛋白的能力来影响乳蛋白的含量和产量,而是通过诱导乳腺细胞的凋亡,减少可用于乳蛋白合成的乳腺细胞的数量来影响乳蛋白的含量和产量。
但是由于目前研究技术的限制,不能活体检测奶牛乳腺组织中乳腺细胞凋亡的情况,尚不能充分证明热应激可诱导活体乳腺细胞的凋亡,需要进一步的改进和提升研究技术,进一步研究热应激引起乳蛋白下降的原因,为采取相关措施缓解热应激引起的乳蛋白下降提供理论依据。
4 结 论热应激可能并不是通过调控单个乳腺细胞合成乳蛋白的能力来影响乳蛋白的含量和产量,而是通过诱导乳腺细胞的凋亡,减少可用于乳蛋白合成的乳腺细胞的数量来影响的。
| [1] | BERNABUCCI U,BASIRICÕ L,MORERA P,et al.Effect of summer season on milk protein fractions in Holstein cows[J]. Journal of Dairy Science,2015,98(3):1815-1827. ( 1) 1)
|
| [2] | MCDOWELL R E,MOODY E G,VAN SOEST P J,et al.Effect of heat stress on energy and water utilization of lactating cows[J]. Journal of Dairy Science,1969,52(2):188-194. ( 1) 1)
|
| [3] | 马露,卜登攀,高胜涛,等.热应激影响奶牛乳腺酪蛋白合成的机制[J]. 动物营养学报,2015,27(11):3319-3325. ( 1) 1)
|
| [4] | NEVILLE M C,MCFADDEN T B,FORSYTH I.Hormonal regulation of mammary differentiation and milk secretion[J]. Journal of Mammary Gland Biology and Neoplasia,2002,7(1):49-66. ( 2) 2)
|
| [5] | BIONAZ M,LOOR J J.Gene networks driving bovine mammary protein synthesis during the lactation cycle[J]. Bioinformatics and Biology Insights,2011,5:83-98. ( 5) 5)
|
| [6] | 童娜.热应激对草鱼肾细胞凋亡的影响[D]. 硕士学位论文.武汉:华中农业大学,2014. ( 2) 2)
|
| [7] | 周振峰,崔瑞莲,王加启,等.热应激对体外培养奶牛乳腺上皮细胞生长、凋亡及其热休克蛋白mRNA转录的影响[J]. 畜牧兽医学报,2010,41(5):600-607. ( 3) 3)
|
| [8] | 蔡亚非,李莲,刘庆华,等.热应激奶牛外周血淋巴细胞凋亡和BAX-α基因表达[J]. 南京农业大学学报,2005,28(1):66-70. ( 2) 2)
|
| [9] | 胡菡,王加启,李发弟,等.高温诱导体外培养奶牛乳腺上皮细胞的应激响应[J]. 农业生物技术学报,2011,19(2):287-293. ( 5) 5)
|
| [10] | BANDARANAYAKA D D,HOLMES C W.Changes in the composition of milk and rumen contents in cows exposed to a high ambient temperature with controlled feeding[J]. Tropical Animal Health and Production,1976,8(1):38-46. ( 2) 2)
|
| [11] | RHOADS M L,RHOADS R P,VANBAALE M J,et al.Effects of heat stress and plane of nutrition on lactating Holstein cows:Ⅰ.Production,metabolism,and aspects of circulating somatotropin[J]. Journal of Dairy Science,2009,92(5):1986-1997. ( 3) 3)
|
| [12] | COWLEY F C,BARBER D G,HOULIHAN A V,et al.Immediate and residual effects of heat stress and restricted intake on milk protein and casein composition and energy metabolism[J]. Journal of Dairy Science,2015,98(4):2356-2368. ( 2) 2)
|
| [13] | ARMSTRONG D V.Heat stress interaction with shade and cooling[J]. Journal of Dairy Science,1994,77(7):2044-2050. ( 2) 2)
|
| [14] | NRC.Nutrient requirements of dairy cattle[M]. 7th ed.Washington,D.C.:The National Academies Press,2001. ( 1) 1)
|
| [15] | 王加启.反刍动物营养学研究方法[M]. 北京:现代教育出版社,2011. ( 1) 1)
|
| [16] | VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science,1991,74(10):3583-3597. ( 1) 1)
|
| [17] | DE MORAES C N,MAIA L,DE LIMA P F,et al.Temporal analysis of prostaglandin F2α receptor,caspase 3,and cyclooxygenase 2 messenger RNA expression and prostaglandin F2α receptor and cyclooxygenase 2 protein expression in endometrial tissue from multiparous Nelore (Bos taurus indicus) cows treated with cloprostenol sodium during puerperium[J]. Theriogenology,2015,83(2):276-284. ( 1) 1)
|
| [18] | KAMEMORI Y,WAKAMIYA K,NISHIMURA R,et al.Expressions of apoptosis-regulating factors in bovine retained placenta[J]. Placenta,2011,32(1):20-26. ( 1) 1)
|
| [19] | OKUDA K,SAKUMOTO R,OKAMOTO N,et al.Cellular localization of genes and proteins for tumor necrosis factor-α (TNF),TNF receptor types Ⅰ and Ⅱ in bovine endometrium[J]. Molecular and Cellular Endocrinology,2010,330(1/2):41-48. ( 1) 1)
|
| [20] | ZIMBLEMAN R B,RHOADS R P,RHOADS,M L,et al.A re-evaluation of the impact of temperature humidity index (THI) and black globe humidity index (BGHI) on milk production in high producing dairy cows[C]//Proceedings of the 24th annual southwest nutrition conference.Arizona:Department of Animal Sciences,the University of Arizona,2009. ( 1) 1)
|
| [21] | 艾阳,曹洋,谢正露,等.热应激时奶牛血液中游离氨基酸流向与乳蛋白下降的关系研究[J]. 食品科学,2015,36(11):38-41. ( 1) 1)
|
| [22] | 程建波,王伟宇,郑楠,等.自然生产条件下热应激周期变化揭示泌乳中期奶牛出现"热应激乳蛋白降低征"[J]. 中国畜牧兽医,2014,41(10):73-84. ( 1) 1)
|
| [23] | WEST J W,MULLINIX B G,BERNARD J K.Effects of hot,humid weather on milk temperature,dry matter intake,and milk yield of lactating dairy cows[J]. Journal of Dairy Science,2003,86(1):232-242. ( 1) 1)
|
| [24] | JOHNSON H D,VANJONACK W J.Effects of environmental and other stressors on blood hormone patterns in lactating animals[J]. Journal of Dairy Science,1976,59(9):1603-1617. ( 1) 1)
|
| [25] | BARBER M C,TRAVERS M T,FINLEY E,et al.Growth-hormone-prolactin interactions in the regulation of mammary and adipose-tissue acetyl-CoA carboxylase activity and gene expression in lactating rats[J]. Biochemical Journal,1992,285:469-475. ( 1) 1)
|
| [26] | BASSETT N S,CURRIE M J,BREIER B H,et al.The effects of ovine placental lactogen and bovine growth hormone on hepatic and mammary gene expression in lactating sheep[J]. Growth Hormone & IGF Research,1998,8(6):439-446. ( 1) 1)
|
| [27] | 王皓宇,秦彤,郝海生,等.胰岛素对体外培养奶牛乳腺上皮细胞乳蛋白、乳脂肪合成相关基因mRNA表达的影响[J]. 畜牧兽医学报,2013,44(5):710-718. ( 1) 1)
|
| [28] | 宋代军,何钦,姚焰础.热应激对不同泌乳阶段奶牛生产性能和血清激素浓度的影响[J]. 动物营养学报,2013,25(10):2294-2302. ( 2) 2)
|
| [29] | HERBEIN J H,AIELLO R J,ECKLER L I,et al.Glucagon,insulin,growth hormone,and glucose concentrations in blood plasma of lactating dairy cows[J]. Journal of Dairy Science,1985,68(2):320-325. ( 1) 1)
|
| [30] | ITOH F,OBARA Y,ROSE M T,et al.Insulin and glucagon secretion in lactating cows during heat exposure[J]. Journal of Animal Science,1998,76(8):2182-2189. ( 1) 1)
|
| [31] | 朱国标,辛火,李继红,等.高热与皮质醇、泌乳素、LPO及SOD的关系[J]. 中国公共卫生学报,1994,13(4):218-219. ( 1) 1)
|
| [32] | MOHAMMED M E,JOHNSON H D.Effect of growth hormone on milk yields and related physiological functions of Holstein cows exposed to heat stress[J]. Journal of Dairy Science,1985,68(5):1123-1133. ( 1) 1)
|
| [33] | MCGUIRE M A,BEEDE D K,COLLIER R J,et al.Effects of acute thermal stress and amount of feed intake on concentrations of somatotropin,insulin-like growth factor (IGF)-Ⅰ and IGF-Ⅱ,and thyroid hormones in plasma of lactating Holstein cows[J]. Journal of Animal Science,1991,69(5):2050-2056. ( 1) 1)
|
| [34] | LIU X,ROBINSON G W,HENNIGHAUSEN L.Activation of STAT5A and STAT5B by tyrosine phosphorylation is tightly linked to mammary gland differentiation[J]. Molecular Endocrinology,1996,10(12):1496-1506. ( 1) 1)
|
| [35] | HENNIGHAUSEN L,ROBINSON G W.Interpretation of cytokine signaling through the transcription factors STAT5A and STAT5B[J]. Genes & Development,2008,22(6):711-721. ( 1) 1)
|
| [36] | SHEKAR P C,GOEL S,RANI S D S,et al.Kappa-casein-deficient mice fail to lactate[J]. Proceedings of the National Academy of Sciences,2006,103(21):8000-8005. ( 1) 1)
|
| [37] | IADEVAIA V,HUO Y L,ZHANG Z,et al.Roles of the mammalian target of rapamycin,mTOR,in controlling ribosome biogenesis and protein synthesis[J]. Biochemical Society Transactions,2012,40(1):168-172. ( 1) 1)
|
| [38] | KIMBALL S R,JEFFERSON L S.New functions for amino acids:effects on gene transcription and translation[J]. The American Journal of Clinical Nutrition,2006,83(2):500S-507S. ( 1) 1)
|
| [39] | YOSHIHARA T,NAITO H,KAKIGI R,et al.Heat stress activates the Akt/mTOR signaling pathway in rat skeletal muscle[J]. Acta Physiologica,2013,207(2):416-426. ( 1) 1)
|
| [40] | KAKIGI R,NAITO H,OGURA Y,et al.Heat stress enhances mTOR signaling after resistance exercise in human skeletal muscle[J]. Journal of Physiological Sciences,2011,61(2):131-140. ( 1) 1)
|




