抵抗素是Steppan等[1]在2001年发现的一种由小鼠脂肪组织特异分泌的小分子蛋白质,因其具有胰岛素抵抗的作用而被人们所关注。在绵羊、猪、牛、兔等动物的肝脏、脾脏、脂肪组织、肺脏中抵抗素均有不同程度的表达,而肥胖或2型糖尿病动物模型中抵抗素表达显著增加,与胰岛素抵抗指数呈正相关[2-4]。王娅等[5]研究发现,重组牛抵抗素具有明显的生物学活性,可提高小鼠血液中葡萄糖和胰岛素水平,促进糖异生,降低胰岛素敏感性。可见,抵抗素与胰岛素抵抗确实存在密切联系,然而其诱导胰岛素抵抗的具体机制尚不明确。近年来研究表明抵抗素具有强烈的促炎效应,在多种炎性疾病中起到重要调控作用,而肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-1(IL-1)以及C反应蛋白(CRP)等也可诱导抵抗素表达,由此形成正反馈调节效应扩大炎症级联反应[6]。肥胖状态下的系统慢性炎症与胰岛素抵抗密切相关,脂肪组织炎症更被认为是胰岛素抵抗发生的始源,多种炎性细胞及炎症因子均可作用于胰岛素信号通路诱导胰岛素抵抗[7]。本文就抵抗素激活肥胖机体胰岛素敏感器官的相关炎症应答诱导胰岛素抵抗的发生做一简要综述。
1 抵抗素诱导组织器官胰岛素抵抗 1.1 诱导脂肪组织胰岛素抵抗抵抗素通过趋化脂肪组织免疫细胞聚集并扩大脂肪组织炎症级联反应损害胰岛素信号通路,最终导致脂肪组织胰岛素抵抗的发生。在健康成年人注射脂多糖(LPS)构建的内毒素血症模型中,炎症因子TNF-α、IL-6、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、急性期反应蛋白和代谢标记物抵抗素、皮质醇、游离脂肪酸的水平升高,但只有抵抗素和急性期反应蛋白的最高值与胰岛素稳态模型评估指数的改变显著相关,可见抵抗素与炎症诱导的胰岛素抵抗有着密切的关系。Qatanani等[8]发现高脂饲喂Humanized resistin mice(敲除鼠抵抗素基因而在巨噬细胞表达人源抵抗素的鼠)与Retn-/-mice(抵抗素基因敲除鼠)相比,脂肪组织TNF-α、IL-6、MCP-1、白介素-1β(IL-1β)的表达量显著增加,胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)丝氨酸307位点磷酸化水平上升,胰岛素敏感性降低,说明抵抗素诱导和维持的脂肪组织炎症环境是促进胰岛素抵抗发生的一个重要因素,在机体先天性免疫和代谢中起到重要连接作用。
肥胖机体脂肪组织炎症以脂肪组织巨噬细胞浸润为特征,被认为是系统慢性低度炎症及胰岛素抵抗的使动环节[7]。肥胖诱导巨噬细胞浸润脂肪组织与MCP-1对血液中单核细胞的趋化作用密不可分,高脂饮食诱导小鼠胰岛素抵抗形成以及脂肪组织巨噬细胞浸润伴随着脂肪组织及血液中MCP-1水平的升高,敲除MCP-1基因后,小鼠胰岛素抵抗及脂肪组织巨噬细胞浸润程度均显著降低[9]。Verma等[10]研究表明抵抗素能诱导内皮细胞大量表达MCP-1、血管细胞黏附分子-1(vascular cell adhesion molecul-1,VCAM-1)。随后Pirvulescu等[11]也证明在内皮细胞/平滑肌细胞共培养体系中抵抗素促进MCP-1、趋化因子(fractalkine,FKN)的表达,并以FKN为效应器正反馈诱导MCP-1的表达,加强单核细胞迁移。在Humanized resistin mice模型中,抵抗素诱导MCP-1水平上升是引起脂肪组织巨噬细胞浸润的主要因素,加剧了脂肪组织炎症以及脂解作用,最终导致胰岛素抵抗的发生。而在体外试验中,抵抗素与T细胞趋化因子具有相似的作用,可通过活化Src-激酶和磷脂酰激醇3-激酶诱导CD4+T细胞的定向迁移[12]。因此,肥胖机体中抵抗素的增多无疑会加剧血液中单核细胞以及其他免疫细胞向脂肪组织的迁移,促进脂肪组织炎症微环境的形成并进一步诱导胰岛素抵抗的发生。
肥胖不仅诱导巨噬细胞积聚于脂肪组织,还 促进其由抗炎的M2态表型[主要表达促炎因子白介素-10(IL-10)、IL-1β]向促炎的M1态表型(主要表达抗炎因子TNF-α、IL-6等)转变,这也是巨噬细胞诱导胰岛素抵抗的主要作用机制[13]。Li等[14]通过高脂饮食诱导肥胖小鼠胰岛素抵抗的发生,恢复正常饮食后,机体胰岛素敏感性得到恢复,M1态表型巨噬细胞也由炎症状态转变为非炎症状态。Wentworth等[15]在人类肥胖中的研究也得到了一致的结论。抵抗素可增强巨噬细胞、单核细胞分泌促炎因子的能力,上调TNF-α、IL-6、MCP-1、白介素-12(IL-12)的基因表达水平,有利于M1态表型巨噬细胞的极化[16-18]。此外,嗜中性粒细胞作为在炎症中最先发挥作用的免疫细胞,在肥胖早期便在脂肪组织浸润中发挥促炎效应并诱导胰岛素抵抗的形成[19]。国内外研究均表明嗜中性粒细胞的嗜苯胺蓝颗粒中储存有大量的抵抗素,炎症刺激(LPS、TNF-α)条件下,嗜中性粒细胞分泌抵抗素的能力明显增加,并将其释放到组织中,从而参与局部组织炎症反应[20-21]。
可见,在肥胖早期抵抗素便在脂肪组织大量表达,一方面刺激血管内皮细胞释放MCP-1等趋化因子,促进单核细胞向脂肪组织迁移;另一方面,抵抗素激活脂肪组织炎症级联反应,诱导大量促炎因子释放,有利于M2态表型巨噬细胞向M1态表型转化,从而加重脂肪组织炎症程度,促进胰岛素抵抗的发生(图 1)。
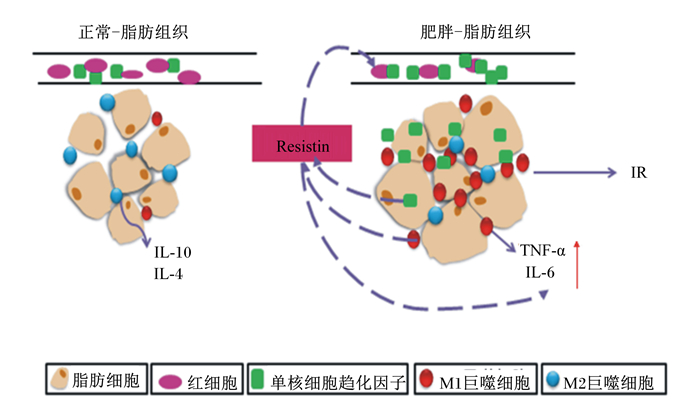
|
Resistin:抵抗素;IR:胰岛素抵抗 insulin resistance。 图1 抵抗素在肥胖诱导的脂肪组织胰岛素抵抗中的促炎作用 Fig. 1 The pro-inflammatory effect of resistin in the insulin resistance of obesity-induced adipose tissue |
肝脏是胰岛素作用的主要靶器官,肝脏胰岛素抵抗是非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)的重要致病因素。抵抗素通过腺苷酸活化蛋白激酶(AMPK)、细胞因子信号抑制物3等信号通路扰乱糖脂代谢,进而诱导肝脏胰岛素抵抗,但其作用并没有得到一致的认可。近年来,大量研究表明抵抗素在NAFLD肝脏炎症的调控中起到重要作用,这为抵抗素诱导肝脏胰岛素抵抗的机制提供了新的思考方向。
肝脏炎症的激活可诱导胰岛素抵抗的发生。杜琳敏[22]研究发现,慢性炎症可使肝脏胰岛素信号通路受阻,糖异生作用增强。对30名进行减肥手术患者的调查研究显示,血清抵抗素高表达者具有更高的肝脏脂肪变性以及炎症评分[23]。而NAFLD患者中血清抵抗素水平与血清白介素-8(IL-8)水平、胰岛素抵抗指数均呈正相关[24-25]。体外试验中,抵抗素可直接刺激小鼠肝细胞(AML-12细胞)[26]和肝星状细胞[27]增加TNF-α、IL-6、MCP-1、IL-8等炎症因子的表达。Singhal等[28]通过在小鼠侧脑室注射抵抗素,发现抵抗素可通过神经肽Y诱导肝脏TNF-α、IL-6表达增加2~3倍,并伴随着蛋白激酶B磷酸化水平降低以及葡萄糖-6-磷酸酶活性上升,从而导致肝脏胰岛素敏感性显著降低,说明抵抗素诱导的肝脏炎症部分参与了肝脏胰岛素抵抗的发生。在LPS诱导的小鼠慢性内毒素血症模型中,BAC-Retn mice(转基因表达人源抵抗素鼠)的肝脏葡萄糖输注率显著低于Rko mice(抵抗素基因敲除鼠),且葡萄糖产率增加60%,肝脏胰岛素抵抗程度更严重,说明抵抗素促进慢性内毒素血症小鼠胰岛素抵抗的发生[29]。为了进一步探究其机制,研究人员检测了肝脏炎症状况,发现BAC-Retn mice肝脏巨噬细胞浸润增多,炎性细胞因子TNF-α、IL-1β、MCP-1表达量显著增加,说明抵抗素诱导胰岛素抵抗与其加剧的炎症应答有关。
由此可见,在肥胖、NAFLD等动物模型或患者中抵抗素与肝脏炎症程度密切相关,通过诱导大量促炎因子的表达加剧肝脏胰岛素抵抗的发生。这也许是肥胖有关慢性炎症诱导机体胰岛素抵抗的重要病理机制,有可能成为治疗胰岛素抵抗有关疾病的药物靶点。
2 抵抗素诱导炎症促进胰岛素抵抗的分子机制 2.1 激活核转录因子-κB(NF-κB)-胰岛素受体底物-1(IRS-1)促进胰岛素抵抗NF-κB抑制蛋白激酶(IKKβ)/NF-κB作为炎症信号转导途径中的枢纽,与机体免疫应答密切相关。近年研究表明,IKKβ/NF-κB及靶因子TNF-α、IL-6等均具有胰岛素抵抗的作用,可通过诱导IRS-1丝氨酸磷酸化而阻碍胰岛素信号转导,降低胰岛素敏感性[30]。罗格列酮[31]、中药复方四妙散[32]等均可以通过抑制IKKβ/NF-κB活性改善机体胰岛素抵抗的程度。由此可见,NF-κB炎症信号通路的激活与机体胰岛素抵抗的发生密不可分。2005年Silswal等[16]首次证明了抵抗素通过激活NF-κB信号通路诱导巨噬细胞表达TNF-α、IL-12。随后的研究发现,在肝星状细胞[27]、脂肪细胞、人冠状动脉内皮细胞[33]以及软骨细胞[34]中,抵抗素诱导这些细胞炎症因子的释放也与IKKβ/NF-κB的激活有关。在NAFLD胰岛素抵抗大鼠模型中,肝脏抵抗素与NF-κB的表达呈正相关,与胰岛素受体底物-2(IRS-2)的表达呈负相关,作者提出抵抗素不仅能直接抑制胰岛素受体底物(IRS)的磷酸化而影响胰岛素信号转导,还可能通过激活NF-κB炎症通路加重胰岛素抵抗反应[35]。
尽管目前已经证实了抵抗素对NF-κB及下游信号通路具有激活作用,但由于抵抗素的特异性受体还没有明确,因此其具体作用机制还不是很清楚。张健[36]用抵抗素处理巨噬细胞,发现抵抗素可以显著上调IKKβ上游激酶转化生长因子β激活激酶1(transforming growth factor beta activated kinase 1,TAK1)基因转录水平以及磷酸化水平,进而上调NF-κB p65亚基mRNA的表达,部分阐释了抵抗素激活NF-κB的分子机制。Toll样受体-4(Toll-like receptor-4,TLR-4)属于模式识别受体,是转化生长因子激酶1(TAK1)-NF-κB信号通路中重要的跨膜信号传递者,不仅诱导炎症应答,而且与肥胖机体胰岛素抵抗的发生密切相关。2010年Tarkowski等[37]首次证明抵抗素与LPS竞争性结合人单核白血病细胞(THP-1)表面的TLR-4受体,激活NF-κB信号通路,诱导促炎因子释放。但Lee等[17]的研究否定了这一结论,即抵抗素对TLR-4并无影响,而是与THP-1胞膜受体腺苷酸环化酶有关蛋白1(adenylate cyclase associated protein 1,CAP1)相结合,激活腺苷酸环化酶(adenylate cyclase,AC),上调环腺苷酸(cAMP)浓度,进而诱导蛋白激酶A和NF-κB的活性,促进IL-6、TNF-α、IL-1β的表达。同时,Lee等[17]还提出兔也许比C57BL/6小鼠更适合作为研究人抵抗素的模型动物,因为兔抵抗素和CAP1均在骨髓以及外周血单核细胞高表达,与人抵抗素表达模式相似,但目前关于兔抵抗素的研究少有报道,因此加强兔抵抗素相关生理生化功能的研究也许有利于进一步了解人抵抗素的生物学效应。
2.2 激活丝裂原活化蛋白激酶(MAPK)-IRS-1促进胰岛素抵抗MAPK信号通路是真核生物细胞信号转导的重要途径之一,包括胞外信号调节(extracellular signal-regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)以及p38,其中JNK和p38 MAPK信号通路在炎症反应中发挥重要作用。Han等[38]发现,尽管高脂饮食诱导了巨噬细胞JNK缺失小鼠肥胖的发生,但机体胰岛素敏感性并没有改变,说明JNK是引起肥胖机体胰岛素抵抗发生的原因之一。在分离的人脂肪细胞、内皮细胞中,抵抗素上调JNK1、JNK2的磷酸化水平,从而诱导一系列趋化因子的表达增加,说明抵抗素不仅可以激活NF-κB诱导脂肪细胞促炎因子表达,还可能通过JNK信号转导通路实现对炎症的调控[39]。随后,Benomar等[40]证实在下丘脑中抵抗素直接与TLR-4结合,通过髓样分化因子88(MyD88)依赖途径增加外周胰岛素敏感器官(肝脏、肌肉、脂肪)中JNK、p38的活性,进而诱导促炎因子IL-6表达,并上调IRS-1丝氨酸磷酸化水平,在诱导炎症应答的同时促进胰岛素抵抗的发生,阐明了抵抗素通过炎症诱导胰岛素抵抗发生的部分分子机制。
由此可见,抵抗素可能与细胞膜上的TLR-4、CAP1结合激活细胞内IKKβ/NF-κB以及MAPK炎症信号通路,上调促炎因子IL-6、TNF-α、IL-12的表达,间接诱导IRS-1丝氨酸磷酸化,进而导致胰岛素抵抗的发生(图 2)。
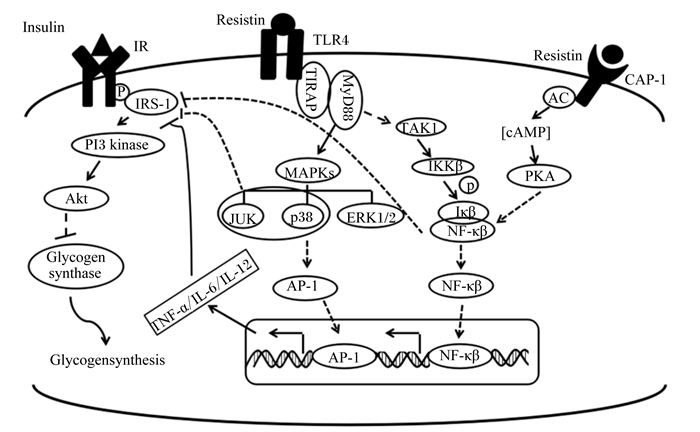
|
Insulin:胰岛素;Resistin:抵抗素;Glycogensynthase:糖原合酶;Glycogensynthesis:糖原合成;AP-1:活化蛋白1 activator protein-1;IR:胰岛素抵抗 insulin resistance;PKA;蛋白激酶A protein kinase A;Akt:丝氨酸/苏氨酸激酶serine/threonine kinase;PI3 kinase肌醇磷脂3-激酶 phosphoinositide 3-kinase。 图2 抵抗素诱导胰岛素抵抗的炎症信号途径 Fig. 2 The inflammatory signaling pathway of resistin induced insulin resistance |
肥胖机体慢性炎症状态与胰岛素抵抗已成为密不可分的一个整体,而炎症与胰岛素抵抗的连接纽带是当前的研究热点。抵抗素加剧脂肪组织巨噬细胞浸润并促进巨噬细胞向促炎表型极化,诱导大量促炎因子释放,在胰岛素敏感的脂肪组织、肝脏中扩大炎症级联反应,促进胰岛素抵抗的发生。其具体机制可能与抵抗素激活NF-κB/MAPK-IRS-1通路有关,为肥胖诱导胰岛素抵抗的分子机制提供一种可能的解释,为二型糖尿病、非酒精性脂肪肝等疾病的治疗提供思考方向。
目前抵抗素在动物方面的研究主要集中在小鼠模型上,在其他动物上则鲜有报道,然而鼠抵抗素与人抵抗素表达模式不尽相同,选择与人抵抗素表达模式相近的动物模型将有助于更好地认识抵抗素在胰岛素抵抗和炎症中的作用及其医学利用价值。因此,研究其他动物抵抗素的表达模式及其与胰岛素抵抗和炎症的关系尤为重要。此外,自然杀伤细胞、B淋巴细胞、T淋巴细胞等免疫细胞与肥胖机体胰岛素抵抗也有密切的联系,而目前关于抵抗素对这些细胞的影响仅有少量体外试验报道,基因敲除或转基因动物模型将有利于明确抵抗素对这些细胞的作用及其诱导肥胖机体胰岛素抵抗的作用机制。
| [1] |
STEPPAN C M, BAILEY S T, BHAT S, et al. The hormone resistin links obesity to diabetes[J].
Nature, 2001, 409(6818): 307–312.
( 0) 0)
|
| [2] |
赵伟利, 薛昌斌, 高磊, 等. 绵羊抵抗素基因(RETN)克隆、序列分析及其在饥饿模型中的表达变化规律[J].
农业生物技术学报, 2015, 23(8): 981–990.
( 0) 0)
|
| [3] |
于健, 邹迪莎, 叶瑶, 等. 巴马小型猪T2DM模型胰岛素抵抗及瘦素、抵抗素水平的变化[J].
山东医药, 2015, 55(5): 10–12.
( 0) 0)
|
| [4] |
CHEN X D, LEI T, XIA T, et al. Increased expression of resistin and tumour necrosis factor-α in pig adipose tissue as well as effect of feeding treatment on resistin and cAMP pathway[J].
Diabetes,Obesity and Metabolism, 2004, 6(4): 271–279.
( 0) 0)
|
| [5] |
王娅, 黄文华, 邓俊良, 等. 重组牛抵抗素对鼠血糖和胰岛素含量的影响[J].
中国兽医学报, 2015, 35(6): 949–952.
( 0) 0)
|
| [6] |
PANG S S, LE Y Y. Role of Resistin in inflammation and inflammation-related diseases[J].
Cellular & Molecular Immunology, 2006, 3(1): 29–34.
( 0) 0)
|
| [7] |
LEE B C, LEE J. Cellular and molecular players in adipose tissue inflammation in the development of obesity-induced insulin resistance[J].
Biochimica et Biophysica Acta::Molecular Basis of Disease, 2014, 1842(3): 446–462.
( 0) 0)
|
| [8] |
QATANANI M, SZWERGOLD N R, GREAVES D R, et al. Macrophage-derived human resistin exacerbates adipose tissue inflammation and insulin resistance in mice[J].
Journal of Clinical Investigation, 2009, 119(3): 531–539.
( 0) 0)
|
| [9] |
KANDA H, TATEYA S, TAMORI Y, et al. MCP-1 contributes to macrophage infiltration into adipose tissue,insulin resistance,and hepatic steatosis in obesity[J].
Journal of Clinical Investigation, 2006, 116(6): 1494–1505.
( 0) 0)
|
| [10] |
VERMA S, LI S H, WANG C H, et al. Resistin promotes endothelial cell activation further evidence of adipokine-endothelial interaction[J].
Circulation, 2003, 108(6): 736–740.
( 0) 0)
|
| [11] |
PIRVULESCU M M, GAN A M, STAN D, et al. Subendothelial resistin enhances monocyte transmigration in a co-culture of human endothelial and smooth muscle cells by mechanisms involving fractalkine,MCP-1 and activation of TLR4 and Gi/o proteins signaling[J].
The International Journal of Biochemistry & Cell Biology, 2014, 50: 29–37.
( 0) 0)
|
| [12] |
WALCHER D, HESS K, BERGER R, et al. Resistin:a newly identified chemokine for human CD4-positive lymphocytes[J].
Cardiovascular Research, 2010, 85(1): 167–174.
( 0) 0)
|
| [13] |
CHINETTI-GBAGUIDI G,STAELS B.Macrophages in obesity and insulin resistance[M]//BISWAS S K,MANTOVANI A.Macrophages:biology and role in the pathology of diseases.New York:Springer,2014:375-385.
( 0) 0)
|
| [14] |
LI P P, LU M, NGUYEN M T A, et al. Functional heterogeneity of CD11c-positive adipose tissue macrophages in diet-induced obese mice[J].
Journal of Biological Chemistry, 2010, 285(20): 15333–15345.
( 0) 0)
|
| [15] |
WENTWORTH J M, NASELLI G, BROWN W A, et al. Pro-inflammatory CD11c+CD206+ adipose tissue macrophages are associated with insulin resistance in human obesity[J].
Diabetes, 2010, 59(7): 1648–1656.
( 0) 0)
|
| [16] |
SILSWAL N, SINGH A K, ARUNA B, et al. Human resistin stimulates the pro-inflammatory cytokines TNF-α and IL-12 in macrophages by NF-κB-dependent pathway[J].
Biochemical and Biophysical Research Communications, 2005, 334(4): 1092–1101.
( 0) 0)
|
| [17] |
LEE S, LEE H C, KWON Y W, et al. Adenylyl cyclase-associated protein 1 is a receptor for human resistin and mediates inflammatory actions of human monocytes[J].
Cell Metabolism, 2014, 19(3): 484–497.
( 0) 0)
|
| [18] |
FU Y C, LUO L H, LUO N L, et al. Proinflammatory cytokine production and insulin sensitivity regulated by overexpression of resistin in 3T3-L1 adipocytes[J].
Nutrition & Metabolism, 2006, 3: 28.
( 0) 0)
|
| [19] |
ELGAZAR-CARMON V, RUDICH A, HADAD N, et al. Neutrophils transiently infiltrate intra-abdominal fat early in the course of high-fat feeding[J].
Journal of Lipid Research, 2008, 49(9): 1894–1903.
( 0) 0)
|
| [20] |
BOSTRÖM E A, TARKOWSKI A, BOKAREWA M. Resistin is stored in neutrophil granules being released upon challenge with inflammatory stimuli[J].
Biochimica et Biophysica Acta:Molecular Cell Research, 2009, 1793(12): 1894–1900.
( 0) 0)
|
| [21] |
高振秋, 张巧, 徐彤, 等. 嗜中性粒细胞是人抵抗素表达的主要细胞[J].
中国生物化学与分子生物学报, 2011, 27(1): 48–54.
( 0) 0)
|
| [22] |
杜琳敏.慢性炎症致C57BL/6J小鼠糖代谢紊乱及其相关分子机制的研究[D].硕士学位论文.重庆:重庆医科大学,2013.
( 0) 0)
|
| [23] |
EDWARDS C R, HINDLE A K, LATHAM P S, et al. Resistin expression correlates with steatohepatitis in morbidly obese patients[J].
Surgical Endoscopy, 2013, 27(4): 1310–1314.
( 0) 0)
|
| [24] |
吴佩娴, 蓝薇, 张帆, 等. 非酒精性脂肪性肝病中抵抗素和肝纤维化的关系[J].
中国医师杂志, 2014, 16(4): 482–484.
( 0) 0)
|
| [25] |
侯鹏高, 吕长淮. 抵抗素与非酒精性脂肪肝病相关性研究[J].
包头医学院学报, 2015, 31(6): 25–26.
( 0) 0)
|
| [26] |
赵彩彦, 闫蕾, 王亚东, 等. 非酒精性脂肪性肝炎发病中抵抗素对肝细胞的致炎作用[J].
中华肝脏病杂志, 2009, 17(9): 683–687.
( 0) 0)
|
| [27] |
BERTOLANI C, SANCHO-BRU P, FAILLI P, et al. Resistin as an intrahepatic cytokine:overexpression during chronic injury and induction of proinflammatory actions in hepatic stellate cells[J].
The American Journal of Pathology, 2006, 169(6): 2042–2053.
( 0) 0)
|
| [28] |
SINGHAL N S, LAZAR M A, AHIMA R S. Central resistin induces hepatic insulin resistance via neuropeptide Y[J].
The Journal of Neuroscience, 2007, 27(47): 12924–12932.
( 0) 0)
|
| [29] |
PARK H K, QATANANI M, BRIGGS E R, et al. Inflammatory induction of human resistin causes insulin resistance in endotoxemic mice[J].
Diabetes, 2011, 60(3): 775–783.
( 0) 0)
|
| [30] |
WIESER V, MOSCHEN A R, TILG H. Inflammation,cytokines and insulin resistance:a clinical perspective[J].
Archivum Immunologiae et Therapiae Experimentalis, 2013, 61(2): 119–125.
( 0) 0)
|
| [31] |
ZHOU X L, YOUS Y. Rosiglitazone inhibits hepatic insulin resistance induced by chronic pancreatitis and IKK-β/NF-κB expression in liver[J].
Pancreas, 2014, 43(8): 1291–1298.
( 0) 0)
|
| [32] |
LUO T J, WANG K Z, ZHAO W W, et al. Modified Si-Miao-San (四妙散加减) regulates adipokine expression and ameliorates insulin resistance by targeting IKKβ/insulin receptor substrate-1 in mice[J].
Chinese Journal of Integrative Medicine, 2014.
doi: 10.1007/s11655-014-1802-x.
( 0) 0)
|
| [33] |
张芸. 抵抗素诱导人冠状动脉内皮细胞通过NF-κB依赖的通路生成组织因子[J].
中国病理生理杂志, 2010(9): 1832.
( 0) 0)
|
| [34] |
ZHANG Z J, ZHANG Z Q, KANG Y, et al. Resistin stimulates expression of chemokine genes in chondrocytes via combinatorial regulation of C/EBPβ and NF-κB[J].
International Journal of Molecular Sciences, 2014, 15(10): 17242–17255.
( 0) 0)
|
| [35] |
朱良荣, 管小琴, 祁明美, 等. 抵抗素在非酒精性脂肪肝大鼠胰岛素抵抗中的作用[J].
中国生物制品学杂志, 2012, 25(2): 185–189.
( 0) 0)
|
| [36] |
张健.Resistin对炎症信号途径的调控研究[D].博士学位论文.武汉:华中农业大学,2010.
( 0) 0)
|
| [37] |
TARKOWSKI A, BJERSING J, SHESTAKOV A, et al. Resistin competes with lipopolysaccharide for binding to toll-like receptor 4[J].
Journal of Cellular and Molecular Medicine, 2010, 14(6b): 1419–1431.
( 0) 0)
|
| [38] |
HAN M S, JUNG D Y, MOREL C, et al. JNK expression by macrophages promotes obesity-induced insulin resistance and inflammation[J].
Science, 2013, 339(6116): 218–222.
( 0) 0)
|
| [39] |
KUSMINSKI C M, DA SILVA N F, CREELY S J, et al. The in vitro effects of resistin on the innate immune signaling pathway in isolated human subcutaneous adipocytes[J].
The Journal of Clinical Endocrinology and Metabolism, 2007, 92(1): 270–276.
( 0) 0)
|
| [40] |
BENOMAR Y, GERTLER A, De LACY P, et al. Central resistin overexposure induces insulin resistance through Toll-like receptor 4[J].
Diabetes, 2013, 62(1): 102–114.
( 0) 0)
|




