肠道不仅是营养物质消化和吸收的场所,也是机体重要的免疫器官,在动物黏膜免疫、肠道功能屏障及生长发育等过程中发挥重要作用[1]。然而在实际生产中,多种应激、细菌、病毒、药物和营养素等因素均能引起动物肠道损伤,导致肠道结构变化,肠道黏膜免疫系统中的细胞因子和抗体等分泌改变,导致肠道屏障功能障碍,严重影响了动物正常生理功能及生产潜能,给畜牧业造成严重的经济损失[2]。
表皮生长因子(epidermal growth factor,EGF)为促生长因子家族重要成员之一,是由53个氨基酸组成的单链多肽[3]。EGF主要由颌下腺、胰腺和十二指肠Brunner腺等分泌,释放入唾液、十二指肠液、乳汁、血液和羊水等[4]。EGF具有多种重要生物学功能,作为强有力的细胞有丝分裂原,具有刺激多种组织细胞分裂和增殖、增加细胞内DNA和蛋白质合成、促进上皮组织成熟与再生、抑制胃酸分泌、促进离子交换等重要作用[5-6]。研究显示,母乳中EGF是促进新生动物胃肠道发育的重要生长因子[7]。敲除小鼠胎儿期或新生期EGF的受体可导致其死亡,小鼠即使存活至产后期也要最终死于出血性小肠炎,说明EGF对肠道生长发育至关重要[8]。外源供给EGF可能是改善肠道功能结构、修复受损肠道组织的重要途径。鉴于此,本研究以葡聚糖硫酸钠(dextra sulfate sodium,DSS)诱导的结肠炎小鼠为模型动物,研究EGF对肠道形态结构、通透性和肠道细胞因子浓度的影响,评价其对损伤肠道的修复作用,为将EGF应用于动物生产研究提供重要的理论依据。
1 材料与方法 1.1 试验材料EGF(货号:AF-100-15)购自美国Peprotech公司。DSS(相对分子质量为36 000~50 000)购自上海MP公司,10%中性甲醛(40%甲醛100 mL,磷酸二氢钠4.0 g,无水磷酸氢二钠6.5 g,蒸馏水900 mL)购自杭州长青化工有限公司,白细胞介素-2(IL-2)、肿瘤坏死因子α(TNF-α)、白细胞介素-4(IL-4)、白细胞介素-10(IL-10)和紧密连接蛋白(Occludin)检测试剂盒(编号H003、H052、H005、H009和H264)购自南京建成生物工程研究所。
1.2 试验设计24只6周龄清结级BALB/c小鼠,体重为18~20 g,购自上海斯莱克实验动物有限责任公司。动物饲养温度为(24±1) ℃,相对湿度为40%~70%,光照周期为12 h明、12 h暗的标准环境,自由采食和饮水。小鼠饲粮浙江省医学科学院,主要营养水平为:粗蛋白质 20 g/kg,粗纤维5 g/kg,粗脂肪4 g/kg,粗灰分8 g/kg,钙1 g/kg,磷0.7 g/kg。小鼠随机分为3组,每组8只,即:正常对照组、DSS模型对照组、DSS+EGF组。正常对照组小鼠在试验第1~10天自由饮用自来水;DSS模型对照组小鼠在试验第1~7天饮用5%的DSS水溶液,第8~10天饮用自来水;DSS+EGF组小鼠按照DSS模型对照组处理,同时每天08:00和16:00腹部皮下注射EGF(0.02 mg/kg)各1次,共注射10 d。每天仔细观察试验小鼠的精神和活动状态以及毛发及粪便等。
1.3 样本采集及处理试验第11天,于眶下静脉采血,分离血清。颈椎脱臼法处死小鼠,沿腹中线打开腹腔,取出肠道组织,测定小鼠盲肠端至肛门的结肠长度。取1 cm结肠组织放入10%中性甲醛溶液中,4 ℃保存;用灭菌生理盐水冲洗剩余部分的结肠,然后立刻将其放于-70 ℃保存。
1.4 结肠形态学观察及损伤程度评分将固定于福尔马林溶液中结肠样品,常规脱水,石蜡包埋,切片后苏木精-伊红 (hematoxylin-eosin staining,HE)染色,显微镜下观察各组小鼠的结肠形态结构。采用Dieleman等[9]报道方法对结肠损伤程度评分(colonic damage score,CDS),评分方法如下:炎症程度按照急慢性的炎症分为0~3;浸润范围按照炎症的程度分为0~4;隐窝损伤和修复程度分为0~4分。估算炎症的作用范围分为:1)1%~25%;2)26%~50%;3)51%~75%;4)76%~100%。每项评分均以该项分数与炎症范围的乘积计算,损伤程度评分为每项评分的总和。
1.5 结肠Occludin及细胞因子浓度测定准确称取结肠组织重量,加入生理盐水,冰水浴条件下机械匀浆,离心后取上清,采用酶联免疫吸附试验(ELISA)方法测定结肠Occludin浓度,以及结肠IL-2、TNF-α、IL-4和IL-10浓度。
1.6 数据处理和统计分析采用SPSS 17.0软件对数据进行单因素方差分析(one-way ANOVA)及Duncan氏法多重比较检验,试验数据以“平均值±标准差”表示。P<0.05为差异显著,P<0.01为差异极显著。
2 结果 2.1 小鼠临床表现正常对照组小鼠精神状况、饮食及活动均正常,毛发光泽,无便血。DSS模型对照组小鼠饮用5%DSS水溶液后,第2天开始精神萎靡,活动迟缓,随着试验天数增加,小鼠毛发变得无光泽,饮食减少,并且出现稀便和血便,试验第6天全部出现严重血便。DSS+EGF组小鼠精神状态和活动较为正常,个别小鼠出现采食量降低。
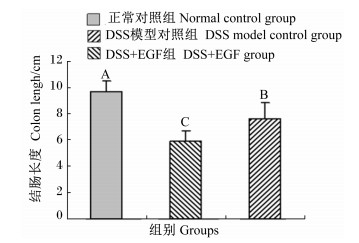
2.2 小鼠肠道长度由图 1可知,与正常对照组相比,DSS模型对照组小鼠结肠长度极显著降低(P < 0.01),降低了39.27%。与正常对照组相比,DSS+EGF组小鼠结肠长度极降低(P < 0.01),降低了21.01%,与DSS模型对照组相比,DSS+EGF组小鼠结肠长度极显著增加(P < 0.01),增加了23.04%。
|
图1 EGF对DSS诱导结肠炎小鼠结肠长度的影响 Fig. 1 Effects of EGF on colon length of mice treated with DSS-induced colitis |
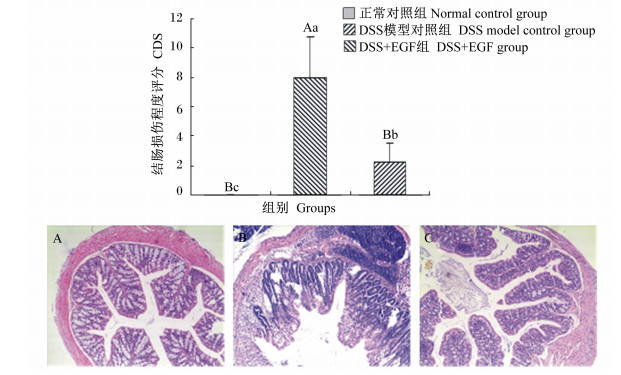
由图 2可知,HE染色结果显示正常对照组小鼠结肠组织结构清楚,各层清晰可见,黏膜层和黏膜上皮细胞完整,未见脱落,固有层内未见炎症细胞浸润,未见溃疡等。DSS模型对照组结肠组织结构尚存,黏膜层和黏膜上皮细胞不完整,脱落,可见典型的溃疡;溃疡周边黏膜上皮细胞可见增生;固有层内和黏膜下层内可见大量炎症细胞浸润,伴淋巴滤泡形成等。皮下注射EGF的小鼠结肠组织结构清晰,黏膜层和黏膜上皮细胞修复完整,未见溃疡;仅见固有层内少量炎症细胞浸润等。
|
A: 正常对照组 Normal control group; B: DSS模型对照组DSS model control group; C: DSS+EGF组DSS+EGF group。 图2 EGF对DSS诱导结肠炎小鼠的结肠形态及结肠损伤程度评分的影响 Fig. 2 Effects of EGF on colonic morphology and CDS of mice treated with DSS-induced colitis |
结肠CDS结果显示,DSS模型对照组CDS极显著高于正常对照组(P < 0.01)。与正常对照组相比,DSS+EGF组小鼠CDS显著高于正常对照组(P < 0.05),与DSS模型对照组相比,DSS+EGF组小鼠CDS极显著降低(P < 0.01),降低了71.88%,说明结肠损伤得到显著改善。
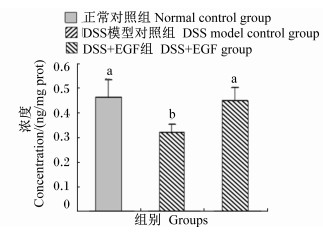
2.4 结肠Occludin浓度由图 3可知,与正常对照组相比,DSS模型对照组小鼠结肠Occludin浓度显著降低(P < 0.05),降低了30.53%。与DSS模型对照组相比,DSS+EGF组小鼠Occludin浓度显著升高(P < 0.05),升高了39.49%,与正常对照组相比,DSS+EGF组小鼠Occludin浓度差异不显著(P>0.05)。
|
图3 EGF对DSS诱导结肠炎小鼠结肠Occludin浓度的影响 Fig. 3 Effects of EGF on colonic Occludin concentration of mice treated with DSS-induced colitis |
由表 1可知,各组间小鼠结肠TNF-α浓度无显著差异(P>0.05)。与正常对照组相比,DSS模型对照组小鼠结肠IL-2和IL-4浓度极显著降低(P < 0.01),分别降低了29.78%和36.59%;IL-10浓度显著降低(P<0.05),降低了24.07%。与DSS模型对照组相比,DSS+EGF组小鼠结肠IL-2和IL-4浓度极显著增加(P < 0.01),分别增加了41.10%和31.56%;IL-10浓度显著增加(P < 0.05),增加了31.17%。与正常对照组相比,DSS+EGF组小鼠结肠IL-2、IL-4和IL-10浓度均无显著差异(P>0.05)。
|
|
表 1 EGF对DSS诱导结肠炎小鼠结肠细胞因子浓度的影响 Table 1 Effects of EGF on colonic cytokine concentrations of mice treated with DSS-induced colitis |
肠道是机体营养物质消化吸收的重要器官,又是体内最大的免疫器官,其以紧密的结构形态最大限度地发挥屏障功能(生物屏障、物理屏障和化学屏障),阻止外界毒素、细菌和抗营养因子等有害物质进入体内,是机体抵御异物的第一道重要防线。然而在实际生产中有诸多不利因素危害动物肠道的健康,导致肠道形态结构改变,肠道黏膜免疫系统中的细胞因子和抗体等分泌紊乱,肠道屏障功能障碍,进一步造成机体其他组织器官损伤,致使动物生长性能和健康受到极大影响,维持肠道健康是畜牧领域的一个重要研究课题。
EGF属于促生长因子家族成员,具有促进胃肠上皮细胞增殖与分化、肠道组织生长和发育等重要作用,被认为是肠道内环境平衡的调控因子[10]。产后母乳中的EGF是刺激新生动物肠道细胞增殖和肠道成熟的主要营养因子[11]。EGF可显著增加新生大鼠小肠重量、长度和DNA含量,加速早期胚胎肠道杯状细胞成熟速度[12-13]。在本研究中,皮下注射EGF极显著增加小鼠结肠长度,结肠组织结构相对完整,黏膜层和黏膜上皮细胞修复完整,未见溃疡;仅见固有层内少量炎症细胞浸润等,并且小鼠结肠CDS极显著降低。这些说明EGF缓解了小鼠结肠的缩短,维持了结肠上皮结构的相对完整性。
机械屏障是肠道黏膜屏障功能最重要的组成部分,细胞间紧密连接是构成肠道机械屏障的基础,能够防止细菌内毒素及毒性大分子等有害物质进入内环境,对维持肠黏膜上皮屏障功能的完整性具有重要作用[14]。Occludin是肠道内皮细胞间紧密连接的主要功能蛋白,与肠道紧密连接及屏障功能密切相关,其浓度减少会导致肠道屏障功能障碍[15]。大鼠肠道缺血性损伤后早期即有渗透性增高及肠黏膜屏障功能损伤,皮下注射高剂量EGF可显著增加大鼠空肠和回肠Occludin浓度[16]。机体组织受到损伤时,内源性EGF合成增 加,但是组织中EGF含量普遍较低,随着病情发展,EGF可能被耗竭而加重损伤,此时外源性补充EGF可减轻组织损伤[17]。在本研究中,小鼠饮用5%的DSS溶液显著降低了小鼠结肠Occludin浓度;而皮下注射EGF显著增加了小鼠结肠Occludin浓度。这些结果说明DSS增加了小鼠肠道的通透性,破坏了肠道屏障功能,而外源递送EGF显著降低了肠道黏膜通透性,保护了肠道上皮的屏障功能,这个结果与HE染色结果相一致。
促炎因子和抑炎因子平衡失调被认为是肠道炎症性疾病的一个重要发病机制,细胞因子异常表达与结肠炎的发生和发展密切相关[18]。给小鼠灌服2.5%DSS溶液6 d,结肠炎症组织白细胞介素-6(IL-6)和TNF-α mRNA表达水平显著升高,IL-4 mRNA表达水平极显著降低[19]。大鼠饮用5%DSS溶液,结肠组织的TNF-α和IL-6浓度显著升高,IL-2、IL-10和转化生长因子-β(TGF-β)浓度显著降低[20]。目前关于DSS结肠炎产生的确切机制还尚不清楚,可能与巨噬细胞功能失调、肠道菌群失衡、某些细胞因子浓度改变、DSS影响结肠上皮DNA合成、抑制细胞增生以及破坏肠道黏膜屏障等有关[21]。IL-2是参与免疫应答的重要细胞因子,具有双向调节的特点,IL-2浓度降低,可导致细胞免疫功能障碍,降低结肠黏膜局部防御功能,从而加重组织损伤[22]。IL-4可抑制单核巨噬细胞产生白细胞介素-1β(IL-1β)、IL-6、白细胞介素-8(IL-8)和TNF-α等,促进白细胞介素-1(IL-1)的受体抗体产生,在维持肠道免疫和抑制肠道炎症反应中发挥重要作用[23]。IL-10介导Th1和Th2细胞之间的相互调节,可抑制细胞因子TNF-α、IL-1和IL-6等释放和炎症反应[24]。在本研究中,DSS模型对照组小鼠结肠IL-2和IL-4 浓度极显著降低,IL-10浓度显著降低;皮下注射EGF极显著增加小鼠结肠IL-2和IL-4浓度,显著增加IL-10浓度,并与正常对照组相比,EGF组小鼠结肠IL-2、IL-4和IL-10浓度无显著改变。这些说明EGF能够调节结肠炎小鼠IL-2、IL-4和IL-10浓度达到正常范围,抑制肠道炎症反应,改善大鼠结肠炎症状,对损伤肠道具有一定的保护与修复作用。
4 结论皮下注射EGF可改善DSS结肠炎小鼠结肠组织形态,降低结肠CDS,抑制结肠组织Occludin浓度降低以及IL-2、IL-4和IL-10浓度增加,对损伤肠道具有保护与修复作用。
| [1] |
WIJTTEN P J A, VAN DER MEULEN J, VERSTEGEN M W A. Intestinal barrier function and absorption in pigs after weaning:a review[J].
British Journal of Nutrition, 2011, 105(7): 967–981.
( 0) 0)
|
| [2] |
BISCHOFF S C, BARBARA G, BUURMAN W, et al. Intestinal permeability-a new target for disease prevention and therapy[J].
BMC Gastroenterology, 2014, 14(1): 189.
( 0) 0)
|
| [3] |
CARPENTER G, COHEN S. Epidermal growth factor[J].
The Journal of Biological Chemistry, 1990, 265(14): 7709–7712.
( 0) 0)
|
| [4] |
PLAYFORD R J, WRIGHT N A. Why is epidermal growth factor present in the gut lumen?[J].
Gut, 1996, 38(3): 303–305.
( 0) 0)
|
| [5] |
JUNG K, KANG B K, KIM J Y, et al. Effects of epidermal growth factor on atrophic enteritis in piglets induced by experimental porcine epidemic diarrhoea virus[J].
The Veterinary Journal, 2008, 177(2): 231–235.
( 0) 0)
|
| [6] |
BOONSTRA J, RIJKEN P, HUMBEL B, et al. The epidermal growth factor[J].
Cell Biology International, 1995, 19(5): 413–430.
( 0) 0)
|
| [7] |
李超, 郭春华, 刘棋, 等. 猪表皮生长因子及其应用前景[J].
畜牧与兽医, 2009, 41(12): 93–96.
( 0) 0)
|
| [8] |
MIETTINEN P J, BERGER J E, MENESES J, et al. Epithelial immaturity and multiorgan failure in mice lacking epidermal growth factor receptor[J].
Nature, 1995, 376(6538): 337–341.
( 0) 0)
|
| [9] |
DIELEMAN L A, PALMEN M J, AKOL H, et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J].
Clinical & Experimental Immunology, 1998, 114(3): 385–391.
( 0) 0)
|
| [10] |
刘淑杰, 徐子伟, 齐珂珂, 等. 表皮生长因子对肠道功能调控的研究[J].
动物营养学报, 2014, 26(3): 565–570.
( 0) 0)
|
| [11] |
汤小朋, 方热军. 表皮生长因子对早期断奶仔猪生长性能及肠道健康的影响[J].
动物营养学报, 2015, 27(11): 3345–3351.
( 0) 0)
|
| [12] |
AVISSAR N E, TOIA L, SAX H C. Epidermal growth factor and/or growth hormone induce differential,side-specific signal transduction protein phosphorylation in enterocytes[J].
Journal of Parenteral and Enteral Nutrition, 2005, 29(5): 322–336.
( 0) 0)
|
| [13] |
BERSETH C L. Enhancement of intestinal growth in neonatal rats by epidermal growth factor in milk[J].
American Journal of Physiology, 1987, 253(5).
( 0) 0)
|
| [14] |
秦环龙, 高志光. 肠上皮细胞紧密连接在肠屏障中的作用研究进展[J].
世界华人消化杂志, 2005, 13(4): 443–447.
( 0) 0)
|
| [15] |
MIR H, MEENA A S, CHAUDHRY K K, et al. Occludin deficiency promotes ethanol-induced disruption of colonic epithelial junctions,gut barrier dysfunction and liver damage in mice[J].
Biochimica et Biophysica Acta:General Subjects, 2016, 1860(4): 765–774.
( 0) 0)
|
| [16] |
GENG Y X, LI J S, WANG F, et al. Epidermal growth factor promotes proliferation and improves restoration after intestinal ischemia-reperfusion injury in rats[J].
Inflammation, 2013, 36(3): 670–679.
( 0) 0)
|
| [17] |
CRIBBS R K, HARDING P A, LUQUETTE M H, et al. Endogenous production of heparin-binding EGF-like growth factor during murine partial-thickness burn wound healing[J].
Journal of Burn Care & Rehabilitation, 2002, 23(2): 116–225.
( 0) 0)
|
| [18] |
TORRES M I, RÍOS A. Current view of the immunopathogenesis in inflammatory bowel disease and its implications for therapy[J].
World Journal of Gastroenterology, 2008, 14(13): 1972–1980.
( 0) 0)
|
| [19] |
王少鑫, 浦江, 刘超群, 等. 炎症因子TNF-α、IL-6和IL-4在溃疡性结肠炎中的表达及临床意义[J].
胃肠病学和肝病学杂志, 2015, 24(1): 104–106.
( 0) 0)
|
| [20] |
DHARMANI P, LEUNG P, CHADEE K. Tumor necrosis factor-α and Muc2 mucin play major roles in disease onset and progression in dextran sodium sulphate-induced colitis[J].
PLoS One, 2011, 6(9): e25058.
( 0) 0)
|
| [21] |
温红珠, 郝薇薇, 李佳, 等. 葡聚糖硫酸钠结肠炎模型影响因素的研究进展[J].
世界华人消化杂志, 2011, 19(36): 3666–3671.
( 0) 0)
|
| [22] |
郭建生, 湛扩, 彭宇, 等. 肠炎愈片对大鼠溃疡性结肠炎血清白介素-2、一氧化氮的影响研究[J].
湖南中医药大学学报, 2007, 27(6): 18–20.
( 0) 0)
|
| [23] |
张歆, 柯晓, 陈锦团, 等. IL-1β、IL-4在湿热证溃疡性结肠炎大鼠模型中的动态表达及意义[J].
西安交通大学学报:医学版, 2015, 36(5): 697–701.
( 0) 0)
|
| [24] |
BERG D J, DAVIDSON N, KVHN R, et al. Enterocolitis and colon cancer in interleukin-10-deficient mice are associated with aberrant cytokine production and CD4+ TH1-like responses[J].
Journal of Clinical Investigation, 1996, 98(4): 1010–1020.
( 0) 0)
|




