2. 南京农业大学海门山羊研发中心, 海门 216121
2. Research Centre of Haimen Goats, Nanjing Agricultural University, Haimen 216121, China
精氨酸作为维持幼年家畜最佳生长和氮平衡的必需氨基酸[1],在促进幼畜肠道蛋白质合成,提高肠道免疫力、抗氧化能力及维护肠道健康等方面都具有重要作用[2]。由于母乳中所含的精氨酸量和自身合成的量往往无法满足幼年家畜的营养需求,可能会限制其生长性能的发挥,因此需要额外提供[3]。然而,精氨酸在瘤胃内的高降解率以及瘤胃保护性精氨酸的高成本限制了其在饲料工业中的应用[4]。N-氨甲酰谷氨酸(N-carbamylglutamate,NCG)作为精氨酸合成激活剂N-乙酰谷氨酸(NAG)的结构类似物[5],可以通过提高精氨酸合成限速酶氨甲酰磷酸合成酶-Ⅰ(CPS-Ⅰ)的活性来促进肠细胞精氨酸合成[6]。因此,NCG被认为是一种精氨酸增强剂。相对于精氨酸,NCG在瘤胃中的降解率极低[7]。不同于NAG,NCG不会被哺乳动物细胞质中高活性的脱酰基酶分解[8],这一特性使其更容易进入细胞线粒体发挥作用。通过对哺乳仔猪灌服NCG能显著提高哺乳仔猪的血浆精氨酸和生长激素(GH)含量,促进仔猪生长和肌肉蛋白质合成[9]。灌服NCG也可以促进7日龄哺乳仔猪生长发育及内源精氨酸的合成[10],但是NCG对哺乳山羊羔羊生长性能的影响报道较少。本试验旨在研究灌服NCG对哺乳山羊羔羊生长性能、血液参数及器官重的影响,为NCG在哺乳山羊羔羊上的应用提供理论依据。
1 材料与方法 1.1 试验动物与试验设计选取32只初生重相近、健康无病的1日龄波尔山羊×海门山羊杂交公羔作为试验羊。为了排除母羊产奶量以及哺乳羔羊数对哺乳山羊羔羊生长性能的潜在影响,每只母山羊哺乳2只公羔,且保证每只母山羊哺乳的公羔分入2个不同组,每组16只。羔羊从1到41日龄每天用注射器灌服0(对照)或100 mg/kg BW的NCG,试验期40 d。试验期间每天分早、晚2次灌喂。NCG与温水混合后用5 mL注射器缓慢注入羔羊口腔,对照组注射等体积温水。试验所用NCG购自亚太兴牧科技有限公司,生产许可证号为豫饲添(2014)T05005,产品纯度为97%。
1.2 饲养管理和样品采集试验在南京农业大学海门山羊研发中心进行。哺乳母羊饲粮参照NRC(2007)推荐的哺乳羊的营养需要配制,哺乳母羊饲粮组成及营养水平见表 1。试验期间哺乳母羊单栏饲喂,自由饮水,自由采食。羔羊自由哺乳。试验期间根据羊场生产安排,对试验羔羊进行驱虫、防疫。羔羊1、21及41日龄时,从每组中随机选取5只羔羊,早上灌服NCG 2 h后颈静脉采血5 mL于灭菌的肝素钠抗凝管中,即刻于3 000 r/min离心8 min,分离血浆,于-20 ℃冻存。
|
|
表 1 哺乳母羊饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the diet for lactating goats(DM basis) |
每组羔羊在1、21及41日龄空腹称重1次,为保证称重时羔羊处在空腹状态,称重当天采血后立即将羔羊抱离哺乳母羊,12 h后称重。计算平均日增重,腹泻率计算公式如下:
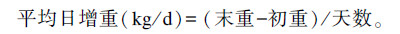
|
每日记录各组试验羔羊腹泻数,羔羊排出粪便稀软或稀如水样,尾根被粪便污染时,判定为腹泻。公式如下:
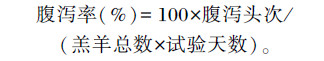
|
将羔羊1、21及41日龄采集分离的血浆样品于4 ℃解冻后用Vital Scientific临床化学分析仪测定葡萄糖(GLU)、总蛋白(TP)、白蛋白(ALB)、尿素氮(UN)、氨、甘油三酯(TG)、总胆固醇(TC)的含量。
1.3.4 血浆激素含量的测定将羔羊1、21及41日龄采集分离的血浆样品于4 ℃解冻,利用酶联免疫分析(ELISA)试剂盒(购自上海卡迈舒生物科技有限公司)测定血浆GH、胰岛素(Ins)及一氧化氮(NO)含量。
1.3.5 血浆氨基酸含量的测定将羔羊41日龄采集分离的血浆样品于4 ℃解冻。测定时,取0.3 mL血浆样品与10%磺基水杨酸按1 ∶ 3比例稀释,混匀,室温下12 000 r/min离心30 min,取上清液,用日立L-8800氨基酸自动分析仪测定氨基酸含量。
1.3.6 器官相对重量的测定于羔羊41日龄时进行屠宰,取内脏、消化道及睾丸,计算相对重量。计算公式如下:
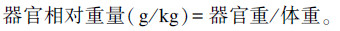
|
试验数据采用SPSS 19.0软件进行统计分析。组间的差异采用t检验,结果为百分数的采用χ2检验。除百分数外的其他数据均以平均值±标准差表示,以P<0.05为差异显著。试验期间有少量羔羊死亡淘汰,因此对照组和NCG组进入统计的羔羊数分别为13和14头。
2 结果 2.1 灌服NCG对哺乳山羊羔羊生长性能及腹泻率的影响由表 2可知,与对照组相比,NCG组羔羊41日龄体重提高了0.89 kg(P<0.05),21~41日龄和1~41日龄平均日增重显著提高(P<0.05)。但NCG对羔羊21日龄体重及1~21日龄平均日增重影响并不显著(P>0.05)。相对于对照组,NCG组羔羊腹泻率显著降低(P<0.05)。
|
|
表 2 灌服NCG对哺乳山羊羔羊生长性能和腹泻率的影响 Table 2 Effects of oral NCG supplementation on growth performance and diarrhea rate of suckling kidlets |
由表 3可知,NCG组羔羊1日龄血浆生化指标与对照组无显著差异(P>0.05)。NCG组羔羊41日龄血浆TP和ALB含量显著高于对照组(P<0.05);但NCG组羔羊21和41日龄血浆中氨和UN含量显著降低(P<0.05)。
|
|
表 3 灌服NCG对哺乳山羊羔羊血浆生化指标的影响 Table 3 Effects of oral NCG supplementation on plasma biochemical indexes of suckling kidlets |
由表 4可知,1日龄NCG组羔羊血浆中激素指标与对照组相比无显著差异(P>0.05);相对于对照组,21和41日龄的NCG组羔羊血浆中GH、Ins及NO含量均显著升高(P<0.05)。
|
|
表 4 灌服NCG对哺乳山羊羔羊血浆激素及一氧化氮含量的影响 Table 4 Effects of oral NCG supplementation on plasma hormones and of nitric oxide contents of suckling kidlets |
由表 5可知,与对照组相比,NCG组羔羊血浆精氨酸、瓜氨酸及鸟氨酸含量显著升高(P<0.05)。
|
|
表 5 灌服NCG对哺乳山羊羔羊血浆氨基酸含量的影响 Table 5 Effects of oral NCG supplementation on plasma amino acid contents of suckling kidlets |
由表 6可知,灌服NCG后,羔羊各器官相对重量均有所升高,其中NCG组羔羊脾脏、小肠以及大肠相对重量均显著高于对照组(P<0.05)。
|
|
表 6 灌服NCG对哺乳山羊羔羊器官相对重量的影响 Table 6 Effects of oral NCG supplementation on organ relative weight of suckling kidlets |
以往多个报道中均表明精氨酸对幼年家畜来说是一种必需氨基酸[11-13],这可能是由于母乳提供的和内源性合成的精氨酸不能满足其营养需求。通过外源性途径直接补充精氨酸会导致其他氨基酸(色氨酸、赖氨酸及组氨酸等)的吸收障碍,而且过量补充精氨酸会导致体内NO急剧增加,对机体组织造成损伤[14]。通过内源性途径调节动物精氨酸含量,提高其生长性能,可以避免直接灌服精氨酸带来的负面效应[14]。NAG是内源性精氨酸合成的一个必要的辅助性因子[15]。许多研究已经证实,NCG作为NAG的结构类似物,可以促进多种哺乳动物(包括鼠[16]、猪[10]、牛[6]、羊[17])内源性精氨酸的合成。
关于NCG对幼龄家畜生产性能的影响,国内外已有一些报道,但主要集中在仔猪上。例如,灌服NCG可以促进哺乳仔猪生长发育及内源精氨酸的合成[18];饲粮添加0.08%的NCG可以显著提高断奶仔猪生长性能,促进肠道发育,缓解断奶应激以及降低腹泻率[12]。但NCG对新生反刍动物生长性能的影响报道较少。本研究表明,灌服NCG 40 d,哺乳山羊羔羊的平均日增重显著提高,腹泻率显著降低。其原因可能是NCG促进了机体内源性精氨酸的合成,进而促进羔羊骨骼肌蛋白合成和肠道发育。Frank等[9]报道,灌服NCG显著提高了哺乳仔猪的平均日增重和骨骼肌蛋白质合成;Wang等[19]报道,在7~14日龄的健康及宫内生长迟缓(IUGR)仔猪代乳料中添加0.6%的精氨酸,显著促进了仔猪的肠道发育,降低了腹泻率。这些报道均与本研究结果一致。
血液中氨是动物体内一种有毒代谢物,动物可以通过尿素循环将多余的氨转化为尿素从而降低氨含量[20],而CPS-Ⅰ是氨向氨甲酰磷酸转化过程中的关键酶[21]。在精氨酸合成代谢过程中,NAG是CPS-Ⅰ的变构激活剂[10,14]。因此,NCG作为NAG的类似物,可以通过激活CPS-Ⅰ而促进体内多余的氨向尿素转化[22]。本试验中,灌服NCG显著降低了21和41日龄哺乳羔羊的血浆氨和UN含量,血浆TP含量相应提高,这表明哺乳仔猪灌服NCG后,一方面通过激活CPS-Ⅰ将体内多余的氨化为尿素,另一方面又促进了体内蛋白质合成并增加了氮沉积。ALB是动物应激的重要指标,应激时通常伴随着ALB的降低[14]。本试验发现NCG组羔羊41日龄血浆ALB含量显著高于对照组,原因可能是灌服NCG提高了了哺乳羔羊的抗应激能力。
众所周知,精氨酸可以促进动物内源性Ins和GH的释放[23-25]。本试验发现灌服NCG显著提高了21和41日龄哺乳羔羊的血浆GH和Ins含量。这可以归因于灌服NCG所引起的血浆精氨酸水平的提高。精氨酸是动物体内NO合成的前体物质和调节因子[26]。本试验发现灌服NCG显著提高了羔羊血浆NO含量,但还在羔羊正常生理范围内。这表明,饲粮中添加NCG并不会使NO大量增多,但NO的适当增加能调节机体免疫、促进血管生成、减少胃肠道黏膜损害[27],进而促进羔羊生长发育。
仔猪出生1周后,母乳提供的精氨酸及内源合成的精氨酸已不能满足其最大生长的营养需要[23]。尽管每天灌服高剂量的精氨酸或瓜氨酸可以提高血浆精氨酸含量,但同时也会导致血浆中其他必需氨基酸的含量(如赖氨酸和色氨酸)的降低。这可能是由氨基酸之间(精氨酸/赖氨酸;瓜氨酸/色氨酸)的拮抗作用所引起的[1]。所以通过灌服NCG来补充精氨酸和瓜氨酸是一种更为可行的选择[9]。作为CPS-Ⅰ的代谢稳定激活因子,在猪肠细胞内,NCG可以促精氨酸和瓜氨酸的合成[1]。本研究发现,灌服NCG促进了哺乳羔羊体内精氨酸的合成,使血浆游离精氨酸、瓜氨酸及鸟氨酸含量显著升高,但并没有降低血浆色氨酸和赖氨酸含量。说明NCG在促进内源性精氨酸合成的同时,并未影响哺乳羔羊对赖氨酸和鸟氨酸的转运与吸收。
精氨酸是重要的免疫调节器。有研究发现,在鸡和鹅的饲粮中添加适量精氨酸可显著增加免疫器官如脾脏和法氏囊的发育[28-29]。麻名文[30]研究发现,肉兔的饲粮添加精氨酸可显著影响胸腺指数,但对脾脏指数影响不显著。本试验发现给哺乳羔羊灌服NCG可以显著提高脾脏相对重量,这与前人结果基本一致,说明NCG可能在哺乳羔羊免疫器官的发育及机体免疫调节方面起促进作用。单胃动物上的研究发现精氨酸可以调节肠上皮细胞哺乳动物雷帕霉素靶蛋白(mTOR)信号通路,促使肠道蛋白质合成,抑制蛋白质降解,同时促进肠黏膜上皮细胞增殖与生长[31]。确实,在21日龄断奶仔猪的基础饲粮中添加1%的精氨酸可以显著提高小肠的相对重量、绒毛高度及隐窝深度,促进了小肠的发育[12,32]。此外,还有研究发现精氨酸可以诱导新生仔猪肠黏膜的生长[33]。近期的研究还发现在饲粮添加瘤胃保护性精氨酸及N-氨甲酰谷氨酸均可提高新疆细毛羊断奶羔羊肠道黏膜的蛋白质合成率[34]。本试验发现给哺乳羔羊灌服NCG可以显著提高大肠和小肠的相对重量,促进了肠道发育,这与前人研究的结果基本一致。肠道是机体重要的消化器官,是营养物质的消化和吸收的最终场所[35]。促进肠道的生长发育可以增强其对营养物质的消化和吸收,这可能是灌服NCG提高哺乳羔羊生长性能的原因之一。
4 结论给哺乳羔羊灌服适量的NCG,可有效提高血浆精氨酸及其代谢产物的水平,降低哺乳羔羊腹泻率,提高羔羊生长性能,促进器官发育。
| [1] |
WU G, KNABE D A, KIM S W. Arginine nutrition in neonatal pigs[J].
The Journal of Nutrition, 2004, 134(10S): 2783S–2790S.
( 0) 0)
|
| [2] |
谭溪清. 精氨酸的营养生理作用[J].
湖南饲料, 2009(6): 15–17.
( 0) 0)
|
| [3] |
刘兆金, 印遇龙, 邓敦, 等. 精氨酸生理营养研究[J].
氨基酸和生物资源, 2005, 27(4): 54–57.
( 0) 0)
|
| [4] |
CHACHER B, LIU H Y, WANG D M, et al. Potential role of N-carbamoyl glutamate in biosynthesis of arginine and its significance in production of ruminant animals[J].
Journal of Animal Science and Biotechnology, 2013, 4: 16.
( 0) 0)
|
| [5] |
GESSLER P, BUCHAL P, SCHWENK H U, et al. Favourable long-term outcome after immediate treatment of neonatal hyperammonemia due to N-acetylglutamate synthase deficiency[J].
European journal of pediatrics, 2010, 169(2): 197–199.
( 0) 0)
|
| [6] |
CHACHER B, ZHU W, YE J A, et al. Effect of dietary N-carbamoylglutamate on milk production and nitrogen utilization in high-yielding dairy cows[J].
Journal of Dairy Science, 2014, 97(4): 2338–2345.
( 0) 0)
|
| [7] |
CHACHER B, WANG D M, LIU H Y, et al. Degradation of L-arginine and N-carbamoyl glutamate and their effect on rumen fermentation in vitro[J].
Italian Journal of Animal Science, 2012, 11(4): e68.
( 0) 0)
|
| [8] |
MORIZONO H, CALDOVIC L, SHI D S, et al. Mammalian N-acetylglutamate synthase[J].
Molecular Genetics and Metabolism, 2004, 81(Suppl.1): 4–11.
( 0) 0)
|
| [9] |
FRANK J W, ESCOBAR J, NGUYEN H V, et al. Oral N-carbamylglutamate supplementation increases protein synthesis in skeletal muscle of piglets[J].
The Journal of Nutrition, 2007, 137(2): 315–319.
( 0) 0)
|
| [10] |
王琤.精氨酸对仔猪宫内发育及N-氨甲酰谷氨酸对断奶仔猪生长的影响[D].博士学位论文.南昌:江西农业大学,2012.
( 0) 0)
|
| [11] |
WAKABAYASHI Y, YAMADA E, YOSHIDA T, et al. Arginine becomes an essential amino acid after massive resection of rat small intestine[J].
Journal of Biological Chemistry, 1994, 269(51): 32667–32671.
( 0) 0)
|
| [12] |
WU X, RUAN Z, GAO Y L, et al. Dietary supplementation with L-arginine or N-carbamylglutamate enhances intestinal growth and heat shock protein-70 expression in weanling pigs fed a corn-and soybean meal-based diet[J].
Amino Acids, 2010, 39(3): 831–839.
( 0) 0)
|
| [13] |
WU G Y, BAZER F W, DAVIS T A, et al. Arginine metabolism and nutrition in growth,health and disease[J].
Amino Acids, 2009, 37(1): 153–168.
( 0) 0)
|
| [14] |
周锡红, 吴信, 唐香山, 等. 不同水平精氨酸生素对断奶仔猪生长性能和血液指标的影响[J].
农业现代化研究, 2010, 31(2): 237–240.
( 0) 0)
|
| [15] |
HALL L M, METZENBERG R L, COHEN P P. Isolation and characterization of a naturally occurring cofactor of carbamyl phosphate biosynthesis[J].
Journal of Biological Chemistry, 1958, 230(2): 1013–1021.
( 0) 0)
|
| [16] |
ZENG X F, HUANG Z M, MAO X B, et al. N-carbamylglutamate enhances pregnancy outcome in rats through activation of the PI3K/PKB/mTOR signaling pathway[J].
PLoS One, 2012, 7(7): e41192.
( 0) 0)
|
| [17] |
LASSALA A, BAZER F W, CUDD T A, et al. Parenteral administration of L-arginine prevents fetal growth restriction in undernourished ewes[J].
The Journal of Nutrition, 2010, 140(7): 1242–1248.
( 0) 0)
|
| [18] |
曹洪战, 陈楠, 芦春莲. N-氨甲酰谷氨酸对哺乳仔猪生长及内源精氨酸合成代谢的影响[J].
畜牧兽医学报, 2013, 44(11): 1844–1850.
( 0) 0)
|
| [19] |
WANG Y X, ZHANG L L, ZHOU G L, et al. Dietary L-arginine supplementation improves the intestinal development through increasing mucosal Akt and mammalian target of rapamycin signals in intra-uterine growth retarded piglets[J].
British Journal of Nutrition, 2012, 108(8): 1371–1381.
( 0) 0)
|
| [20] |
O'CONNOR J E, JORDÁ A, GRISOLÍA S. Acute and chronic effects of carbamyl glutamate on blood urea and ammonia[J].
European Journal of Pediatrics, 1985, 143(3): 196–197.
( 0) 0)
|
| [21] |
GUFFON N, VIANEY-SABAN C, BOURGEOIS J, et al. A new neonatal case of N-acetylglutamate synthase deficiency treated by carbamylglutamate[J].
Journal of Inherited Metabolic Disease, 1995, 18(1): 61–65.
( 0) 0)
|
| [22] |
周笑犁, 印遇龙, 孔祥峰, 等. N-氨甲酰谷氨酸对环江香猪生长性能、营养物质消化率及血浆游离氨基酸含量的影响[J].
动物营养学报, 2011, 23(11): 1970–1975.
( 0) 0)
|
| [23] |
FLYNN N, KNABE D A, MALLICK B K, et al. Postnatal changes of plasma amino acids in suckling pigs[J].
Journal of Animal Science, 2000, 78(9): 2369–2375.
( 0) 0)
|
| [24] |
WU G Y, MORRIS S M, J r. Arginine metabolism:nitric oxide and beyond[J].
Biochemical Journal, 1998, 336(1): 1–17.
( 0) 0)
|
| [25] |
YAO K, YIN Y L, CHU W, et al. Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs[J].
The Journal of Nutrition, 2008, 138(5): 867–872.
( 0) 0)
|
| [26] |
WU G Y, MEININGER C J. Regulation of nitric oxide synthesis by dietary factors[J].
Annual Review of Nutrition, 2002, 22: 61–86.
( 0) 0)
|
| [27] |
MORRIS S M,Jr. Recent advances in arginine metabolism:roles and regulation of the arginases[J].
British journal of pharmacology, 2009, 157(6): 922–930.
( 0) 0)
|
| [28] |
KWAK H, AUSTIC R E, DIETERT R R. Influence of dietary arginine concentration on lymphoid organ growth in chickens[J].
Poultry Science, 1999, 78(11): 1536–1541.
( 0) 0)
|
| [29] |
闫伟.L-精氨酸对免疫应激鹅生长性能、器官发育及血液生化指标的影响[D].硕士学位论文.扬州:扬州大学,2010.
( 0) 0)
|
| [30] |
麻名文.日粮精氨酸对生长肉兔生长性能、免疫、血液生化指标、激素水平及IGF-ⅠmRNA表达量的影响[D].硕士学位论文.泰安:山东农业大学,2009.
( 0) 0)
|
| [31] |
NICHOLSON B, MANNER C K, KLEEMAN J, et al. Sustained nitric oxide production in macrophages requires the arginine transporter CAT2[J].
Journal of Biological Chemistry, 2001, 276(19): 15881–15885.
( 0) 0)
|
| [32] |
YAO K, GUAN S, LI T J, et al. Dietary L-arginine supplementation enhances intestinal development and expression of vascular endothelial growth factor in weanling piglets[J].
British Journal of Nutrition, 2011, 105(5): 703–709.
( 0) 0)
|
| [33] |
PUIMAN P J, STOLL B, VAN GOUDOEVER J B, et al. Enteral arginine does not increase superior mesenteric arterial blood flow but induces mucosal growth in neonatal pigs[J].
The Journal of Nutrition, 2011, 141(1): 63–70.
( 0) 0)
|
| [34] |
赵宏丽.精氨酸对细毛羊肠道蛋白质合成、氨基酸转运蛋白mRNA表达及肠道健康的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2012.
( 0) 0)
|
| [35] |
RIEDIJK M A, STOLL B, CHACKO S, et al. Methionine transmethylation and transsulfuration in the piglet gastrointestinal tract[J].
Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(9): 3408–3413.
( 0) 0)
|




