2. 中国科学院亚热带农业生态研究所, 亚热带农业生态过程重点实验室, 湖南省畜禽健康养殖工程技术中心, 农业部中南动物营养与饲料科学观测试验站, 长沙 410125;
3. 湖南畜禽安全生产协同创新中心, 长沙 410128
2. Key Laboratory of Agro-Ecological Processes in Substropical Region, Hunan Research Center of Livestock & Poultry Science, South-Central Experimental Station of Animal Nutrition and Feed Science in Ministry of Agriculture, Institute of Substropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China;
3. Hunan Co-Innovation Center of Animal Production Safety, Changsha 410128, China
草地畜牧业一直是西藏的重要经济基础,几十年来一直占农业生产总值的60%左右[1]。近年来,随着西藏人口增加和畜牧业的进一步发展,传统的单纯依赖天然草地和以作物秸秆为主的畜牧业生产模式已不能满足牲畜对饲草的需求[2-3]。而随着家畜数量的不断增加,导致草畜之间矛盾日益突出,生态环境不断恶化,严重影响西藏地区畜牧生产系统的平衡、稳定与发展[4]。因此,大规模人工种植适合西藏特殊生长环境的牧草,对满足西藏地区畜牧业生产对牧草的需求、维持西藏地区生态平衡稳定、促进藏区经济发展等都具有重要意义。
近年来,学者对西藏地区牧草以及作物秸秆的研究较多。曲广鹏等[5]通过对西藏农区牧草和饲草作物引种试验表明,燕麦、多花黑麦草、饲用玉米、绿麦、红苋5种牧草适合在西藏农区及河谷地区种植,但其并未对这5种牧草进行相关的营养价值评价。张中岳[6]对西藏地区28种牧草的营养价值及瘤胃降解特性进行了评价,为进一步研究西藏牧草提供了宝贵的基础数据。张吉等[7]研究了添加剂对西藏燕麦和箭筈豌豆混合青贮品质的影响,结果表明添加糖蜜能显著提高混合青贮的品质。孙肖慧等[8]和李君风等[9]通过向西藏地区燕麦和紫花苜蓿混合青贮中添加4%糖蜜或3.5%乙醇或0.4%乙酸获得优质青贮饲料。赵庆杰等[10]通过向西藏青稞秸秆和多年生黑麦草混合青贮中添加糖蜜和乳酸菌显著提高了混合青贮发酵品质。原现军[11]对西藏作物秸秆与牧草混合青贮进行了研究,均有效地提高了混合青贮的发酵品质。综上,目前对西藏地区牧草及作物秸秆的研究多数集中在西藏地区青贮料的研究领域,而对牧草干草瘤胃降解特性研究鲜有报道。因此,本试验利用体外产气技术,对西藏拉萨地区常见牧草的瘤胃体外发酵参数进行研究,并通过试验数据分析,筛选出易被瘤胃微生物降解利用的牧草,以期为西藏地区农牧业发展提供科学依据。
1 材料与方法 1.1 试验材料 ${section.labelNum} 1.1.1样品采集及处理试验牧草(紫花苜蓿、黑麦草、芦苇、苇状羊茅、燕麦)采集于西藏自治区贡嘎县岗堆镇吉纳村草场,牧草经65 ℃烘干24 h,粉碎经1 mm孔径筛后备用。
1.1.2 试验动物及饲粮试验供体奶牛为健康状况良好、体重(500±50)kg的3头装有永久瘤胃瘘管的荷斯坦奶牛,试验奶牛由湖南省长沙市望城区白若铺镇胜和奶牛养殖基地提供。试验期间,奶牛饲粮参照NRC[12]标准配制。基础饲粮由水稻秸秆和精料补充料组成,饲粮精粗比为40 : 60。饲粮营养水平测定依照Hall等[13],使用Fibretherm FT12全自动纤维仪(gerhardt analytical systems,Germany)测定中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)含量;按照杨胜[14]确定的常规方法测定干物质(dry matter,DM)、粗蛋白质(crude protein,CP)含量,利用ICP-AES法测定钙(Ca)、磷(P)含量[15]。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diet(DM basis) |
经处理后的粗饲料利用杨胜[14]提供的饲料分析方法分别对其进行DM、粗脂肪(EE)、粗纤维(CF)、NDF、ADF等营养成分含量进行测定;粗灰分(ash)按GB/T 6438—2007方法进行测定(表 2)。
|
|
表 2 牧草营养价值 Table 2 Nutrient values of pastures |
按照Menke等[17]提供的方法配制厌氧缓冲液。于晨饲前采集3头瘘管牛瘤胃内容物,用8层纱布过滤,滤液等体积混合后装入事先充满二氧化碳(CO2)并预热到39.5 ℃的保温瓶中,迅速带回实验室,与事先在39.5 ℃恒温水浴锅中预热的厌氧缓冲液混合(V缓冲液 : V瘤胃液=9 : 1)。并持续通入CO2。
1.2.3 体外培养称取(0.500 0±0.000 3)g粉碎的牧草秆于发酵瓶中,置于39.5 ℃恒温培养箱中预热,向发酵瓶中加入发酵液前,向瓶中通入CO2 1 min,随后加入50 mL发酵液,并持续通入CO2,立即加上瓶塞瓶盖,并使用针头放气,使内外压强保持一致,然后迅速放回恒温培养箱,39.5 ℃恒温静止培养48 h。每种发酵底物设置12、24、48 h 3个采样时间点重复,每个采样时间点设置3个样品重复。
1.2.4 体外发酵总产气量测定体外发酵产气量按王祚等[18]提供方法进行测定。
利用Wang等[19-20]提出的逻辑斯谛-指数(LE)模型对累积产气量数据进行拟合:
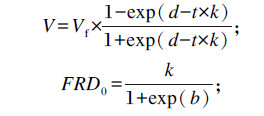
|
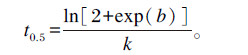
|
其中:V表示t时间点底物的产气量(mL);Vf表示理论最大产气量(mL);k表示产气分率;b和d是曲线的形状指标,b>0表示曲线为s形,b<0则表示曲线非s形。FRD0表示初始产气速率(<12 h),t0.5表示达到最大产气量一半所需时间。
1.2.5 体外发酵相关参数测定 ${section.labelNum} 1.2.5.1甲烷测定及计算方法分别于体外发酵中的12、24、48 h取出发酵瓶,利用注射器从发酵瓶中抽取5 mL气体,注入事先已抽真空的集气瓶中,然后再注入25 mL高纯度氮气(N2)。利用安捷伦7890A型气相色谱仪(USA)进行测量,载气使用高纯N2,总压力130 kPa,总流量30.2 mL/min,柱流量1.7 mL/min,线速度39.8 cm/s,分流比15,吹扫流量3 mL/min,循环流量8 mL/min,氢气(H2)流量40 mL/min,空气流量400 mL/min[21]。甲烷产量计算公式为:
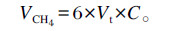
|
其中:6是稀释倍数,Vt指在发酵时间t时,发酵瓶中气体总体积(mL);C指在发酵时间t时,所测甲烷浓度(%);VCH4指在发酵时间t时,所生产甲烷体积(mL)。
1.2.5.2 pH测定方法分别于体外发酵中的12、24、48 h取出发酵瓶,发酵液经400目尼龙布过滤,取5 mL滤液,利用pH计(REX PHS-3C,上海仪器设备厂)立即测定滤液pH。
1.2.5.3 体外发酵氨态氮(NH3-N)浓度分别于体外发酵中的12、24、48 h取出发酵瓶,发酵液经400目尼龙布过滤,取4 mL滤液,分装到2个容积为2 mL离心管中,放入-20 ℃冰箱保存,分别用于测量NH3-N浓度。利用冯宗慈等[22]改进的比色法,使用紫外/可见分光光度计(UV-2450)进行测定。
1.2.5.4 体外发酵挥发性脂肪酸(VFA)含量分别于体外发酵中的12、24、48 h取出发酵瓶,每瓶取2 mL发酵液,经24 100×g离心15 min后,取1.5 mL上清液于2 mL离心管中,并加入0.15 mL 25%偏磷酸,放入-20 ℃冰箱保存。样品在常温条件下解冻,24 100×g和4 ℃条件下离心10 min,取0.6 mL装与上机瓶中,利用气相色谱仪(安捷伦7890A,美国)对样品中VFA含量进行测定[23]。
1.2.5.5 体外干物质消失率(IVDMD)测定及计算方法分别于体外发酵中的12、24、48 h取出发酵瓶,发酵液经400目尼龙布过滤,将过滤后的残渣全部转移至石英坩埚中并用热蒸馏水反复冲洗,置于105 ℃烘箱中烘干8 h以测定剩余干物质,并计算其消失率:
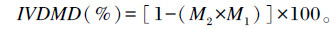
|
其中:M1为发酵前干物质质量;M2为发酵后干物质剩余质量。
1.2.5.6 体外中性洗涤纤维消失率(IVNDFD)测定及计算方法测定过干物质消失率后的剩余干物质,按照Hall等[13]提供的方法进行测定,并计算IVNDFD:
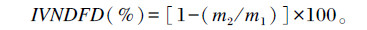
|
其中:m1为发酵前发酵底物中NDF质量;m2为发酵后剩余干物资中NDF质量。
1.3 数据分析试验数据采用SAS 8.2的MIXED过程统计,统计差异显著性定义为P<0.05。
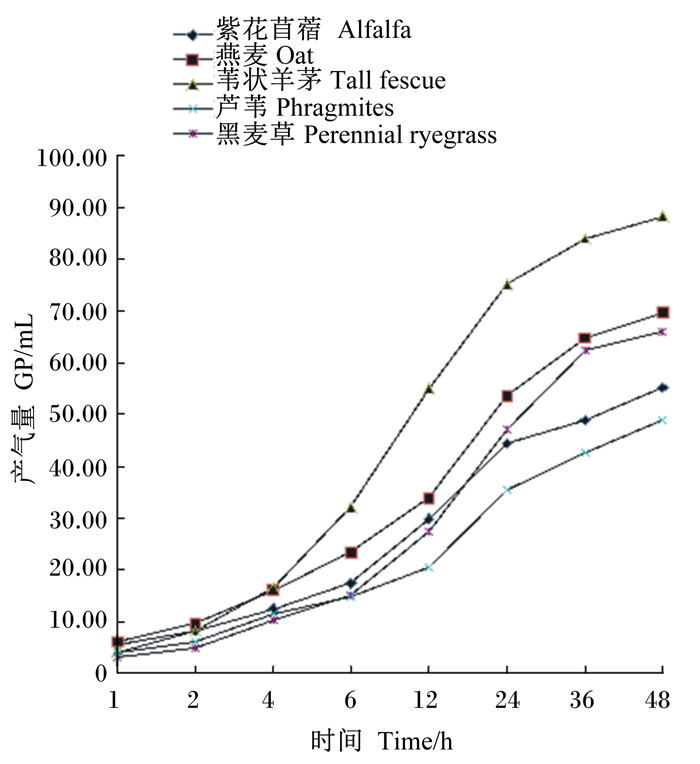
2 结果 2.1 不同牧草对体外产气量的影响不同牧草体外发酵产气量如图 1。由图 1可知,5种牧草体外发酵产气量在发酵初期1~4 h均无明显差异,第4 h后,各牧草体外产气量开始逐渐上升,且由各曲线斜率可知,5种牧草体外发酵产气速率也逐渐增大;在第12~24 h,各曲线斜率达到最大,体外发酵产气速率到达最大值。体外发酵36 h以后,5种牧草曲线逐渐斜率变小,产气速率逐渐趋于稳定。同时由图 1可知,苇状羊茅体外产气量在第4 h后始终高于其他牧草体外产气量。体外发酵24和48 h时,苇状羊茅体外产气量分别为72.16、88.15 mL,均高于其他4种牧草;芦苇体外产气最低,分别为35.44、48.84 mL,均低于其他牧草体外产气量。5种牧草体外发酵48 h体外累积产气量按苇状羊茅、燕麦、黑麦草、紫花苜蓿、芦苇的顺序依次降低。
|
图1 不同牧草对体外产气量的影响 Fig. 1 Effects of different pastures on in vitro gas production |
不同牧草对体外发酵产气参数及CH4产量的影响如表 3所示。由表 3可知,5种牧草体外理论最大产气量(Vf)、初始产气速率(FRD0)和CH4产量均以苇状羊茅最高,均显著高于其他4种牧草(P<0.05)。FRD0越高,意味着对应的达到最大产气量一半时所需时间(t0.5)越短。而t0.5则以苇状羊茅和紫花苜蓿最低,两者之间没有显著差异(P>0.05),但均显著低于其余3种牧草(P<0.05)。
|
|
表 3 不同牧草对体外发酵产气参数和CH4产量的影响 Table 3 Effects of different pastures on in vitro fermentation gas production parameters and CH4 production |
不同牧草对IVDMD以及IVNDFD的影响如表 4所示。5种牧草之间IVDMD均存在显著差异(P<0.05),其中苇状羊茅IVDMD最高(56.25%),显著高于其他4种牧草(P<0.05)。5种牧草IVDMD大小按苇状羊茅、黑麦草、燕麦、紫花苜蓿、芦苇的顺序依次显著降低(P<0.05)。对于IVNDFD,苇状羊茅IVNDFD显著高于紫花苜蓿和芦苇(P<0.05),与燕麦和黑麦草无显著差异(P>0.05);紫花苜蓿IVNDFD最低(14.03%),显著低于其他4种牧草(P<0.05)。
|
|
表 4 不同牧草对IVDMD和IVNDFD的影响 Table 4 Effects of different pastures on IVDMD and IVNDFD |
不同牧草对体外发酵pH和NH3-N浓度影响见表 5。5种牧草以紫花苜蓿体外发酵pH最高,其次为芦苇和燕麦,三者之间无显著差异(P>0.05),但均显著高于苇状羊茅和黑麦草(P<0.05);5种牧草以苇状羊茅体外发酵pH最低(6.32),显著低于其他4种牧草(P<0.05)。对于体外发酵液中NH3-N浓度,5种牧草相互之间存在显著差异(P<0.05),紫花苜蓿NH3-N浓度最高(18.64 mg/dL),显著高于其他4种牧草(P<0.05);苇状羊茅NH3-N浓度最低(6.26 mg/dL)。5种牧草体外发酵48 h后,发酵液中NH3-N浓度按紫花苜蓿、燕麦、黑麦草、芦苇、苇状羊茅的顺序显著降低。
|
|
表 5 不同牧草对体外发酵pH及NH3-N浓度的影响 Table 5 Effects of different pasture on in vitro fermentation pH and NH3-N concentration |
不同牧草对体外发酵VFA产量的影响如表 6所示。5种牧草中,以苇状羊茅体外乙酸、丙酸、丁酸和总VFA产量最高,均显著高于其他4种牧草(P<0.05);而乙酸/丙酸则以苇状羊茅最低,显著低于其余4种牧草(P<0.05)。
|
|
表 6 不同牧草对体外发酵VFA产量的影响 Table 6 Effects of different pastures on in vitro fermentation VFA production |
研究表明,5种牧草之间体外产气量均存在差异,以苇状羊茅48 h累积产气量最高,这可能是由于不同牧草所含的碳水化合物不同所造成的。牧草体外发酵产气来源主要是碳水化合物,虽然牧草所含CP在体外发酵时也会产生一部分气体,但整个体外发酵过程中,CP对体外产气量的贡献量远低于碳水化合物[24],Cone等[25]对酪蛋白和淀粉的体外发酵研究发现,发酵72 h后蛋白质发酵的产气量仅为碳水化合物的30%。此外,本试验所用5种牧草除紫花苜蓿为豆科外,其他4种牧草均为禾本科牧草;种属不同可能也是粗饲料体外产气量存在差异的原因之一。有研究报道指出不同类型粗饲料体外发酵产气特性有较大差异,通常情况下,种内差异较小,种间差异较大[24]。本试验结果表明,粗饲料体外发酵在6~24 h时,体外产气量均急剧上升,36 h以后趋于平缓,此结果与刘书杰[26]已报道结果有差异。刘书杰[26]利用阉割牦牛对青海高原天然牧草营养价值进行评价时报道,天然牧草在12~48 h产气量的平均值急剧上升,48 h以后平均产气量的增加逐渐平缓。两者之间差异可能是由于发酵底物不同和发酵液成分不同造成的。
3.2 不同牧草对体外发酵产气参数及CH4产量的影响在体外发酵过程中,发酵底物为瘤胃微生物所利用的程度可以通过体外发酵累积产气量来反映[27]。本试验中,各牧草之间理论最大产气量存在明显差异,这可能是由于不同牧草可溶性非结构性碳水化合物与CP的比例不同所造成的。汤少勋等[24]研究报道,当可溶性非结构性碳水化合物与CP之间的比例越大时,理论最大产气量越高;比例越小时,理论最大产量越低,亦即随着牧草中非结构性碳水化合物含量的增加,体外发酵增强。高巍等[28]研究表明,青贮玉米秸秆及苜蓿干草中性洗涤可溶物(DNS)的产气量占饲草累积产气量的绝大部分。
FRD0表示体外发酵12 h之前产气速率,t0.5表示体外累积产气量达到最大值一半时所需时间,通常情况下,FRD0越大,t0.5越小[29]。在本试验中,牧草中以苇状羊茅FRD0最大,其t0.5也最小。Muck等[30]研究报道,体外发酵过程中65%~70%产气量在发酵初期9~10 h内产生,而本试验中,除苇状羊茅外,其余4种牧草体外发酵产气量达到总产气量50%时所需时间为10~19 h之间,明显高于Muck等[30]所报道的结论,可能是由于两者体外培养方式以及发酵底物的不同而导致FRD0和t0.5上存在差异。
反刍动物瘤胃中CH4是由瘤胃中碳水化合物经瘤胃微生物厌氧发酵所生成的[31]。在瘤胃代谢过程中,瘤胃中CH4的生成是瘤胃发酵能量损失的主要原因之一,据报道,6%~15%的饲料能量以CH4的形式散失[32]。瘤胃中CH4的生成与饲粮中CP、ADF、NDF、无氮浸出物(NFE)以及IVDMD相关[33]。在本研究中,不同牧草之间体外发酵CH4产量存在显著差异,其中,以苇状羊茅体外CH4产量最高,与刘树军等[34]研究结果一致,这种差异可能是不同粗饲料中可发酵的碳水化合物类型以及与CH4生成相关的牧草成分含量的不同所致[35]。有报道指出牧草纤维物质含量是影响CH4产量的一个重要因素[36],这可能是由于富含纤维物质的饲料能促进一些纤维分解菌和CH4合成菌的共生引起的,这类微生物可以偶联碳水化合物的降解产物,利用氢气还原CO2以合成CH4[37]。
3.3 不同牧草对IVDMD和IVNDFD的影响IVDMD和IVNDFD是体现瘤胃发酵过程中粗饲料利用率的重要指标[18]。粗饲料在瘤胃中的降解实际上是微生物以及微生物分泌的酶相互作用的结果,而降解率的高低与营养物质的结构、微生物对底物的附着能力以及微生物分泌酶的催化能力有关[6]。在本试验中,不同牧草IVDMD存在明显差异,其中,牧草以苇状羊茅IVDMD最高。这中差异可能是由于牧草富含非结构性碳水化合物以及可消化的有机物含量不同造成的,苇状羊茅非结构性碳水化合物和可消化有机物含量高于其他牧草,此种结果也暗示苇状羊茅很容易被瘤胃微生物降解利用;而芦苇的IVDMD最低,可能由于其结构不利用微生物的附着及生长所造成的。
由于NDF的降解性影响动物的生长性能,并且牧草在反刍动物瘤胃中的降解率差异比较大,因此,牧草中NDF的降解率是评定牧草品质的一个重要指标。本研究中,牧草以苇状羊茅IVNDFD最高,而其他牧草的IVNDFD也存在明显差异,造成这种差异的原因可能与微生物与底物的吸附能力以及底物的结构有关,相对于其他牧草,苇状羊茅可能更容易吸附纤维降解菌。Fernando等[38]报道细菌与底物的吸附能力是影响底物消化率的重要因子,徐俊等[39]研究报道,苜蓿茎被瘤胃微生物降解的速率及程度受其组织结构及组分影响,同时其指出微生物对植物组织的吸附方式的不一致性也可能是造成不同底物纤维降解率不同的原因之一。
3.4 不同牧草对体外发酵pH和NH3-N浓度的影响瘤胃pH是评价瘤胃内环境的重要指标之一,维持瘤胃正常pH是保证瘤胃正常发酵的前提,而正常奶牛瘤胃液pH的正常范围为5.5~7.5[40],在本试验中,5种发酵底物体外发酵液pH范围为6.32~6.59,均在正常范围内。已有报道指出,当pH大于5.7时,瘤胃微生物具有最大生长速度[41],由此可知,本试验中粗饲料体外发酵均有利于微生物的生长。瘤胃pH的大小受反刍动物唾液分泌,有机酸的生成、吸收和排出等多种因素影响,但其波动的根本原因在于饲粮结构[42],本试验中,牧草以苇状羊茅体外发酵液中pH最低,可能是由于发酵产生较高的VFA所造成的。牧草体外发酵液pH大小与各粗饲料对应体外发酵VFA总量基本保持一致。
瘤胃中NH3-N是瘤胃微生物合成微生物蛋白和机体蛋白的主要原料,也是微生物生长的重要氮源,其浓度在一定程度上可以反应出瘤胃中蛋白质降解与合成之间的平衡状态[43]。Suwanlee等[44]研究指出,瘤胃中NH3-N的最佳浓度范围为6.2~27.5 mg/dL,而在本试验中,5种发酵底物体外发酵液中NH3-N浓度范围为6.26~19.74 mg/dL,均在所报道的最佳浓度范围内。同时,牧草之间体外NH3-N浓度均存在显著差异,这种差异可能是由于不同牧草蛋白质含量不同所造成的。其中,牧草以紫花苜蓿体外NH3-N浓度最高,且显著高于其他牧草,这可能是由于紫花苜蓿为豆科植物,其他牧草为禾本科植物造成的。已有报道指出豆科植物的蛋白质含量大于禾本科植物的蛋白质含量[6],由此可知,豆科的紫花苜蓿的蛋白质含量高于禾本科的其他牧草,因此体外发酵NH3-N浓度高于其他牧草。
3.5 不同牧草对体外发酵VFA产量的影响VFA主要是由瘤胃微生物对饲料营养物质进行厌氧发酵而得到的终产物[45],是反刍动物赖以生存、保持正常生长、泌乳和繁殖的主要能源,可提供反刍动物总能量需要的70%~80%,因而在反刍动物碳水化合物营养中占有重要地位[46]。VFA的种类主要有乙酸、丙酸、丁酸、戊酸、异丁酸、异戊酸等,而对动物代谢最为重要的是乙酸、丙酸、丁酸,三者约占瘤胃VFA总量的95%,其中又以乙酸是产量最大的VFA,喂粗料饲粮时占VFA总产量的70%~75%[47]。
在本试验中,不同牧草体外VFA产量及其组成均存在明显差异,牧草中苇状羊茅体外乙酸、丙酸、丁酸以及总VFA的产量均显著高于其他牧草,但乙酸/丙酸却相对较低;芦苇体外总VFA含量相对较低,但其乙酸/丙酸相对较高,这种差异可能是由不同牧草所含可发酵有机物以及NDF含量不同所引起的。郭冬生等[47]研究报道,VFA的生成量主要取决于可发酵有机物,李旺[48]研究报道,饲料中矿物元素也会影响到VFA的产量,同时指出VFA的组成受饲料中NDF和非NDF的影响较大。此外,不同来源植物细胞壁体外发酵VFA产量也存在显著差异;张元庆等[49]研究报道6种不同来源植物细胞壁发酵产生总VFA含量及其除丁酸含量外的其他VFA组分均存在显著性差异。
4 结论①体外发酵48 h后,苇状羊茅体外产气量、Vf、FRD0、IVDMD及CH4、乙酸、丙酸、丁酸、总VFA产量均显著高于其他4种牧草。
②体外发酵48 h后,苇状羊茅体外发酵pH及乙酸/丙酸显著低于其他试验牧草,紫花苜蓿体外NH3-N浓度最高,为18.64 mg/dL,显著高于其他试验牧草。
③综合不同牧草体外产气参数、体外发酵指标和降解率发现,以苇状羊茅体外发酵效果最佳,与其他试验牧草相比,更容易被瘤胃微生物降解利用。
| [1] |
呼天明, 边巴卓玛, 曹中华, 等. 施行草地农业推进西藏畜牧业的可持续发展[J].
家畜生态学报, 2005, 26(1): 78–80.
( 0) 0)
|
| [2] |
边巴卓玛, 呼天明, 吴红新. 依靠西藏野生牧草种质资源提高天然草场的植被恢复效率[J].
草业科学, 2006, 23(2): 6–8.
( 0) 0)
|
| [3] |
姜文清, 周志宇, 秦彧, 等. 西藏牧草和作物秸秆热值研究[J].
草业科学, 2010, 27(07): 147–153.
( 0) 0)
|
| [4] |
赵禹臣, 孟庆翔, 参木有, 等. 西藏高寒草地冷暖季牧草的营养价值和养分提供量分析[J].
动物营养学报, 2012, 24(12): 2515–2522.
( 0) 0)
|
| [5] |
曲广鹏,袁庆华,参木友.西藏农区牧草饲草作物引种试验研究[D].硕士毕业论文.北京:中国农业科学院,2012:17.
( 0) 0)
|
| [6] |
张中岳.西藏地区牧草营养价值及其瘤胃降解特性研究[M].硕士学位论文.西安:西北农林科技大学,2009.
( 0) 0)
|
| [7] |
张吉, 原现军, 郭刚, 等. 添加剂对西藏燕麦和箭筈豌豆混合青贮发酵品质的影响[J].
草业学报, 2014, 23(5): 359–364.
( 0) 0)
|
| [8] |
孙肖慧, 原现军, 郭刚, 等. 添加乙醇和糖蜜对西藏地区燕麦和紫花苜蓿混合青贮发酵品质的影响[J].
畜牧兽医学报, 2014, 45(3): 417–425.
( 0) 0)
|
| [9] |
李君风, 孙肖慧, 原现军, 等. 添加乙酸对西藏燕麦和紫花苜蓿混合青贮发酵品质和有氧稳定性的影响[J].
草业学报, 2014, 23(5): 271–278.
( 0) 0)
|
| [10] |
赵庆杰, 原现军, 郭刚, 等. 添加糖蜜和乳酸菌制剂对西藏青稞秸秆和多年生黑麦草混合青贮发酵品质的影响[J].
草业学报, 2014, 23(4): 100–106.
( 0) 0)
|
| [11] |
原现军.西藏地区农作物秸轩与牧草混合青贮研究[D].博士学位论文.南京:南京农业大学,2012:127.
( 0) 0)
|
| [12] |
National Research Council.
National Research Council.Subcommittee on dairy cattle nutrition.Nutrient requirements of dairy cattle[M].Washington,D.C.:National Academies Press,2001.. .
( 0) 0)
|
| [13] |
HALL M B, PELL A N, CHASE L E. Characteristics of neutral detergent-soluble fiber fermentation by mixed ruminal microbes[J].
Animal Feed Science and Technology, 1998, 70(1/2): 23–39.
( 0) 0)
|
| [14] |
杨胜.
饲料分析及饲料质量检测技术[M]. 北京: 北京农业大学出版社 , 1993 : 58 -64.
( 0) 0)
|
| [15] |
冯三令, 储瑞武, 吴玲, 等. ICP-AES法测定饲料中多种微量元素的方法研究[J].
畜牧与饲料科学, 2010, 31(4): 109–112.
( 0) 0)
|
| [16] |
刘玉杰, 李向林, 何峰. 基于饲养标准的家畜单位折算方法[J].
草地学报, 2009, 17(4): 500–504.
( 0) 0)
|
| [17] |
MENKE K H, STEINGASS H. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J].
Animal Research and Development, 1988, 28(7): 55.
( 0) 0)
|
| [18] |
王祚, 周传社, 汤少勋, 等. 两种酵母对奶牛瘤胃体外发酵特性的影响[J].
农业现代化研究, 2014, 35(2): 218–224.
( 0) 0)
|
| [19] |
WANG M, TANG S X, TAN Z L. Modeling in vitro gas production kinetics: derivation of logistic-exponential (LE) equations and comparison of models[J].
Animal Feed Science and Technology, 2011, 165: 137–150.
( 0) 0)
|
| [20] |
WANG M, JANSSEN P H, SUN X Z, et al. A mathematical model to describe in vitro kinetics of H2 gas accumulation[J].
Animal Feed Science and Technology, 2013, 184: 1–16.
( 0) 0)
|
| [21] |
LI X Z, LONG R J, YAN C G, et al. Rumen microbial responses in fermentation characteristics and production of CLA and methane to linoleic acid in associated with malate or fumarate[J].
Animal Feed Science and Technology, 2010, 155(2/3/4): 132–139.
( 0) 0)
|
| [22] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J].
畜牧与饲料科学, 2010, 31(6/7): 37.
( 0) 0)
|
| [23] |
WANG M, SUN X Z, JANSSEN P H, et al. Responses of methane production and fermentation pathways to the increased dissolved hydrogen concentration generated by eight substrates in in vitro ruminal cultures[J].
Animal Feed Science and Technology, 2014, 194: 1–11.
( 0) 0)
|
| [24] |
汤少勋, 姜海林, 周传社, 等. 不同牧草品种对体外发酵产气特性的影响[J].
草业学报, 2005, 14(3): 72–77.
( 0) 0)
|
| [25] |
CONE J W, GELDE VAN A H. Influence of protein fermentation on gas production profiles[J].
Animal Feed Science and Technology, 1999, 76: 251–264.
( 0) 0)
|
| [26] |
刘书杰.利用体外产气法评定青海高原天然牧草营养价值的研究[D].硕士学位论文.西宁:青海大学,2007:13.
( 0) 0)
|
| [27] |
METZLER-ZEBELI B U, SCHERR C, SALLAKU E, et al. Evaluation of associative effects of total mixed ration for dairy cattle using in vitro gas production and different rumen inocula[J].
Journal of the Science of Food and Agriculture, 2012, 92(12): 2479–2485.
( 0) 0)
|
| [28] |
高巍, 王新峰, 潘晓亮, 等. 玉米秸青贮与黄贮及苜蓿干草的体外发酵动态消化研究[J].
石河子大学学报:自然科学版, 2002, 6(3): 222–225.
( 0) 0)
|
| [29] |
WANG M, SUN X Z, TANG S X, et al. Deriving fractional rate of degradation of logistic-exponential (LE) model to evaluate early in vitro fermentation[J].
Animal, 2013, 7(6): 1–10.
( 0) 0)
|
| [30] |
MUCK R E, FILYA I, CONTRERAS-GOVEA F E. Inoculant effects on alfalfa silage: in vitro gas and volatile fatty acid production[J].
Journal of Dairy Science, 2007, 90(11): 5115–5125.
( 0) 0)
|
| [31] |
郭嫣秋, 胡伟莲, 刘建新. 瘤胃甲烷菌及甲烷生成的调控[J].
微生物学报, 2005, 45(1): 145–148.
( 0) 0)
|
| [32] |
JOHNSON K A, JOHNSON D E. Methane emissions from cattle[J].
Animal Science, 1995, 73: 2483–2492.
( 0) 0)
|
| [33] |
郭雪峰, 金海, 卢德勋, 等. 甲烷气体产生量与牧草营养参数的相关性分析[J].
江西农业大学学报, 2009, 31(1): 35–40.
( 0) 0)
|
| [34] |
刘树军, 李向林, 何峰, 等. 奶牛常用饲草的体外发酵CH4产量研究[J].
草地学报, 2011, 19(5): 858–864.
( 0) 0)
|
| [35] |
MOSS A R, GIVENS D I. The effect of alkali treatment of cereal straws on the digestibility and methane production by sheep[J].
Animal Feed Science and Technology, 1994, 49: 245–259.
( 0) 0)
|
| [36] |
HOLTER J B, YOUNG A J. Methane prediction in dry and lactating Holstein cows[J].
Journal of Dairy Science, 1992, 75(8): 2165–2175.
( 0) 0)
|
| [37] |
MILLER T L, WOLIN M J. Inhibition of growth of methane-producing bacteria of the ruminant forestomach by hydroxylmethylglutaryl-ScoA reductase inhibitors[J].
Journal of Dairy Science, 2001, 84: 1445–1448.
( 0) 0)
|
| [38] |
FERNANDO W M, FLINT S, BRENNAN C S, et al. The influence of environmental factors on the adhesion of combinations of probiotics to rice fibre fractions[J].
World Journal of Microbiology and Biotechnology, 2012, 28(6): 2293–2302.
( 0) 0)
|
| [39] |
徐俊, 侯玉洁, 赵国琦, 等. 瘤胃微生物对苜蓿茎降解特性及超微结构的影响[J].
动物营养学报, 2014, 26(3): 776–782.
( 0) 0)
|
| [40] |
MARIE K K, OETZEL G R. Understanding and preventing subacute ruminal acidosis in dairy herds: a review[J].
Animal Feed Science and Technology, 2006, 126(3): 215–255.
( 0) 0)
|
| [41] |
VAN HOUTERT M F J. The production and metabolism of volatile fatty acids by ruminants fed roughages: a review[J].
Animal Feed Science and Technology, 1993, 43(3): 189–255.
( 0) 0)
|
| [42] |
XU S, HARRSION J H, CHALUPA W, et al. The effect of ruminal bypass lysine and methionine on milk yield and composition of lactating cows[J].
Journal of Dairy Science, 1998, 81(4): 1062–1077.
( 0) 0)
|
| [43] |
FIRKINS J L, YU Z, MORRISON M R. Ruminal nitrogen metabolism: perspectives for intergration of microbiology and nutrition for dairy[J].
Journal of Dairy Science, 2007, 90(1): 1–6.
( 0) 0)
|
| [44] |
SUWANLEE S, WANAPAT M. Effect of ruminal NH3-N levels on ruminal fermentation, purine derivatives, digestibility and rice straw intake in Swamp Buffaloes[J].
Asian-Australasian Journal of Animal Science, 1999, 12(6): 904–907.
( 0) 0)
|
| [45] |
BERGMAN E N. Interconversions and production of volatile fatty acids in the sheep rumen[J].
Biochemistry Journal, 1965, 97: 53–58.
( 0) 0)
|
| [46] |
王中华. 反刍动物挥发性脂肪酸中间代谢[J].
草食家畜, 1995, 2: 23–33.
( 0) 0)
|
| [47] |
郭冬生, 彭小兰. 反刍动物挥发性脂肪酸消化代谢规律刍议[J].
畜牧与饲料科学, 2005, 1: 1–3.
( 0) 0)
|
| [48] |
李旺. 瘤胃挥发性脂肪酸的作用及影响因素[J].
中国畜牧杂志, 2012, 48(7): 63–66.
( 0) 0)
|
| [49] |
张元庆, 魏吉安, 孟庆翔. 不同植物细胞壁的体外发酵特征及其对甲烷产生的贡献[J].
畜牧兽医学报, 2006, 37(10): 992–998.
( 0) 0)
|




