反刍动物的饲养及营养需要要求对反刍动物采食的饲料进行养分利用率的优化,即需要一个简单、快速、精准的方法估测动物饲粮中饲料的营养价值[1-2]。目前主要是对反刍动物采食的饲料进行化学成分、瘤胃降解特性和消化特性的测定。瘤胃降解特性可以影响饲料的营养价值,也可以作为饲粮配方依据以满足动物的能、氮平衡,从而同步瘤胃营养,提高微生物蛋白质的合成和饲料利用率[3]。
Yu等[4]通过对具有相似化学组成的2种类型的大麦(麦芽型大麦和饲用型大麦)进行比较,发现二者瘤胃降解程度却不同,麦芽型大麦的降解程度强于饲用型大麦。Liu等[5]在研究中发现不同品种的大麦虽然化学组成相近,但降解特性却差异显著。由此可见,传统的化学分析方法在处理过程或测定过程中破坏了分子内在结构和理化特性,仅能测定出化学组分的相关信息,无法揭示蛋白质内在分子结构与营养价值以及利用率的关系[6-7]。卢雁等[8]指出,傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)技术是对蛋白质二级结构定量计算的强有力手段。FTIR分析技术是一种可以揭示饲料生物学分子结构特点的快速、直接、破坏程度小的分析技术[7, 9-13]。由于每个生物组分都有其特定的分子结构信息,所以也存在独特的光谱信息与之对应。例如,蛋白质分子光谱区域分为酰胺Ⅰ带(主要由80%的C=O和20%的C—N伸缩振动组成)和酰胺Ⅱ带(主要由60%N—H弯曲振动和40%的C—N伸缩振动组成)[14]。酰胺Ⅰ带中蛋白质分子的二级结构主要包含α-螺旋、β-折叠和少量的β-转角、无规则卷曲[15-18]。每一个官能团都与样本的营养组分及生物学特性紧密相关。
所以,本文旨在利用FTIR技术对玉米青贮进行光谱扫描,在蛋白质区域取得光谱特性,进而与其瘤胃降解特性进行相关及回归分析,并构建预测方程,以探索玉米青贮的蛋白质分子结构特性是否与其瘤胃降解特性存在一定的相关关系。
1 材料与方法 1.1 试验材料本试验所选用的玉米青贮(n=11)采集于2014年5月至9月,采集地点为位于黑龙江省哈尔滨市、齐齐哈尔市、大庆市等地的奶牛养殖场,玉米种类见表 1。
|
|
表 1 试验样品基本信息 Table 1 Basic information of experimental samples |
采集后的样品经过65 ℃烘干48 h,粉碎过100目网筛,用于光谱分析;粉碎过1 mm网筛,用于化学分析;粉碎过2 mm网筛用于瘤胃降解试验。
1.2 试验动物与饲粮试验选用3头装有永久性瘤胃瘘管的健康荷斯坦奶牛,于东北农业大学香坊实验基地进行瘤胃降解试验。试验牛的饲粮参照我国奶牛饲养标准配制,试验饲粮组成及营养水平见表 2。试验期间每日于08:00和16:00饲喂饲粮,自由饮水,单槽饲养。
|
|
表 2 试验饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of the experimental diet (air-dry basis) |
干物质(dry matter,DM)、粗蛋白质(crude protein,CP)的测定参照AOAC(1950)[20]的方法,中性洗涤纤维(neutral-detergent fiber,NDF)的测定参照Van Soest等[21]的方法。
1.3.2 瘤胃尼龙袋法根据Peng等[22]的瘤胃降解试验方法,称取7 g左右粉碎后的试验样品分别放入孔径为50 μm、大小为10 cm×20 cm的已知重量的尼龙袋中,用尼龙绳距袋口2 cm处系好,使得每个袋子内的样品占袋子表面积的比例约为19 mg/cm2。每种样品称3个重复。在饲喂前按照“依次投入,同时取出”的原则,将称好的尼龙袋随机放入规格为45 cm×45 cm的瘤胃网兜中,并用90 cm长的绳子固定在瘤胃瘘管上,分别培养72、48、36、24、16、12、8、4、0 h。每头牛、每个时间点瘤胃中尼龙袋的数目不超过28个。取出后的尼龙袋(包括0 h)放在自来水下冲洗,直至水澄清,并在65 ℃的条件下烘干48 h至恒重,记录残渣与尼龙袋的总重,然后粉碎过1 mm网筛,于封口袋中保存待测。
1.3.3 中红外光谱的检测试验采用的仪器为BRUKER ALPHA中红外光谱仪(德国布鲁克光谱仪器公司)。
试验参照焦培鑫等[23]的方法,在红外烤灯照射的干燥条件下,以溴化钾(光谱纯)作为背景,将2 mg样品与200 mg溴化钾在玛瑙研钵中充分研磨、混匀并进行压片,放入光谱仪中进行读取分析。光谱采集时仪器的设定参数参照Kim等[24]的报道。扫描范围为700~4 000 cm-1(图 1),扫描次数为128次,分辨率为4 cm-1,每个样品重复装样5次(图 2),重复2遍。
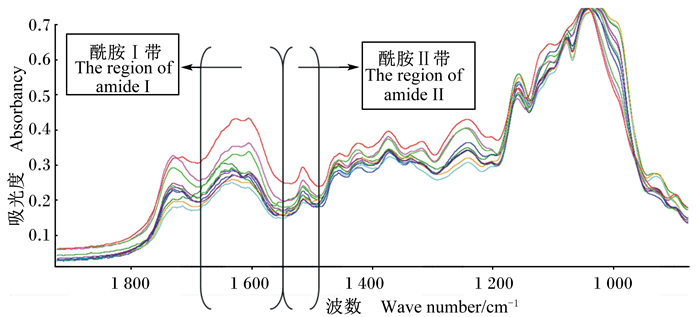
|
图1 11种玉米青贮蛋白质光谱酰胺Ⅰ带与酰胺Ⅱ带的区域划分 Fig. 1 The region of amide Ⅰ and amide Ⅱ of FTIR protein spectroscopy in 11 kinds of corn silages |
某成分瘤胃消失率(%)=100×(某成分质量-残留物中某成分质量)/某成分质量。
根据Ørskov等[25]提出的瘤胃动力学数学指数模型进行计算:
Y=a+b(1-e-ct)。
式中:Y为尼龙袋在瘤胃中滞留时间t后营养成分的瘤胃消失率(%),a为快速降解部分(%),b为慢速降解部分(%),c为慢速降解部分的降解速率(%/h),t为瘤胃滞留时间(h),下式同。
不可降解部分(u,%)的计算公式为:
u=1-(a+b)。
饲料有效降解率(ED,%)的计算公式为:
ED=a+[(b×c)/(c+k)]。
式中:k为瘤胃外流速率,为0.031/h[26]。
1.4.2 中红外光谱分析利用光谱处理软件Ominic 8.2(Spectra tech,Madison,WI,USA)对光谱中蛋白质区域酰胺区段(1 720~1 480 cm-1)进行分析,并分别对酰胺Ⅰ带与酰胺Ⅱ带进行基线校正。对酰胺Ⅰ带区段进行二阶导处理,并对二阶导图谱进行平滑,然后找到原光谱对应的蛋白质二级结构位置[27]:α-螺旋出现在1 658~1 648 cm-1波段;β-折叠出现在1 640~1 620 cm-1波段。本试验分别对酰胺Ⅰ带、酰胺Ⅱ带的峰高、峰面积、峰高比、峰面积比,以及蛋白质二级结构α-螺旋、β-折叠的峰高、峰高比进行分析计算,探索玉米青贮蛋白质分子结构与其干物质、粗蛋白质以及中性洗涤纤维瘤胃降解特性是否存在相关关系。
1.4.3 数据统计与分析用Excel 2010进行数据的初步整理,用SAS 9.2软件中的PROC MIXED程序对玉米青贮瘤胃降解特性中的参数(快速降解部分、慢速降解部分、慢速降解部分的降解速率、不可降解部分、有效降解率)和蛋白质分子光谱的数据(酰胺Ⅰ带、酰胺Ⅱ带的峰面积、峰高、峰面积比和峰高比,二级结构α-螺旋、β-折叠的峰高、峰高比)进行分析,用PROC CORR 程序分析瘤胃降解特性与蛋白质光谱数据的Pearson相关性(P<0.01、P<0.05、P<0.10和P≥0.10分别为极显著相关、显著相关、趋于相关和不相关),并用PROC REG程序进行多元回归分析(R2<0.2、R2<0.4、R2<0.6和R2>0.6分别为弱拟合、中等拟合、中高度拟合和强拟合)。
2 结果与分析 2.1 瘤胃降解特性与蛋白质分子结构的总体信息 2.1.1 瘤胃降解特性降解参数的信息11种玉米青贮瘤胃降解参数的信息见表 3。其中,干物质瘤胃降解特性快速降解部分(DMa)为14.86%~32.80%,干物质慢速降解部分(DMb)为43.58%~67.36%,干物质慢速降解部分的降解速率(DMc)为1.46%~4.93%,干物质不可降解部分(DMu)为11.75%~31.16%,干物质有效降解率(DMED)为40.99%~54.58%。蛋白质瘤胃降解特性快速降解部分(CPa)为35.80%~61.02%,蛋白质慢速降解部分(CPb)为12.24%~46.09%,蛋白质慢速降解部分的降解速率(CPc)为0.85%~7.07%,蛋白质不可降解部分(CPu)为10.41%~44.66%,蛋白质有效降解率(CPED)为45.85%~69.35%。中性洗涤纤维瘤胃降解特性快速降解部分(NDFa)为1.03%~22.70%,中性洗涤纤维慢速降解部分(NDFb)为46.34%~88.05%,中性洗涤纤维慢速降解部分的降解速率(NDFc)为1.23%~4.12%,中性洗涤纤维不可降解部分(NDFu)为8.81%~35.39%,中性洗涤纤维有效降解率(NDFED)为32.98%~47.59%。其中不同地区的玉米青贮瘤胃降解参数变异较大,为后续与蛋白质分子结构的相关分析以及回归拟合提供了良好的数据支持。
|
|
表 3 玉米青贮瘤胃降解特性的数据汇总 Table 3 Summary of rumen degradation characteristics data of corn silages |
11种玉米青贮蛋白质分子结构的信息见表 4。酰胺Ⅰ带的峰面积(A_Ⅰ)范围为4.66~11.68,酰胺Ⅱ带的峰面积(A_Ⅱ)范围为0.39~1.00,酰胺Ⅰ带的峰高(H_Ⅰ)范围为0.06~0.14,酰胺Ⅱ带的峰高(H_Ⅱ)范围为0.02~0.05,α-螺 旋的峰高(α)范围为0.05~0.10,β-折叠的峰高 (β)范围为0.06~0.14,酰胺Ⅰ带、Ⅱ带的峰面积比(A_Ⅰ_Ⅱ)范围为5.53~22.02,酰胺Ⅰ带、Ⅱ带的峰高比(H_Ⅰ_Ⅱ)范围为1.72~4.34,α-螺旋和β-折叠的峰高比(α_β)范围为0.58~1.00。其中不同地区的11种玉米青贮蛋白质分子结构参数变异较大。
|
|
表 4 玉米青贮蛋白质结构光谱特性的数据汇总 Table 4 Summary of protein structural characteristics data of corn silages |
由表 5可知,DMa分别与A_Ⅱ呈显著负相关(r=-0.47,P=0.03),与A_Ⅰ_Ⅱ呈显著正相关(r=0.45,P=0.03),与H_Ⅰ_Ⅱ呈极显著正相关(r=0.57,P=0.006)。DMb分别与A_Ⅰ_Ⅱ趋于负相关(r=-0.37,P=0.09),与H_Ⅰ_Ⅱ极呈极显著负相关(r=-0.55,P=0.008)。DMc与H_Ⅱ趋于负相关(r=-0.37,P=0.09),与α趋于正相关(r=0.37,P=0.09),与α_β呈极显著正相关(r=0.59,P=0.004)。DMu分别与α呈极显著正相关(r=0.59,P=0.004),与β呈趋于正相关(r=0.43,P=0.05)。DMED分别与A_Ⅱ、H_Ⅱ呈极显著负相关(r=-0.61,P=0.003;r=-0.71,P=0.000 2),与A_Ⅰ_Ⅱ呈显著正相关(r=0.44,P=0.04),与H_Ⅰ_Ⅱ呈极显著正相关(r=0.61,P=0.003)。
|
|
表 5 玉米青贮干物质瘤胃降解特性与蛋白质结构光谱的相关性 Table 5 Correlation between rumen degradation characteristics of dry matter and protein structural characteristics of corn silages |
由表 6可知,CPa与α呈显著正相关(r=0.45,P=0.04),与H_Ⅰ_Ⅱ、α_β趋于正相关(r=0.37,P=0.09;r=0.39,P=0.07)。CPc分别与A_Ⅰ、β趋于负相关(r=-0.38,P=0.08;r=-0.38,P=0.08),与A_Ⅰ_Ⅱ呈显著负相关(r=-0.46,P=0.03),与α_β呈显著正相关(r=0.57,P=0.01)。CPu分别与A_Ⅱ呈显著正相关(r=0.50,P=0.02),与A_Ⅰ_Ⅱ呈显著负相关(r=-0.48,P=0.03),与H_Ⅰ_Ⅱ呈显著正相关(r=0.50,P=0.02)。CPED分别与A_Ⅱ趋于负相关(r=-0.40,P=0.06),与α、H_Ⅰ_Ⅱ趋于正相关(r=0.38,P=0.09;r=0.38,P=0.08),与α_β呈显著正相关(r=0.43,P=0.04)。
|
|
表 6 玉米青贮蛋白质瘤胃降解特性与蛋白质结构光谱的相关性 Table 6 Correlation between rumen degradation characteristics of crude protein and protein structural characteristics of corn silages |
从表 7可知,NDFa与蛋白质的分子结构无相关性(P>0.10)。NDFb与H_Ⅱ趋于正相关(r=0.39,P=0.08)。NDFc与H_Ⅱ呈显著负相关(r=-0.52,P=0.01),与α_β趋于正相关(r=0.39,P=0.08)。NDFu与H_Ⅱ呈显著负相关(r=-0.46,P=0.03)。NDFED与α_β呈趋于正相关(r=0.42,P=0.05)。
|
|
表 7 玉米青贮中性洗涤纤维瘤胃降解特性与蛋白质结构光谱的相关性 Table 7 Correlation between rumen degradation characteristics of neutral-detergent and protein structural characteristics of corn silages |
由表 8可知,H_Ⅰ_Ⅱ分别是拟合DMa和DMb回归方程的最佳自变量,决定系数R2分别为0.32和0.30,属中等拟合;α是拟合DMu的最佳自变量,R2=0.34,属中等拟合;α_β是拟合DMc的最佳自变量,R2=0.35,属中等拟合;H_Ⅱ与DMED拟合度较好,R2=0.50。
|
|
表 8 玉米青贮中性洗涤纤维瘤胃降解特性与蛋白质结构光谱的相关性 Table 8 Correlation between rumen degradation characteristics of neutral-detergent and protein structural characteristics of corn silages |
由表 8可知,α可对CPa进行拟合,R2=0.20;未得到CPb与蛋白质分子结构的拟合方程;α_β可中等拟合CPc,R2=0.33;H_Ⅰ_Ⅱ分别是拟合CPu与CPED的最佳自变量,R2分别为0.25和0.48,对CPED的拟合度最好。
2.3.3 中性洗涤纤维瘤胃降解特性与蛋白质分子结构的的回归分析由表 8可知,蛋白质分子结构与NDFa、NDFb的相关性不强,故未得到拟合方程;H_Ⅱ可分别拟合NDFc与NDFu,R2分别为0.27和0.21;α_β可拟合NDFED,但拟合效果较弱,R2=0.18。
3 讨 论 3.1 干物质瘤胃降解特性与蛋白质分子结构的关系蛋白质分子结构对DMb的拟合度好于DMa,这可能是由于DMa与蛋白质分子结构的联系相对于DMb更为密切。DMc与蛋白质分子结构的相关性与Zhang等[27]的结论不完全相符,该试验以空气为背景,对样品直接进行检测的原理与本文一致,其结果的差异可能是由于研究的对象不同,该文献研究的是玉米酒精糟及可溶物(DDGS)与无壳大麦组成的5种不同比例混合饲料与瘤胃降解特性的关系,由于饲料种类的不同,其营养价值也不一样,故所反映的蛋白质分子结构与瘤胃降解特性的相关性也可能存在差异。
干物质降解特性能与蛋白质分子结构建立联系,且部分降解特性拟合度较好的原因可能是因为其与纤维中芳香族化合物振动有关,光谱范围集中于1 498~1 587 cm-1[28],存在于蛋白质结构光谱区域内,故二者存在一定的联系。
3.2 粗蛋白质瘤胃降解特性与蛋白质分子结构的关系蛋白质分子结构光谱特性(酰胺Ⅰ带、Ⅱ带光谱强度、二级结构的强度以及它们的比例)会影响粗蛋白质的品质和利用率[7, 29-31]。这主要是因为蛋白质结构会影响与粗蛋白质品质和利用率有关的微生物和胃肠道消化酶的接触。所以研究蛋白质分子结构,对粗蛋白质的组成、品质、以及瘤胃降解特性极其重要。饲料的粗蛋白质瘤胃降解特性与其分子结构联系紧密[9]。
Liu等[5]在利用漫反射红外光谱技术对6种大麦的外壳与籽粒之间不同降解特性研究时发现CPa与α-螺旋和β-折叠的峰高比呈显著正相关,与本文结论一致,但未发现本文中提及的CPa与α-螺旋峰高显著正相关,这可能由于蛋白质来源不同、加工处理的方式不同带来的差异。Zhang等[27]在研究中并未发现CPc与α-螺旋的峰高存在联系,与本文一致,但本文CPc与β-折叠的峰高负相关、与α-螺旋与β-折叠的峰高比呈显著正相关,与报道中的无相关不符。本研究中蛋白质α-螺旋与β-折叠的峰高比与CPu无相关,与CPED显著正相关的结论与焦培鑫等[23]、吴鹏华等[32]、Liu等[5]、Yari等[33]报道的一致,说明饲料蛋白质α-螺旋与β-折叠的峰高比值越高,其有效降解率越高,且二者的拟合度较好。Zhang等[34]指出α-螺旋与β-折叠的峰高比与蛋白质营养价值和利用率密切相关,但酰胺Ⅰ带、Ⅱ带的峰面积比并不完全与之相关,本研究中未见CPED与酰胺Ⅰ带、Ⅱ带的峰面积比的相关性,结论与Liu等[5]一致。
相对于大麦、燕麦、小麦来说,羽毛中含有高达84%的β-折叠,但蛋白质的利用率却最低,这与其β-折叠、角蛋白含量、二硫键含量等结构特点密切相关[35]。证明植物性饲料蛋白的营养价值,不仅与蛋白质种类、总蛋白质和氨基酸的含量密切相关,也与瘤胃中蛋白质对水解酶的敏感度有关,更与蛋白质分子的自身结构关系密切,其中β-折叠所占比例的高低通常和饲料与胃肠道消化酶接触的多少有关。Yu[14]曾在研究不同加工方式对金黄色亚麻籽影响时发现,加热处理会使蛋白质与木质素的连接增多,增加蛋白质美拉德反应的数目,同时随蛋白质二级结构β-折叠的比例增加,蛋白质的吸收利用也受到了影响。所以相似的蛋白质含量,若其二级结构α-螺旋、β-折叠的比例不同,也会使饲料的降解特性有所不同[12],其中β-折叠的比例高通常导致饲料的营养价值低[4, 7, 11]。
3.3 中性洗涤纤维瘤胃降解特性与蛋白质分子结构的关系中性洗涤纤维的瘤胃降解特性与碳水化合物光谱区域关系较为密切[36-37],前人对于其与蛋白质分子结构的关系研究较少。本研究的结果也表明,蛋白质分子结构与中性洗涤纤维瘤胃降解特性关联较差,NDFa和NDFb均未得出拟合方程,对NDFED的拟合度也较低,其微弱的关系可能同样是由于中性洗涤纤维中不被微生物利用的木质素中芳香化合物的存在,而部分与芳香化合物分子振动相关的结构受蛋白质酰胺带的干扰[38]。
4 结 论① 利用FTIR技术可以获得玉米青贮蛋白质分子结构的光谱信息,并根据其与瘤胃降解特性的相关性,建立回归方程。其中,玉米青贮蛋白质分子结构中酰胺Ⅱ带的峰高与其干物质瘤胃有效降解率极显著相关,拟合度最好;酰胺Ⅰ带、Ⅱ带的峰高比和蛋白质二级结构(α-螺旋、β-折叠)的峰高比对蛋白质瘤胃有效降解率拟合度最好;玉米青贮蛋白质二级结构对中性洗涤纤维瘤胃有效降解率拟合度较弱。
② 利用FTIR技术可同时分析饲料的多个瘤胃降解特性,分析速度快,具有常规试验方法所不具有的优点。玉米青贮蛋白质分子结构评定部分瘤胃降解特性可行,其对干物质和蛋白质瘤胃有效降解率评定效果最好。
| [1] |
ALDERMAN G, COTTRILL B R.
Energy and protein requirements of ruminants:an advisory manual prepared by the AFRC technical committee on responses to nutrients[M]. Wallingford: CAB International, 1993 .
( 0) 0)
|
| [2] |
NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington,D.C.:National Academy of Sciences,2001.
( 0) 0)
|
| [3] |
CASPER D P, MAIGA H A, BROUK M J, et al. Synchronization of carbohydrate and protein sources on fermentation and passage rates in dairy cows[J].
Journal of Dairy Science, 1999, 82(8): 1779–1790.
( 0) 0)
|
| [4] |
YU P, CHRISTENSEN D A, CHRISTENSEN C R, et al. Use of synchrotron FTIR microspectroscopy to identify chemical differences in barley endosperm tissue in relation to rumen degradation characteristics[J].
Canadian Journal of Animal Science, 2004, 84(3): 523–527.
( 0) 0)
|
| [5] |
LIU N, YU P Q. Molecular clustering,interrelationships and carbohydrate conformation in hull and seeds among barley cultivars[J].
Journal of Cereal Science, 2011, 53(3): 379–383.
( 0) 0)
|
| [6] |
YU P Q, JONKER A, GRUBER M. Molecular basis of protein structure in proanthocyanidin and anthocyanin-enhanced Lc-transgenic alfalfa in relation to nutritive value using synchrotron-radiation FTIR microspectroscopy:a novel approach[J].
Spectrochimica Acta Part A, 2009, 73(5): 846–853.
( 0) 0)
|
| [7] |
YU P. Application of advanced synchrotron radiation-based Fourier transform infrared (SR-FTIR) microspectroscopy to animal nutrition and feed science:a novel approach[J].
British Journal of Nutrition, 2004, 92(6): 869–885.
( 0) 0)
|
| [8] |
卢雁, 张玮玮, 王公轲. FTIR用于变性蛋白质二级结构的研究进展[J].
光谱学与光谱分析, 2008, 28(1): 88–93.
( 0) 0)
|
| [9] |
YU P Q, MCKINNON J J, CHRISTENSEN C R, et al. Using synchrotron-based FTIR microspectroscopy to reveal chemical features of feather protein secondary structure:comparison with other feed protein sources[J].
Journal of Agricultural and Food Chemistry, 2004, 52(24): 7353–7361.
( 0) 0)
|
| [10] |
YU P, MCKINNON J J, SOITA H W, et al. Use of synchrotron-based FTIR microspectroscopy to determine protein secondary structures of raw and heat-treated brown and golden flaxseeds:a novel approach[J].
Canadian Journal of Animal Science, 2005, 85(4): 437–448.
( 0) 0)
|
| [11] |
DOIRON K, YU P, MCKINNON J J, et al. Heat-induced protein structure and subfractions in relation to protein degradation kinetics and intestinal availability in dairy cattle[J].
Journal of Dairy Science, 2009, 92(7): 3319–3330.
( 0) 0)
|
| [12] |
SAMADI, YU P. Dry and moist heating-induced changes in protein molecular structure,protein subfraction,and nutrient profiles in soybeans[J].
Journal of Dairy Science, 2011, 94(12): 6092–6102.
( 0) 0)
|
| [13] |
YU P Q. Protein molecular structures,protein subfractions,and protein availability affected by heat processing:a review[J].
American Journal of Biochemistry and Biotechnology, 2007, 3(2): 66–86.
( 0) 0)
|
| [14] |
YU P Q. Protein secondary structures (α-helix and β-sheet) at a cellular level and protein fractions in relation to rumen degradation behaviors of protein:a novel approach[J].
British Journal of Nutrition, 2005, 94(4): 655–665.
( 0) 0)
|
| [15] |
DYSON H J, WRIGHT P E. Peptide conformation and protein folding[J].
Current Opinion in Structural Biology, 1993, 3(1): 60–65.
( 0) 0)
|
| [16] |
KEMP W.
Organic spectroscopy[M]. Edinburgh: W H Freeman & Co, 1991 .
( 0) 0)
|
| [17] |
JACKSON M, MANTSCH H H. The use and misuse of FTIR spectroscopy in the determination of protein structure[J].
Critical Reviews in Biochemistry and Molecular Biology, 1995, 30(2): 95–120.
( 0) 0)
|
| [18] |
JACKSON M,MANTSCH H.Biomedical infrared spectroscopy[M]//MANTSCH H H,CHAPMAN D.Infrared Spectroscopy of Biomolecules.New York:Wiley-Liss Inc.,1996.
( 0) 0)
|
| [19] |
(美)国家科学研究委员会.奶牛营养需要[M].孟庆翔,译.北京:中国农业大学出版社,2002.
( 0) 0)
|
| [20] |
AOAC.Official methods of analysis of the Association of Official Analytical Chemists[S].7th ed.[S.l.]:Association of Official Analytical Chemists,1950.
( 0) 0)
|
| [21] |
VAN SOEST P J, ROBERTSON B R, LEWIS B A. Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].
Journal of Dairy Science, 1991, 74(10): 3583–3597.
( 0) 0)
|
| [22] |
PENG Q H, KHAN N A, WANG Z S, et al. Moist and dry heating-induced changes in protein molecular structure,protein subfractions,and nutrient profiles in camelina seeds[J].
Journal of Dairy Science, 2013, 97(1): 446–457.
( 0) 0)
|
| [23] |
焦培鑫, 刘大森, 郑帅, 等. 饲料原料蛋白质二级结构对奶牛瘤胃降解特性的影响[J].
饲料工业, 2012, 33(13): 48–51.
( 0) 0)
|
| [24] |
KIM S, KIM H, REUHS H, et al. Differentiation of outer membrane proteins from Salmonellaenterica serotypes using Fourier transform infrared spectroscopy and chemometrics[J].
Letters in Applied Microbiology, 2006, 42(3): 229–234.
( 0) 0)
|
| [25] |
ØRSKOVE R, MCDONALDI. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J].
Journal of Agricultural Science, 1979, 92(2): 499–503.
( 0) 0)
|
| [26] |
莫放, 冯仰廉. 常用饲料蛋白质在瘤胃的降解率[J].
中国畜牧杂志, 1995(3): 23–26.
( 0) 0)
|
| [27] |
ZHANG X W, YU P Q. Using ATR-FT/IR molecular spectroscopy to detect effects of blend DDGS inclusion level on the molecular structure spectral and metabolic characteristics of the proteins in hulless barley[J].
Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2012, 95: 53–63.
( 0) 0)
|
| [28] |
BELANCHE A, WEISBJERG M R, ALLISON G G, et al. Measurement of rumen dry matter and neutral detergent fiber degradability of feeds by Fourier-transform infrared spectroscopy[J].
Journal of Dairy Science, 2014, 97(4): 2361–2375.
( 0) 0)
|
| [29] |
WETZEL D L, SRIVARIN P, FINNEY J R. Revealing protein infrared spectral detail in a heterogeneous matrix dominated by starch[J].
Vibrational Spectroscopy, 2003, 31(1): 109–114.
( 0) 0)
|
| [30] |
SEGUCHI M, TAKEMOTO M, MIZUTANI U, et al. Effects of secondary structures of heated egg white protein on the binding between prime starch and tailings fractions in fresh wheat flour[J].
Cereal Chemistry, 2004, 81(5): 633–636.
( 0) 0)
|
| [31] |
YU P. Molecular chemistry imaging to reveal structural features of various plant feed tissues[J].
Journal of Structural Biology, 2005, 150(1): 81–89.
( 0) 0)
|
| [32] |
吴鹏华, 刘大森, 仝泳, 等. 干酒糟及其可溶物和豆粕混合饲料蛋白质二级结构与瘤胃降解特性的关系[J].
动物营养学报, 2013, 25(11): 2763–2769.
( 0) 0)
|
| [33] |
YARI M, VALIZADEH R, NASERIAN A A, et al. Protein molecular structures in alfalfa hay cut at three stages of maturity and in the afternoon and morning and relationship with nutrient availability in ruminants[J].
Journal of the Science of Food and Agriculture, 2013, 93(12): 3072–3080.
( 0) 0)
|
| [34] |
ZHANG X, YU P. Molecular basis of protein structure in combined feeds (hulless barley with bioethanol coproduct of wheat dried distillers grains with solubles) in relation to protein rumen degradation kinetics and intestinal availability in dairy cattle[J].
Journal of Dairy Science, 2012, 95(6): 3363–3379.
( 0) 0)
|
| [35] |
WARD W H, LUNDGREN H P. The formation,composition,and properties of the keratins[J].
Advances in Protein Chemistry, 1954, 9: 243–297.
( 0) 0)
|
| [36] |
LAMMERS K, ARBUCKLE-KEIL G, DIGHTON J. FT-IR study of the changes in carbohydrate chemistry of three New Jersey pine barrens leaf litters during simulated control burning[J].
Soil Biology and Biochemistry, 2009, 41(2): 340–347.
( 0) 0)
|
| [37] |
STEWART D. Fourier transform infrared microspectroscopy of plant tissues[J].
Applied Spectroscopy, 1996, 50(3): 357–365.
( 0) 0)
|
| [38] |
HIMMELSBACH D S, KHALILI S, AKIN D E. FT-IR microspectroscopic imaging of flax (Linum usitatissimum L.) stems[J].
Cellular and Molecular Biology, 1998, 44(1): 99–108.
( 0) 0)
|




