2. 青岛农业大学动物科技学院, 青岛 266109
2. College of Animal Science and Technology, Qingdao Agricultural University, Qingdao 266109, China
脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)是近年来发现的一种新的脂肪酶,它主要参与体内甘油三酯水解第一步的反应[1],参与脂肪动员过程,能防止脂肪在体内的过度积累,调节机体的生长发育[2]。长链脂肪酸是生物体能量的获取和脂肪合成的重要代谢底物。长链脂酰辅酶A合成酶1(acyl-CoA synthetase 1,ACSL1)以长链脂肪酸、ATP和辅酶A(CoA)作为底物,可以合成长链酯酰CoA酯,通过对脂肪酸酯化反应的控制,达到调控整个机体脂肪酸代谢的目的。Zimmermann等[1]研究发现,ATGL基因在小鼠脂肪组织中表达量最高,睾丸、心肌和骨骼肌次之。Dai等[3]发现,在猪的背部脂肪中ATGL基因表达量最高,其次是肌肉、小肠和心脏。ATGL基因在鸡[4]和鸭[5]的脂肪组织中表达量最高。王芳等[6]对朗德鹅的研究显示,ATGL基因在皮下脂肪和大脑中的表达量明显高于其他组织。ACSL1基因在哺乳动物不同的组织的表达量差异较大,Suzuki等[7]在大鼠肝脏中首次克隆发现ACSL1,同时在心脏和脂肪组织中检测到其mRNA的存在。Mashek等[8]研究发现,ACSL1基因除了在棕色脂肪组织、性腺、肝脏和心脏中高表达外,还在骨骼肌和大脑中有少量表达。吕佳[9]对四川白鹅的研究显示,ACSL1基因在腹部脂肪和皮下脂肪中有极高的表达。五龙鹅(又称豁眼鹅)是世界体型最小的鹅种之一,产蛋量高,而腹部脂肪含量较少,脂肪沉积速度要低于大型鹅种。目前,关于ACSL1和ATGL基因在鹅组织器官中的表达、机体脂肪沉积及与血清脂类代谢关系的研究报道较少。为此,本试验以5~16周龄五龙鹅为试验对象,通过荧光定量PCR技术对正常生理条件下ATGL和ACSL1基因在鹅的肝脏、脾脏、腹部脂肪、皮下脂肪等13个组织器官中的表达进行研究,旨在探索ATGL和ACSL1基因在鹅不同组织器官中表达差异;此外,通过分析与脂肪沉积、肌肉生长发育及脂肪代谢的相关性,初步探索功能基因与鹅生长发育和脂肪代谢的调控机理。
1 材料与方法 1.1 试验材料采用相同饲养条件将五龙鹅,从5周龄饲养到16周龄,并于16周龄选择平均体重差异不显著(P>0.05)的试验鹅30只(公母各占1/2)进行屠宰取样测定。
1.2 基础饲粮基础饲粮营养水平参照NRC(1994)家禽营养需要量设计,其组成及营养水平见表 1。采用高效液相色谱法测得基础饲粮中泛酸含量为9.45 mg/kg。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验前对鹅舍进行全面消毒;全期采取舍饲,网上分栏饲养。试验鹅自由饮水和采食,少添喂勤,注意观察鹅群的生长状况。
1.4 测定指标及方法 1.4.1 屠宰指标测定16周龄末,翅静脉采血后对试验鹅进行屠宰,宰前禁食12 h,按照《家禽生产性能名词术语和度量统计方法》(NY/T 823—2004)测定腹部脂肪重、颈部皮下脂肪重、胸肌重、腿肌重和肝脏重,迅速将采集腹部脂肪、皮下脂肪、肾脏、肝脏、心脏、小肠、胸肌、腿肌、胃和肺等组织样品,存放于液氮速冻保存,用于提取总RNA试验。并于相同部位采集肝脏、腿肌、胸肌,保存于-20 ℃冰箱中用于测定肝脏、腿肌、胸肌含脂率[10]。
1.4.2 腿肌、胸肌、肝脏脂肪率测定将样品从-20 ℃冰箱中取出解冻,剪碎称重,置于105 ℃烘箱中烘干,用电子天平称量其绝对干重,将脱脂滤纸在105 ℃烘箱中烘干后称重,然后将样品磨碎后取2 g左右包在滤纸中,再在烘箱中烘至绝干,在电子天平上称出其准确重量,然后,将滤纸包好,放入索式提取器中用乙醚抽提12 h,水浴温度为70~80 ℃,脱脂后的样包烘干后称出其脱脂后重量。
样品(绝干)脂肪率(%)=100×(脱脂前样包重-脱脂后样包重)/(脱脂前样包重-绝干滤纸重)[10]。
1.4.3 血清生化指标16周龄末,翅下静脉采血5 mL,3 000 r/ min离心10 min,取上清液。血清中甘油三酯、总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇含量均用试剂盒测定,所用试剂盒均购自南京建成生物工程研究所。
1.4.4 基因表达定量测定将肝脏样品从液氮中取出,迅速剪取50~100 mg,加入1 mL RNAisoTM Plus试剂,按照说明书方法提取总RNA。用分光光度计(UV-1100)检查总RNA浓度及纯度;用琼脂糖凝胶电泳鉴定总RNA质量,总将RNA溶液稀释为1.0 μg/μL。
按照试剂盒说明书,用PrimeScriptTM RT reagent Kit (Takara,DRR037D)对提取的RNA立即进行反转录试验。反转录反应体系为20 μL:10 μL 2×RT Buffer,1 μL随机引物 (100 pmol/μL),1 μL RT-mix,5 μL模板 (RNA),3 μL焦碳酸二乙酯(DEPC)水。反应条件:轻轻搅拌;25 ℃ 10 min,42 ℃ 60 min,85 ℃ 5 min,反应结束后,将反转产物cDNA置于-20 ℃保存。
根据GenBank发表的鹅的ATGL mRNA序列(GenBank登录号HQ 914789)和ACSL1 mRNA序列(GenBank登录号GQ 891991)与鹅的全部基因组序列相对比,应用Primer5.0软件进行引物设计,ATGL基因上游引物5′-TCGCAACCTCTACCGCCTCT-3′,下游引物5′-TCCGCACAAGCCTCCATAAGA-3′;ACSL1基因上游引物5′-GGAGGAAGAGTAAGGCTGATGGT-3′,下游引物5′-CCAGGAACCGACAGTGAGCAT-3′;β肌动蛋白(β-actin)为内参基因,上游引物5′-GTTCTTGACTCTGGCGATGG-3′,下游引物5′-TAAGGTTTCAGGACAGCGGA-3′。预测扩增长度为130 bp左右,基因设计的引物由上海生工生物公司合成。
用实时定量PCR仪(Bio-Rad CFX)对反转录产物cDNA进行定量PCR,PCR反应体系为50 μL:25 μL 2×PCR Buffer,1.2 μL Primer(25 pmol/μL),0.3 μL SYBR Green Ⅰ,1 μL模板(cDNA),22.5 μL DEPC水,反应条件:94 ℃ 4 min;94 ℃ 20 s;60 ℃ 30 s;72 ℃ 30 s;循环35次,观察扩增曲线。
1.5 数据处理与统计分析采用2-△△Ct法处理试验原始数据,然后再将所得数据采用SPSS 17.0进行单因素方差分析(one-way ANOVA),显著性检验用LSD法,试验数据以“平均值±标准差”表示,同时对基因表达量与其他指标的相关性进行分析。
2 结果与分析 2.1 ATGL、ACSL1基因的RT-PCR扩增以抽提的总RNA为模板,经RT-PCR获得cDNA,对ATGL、ACSL1和β-actin基因进行扩增(图 1)。将提取的总RNA进行1.0%琼脂糖凝胶电泳可见在28S、18S 2条清晰的rRNA条带,且28S条带亮度约为18S亮度的2倍,说明所提取的总RNA完整。
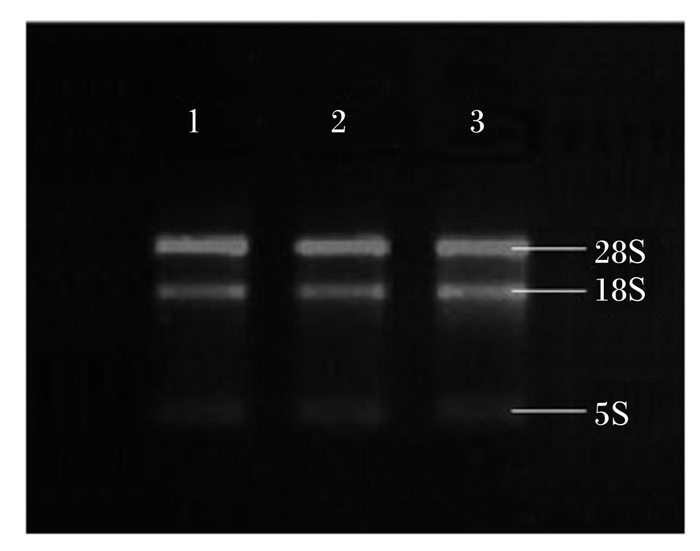
|
1:脂肪甘油三酯脂肪酶 ATGL;2:长链脂酰辅酶A合成酶1 ACSL1;3:β肌动蛋白 β-actin。 图1 总RNA电泳图 Fig. 1 Electrophoretogram of total RNA |
以β-actin为内参基因,运用RT-PCR的方法检测鹅的肝脏、心脏、皮下脂肪、腹部脂肪、胸肌、腿肌、肌胃、腺胃、小肠、肾脏、大脑、肺、脾脏中的ATGL、ACSL1基因表达量。试验结果表明,ATGL基因在皮下脂肪、腹部脂肪、肝脏、脾脏中表达量较高,在肾脏、心脏、胸肌和腿肌中有少量表达,而在肌胃、腺胃和肺中几乎不表达;ACSL1基因在皮下脂肪、腹部脂肪、肝脏、脾脏中表达量较高,在肾脏、心脏、胸肌和腿肌中有少量表达,而在肌胃、腺胃和肺中几乎不表达(图 2)。
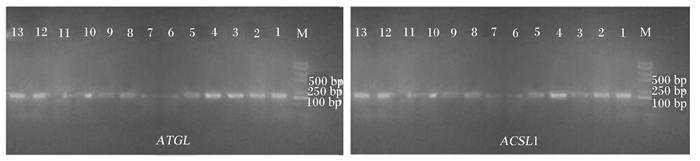
|
M: DL2000 DNA 相对分子质量标准;1:肝脏;2:心脏;3:皮下脂肪;4:腹部脂肪;5:胸肌;6:腿肌;7:肌胃;8:腺胃;9:小肠;10:肾脏;11:大脑;12:肺;13:脾脏。 M: DL2000 DNA maker; 1: liver; 2: heart; 3: subcutaneous fat; 4: abdominal fat; 5: breast muscle; 6: leg muscle; 7: muscular stomach; 8: glandular stomach; 9: small intestine; 10: kidney; 11: brain; 12: lung; 13: spleen 图2 ATGL和ACSL1基因琼脂糖凝胶电泳结果 Fig. 2 Agarose gel electrophoresis results of ATGL and ACSL1 genes |
由图 3所示,ATGL和ACSL1基因扩增曲线走势正常,熔解曲线都只显示单峰且峰值单一,没有其他杂峰,说明引物特异性比较好,没有引物二聚 体等非特异性扩增产物产生,检测体系比较稳定,可靠性高。
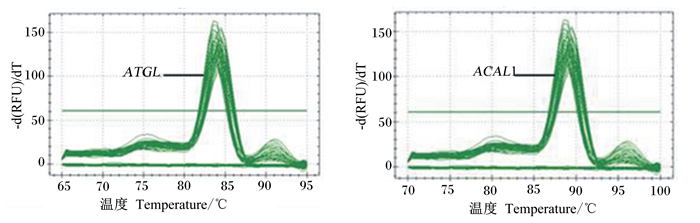
|
图3 ATGL和ACSL1基因的熔解曲线 Fig. 3 Melting curve of ATGL and ACSL1 genes |
由图 4所示,ATGL及ACSL1基因的扩增曲线的拐点均很清楚,基线平直,S型曲线较好。
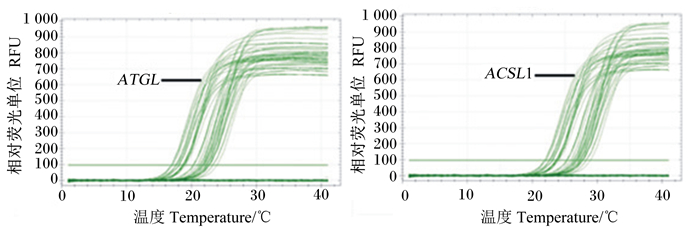
|
图4 ATGL和ACSL1基因的扩增曲线 Fig. 4 Melting curve of ATGL and ACSL1 genes |
由表 2可知,ATGL、ACSL1基因在不同组织器官中几乎都有表达,尤其是在腹部脂肪和皮下脂肪中表达最高,在肾脏、心脏、胸肌和腿肌中有少量表达,而在腺胃、肌胃和肺中几乎不表达。其中,ATGL基因在皮下脂肪的表达量分别是肌胃、腺胃和肺中的24.57、36.86和73.71倍(P < 0.01);在腹部脂肪中的表达量分别是肌胃、腺胃和肺中的17.57、26.36和52.71倍(P < 0.01)。ACSL1基因在皮下脂肪的表达量分别是肌胃、腺胃和肺中的6.65、6.00和11.71倍(P < 0.01);在腹部脂肪中对表达量分别是肌胃、腺胃和肺中的18.16、16.39和32.00倍(P < 0.01)。
|
|
表 2 ATGL、ACSL1基因在不同组织器官中的表达量 Table 2 The ATGL and ACSL1 genes expression in different tissues and organs |
以上结果表明,ATGL和ACSL1基因在上述组织器官中的表达存在差异性,且在腹部脂肪和皮下脂肪中的表达量最高,说明2种基因对脂肪沉积均有调控作用。
2.4 ATGL、ACSL1基因表达量与脂肪沉积和肌肉生长发育的关系由表 3和表 4可知,ATGL基因表达量与腿肌肌内脂肪率和胸肌肌内脂肪率呈极显著负相关(P < 0.01),与腹部脂肪率、胸肌率和腿肌率呈显著负相关(P < 0.05),与皮下脂肪率呈显著正相关(P < 0.05);ACSL1基因表达量与腿肌肌内脂肪率和胸肌肌内脂肪率呈正相关(P>0.05),与腿肌率(P < 0.05)和胸肌率(P>0.05)呈正相关,与皮下脂肪率呈显著负相关(P < 0.05)。腹部脂肪率仅占1.55%,并且与ATGL、ACSL1基因表达均呈负相关(P>0.05),充分表明了五龙鹅低脂的种质特性。
|
|
表 3 五龙鹅脂肪沉积指标 Table 3 Fat deposition indices of Wulong geese |
|
|
表 4 ATGL、ACSL1基因表达量与脂肪沉积指标的相关分析 Table 4 Correlation analysis among ATGL and ACSL1 gene expressions and fat deposition indices |
以上结果表明,ATGL和ACSL1基因对鹅机体脂肪沉积和肌肉生长发育呈反向调控,ATGL基因对组织脂肪沉积作用影响要比ACSL1基因更为显著。
2.5 ATGL、ACSL1基因表达量与血清脂类代谢指标的相关性由表 5和表 6可知,ATGL基因表达量与血清总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和葡萄糖含量呈正相关;其中,ATGL基因表达量与甘油三酯含量呈极显著正相关(P < 0.01)。ACSL1基因表达量与血清总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和葡萄糖含量呈负相关;其中,ACSL1基因表达量与甘油三酯含量呈显著负相关(P < 0.05)。
|
|
表 5 五龙鹅血清脂类代谢指标 Table 5 Serum lipid metabolism indices of Wulong geese |
|
|
表 6 ATGL、ACSL1基因表达量与血清脂类代谢指标的相关分析 Table 6 Correlation analysis among ATGL and ACSL1 gene expressions and serum lipid metabolism indices |
以上结果表明,ATGL、ACSL1基因表达量与脂类代谢密切相关,尤其是与甘油三酯代谢关系更为紧密,并呈反向调控。
3 讨 论 3.1 ATGL和ACSL1基因的组织表达特异性ATGL蛋白质具有脂肪酶活性的GXSXG模序,在该蛋白质的N端含有一个特殊的Patain结构域,且在不同物种间具有高度的保守性,其在小鼠脂肪组织中表达量最高,在睾丸、心肌和骨骼肌中次之,在肝脏、脾脏、肾脏、脑和肺组织中也有低水平的表达[1]。Nie等[11, 12]研究表明,ATGL基因在禽类的脂肪组织中有较高的表达。王芳[6]研究发现,朗德鹅ATGL基因在皮下脂肪的表达量较高,显著高于除脑组织外的其他组织,在胃和肺中的表达量最低。Mashek等[8]研究发现,ACSL1基因除了在棕色脂肪组织、性腺、肝脏和心脏中高表达外,还在骨骼肌和大脑中有少量表达。吕佳[9]研究结果表明,四川白鹅ACSL1基因在腹部脂肪和皮下脂肪中表达量极高,在肝脏、心脏中次之,在大脑中表达量极低。本试验发现,在鹅的皮下脂肪、腹部脂肪、肝脏、脾脏、肾脏、心脏、胸肌和腿肌中均检测出ATGL基因的表达,可看出在正常生理条件下ATGL基因广泛在鹅的各组织器官中表达,在脂肪组织中表达量较高,与Nie等[11]的研究结果一致。ATGL基因在皮下脂肪和腹部脂肪中表达量最高,与哺乳动物和鸡、鸭[12]相似,其次是肝脏和脾脏,在肾脏、心脏、胸肌和腿肌中只有少量表达,在胃、肺和小肠中几乎不表达,表明ATGL基因的表达在鹅的各组织器官中存在差异性,可以进一步推测出ATGL基因在脂肪组织的表达有重要的生物学意义。但在本试验中脾脏中的ATGL基因的表达量处于中间水平,为在腹部脂肪中表达量的1/5,而在王芳[6]的研究中脾脏中的ATGL基因的表达量是腹部脂肪中表达量的2倍,这个结果是因个体差异或是品种差异还有待进一步研究。
本试验结果还表明,在鹅的皮下脂肪、腹部脂肪、肝脏、脾脏、肾脏、心脏、胸肌和腿肌中均检测出ACSL1基因的表达,与Mashek等[8]的研究具有一致性。在皮下脂肪、腹部脂肪、肝脏、脾脏中表达量较高,在肾脏、心脏、胸肌和腿肌中有少量表达,而在肌胃、腺胃和肺中几乎不表达,其组织表达规律与吕佳[9]的研究类似,并且在其功能区域序列变异较小,表明该基因在功能上具有一定的保守性,显示ACSL1基因与脂肪酸的合成代谢有密切的关系。ACSL1基因在人的HepG2细胞[13]及大鼠的肝脏[14]、心脏[15]中发生过表达之后,都会促进脂肪酸向甘油三酯的转化。通过免疫共沉淀的方法发现,脂肪酸转运蛋白1(FATP1)基因与ACSL1基因之间存在相互作用,促进细胞对脂肪酸的摄取[16]。通过本试验中ACSL1基因的表达规律可以看出,ACSL1基因具有促进甘油三酯的沉积与脂肪酸转运的功能。
3.2 ATGL和ACSL1基因表达量与机体脂肪沉积指标的相关性屠宰性能指标能从表观上反映营养物质在不同组织及同一组织的不同部位中沉积量差异。Zimmermann等[1]研究发现,ATGL基因的表达与机体脂肪组织的发育密切相关。Muoio等[17]研究发现,长链脂酰辅酶A是生物体进行脂类和蛋白质合成所必需的底物,当ACSL1被抑制后,会导致小鼠体内甘油三酯等含量出现不同程度的降低。Kim等[4]研究表明,肝脏中的过氧化物酶体增殖物激活受体(PPAR)作为激动剂能诱导ACSL1基因的表达,增加相关酶的活性。本试验研究发现,ATGL和ACSL1基因的表达量与腹部脂肪率均呈负相关,与Zimmermann等[1]的研究基本一致;由此证明了ACSL1与ATGL基因在长链脂肪酸的合成和机体发育过程中发挥积极作用。
Cui等[18]研究发现,肝脏是合成脂肪的重要器官,在生长发育阶段肝脏中脂肪代谢相关酶活性会明显提高。ACSL1基因启动子区域含有PPAR的作用元件[19],介导信号转导途径参与蛋白质的合成调控机体的生长;ATGL基因则可以通过调控脂肪代谢通路中的白细胞介素、转录因子结合蛋白和解偶联蛋白1调节胰岛素的分泌和敏感性,促进脂肪分解[20],减少脂肪细胞的数量,使肌肉中脂肪增加的速度低于肌肉生长的速度。本试验结果表明,ATGL基因的表达量与胸肌肌内脂肪率、腿肌肌内脂肪率呈极显著负相关,ACSL1基因与胸肌肌内脂肪率、腿肌肌内脂肪率呈正相关,表明这2个基因对肌内脂肪率呈反向调控,ATGL基因对胸肌和腿肌的脂肪率调控作用更加显著,肌内脂肪的主要成分为磷脂和甘油三酯,ATGL是甘油三酯水解的限速酶,有助于防止胸肌和腿肌中脂肪的过度沉积,减少肥胖及相关病症的发生。本试验选择的试验动物五龙鹅,腹部脂肪含量较低,脂肪沉积速度较慢,原因可能是由于ATGL、ACSL1基因通过影响肝脏中脂肪代谢相关酶活性调控肌肉中脂肪细胞发育实现的,其调控机理还有待于继续研究。
尹靖东等[21]认为,鹅腿肌中的肌内脂肪含量比胸肌高,其原因与不同的部位脂肪细胞的生长发育、ACSL1的活性及微小血管组织的生长发育有关。本试验发现,五龙鹅腿肌肌内脂肪率同样高于胸肌肌内脂肪率,组织表达中也证实ACSL1基因在2个器官中均有表达,表明ACSL1基因对肌内脂肪代谢起重要调控作用。
3.3 ATGL和ACSL1基因表达量与血清脂类代谢指标的相关性家禽脂肪的发育和沉积主要受血清中甘油三酯的含量影响[22]。闻治国等[23]在对北京鸭的研究中发现,当高密度脂蛋白和极低密度脂蛋白的分泌速度低于甘油三酯的合成速度时,脂肪在肝脏大量沉积,血液中甘油三酯含量显著升高。Zechner等[25]研究证实,ATGL催化机体整个脂解过程中的第一步,也是脂解限速的关键一步。在哺乳动物中ACSL1基因主要表达于脂肪组织和肝脏,定位于细胞内膜,与甘油三酯的合成和脂肪酸的摄取有关[26]。ATGL参与水解甘油三酯的第1步反应,生成甘油二酯和游离脂肪酸[27];ACSL1能够以长链脂肪酸(C12~C22)、ATP和CoA作为底物,生成相应长链脂酰CoA酯[28],脂酰辅酶A酯又是体内合成甘油三酯的重要底物。本试验结果显示,ATGL基因表达量与甘油三酯含量呈极显著正相关,ACSL1基因表达量与甘油三酯含量呈显著负相关;这表明在五龙鹅脂肪代谢过程中,ATGL和ACSL1基因对促进脂质合成和脂肪酸的运转都发挥了积极的作用,并且这2个基因对脂类代谢呈反向调控作用。
葡萄糖是机体积累和转化能量的主要方式,李金锋[24]在肉种鸡后代脂肪代谢研究结果表明,葡萄糖是动物机体的主要功能物质,是机体内脂肪合成的前体,血清葡萄糖含量受到机体脂肪代谢程度的影响。肝脏为调节糖代谢的枢纽[29],ATGL和ACSL1基因参与肝脏内糖和脂肪代谢,调控甘油三酯及相关蛋白质合成与分解[30],释放甘油和游离脂肪酸,参与三羧酸循环过程而影响葡萄糖含量,也可以通过对胰岛素分泌的抑制,有效的减少脂肪的生成和积蓄,促进能量消耗,维护机体的正常生理功能。本试验结果表明,ATGL基因表达量与葡萄糖的含量呈正相关,ACSL1基因与之呈负相关,这表明这2个基因对葡萄糖代谢也呈反向调控。而王海威等[31]在肉鸡上的研究发现,葡萄糖的含量与体内脂类代谢基因无显著相关性,其原因是与物种有关还是由于试验误差造成的还有待于继续研究。
4 结 论① ATGL和ACSL1基因在五龙鹅不同组织器官中表达具有明显差异性,尤其是在腹部脂肪和皮下脂肪中表达最高,表明这2个基因的表达均对脂肪沉积有调控作用。
② ATGL基因表达量与腿肌肌内脂肪率、胸肌肌内脂肪率、胸肌率和腿肌率呈负相关,与皮下脂肪率呈显著正相关;ACSL1基因表达量与腿肌肌内脂肪率、胸肌肌内脂肪率、胸肌率和腿肌率呈正相关,与皮下脂肪率呈显著负相关。
③ ATGL基因表达量与血清总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和葡萄糖含量呈正相关;ACSL1基因表达量与血清总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和葡萄糖含量呈负相关;尤其是与甘油三酯代谢关系更为紧密。
④ ATGL、ACSL1基因表达量对鹅脂肪沉积和血清脂类代谢具有反向调控作用。
| [1] |
ZIMMERMANN R, STRAUSS J G, HAEMMERLE G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase[J].
Science, 2004, 306(5700): 1383–1386.
( 0) 0)
|
| [2] |
HAEMMERLE G, LASS A, ZIMMERMANN R, et al. Defective lipolysis and altered energy metabolism in mice lacking adipose triglyceride lipase[J].
Science, 2006, 312(5774): 734–737.
( 0) 0)
|
| [3] |
DAI L H, XIONG Y Z, JIANG S W, et al. Molecular characterization and association analysis of porcine adipose triglyceride lipase (PNPLA2) gene[J].
Molecular Biology Reports, 2011, 38(2): 921–927.
( 0) 0)
|
| [4] |
史铭欣, 荣恩光, 周纬男, 等. 高、低脂鸡脂肪组织ATGL基因的表达及其激素调控的差异分析[J].
畜牧兽医学报, 2013, 44(12): 1874–1881.
( 0) 0)
|
| [5] |
寇洁.鸭不同部位皮下脂肪组织发育差异研究[D].博士学位论文.雅安:四川农业大学,2013.
( 0) 0)
|
| [6] |
王芳.鹅脂肪性状相关基因的克隆表达及LEPR在脂肪细胞中的功能研究[D].博士学位论文.杭州:浙江大学,2011:76-91.
( 0) 0)
|
| [7] |
SUZUKI H, KAWARABAYASI Y, KONDO J, et al. Structure and regulation of rat long-chain acyl-CoA synthetase[J].
The Journal of Biological Chemistry, 1990, 265(15): 8681–8685.
( 0) 0)
|
| [8] |
MASHEK D G, LI L O, COLEMAN R A. Rat long-chain acyl-CoA synthetase mRNA,protein,and activity vary in tissue distribution and in response to diet[J].
The Journal of Lipid Research, 2006, 47(9): 2004–2010.
( 0) 0)
|
| [9] |
吕佳.鹅ACSL家族CDS区的克隆、组织表达及棕榈酸对其在肝细胞中mRNA表达的影响[D].硕士学位论文.雅安:四川农业大学,2009:30-32.
( 0) 0)
|
| [10] |
顾志良, 赵万里, 周勤宣. 肉鸡腹脂与皮下脂肪、肌脂率、肝脂率的关系[J].
中国家禽, 1994(3): 27–29.
( 0) 0)
|
| [11] |
NIE Q H, FANG M X, XIE L, et al. Associations of ATGL gene polymorphisms with chicken growth and fat traits[J].
Journal of Applied Genetics, 2010, 51(12): 185–196.
( 0) 0)
|
| [12] |
NIE Q H, HU Y S, XIE L, et al. Identification and characterization of adipose triglyceride lipase (ATGL) gene in birds[J].
Molecular Biology Reports, 2010, 37(7): 3487–3493.
( 0) 0)
|
| [13] |
LEE K, SHIN J, LATSHAW J D, et al. Cloning of adipose triglyceride lipase complementary deoxyribonucleic acid in poultry and expression of adipose triglyceride lipase during development of adipose in chickens[J].
Poultry Science, 2009, 88(3): 620–630.
( 0) 0)
|
| [14] |
PARKES H A, PRESTON E, WILKS D, et al. Overexpression of acyl-CoA synthetase-1 increases lipid deposition in hepatic (HepG2) cells and rodent liver in vivo[J].
AJP: Endocrinology and Metabolism, 2006, 291(4): E737–E744.
( 0) 0)
|
| [15] |
CHIU H C, KOVACS A, FORD D A, et al. A novel mouse model of lipotoxic cardiomyopathy[J].
Journal of Clinical Investigation, 2001, 107(7): 813–822.
( 0) 0)
|
| [16] |
RICHARDS M R, HARP J D, ORY D S, et al. Fatty acid transport protein 1 and long-chain acyl coenzyme A synthetase 1 interact in adipocytes[J].
Journal of Lipid Research, 2006, 47(3): 665–672.
( 0) 0)
|
| [17] |
MUOIO D M, LEWIN T M, WIEDMER P, et al. Acyl-CoAs are functionally channeled in liver:potential role of Acyl-CoA synthetase[J].
AJP:Endocrinology and Metabolism, 2000, 279(6): E1366–E1373.
( 0) 0)
|
| [18] |
CUI H X, ZHENG M Q, LIU R R, et al. Liver dominant expression of fatty acid synthase (FAS) gene in two chicken breeds during intramuscular-fat development[J].
Molecular Biology Reporter, 2012, 39(4): 3479–3484.
( 0) 0)
|
| [19] |
SCHOONJANS K, WATANABE M, SUZUKI H, et al. Induction of the acyl-coenzyme A synthetase gene by fibrates and fatty acids is mediated by a peroxisome proliferator response element in the C promoter[J].
The Journal of Biological, 1995, 270(33): 19269–19276.
( 0) 0)
|
| [20] |
RAMSAY T G. Porcine leptin inhibits lipogenesis in porcine adipocytes[J].
Journal of Animal Science, 2003, 81(12): 3008–3017.
( 0) 0)
|
| [21] |
尹靖东, 齐广海, 霍启光. 家禽脂类代谢调控机理的研究进展[J].
动物营养学报, 2000, 12(2): 1–7.
( 0) 0)
|
| [22] |
付睿琦, 赵桂苹, 刘冉冉, 等. 北京油鸡体脂分布及沉积规律研究[J].
动物营养学报, 2013, 25(7): 1465–1472.
( 0) 0)
|
| [23] |
闻治国, 侯水生, 谢明, 等. 不同填饲量对北京鸭生长性能、血清生化指标和肝脏组织学的影响[J].
动物营养学报, 2012, 24(1): 69–77.
( 0) 0)
|
| [24] |
李金锋.饲粮能量水平对肉种鸡产蛋后期子代脂肪代谢的影响[D].硕士学位论文.哈尔滨:东北农业大学,2014:22-23.
( 0) 0)
|
| [25] |
ZECHNER R, KIENESBERGER P C, HAEMMERLE G, et al. Adipose triglyceride lipase and the lipolytic catabolism of cellular fat stores[J].
The Journal of Lipid Research, 2009, 50(1): 3–21.
( 0) 0)
|
| [26] |
LEWIN T M, KIM J H, GRANGER D A, et al. Acyl-CoA synthetase isoforms 1,4,and 5 are present in different subcellular membranes in rat liver and can be inhibited independently[J].
Journal of Biological Chemistry, 2001, 276(27): 24674–24679.
( 0) 0)
|
| [27] |
SCHOENBORN V, HEID I M, VOLLMERT C, et al. The ATGL gene is associated with free fatty acids,triglycerides,and type 2 diabetes[J].
Diabetes, 2006, 55(5): 1270–1275.
( 0) 0)
|
| [28] |
COLEMAN R A, LEWIN T M, MUOIO D M. Physiological and nutritional regulation of enzymes of triacylglycerol synthesis[J].
Annual Review of Nutrition, 2000, 20(1): 77–103.
( 0) 0)
|
| [29] |
秦霞, 杨连玉. 瘦素对脂肪沉积的调控作用[J].
畜牧与饲料科学, 2010, 31(1): 38–41.
( 0) 0)
|
| [30] |
SINGH I, LAZO O, DHAUNSI G S, et al. Transport of fatty acids into human and rat peroxisomes[J].
The Journal of Biological Chemistry, 1992, 267(19): 13306–13313.
( 0) 0)
|
| [31] |
王海威, 王启贵, 王守志, 等. 肉鸡高、低脂系体脂性状和血清生化指标的比较分析[J].
东北农业大学学报, 2009, 40(11): 76–80.
( 0) 0)
|



