仔猪断奶应激(环境应激、饲粮应激、管理应激、离开母体等)会对仔猪生长性能及自身肠道健康产生不良的影响,导致仔猪腹泻、生长缓慢、抵抗力下降等[1, 2]。目前仔猪腹泻仍是养猪生产中的难题。而生产中普遍存在将高剂量氧化锌添加到饲粮中来达到预防仔猪腹泻、促进仔猪生长的目的[3]。研究证明,氧化锌以3 000 mg/kg剂量添加到断奶仔猪饲粮中时,能显著减少断奶仔猪的腹泻,提高仔猪的生长性能[4, 5]。有研究表明,饲粮中添加氧化锌降低仔猪腹泻率与肠道黏膜屏障改变有关[6, 7]。然而,氧化锌来源的高锌虽然具有预防仔猪腹泻、促进生长的作用,但其生物利用率很低。在断奶仔猪中,只有5%~10%被机体利用,大部分都从粪尿中排出,对环境造成严重的污染,不利于养殖业的持续、健康发展[8, 9, 10, 11]。 微生态制剂作为新型、环保的饲料添加剂越来越多地应用于畜禽生产中,对降低仔猪腹泻、提高仔猪生长性能具有良好的效果,不同益生菌因菌株不同而功能各异。酪酸梭菌(Clostridium butyricum,CB)是动物的正常肠道菌,因其产丁酸而又被命名为丁酸梭菌。有研究表明,饲粮中添加500 mg/kg的酪酸梭菌可以显著改善断奶仔猪小肠形态,提高仔猪免疫及抗氧化能力[12]。饲粮中添加酪酸梭菌可以有效地促进肉鸡的生长性能和免疫功能[13]。Ling等[14]研究发现,酪酸梭菌可以减少小鼠腹泻,促进肠道组织修复,降低肠道通透性。目前关于酪酸梭菌在畜禽生产上的应用已有一定的研究,但对缓解断奶仔猪断奶应激,减少仔猪腹泻及肠道通透性方面的研究还相对较少。本试验通过在断奶仔猪饲粮中添加酪酸菌,以高剂量氧化锌作为参比,研究酪酸梭菌对断奶仔猪生长性能、腹泻及紧密连接蛋白表达情况的影响,为氧化锌替代产品的研发以及酪酸梭菌缓解断奶应激、改善仔猪腹泻提供理论依据和数据支持。
1 材料与方法 1.1 试验材料酪酸梭菌购自于青岛某生物技术公司,活度为1×1010 CFU/g,添加量为500 mg/kg;氧化锌购自于某国药集团化学试剂有限公司,含锌量≧79%,添加量为3 000 mg/kg。
1.2 基础饲粮基础饲粮为玉米-豆粕型,参照NRC(2012)营养标准配制,不含抗生素,满足断奶仔猪(5~10 kg)营养需要量。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
选取健康、出生时间及胎次相近的21日龄断奶“杜×长×大”三元杂交仔猪18头,体重(5.35±1.33) kg,随机分为3组,分别饲喂基础饲粮(对照组)、基础饲粮+500 mg/kg酪酸梭菌(酪酸梭菌组,CB组)、基础饲粮+3 000 mg/kg氧化锌(氧化锌组,ZnO组),每组6个重复,每个重复1头仔猪。
1.4 饲养管理与屠宰试验在动物营养学国家重点实验室昌平实验基地进行。试验期间仔猪自由采食、饮水。试验期共14 d,最后1 d所有仔猪屠宰采样,分离回肠末端、结肠中段肠段,采集回肠、结肠组织及黏膜样品。组织样品采用4%多聚甲醛固定;黏膜样品液氮预存,随后转移至-80 ℃保存。
1.5 指标测定 1.5.1 生长性能的测定断奶当天(第1天)、试验第14天分别对所有仔猪(空腹)称重,记录所有仔猪每天采食量,计算平均日增重、平均日采食量及料重比。
1.5.2 腹泻率的测定每天观察和记录仔猪的腹泻与健康情况,计算腹泻率。
腹泻率(%)=[试验期内仔猪腹泻头数/(试验天数×同组猪头数)]×100。
1.5.3 肠道组织绒毛高度和隐窝深度的测定仔猪屠宰后,剪取回肠末端约1 cm的肠环,用预冷的生理盐水将其冲洗干净,用4%多聚甲醛溶液固定过夜后,石蜡包埋,连续切片,苏木精-伊红(HE)染色,封固。光镜(Nikon eclipse ci光学显微镜)观察,拍照(Tucsen图森CCD ICE5.0拍照系统),采用Image pro insight 8.0采集、测量图片,每个切片选择5~10个左右肠绒毛和隐窝测量肠绒毛长度及隐窝深度。
1.5.4 肠道组织杯状细胞数量的测定取回肠末端肠环(1 cm左右),经4%多聚甲醛固定,石蜡包埋,切片,阿利新兰-高碘酸雪夫氏(AB-PAS)染色,光学显微镜下对杯状细胞进行计数(每个组织切片上选取5~10个完整肠绒毛)。判定标准:染成红色的杯状细胞为分泌中性黏蛋白的中性杯状细胞;染成蓝色的为分泌酸性黏蛋白的酸性杯状细胞;染成蓝紫色的为可分泌中性黏蛋白又可分泌酸性黏蛋白的杯状细胞,即中性酸性杯状细胞。
1.5.5 肠道通透性指标的测定采集试验第3天、第7天及第14天仔猪(空腹)前腔静脉血液,4 ℃静置过夜,4 000 r/min(4 ℃)离心20 min,分离血清,分装于0.5 mL离心管中,-80 ℃保存。采用D-乳酸试剂盒(D-lactate colorimetric assay,Sigma)和显色基质鲎试剂盒(含偶氮化试剂终点显色法,厦门市鲎试剂实验厂有限公司)分别测定血清中D-乳酸和内毒素的浓度。
1.5.6 肠道黏膜紧密连接蛋白mRNA表达量的测定回肠及结肠黏膜总RNA的提取采用Trizol试剂(Invitrogen)提取法进行,按试剂盒(PrimeScriptTM RT reagent kit with gDNA Eraser,TaKaRa)操作步骤进行反转录,合成cDNA。实时荧光定量PCR以3-磷酸甘油醛脱氢酶(GAPDH)为内参基因,反应条件为95 ℃预变性2 min;95 ℃变性10 s;60 ℃退火并延伸40 s,循环40次;荧光的采集与熔解曲线的制作按照荧光定量PCR仪(美国ABI的PRISM7500型荧光定量PCR仪)操作说明进行,咬合蛋白(Occludin)和闭合小环蛋白-1(ZO-1)mRNA表达量用2-△△Ct法计算。引物信息见表 2,由英潍捷基(上海)贸易有限公司合成。
|
|
表 2 引物序列信息 Table 2 Primer sequences information |
根据单因素完全随机设计,以SAS 9.2的MEANS模块对基本统计量进行分析,采用GLM模块对数据进行方差分析,采用Tukey法进行多重比较,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结 果 2.1 酪酸梭菌对断奶仔猪生长性能和腹泻率的影响由表 3可知,试验期内各组断奶仔猪平均日增重与料重比均没有显著差异(P>0.05)。与对照 组相比,酪酸梭菌组和氧化锌组断奶仔猪1~7 d腹泻率分别降低了44.45%、66.67%(P < 0.05),1~14 d腹泻率分别降低了46.88%、62.49%(P < 0.05)。酪酸梭菌组与氧化锌组断奶仔猪腹泻率在试验期内差异不显著(P>0.05)。
|
|
表 3 断奶仔猪生长性能和腹泻率 Table 3 Growth performance and diarrhea rate of weaning piglets |
由表 4可知,与对照组相比,酪酸梭菌组和氧化锌组断奶仔猪回肠隐窝深度显著降低(P < 0.05),回肠绒毛高度增加(P>0.05),绒腺比极显著增加(P < 0.01);酪酸梭菌组和氧化锌组断奶仔猪回肠总杯状细胞数量无显著差异(P>0.05),但氧化锌组断奶仔猪中性酸性杯状细胞数量显著增多(P < 0.05)。氧化锌组与酪酸梭菌组断奶仔猪的总杯状细胞数量与对照组相比有增多的趋势(P>0.05)。由图 1可知,酪酸梭菌组和氧化锌组断奶仔猪在回肠组织形态结构上无明显差异。
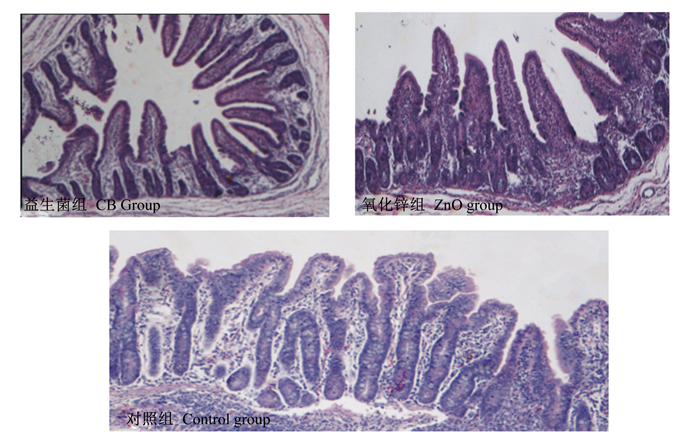
|
图1 断奶仔猪回肠组织形态结构图 Fig. 1 Ileum morphological structure graphs of weaning piglets |
|
|
表 4 断奶仔猪回肠组织形态和杯状细胞数量 Table 4 Ileum morphology and goblet cell number of weaning piglets |
由表 5可知,各组断奶仔猪血清内毒素与D-乳酸浓度从试验第7天开始出现差异,与对照组相比,氧化锌组断奶仔猪第7天血清内毒素浓度显著降低(P < 0.05),氧化锌组和酪酸梭菌组断奶仔猪第14天血清内毒素和D-乳酸浓度显著降低(P < 0.05)。酪酸梭菌组与氧化锌组之间断奶仔猪血清内毒素和D-乳酸浓度无显著差异(P>0.05)。
|
|
表 5 断奶仔猪血清内毒素和D-乳酸浓度 Table 5 Serum endotoxin and D-lactate concentration of weaning piglets |
由表 6可知,与对照组相比,氧化锌组和酪酸梭菌组断奶仔猪回肠和结肠Occludin mRNA表达量显著升高(P < 0.05),酪酸梭菌组回肠和结肠ZO-1 mRNA表达量无显著差异(P>0.05),氧化锌组回肠ZO-1 mRNA表达量显著升高(P < 0.05)。与氧化锌组相比,酪酸梭菌组断奶仔猪回肠和结肠ZO-1与Occludin mRNA表达量均无显著差异(P>0.05)。
|
|
表 6 断奶仔猪肠道ZO-1及Occludin mRNA表达量 Table 6 The mRNA expression of ZO-1 and Occludin in intestine of weaning piglets |
仔猪断奶是养猪生产中的重要环节,断奶应激会导致仔猪腹泻、生长缓慢等问题,生产中常以高剂量氧化锌来解决此问题。在本试验中,氧化锌组断奶仔猪在试验前7 d及试验全期腹泻率均显著降低,这与Zhang等[6]及Hu等[15, 16]研究结果一致。同时酪酸梭菌组仔猪腹泻情况与氧化锌组之间无显著差异,说明酪酸梭菌在对抗仔猪腹泻方面表现出了与氧化锌同样的效果。但在本研究中,试验期内各组断奶仔猪之间生长性能没有显著差异。这与部分研究结果氧化锌可以促进仔猪生长性能的结果[6, 16, 17]不一致,但也有报道发现断奶仔猪饲粮中添加1 000、2 000和3 000 mg/kg氧化锌时,2周内无显著促生长作用[18]。刘婷婷等[12]研究发现,饲粮中单独添加酪酸梭菌时对断奶仔猪的生长性能有增加的趋势,但与对照组相比无显著差异。本试验期内各组之间生长性能无显著差异可能与试验期较短,仔猪组内个体之间存在一定的差异有关。
仔猪腹泻往往与肠道的健康密切相关,仔猪断奶后,肠道组织形态会因断奶应激发生改变,表现在绒毛高度降低,隐窝深度加深,肠黏膜细胞增殖能力下降,并且会随着断奶时间的提前而加重[19]。Carlson等[20]报道,补饲高剂量氧化锌能改善肠道形态,使肠道隐窝变深,绒毛变长。同时研究发现,3 000 mg/kg氧化锌能显著增加小肠黏膜的绒毛高度及相关基因在mRNA和蛋白质水平的表达量[4, 21]。锌作为肠道上皮细胞发育成熟的必需微量元素,有利于改善肠道形态,增加蛋白质合成和肠道细胞的增殖[11, 17]。在本试验中,氧化锌组和酪酸梭菌组断奶仔猪隐窝深度显著降低,绒腺比显著提高,说明酪酸梭菌与氧化锌一样抵御了肠道组织形态受损。这可能与酪酸梭菌在体内可代谢产生丁酸有关,丁酸是肠道上皮组织细胞再生和修复的主要营养物质,对肠道组织形态的修复和改善同样具有重要作用[12]。
杯状细胞是特化的肠上皮细胞,能够分泌黏蛋白,附着在肠黏膜表面,与肠道健康有着密切联系[22]。新形成的杯状细胞分泌中性黏液,而成熟度较高的杯状细胞则以分泌酸性黏液为主,酸性黏液对有害微生物具有更强的抵御作用[5, 23]。本试验中,饲喂氧化锌仔猪回肠中性酸性杯状细胞数量显著增多,总杯状细胞数量有增多的趋势,这与Liu等[24]研究结果相一致。而饲喂酪酸梭菌断奶仔猪在总杯状细胞数量上与饲喂氧化锌一样均有增多的趋势。从各种杯状细胞数量来看,仔猪肠道细胞的增殖处于发育初期,进一步说明锌具有促进细胞生长和增殖的作用,而酪酸梭菌的作用要弱于氧化锌,这可能与益生菌间接作用于肠道黏膜细胞有关。
肠道屏障的完整是肠道正常行使功能的基础,而肠道屏障受损会使其通透性增大[16]。大量研究发现断奶应激会损伤肠道黏膜屏障,增大肠道通透性[15, 25-27]。血清D-乳酸和内毒素浓度可以作为肠道通透性的指标,反映肠道通透性的大小[7, 16, 28]。正常情况下,血清中D-乳酸和内毒素的浓度很少,当肠道通透性加大时,其血清浓度会上升。在本试验中,仔猪断奶前期血清内毒素和D-乳酸浓度显著升高,说明断奶应激对肠道通透性具有极大的影响,损伤了肠道黏膜结构,破坏了肠道菌群,使得菌群分泌的内毒素和D-乳酸渗透入血。从试验第7天开始饲喂酪酸梭菌与氧化锌仔猪血清内毒素和D-乳酸浓度显著下降,缓解了由断奶应激引起的肠道通透性加大,腹泻率上升。这表明饲粮中添加氧化锌或酪酸梭菌协助了仔猪自身肠道的修复,进一步说明高锌和酪酸梭菌减少腹泻与肠道通透性的改变有关。
肠道通透的结构基础是紧密连接蛋白,其中ZO-1和Occludin常被用来作为观察紧密连接屏障功能和通透性功能的指标[7, 29]。Zhang等[6]研究发现,饲粮中添加2 000 mg/kg氧化锌可以显著增加回肠ZO-1及Occludin mRNA及蛋白质表达量。本试验中,饲喂酪酸梭菌或氧化锌断奶仔猪回肠和结肠Occludin mRNA表达量显著升高,氧化锌组回肠ZO-1 mRNA表达量显著升高,饲喂酪酸梭菌仔猪回肠ZO-1 mRNA表达量有升高的趋势。可见二者对肠道黏膜完整性具有相同的作用。在应激情况下,细菌和内毒素可以通过调节或影响一些细胞因子及蛋白激酶C等来调控ZO-1和跨膜蛋白Occludin的表达,从而降低肠上皮细胞的屏障功能[30]。有研究表明,上皮细胞紧密连接蛋白的基因表达与肠道细菌的代谢产物(如丁酸、磷壁酸)有关[31]。因此,酪酸梭菌可能通过在体内代谢产生丁酸或改变肠道微生态,改善肠道组织形态,上调肠上皮紧密连接蛋白基因表达,进而达到降低肠道通透性,减少腹泻的目的。
4 结 论在本试验中,断奶仔猪饲粮中添加500 mg/kg酪酸梭菌或3 000 mg/kg氧化锌能够显著降低腹泻率,改善肠黏膜形态,降低肠道通透性,上调紧密连接蛋白基因的表达,从而保护肠道黏膜屏障功能,减弱早期断奶应激引起的不利影响。
| [1] |
HEO J M, OPAPEJU F O, PLUSKE J R, et al. Gastrointestinal health and function in weaned pigs:a review of feeding strategies to control post-weaning diarrhoea without using in-feed antimicrobial compounds[J].
Journal of Animal Physiology and Animal Nutrition, 2013, 97(2): 207–237.
( 0) 0)
|
| [2] |
LALL?S J P, BOSI P, SMIDT H, et al. Weaning-a challenge to gut physiologists[J].
Livestock Science, 2007, 108(1/2/3): 82–93.
( 0) 0)
|
| [3] |
杨怀兵, 李辉, 黄建国, 等. 高锌在断奶仔猪日粮中的应用效果研究概述[J].
中国畜牧兽医, 2013, 40(12): 220–223.
( 0) 0)
|
| [4] |
LI X L, YIN J D, LI D F, et al. Dietary supplementation with zinc oxide increases IGF-Ⅰ and IGF-Ⅰ receptor gene expression in the small intestine of weanling piglets[J].
The Journal of Nutrition, 2006, 136(7): 1786–1791.
( 0) 0)
|
| [5] |
OU D Y, LI D F, CAO Y H, et al. Dietary supplementation with zinc oxide decreases expression of the stem cell factor in the small intestine of weanling pigs[J].
The Journal of Nutritional Biochemistry, 2007, 18(12): 820–826.
( 0) 0)
|
| [6] |
ZHANG B K, GUO Y M. Supplemental zinc reduced intestinal permeability by enhancing occludin and zonula occludens protein-1 (ZO-1) expression in weaning piglets[J].
British Journal of Nutrition, 2009, 102(5): 687–693.
( 0) 0)
|
| [7] |
胡彩虹, 钱仲仓, 刘海萍, 等. 高锌对早期断奶仔猪肠黏膜屏障和肠上皮细胞紧密连接蛋白表达的影响[J].
畜牧兽医学报, 2009, 40(11): 1638–1644.
( 0) 0)
|
| [8] |
HU C H, XIAO K, SONG J, et al. Effects of zinc oxide supported on zeolite on growth performance,intestinal microflora and permeability,and cytokines expression of weaned pigs[J].
Animal Feed Science and Technology, 2013, 181(1/2/3/4): 65–71.
( 0) 0)
|
| [9] |
VERSTEGEN M W A, WILLIAMS B A. Alternatives to the use of antibiotics as growth promoters for monogastric animals[J].
Animal Biotechnology, 2002, 13(1): 113–127.
( 0) 0)
|
| [10] |
王超.包膜氧化锌促仔猪生长效果及机理研究[D].博士学位论文.杭州:浙江大学,2013:13-16.
( 0) 0)
|
| [11] |
CARLSON M S, HILL G M, LINK J E. Early- and traditionally weaned nursery pigs benefit from phase-feeding pharmacological concentrations of zinc oxide:effect on metallothionein and mineral concentrations[J].
Journal of Animal Science, 1999, 77(5): 1199–1207.
( 0) 0)
|
| [12] |
刘婷婷, 张帅, 邓斐月, 等. 谷氨酰胺与丁酸梭菌对断奶仔猪生长性能、免疫功能、小肠形态和肠道菌群的影响[J].
动物营养学报, 2011, 23(6): 998–1005.
( 0) 0)
|
| [13] |
YANG C M, CAO G T, FERKET P R, et al. Effects of probiotic,Clostridium butyricum,on growth performance,immune function,and cecal microflora in broiler chickens[J].
Poultry Science, 2012, 91(9): 2121–2129.
( 0) 0)
|
| [14] |
LING Z X, LIU X, CHENG Y W, et al. Clostridium butyricum combined with Bifidobacterium infantis probiotic mixture restores fecal microbiota and attenuates systemic Inflammation in mice with antibiotic-associated diarrhea[J].
BioMed Research International, 2015, 2015: 582048.
( 0) 0)
|
| [15] |
HU C H, XIAO K, LUAN Z S, et al. Early weaning increases intestinal permeability,alters expression of cytokine and tight junction proteins,and activates mitogen-activated protein kinases in pigs[J].
Journal of Animal Science, 2013, 91(3): 1094–1101.
( 0) 0)
|
| [16] |
HU C H, GU L Y, LUAN Z S, et al. Effects of montmorillonite-zinc oxide hybrid on performance,diarrhea,intestinal permeability and morphology of weanling pigs[J].
Animal Feed Science and Technology, 2012, 177(1/2): 108–115.
( 0) 0)
|
| [17] |
胡彩虹, 游兆彤, 朱康, 等. 纳米氧化锌对断奶仔猪生长性能和肠黏膜屏障的影响[J].
动物营养学报, 2012, 24(2): 285–290.
( 0) 0)
|
| [18] |
计峰, 罗绪刚, 李素芬, 等. 高锌对断乳仔猪促生长作用及其机理的研究进展[J].
动物营养学报, 2003, 15(3): 1–5.
( 0) 0)
|
| [19] |
顾宪红, 张宏福, 佘锐萍, 等. 断奶日龄对消化器官形态及小肠组织化学的影响[J].
家畜生态, 2003, 24(1): 24–30.
( 0) 0)
|
| [20] |
CARLSON M S, HOOVER S L, HILL G M, et al. Effect of pharmacological zinc on intestinal metallothionein concentration and morphology in the nursery pig[J].
Journal of Animal Science, 1998, 76(Suppl.1): 57.
( 0) 0)
|
| [21] |
申俊华, 周安国, 王之盛, 等. 包被氧化锌对断奶仔猪腹泻指数及肠道发育的影响[J].
畜牧兽医学报, 2013, 44(6): 894–900.
( 0) 0)
|
| [22] |
DEPLANCKE B, GASKINS H R. Microbial modulation of innate defense:goblet cells and the intestinal mucus layer[J].
The American Journal of Clinical Nutrition, 2001, 73(6): 1131S–1141S.
( 0) 0)
|
| [23] |
隋欣.益生菌对雏鸡肠道杯状细胞数量及黏蛋白2含量的影响[D].硕士学位论文.哈尔滨:东北农业大学,2014:45-46
( 0) 0)
|
| [24] |
LIU P, PIEPER R, RIEGER J, et al. Effect of dietary zinc oxide on morphological characteristics,mucin composition and gene expression in the colon of weaned piglets[J].
PLoS One, 2014, 9(3): e91091.
( 0) 0)
|
| [25] |
PEACE R M, CAMPBELL J, POLO J, et al. Spray-dried porcine plasma influences intestinal barrier function,inflammation,and diarrhea in weaned pigs[J].
The Journal of Nutrition, 2011, 141(7): 1312–1317.
( 0) 0)
|
| [26] |
KIM J C, HANSEN C F, MULLAN B P, et al. Nutrition and pathology of weaner pigs:nutritional strategies to support barrier function in the gastrointestinal tract[J].
Animal Feed Science and Technology, 2012, 173(1/2): 3–16.
( 0) 0)
|
| [27] |
SMITH F, CLARK J E, OVERMAN B L, et al. Early weaning stress impairs development of mucosal barrier function in the porcine intestine[J].
American Journal of Physiology-Gastrointestinal and Liver Physiology, 2010, 298(3): G352–G363.
( 0) 0)
|
| [28] |
ZHAO Y, QIN G X, SUN Z W, et al. Effects of soybean agglutinin on intestinal barrier permeability and tight junction protein expression in weaned piglets[J].
International Journal of Molecular Sciences, 2011, 12(12): 8502–8512.
( 0) 0)
|
| [29] |
BERKES J, VISWANATHAN V K, SAVKOVIC S D, et al. Intestinal epithelial responses to enteric pathogens:effects on the tight junction barrier,ion transport,and inflammation[J].
Gut, 2003, 52(3): 439–451.
( 0) 0)
|
| [30] |
WEILER F, MARBE T, SCHEPPACH W, et al. Influence of protein kinase C on transcription of the tight junction elements ZO-1 and occludin[J].
Journal of Cellular Physiology, 2005, 204(1): 83–86.
( 0) 0)
|
| [31] |
宦海琳, 白建勇, 周维仁, 等. 抗菌肽对仔猪血清生化指标、肠黏膜形态结构及空肠上皮紧密连接蛋白基因相对表达量的影响[J].
动物营养学报, 2015, 27(12): 3797–3804.
( 0) 0)
|




