在现代畜牧业发展的过程中,抗生素作为治疗、预防动物疾病以及促进动物生长的饲料添加剂,已经给生产及人类的健康带了巨大的挑战[1]。寻找抗生素有效的替代品已经成为满足畜牧业健康、绿色、高效和环保发展要求的研究热点。卵黄抗体(immunoglobulin of yolk,IgY)是家禽经过特定抗原免疫后,机体发生免疫反应通过血液循环在卵细胞蓄积并储存在卵黄中形成的相应特异性抗体[2]。IgY具有较强的耐酸、耐热、耐高渗、抗离子强度和抗特定酶解的能力[3],能有效地通过反刍动物前胃与真胃,在肠道发挥免疫抗体作用;同时还可以经肠道吸收转运进入循环系统在非肠道部分发挥作用[2]。随着IgY研究的不断深入,其作为免疫强化剂正在逐渐被广泛应用于动物生产中。Rahimi等[4]与Mahdavi等[5]分别使用含有抗沙门氏菌与抗大肠杆菌的IgY饲喂雏鸡研究发现,IgY不仅可以抑制病原菌在肠黏膜的黏附作用,还可以改善雏鸡肠道健康指数以及提高机体免疫应答。在仔猪上,罗淡彬[6]与程学慧等[7]分别在饲粮中添加IgY,能够有效抑制病原菌对仔猪空肠上皮细胞的黏附,显著提高早期断奶仔猪的生长性能和免疫力,降低仔猪的腹泻率。Vega等[8]与Dhama等[9]利用含有单一抗轮状病毒的特异性IgY饲喂犊牛,发现IgY通过激活肠黏膜抗体分泌细胞免疫反应,增强机体免疫力,降低了犊牛腹泻率与死亡率。目前的研究主要集中在单一特异性IgY对幼龄家畜免疫力的调节作用上,然而关于抵抗多种致病菌与病毒引起的复合性疾病的复合特异性IgY,对幼龄反刍动物尤其在犊牛上的应用研究很少。复合特异性IgY作为抗生素的替代品,对于提高免疫系统未发育完善的犊牛机体免疫力以及更好地适应外界环境具有重要的意义。因此,本试验旨在饲粮中添加复合特异性IgY探究其对犊牛腹泻和免疫力的影响,为复合特异性IgY在幼龄反刍动物培育中的应用提供理论依据。
1 材料与方法 1.1 试验设计与饲粮本试验采用单因素随机设计,分为2组。对照(CON)组饲喂基础饲粮;试验(IGY)组在基础饲粮中添加复合特异性IgY(由大连赛姆生物工程技术有限公司提供)。复合特异性IgY由2种复合抗原(细菌性抗原:F4、F5、F6、F18、F41+SLT-IIv+STa-LTb+SEM-AJ01;病毒性抗原:TGEV+PEDV+RV+SEM-AJ01;SEM-AJ01为高效佐剂)免疫母鸡后,通过机体免疫应答将产生的特定抗体转移到卵黄中制得。复合特异性IgY日添加量为45 mg/kg BW。基础饲粮为不含抗生素和微生物制剂的代乳品和开食料,其中代乳品是依照国家发明专利CN 02128844.5由北京精准动物营养研究中心生产提供。基础饲粮营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验选用自然分娩、初生重为40 kg左右的中国荷斯坦公犊牛20头。随机分为2组,每组10头。犊牛出生后1 h内保证采食足够初乳,随后饲喂鲜奶至10日龄,11~17日龄为试验预试期,期间进行代乳品过渡,18日龄全部换成代乳品,18~28日龄为正试期。代乳品用煮沸后冷却到50~60 ℃热水按干物质占12.5%比例冲泡成乳液,待温度降至40 ℃左右饲喂犊牛,每天分2次饲喂(08:00和15:00),每头犊牛每天饲喂量为体重的12%。试验过程中根据犊牛体重将复合特异性IgY添加到代乳品乳液中,搅拌均匀后饲喂犊牛。试验期开食料自由采食,并保证干净、充足水源。犊牛采用犊牛岛单独培养,每个犊牛岛占地为1.6 m×3.6 m。
1.3 测定指标与方法 1.3.1 生长性能和粪便评分分别于犊牛18和28日龄晨饲前称重,计算犊牛平均日增重(average daily gain,ADG)。试验期间每天记录犊牛饲粮采食量,计算料重比。试验过程中采集有代表性的代乳品、开食料样品,依照AOAC(2000)[10]的方法测定其营养成分含量,其中,总能(GE)以PARR-6400全自动氧弹量热仪测定;粗蛋白质(CP)含量以KDY-9830全自动凯氏定氮仪测定;粗脂肪(EE)含量采用ANKOM-XT15i全自动脂肪分析仪测定;同时采用常规方法测定干物质(DM)、有机物(OM)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、钙(Ca)和磷(P)含量。
每天观察犊牛健康状况并根据表 2[11]进行粪便评分。当粪便评分≥2时记为1个腹泻日;当粪便评分>3时,对犊牛灌服电解液,有必要时进行抗生素治疗。计算腹泻率和粪便指数:

|
|
|
表 2 犊牛粪便评分标准 Table 2 The evaluation rules of fecal of bull calves[11] |
于试验结束当天(28日龄)晨饲前每头犊牛颈静脉采血5 mL,3 000 r/min离心20 min,收集血清分装于1.5 mL离心管中,-20 ℃下保存。样品分别采用免疫比浊法(松上A8全自动生化分析仪)测定免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)浓度;采用生化法(日立7600生化仪)测定总抗氧化能力(total antioxidant capacity,T-AOC)、一氧化氮(nitric oxide,NO)和溶菌酶(lysozyme,LZM)浓度及碱性磷酸酶(alkaline phosphatase,AKP)活性,测定所需试剂盒均购自南京建成生物工程研究所。
1.4 统计分析试验数据利用SAS 9.2统计软件进行非配对t检验分析,以P<0.05与P<0.01分别作为判断差异显著与极显著的标准。
2 结果 2.1 复合特异性IgY对犊牛生长的影响由表 3可知,试验期间2组犊牛初始重和末重均无显著的差异(P>0.05),然而饲粮添加复合特异性IgY有提高犊牛ADG的趋势(P=0.082)。复合特异性IgY对犊牛平均日采食量和料重比无显著影响(P>0.05)。
|
|
表 3 复合特异性IgY对犊牛生长的影响 Table 3 Effects of compound specific IgY on growth of calves |
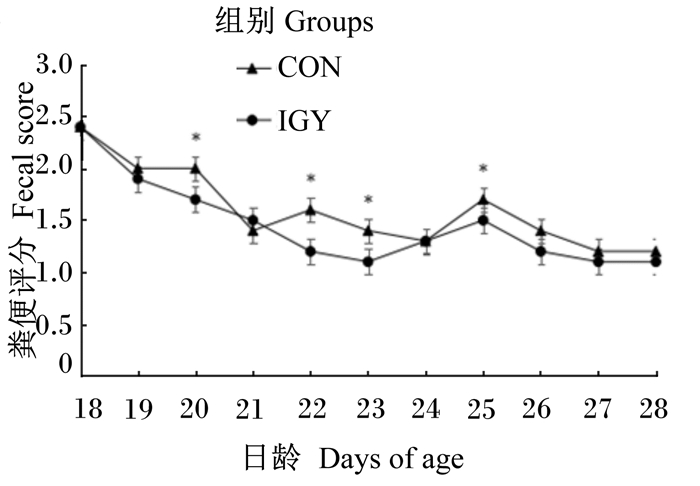
由图 1可知,饲粮添加复合特异性IgY有助于降低犊牛的粪便评分,其中在犊牛20、22、23和25日龄时,IGY组粪便评分显著低于CON组(P<0.05)。
|
折线节点标注*表示组间差异显著(P<0.05)。 Nodes of line with * mean significant difference between groups (P<0.05). 图1 复合特异性IgY对犊牛粪便评分的影响 Fig. 1 Effects of compound specific IgY on fecal score of calves |
由表 4可知,虽然复合特异性IgY对犊牛粪便指数未造成显著影响(P>0.05),但IGY组腹泻率显著低于CON组(P<0.05)。
|
|
表 4 复合特异性IgY对犊牛腹泻率和粪便指数的影响 Table 4 Effects of compound specific IgY on diarrhea incidence and fecal index of calves |
由表 5可知,饲粮添加复合特异性IgY较CON组极显著提高了犊牛血清中IgG、IgM和IgA的浓度(P<0.01),分别提高了7.19%、5.71%和8.50%。
|
|
表 5 复合特异性IgY对犊牛血清免疫球蛋白浓度的影响 Table 5 Effects of compound specific IgY on serum immunoglobulin concentrations of calves |
由表 6可知,复合特异性IgY对犊牛抗氧化能力造成了显著或极显著影响(P<0.05或P<0.01),其中IGY组血清T-AOC极显著高于CON组(P<0.01),而NO浓度却显著低于CON组(P=0.043)。
|
|
表 6 复合特异性IgY对犊牛血清抗氧化能力的影响 Table 6 Effects of compound specific IgY on serum antioxidant capacity of calves |
由表 7可知,IGY组血清LZM浓度极显著低于CON组(P<0.01),然而复合特异性IgY对血清AKP活性无显著影响(P>0.05)。
|
|
表 7 复合特异性IgY对犊牛血清免疫相关酶的影响 Table 7 Effects of compound specific IgY on enzyme activity of immunity of calves |
朱锦兰等[12]对肉鸭的研究表明,饲粮添加IgY通过提高血清中三碘甲腺原氨酸和胰岛素样生长因子-1浓度显著提高了ADG。而本试验添加复合特异性IgY仅对犊牛ADG有提高的趋势,对体重没有显著影响,这可能是由于试验周期短,IgY通过调节激素水平而产生促生长作用的累积效应还没有到达显著水平造成;也可能与试验动物品种不同有关。
腹泻是影响犊牛生长发育的重要原因之一。目前,研究人员采用包括粪便评分在内的粪便形态特点作为腹泻严重程度的预示指标去评价犊牛的健康状况[13]。本试验通过对犊牛粪便连续评分,发现饲粮添加复合特异性IgY后粪便评分和腹泻率较对照组显著降低,这与Vega等[14]利用特异性IgY对犊牛腹泻的研究结果一致。研究认为,IgY可通过直接黏附于大肠杆菌或沙门氏菌等病原菌的菌毛或鞭毛上,使其不能黏附于肠道黏膜上皮细胞而被排除体外,导致肠道致病菌增殖减弱甚至减少,从而降低了犊牛腹泻发生[2]。同时研究还发现,犊牛通过口服特异性IgY还可以调节黏膜和系统免疫反应,提高肠道尤其是十二指肠黏膜对特异型病毒的免疫防御,降低犊牛病毒性腹泻发病率[14]。另外,观察全期粪便评分与临床症状还可以发现,犊牛在遭受外界应激时,饲粮添加复合特异性IgY有助于推迟犊牛腹泻发生峰的出现,并且缩短腹泻发生的时间,这与Parreño等[15]利用添加特异性IgY的初乳对犊牛的腹泻研究结果一致。
3.2 复合特异性IgY对犊牛血清免疫球蛋白浓度的影响腹泻率与粪便指数可以直接观察到犊牛健康状况,而血清免疫球蛋白作为一种隐性指标可以从机体内部评价动物免疫能力,两者合理结合有助于全面分析试验结果[16]。刚出生犊牛体内的免疫球蛋白主要是在肠道细胞“闭合”之前通过初乳获得,血清中足量的免疫球蛋白对于提高犊牛机体的免疫力至关重要。其中IgM是免疫反应起始阶段主要的抗体;作为血清中主要的抗体,IgG在体液免疫应答中发挥着重要的角色;IgA则介导黏膜免疫反应,主要功能是通过与非特异性免疫系统协同与感染病原菌发生免疫排斥作用[17]。研究表明,腹泻犊牛血清中免疫球蛋白含量明显低于健康犊牛[18]。从本试验可以看出,饲粮添加复合特异性IgY极显著提高了犊牛血清IgG、IgA和IgM浓度。免疫球蛋白抗体分泌细胞(antibody secreting cells,ASC)主要分布在肠道(十二指肠、空肠和回肠)黏膜固有层,空肠、回肠淋巴集结以及肠系淋巴结。Parreño等[15]通过对轮状病毒攻毒后的犊牛口服特异性IgY,发现较对照组在肠道黏膜检测到IgM与IgA的ASC显著减少,甚至没有发现IgG的ASC,同时对于IgA的ASC应答也明显受到抑制。这就说明饲粮添加特异性IgY可以直接在肠道与病原菌抗原发生免疫中和反应,提高机体的被动免疫能力[8],而使血清中免疫球蛋白保持在一个较高的水平。然而,被动性免疫抗体通过剂量依赖性方式对抗体介导的黏膜与机体免疫应答系统的发育抑制作用,也有必要引起重视以及进一步研究。
3.3 复合特异性IgY对犊牛血清抗氧化能力的影响氧化应激是机体在遭受有害刺激时,体内高活性分子如活性氧自由基或活性氮自由基产生过多,机体氧化程度超出了对氧化物的清除能力,氧化系统和抗氧化系统失衡,从而引起的细胞或组织损伤[19]。其中T-AOC是机体拮抗氧化自由基的主要体系,制约和清除机体过多的自由基,保护细胞正常功能,维持机体的正常代谢[20]。从本试验结果可以看出,复合特异性IgY显著提高了犊牛血清中T-AOC浓度,较高水平的T-AOC有助于及时清除体内氧化过程中产生的自由基,从而使机体处于氧化与抗氧化动态平衡,保证动物健康。然而未添加复合特异性IgY组犊牛的血清中NO浓度显著高于添加组,这可能是由于代乳品中植物性蛋白质对犊牛引起的应激反应产生了代偿作用,造成了血清中高浓度的NO。同时研究还发现,代乳品中植物性蛋白质含量越高,这种代偿作用越明显[20]。这就说明饲粮添加复合特异性IgY有效地降低了外源应激对犊牛产生的代偿作用,从而提高犊牛对植物性蛋白质的适应能力。这一结果与犊牛粪便评分和腹泻结果相一致。
3.4 复合特异性IgY对犊牛血清免疫相关酶的影响LZM作为机体非特异性免疫因子,参与机体多种免疫反应,在正常防御和非特异性免疫中发挥着重要的作用[21]。LZM主要由单核巨噬细胞释放,广泛分布于动物组织、体液和分泌液中,主要通过溶解细菌或真菌细胞壁,达到抗菌消炎、增强机体免疫能力的作用[22]。本试验通过添加复合特异性IgY,显著降低了犊牛血清中LZM的浓度,这说明复合特异性IgY通过发挥自身的抗原抗体免疫反应,有助于降低机体非特异性免疫反应,降低外界刺激对犊牛产生的不良影响,提高机体适应能力。AKP则在动物组织、体液和分泌液中,通过改变细菌表面的结构,增强异己性使其易于被机体吞噬细胞吞噬和降解[16]。AKP与LZM发挥协同作用,共同增强机体抵抗外界病原菌感染能力。然而,从本试验结果却发现,复合特异性IgY并没有影响犊牛血清中AKP活性,这可能与犊牛当时所处的状态有关。
特异性IgY在降低犊牛腹泻,提高免疫球蛋白、抗氧化能力以及免疫相关酶活性方面均表现出积极作用。然而特异性IgY经幼龄动物口服在胃肠道与致病性抗原发生的免疫中和反应机制以及特异性IgY对肠道黏膜免疫细胞的免疫应答机制的调节作用有待进一步研究。同时母鸡在免疫过程中蓄积在卵黄中大量的非特异性抗体对幼龄动物产生的积极作用也应该引起重视并加以充分利用,通过系统深入的研究使复合特异性IgY在生产中得到更好的应用。
4 结论在本试验条件下,饲粮中添加复合特异性IgY通过提高犊牛免疫球蛋白浓度和抗氧化能力以及发挥卵黄抗体本身抗原抗体反应,增强犊牛免疫能力和抵抗外界应激能力,降低了腹泻率,促进了犊牛健康。
| [1] |
KOVACS-NOLAN J, MINE Y. Egg yolk antibodies for passive immunity[J].
Annual Review of Food Science and Technology, 2012, 3: 163–182.
( 0) 0)
|
| [2] |
巨晓军, 杨海明, 王志跃, 等. 卵黄免疫球蛋白在畜禽生产中的研究与应用[J].
动物营养学报, 2015, 27(3): 691–697.
( 0) 0)
|
| [3] |
FU C Y, HUANG H, WANG X M, et al. Preparation and evaluation of anti-SARS coronavirus IgY from yolks of immunized SPF chickens[J].
Journal of Virological Methods, 2006, 133(1): 112–115.
( 0) 0)
|
| [4] |
RAHIMI S, SHIRAZ Z M, SALEHI T Z, et al. Prevention of Salmonella infection in poultry by specific egg-derived antibody[J].
International Journal of Poultry Science, 2007, 6(4): 230–235.
( 0) 0)
|
| [5] |
MAHDAVI A H, RAHMANI H R, NILI N, et al. Effects of dietary egg yolk antibody powder on growth performance,intestinal Escherichia coli colonization,and immunocompetence of challenged broiler chicks[J].
Poultry Science, 2010, 89(3): 484–494.
( 0) 0)
|
| [6] |
罗淡彬.鸡卵黄免疫球蛋白对早期断奶仔猪生长与免疫性能的影响[D].硕士学位论文.长沙:湖南农业大学,2006.
( 0) 0)
|
| [7] |
程学慧, 王劼, 蒋思文, 等. 纯化ETEC K88菌毛特异性卵黄抗体的加工贮藏及体外抗黏附性研究[J].
饲料研究, 2005(4): 3–5.
( 0) 0)
|
| [8] |
VEGA C, BOK M, CHACANA P, et al. Egg yolk IgY:protection against rotavirus induced diarrhea and modulatory effect on the systemic and mucosal antibody responses in newborn calves[J].
Veterinary Immunology and Immunopathology, 2011, 142(3/4): 156–169.
( 0) 0)
|
| [9] |
DHAMA K, CHAUHAN R S, MAHENDRAN M, et al. Rotavirus diarrhea in bovines and other domestic animals[J].
Veterinary Research Communications, 2009, 33(1): 1–23.
( 0) 0)
|
| [10] |
AOAC.Official methods of analysis[S].17th ed.Arlington:Association of Offical Analytical Chemists,2000.
( 0) 0)
|
| [11] |
HEINRICHS A J, JONES C M, HEINRICHS B S. Effects of mannan oligosaccharide or antibiotics in neonatal diets on health and growth of dairy calves[J].
Journal of Dairy Science, 2003, 86(12): 4064–4069.
( 0) 0)
|
| [12] |
朱锦兰, 李焕友, 冯定远, 等. 卵黄抗体添加剂对肉鸭增重及有关代谢激素水平的影响[J].
黑龙江畜牧兽医, 2004(12): 27–28.
( 0) 0)
|
| [13] |
RADA V, VLKOVÁ E, NEVORAL J, et al. Comparison of bacterial flora and enzymatic activity in faeces of infants and calves[J].
FEMS Microbiology Letters, 2006, 258(1): 25–28.
( 0) 0)
|
| [14] |
VEGA C, BOK M, SAIF L, et al. Egg yolk IgY antibodies:a therapeutic intervention against group a rotavirus in calves[J].
Research in Veterinary Science, 2015, 103: 1–10.
( 0) 0)
|
| [15] |
PARREÑO V, BÊJAR C, VAGNOZZI A, et al. Modulation by colostrum-acquired maternal antibodies of systemic and mucosal antibody responses to rotavirus in calves experimentally challenged with bovine rotavirus[J].
Veterinary Immunology and Immunopathology, 2004, 100(1/2): 7–24.
( 0) 0)
|
| [16] |
张乃锋, 刁其玉, 李辉. 植物蛋白对6~11日龄犊牛腹泻与血液指标的影响[J].
中国农业科学, 2010, 43(19): 4094–4100.
( 0) 0)
|
| [17] |
SUN P, WANG J Q, ZHANG H T. Effects of Bacillus subtilis natto on performance and immune function of preweaning calves[J].
Journal of Dairy Science, 2010, 93(12): 5851–5855.
( 0) 0)
|
| [18] |
STOTT G H, FELLAH A. Colostral immunoglobulin absorption linearly related to concentration for calves[J].
Journal of Dairy Science, 1983, 66(6): 1319–1328.
( 0) 0)
|
| [19] |
李花英, 邱晓萍, 刘小莺, 等. Graves病患者血清氧化及抗氧化能力指标的观察[J].
中华内分泌代谢杂志, 2011, 27(6): 495–497.
( 0) 0)
|
| [20] |
费水英, 李玉, 李军田, 等. 不同比例植物蛋白代乳粉对早期断奶犊牛免疫指标的影响[J].
西北农业学报, 2009, 18(6): 77–81.
( 0) 0)
|
| [21] |
HANCOCK R E W, SCOTT M G. The role of antimicrobial peptides in animal defenses[J].
Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(16): 8856–8861.
( 0) 0)
|
| [22] |
丁亚红.防治仔猪大肠杆菌性腹泻复合型全蛋粉的初步研制[D].硕士学位论文.扬州:扬州大学,2006.
( 0) 0)
|




