2. 甘肃省肉羊繁育生物技术工程实验室, 民勤 733300;
3. 甘肃农业大学动物科学技术学院, 兰州 730070
2. Engineering Laboratory of Sheep Breeding and Reproduction Biotechnology in Gansu Province, Minqin 733300, China;
3. College of Animal Science and Technology, Gansu Agriculture University, Lanzhou 730070, China
随着人们生活水平的提高,羊肉在餐桌上越来越受到欢迎,这主要是由于羊肉具有营养丰富、口感好以及食疗药补等优点,被认为是一种保健型的肉类[1]。但与养羊业发达的国家相比,我国在羊肉的品质方面还存在着很大的提升空间。羊肉中脂肪酸的组成是肉品质的主要影响因素,因此研究羔羊脂肪酸的沉积对提高肉品质具有重要的意义[2]。
通过控制断奶时间来改善羊肉肉品质已成为反刍动物营养领域的一个热点。通过控制断奶时间可以改变反刍动物的饲粮摄入,反刍动物饲粮粗精比[3-4]、能量[5-6]和蛋白质水平[7]直接影响动物肌肉中脂肪酸的组成,从而起到改变肌肉中脂肪酸的组成达到改善肉品质的目的。Sañudo等[8]对比了56日龄断奶组和不断奶组羔羊肌肉中脂肪酸的组成,不断奶组C12∶0、C14∶0、C15∶0、C16∶0、C16∶1和C18∶3的含量高于56日龄断奶组,C17∶0、C18∶0、C18∶1和C20∶0的含量却低于56日龄断奶组。反刍动物断奶后,饲料中脂肪源会产生变化。不同类型的脂肪源会对动物肌肉中脂肪酸的组成产生影响。饲粮中添加不同类型的脂肪源可以降低反刍动物肉产品中饱和脂肪酸(SFA)含量,增加单不饱和脂肪酸(MUFA)、多不饱和脂肪酸(PUFA)含量,尤其是n-3系列的PUFA, 使PUFA/SFA提高,n-6/n-3 PUFA降低,从而提高反刍动物肉制品的营养价值[9-10]。不同断奶时间及日龄变化能使反刍动物瘤胃内微生物区系发生改变,瘤胃内大部分纤维素降解菌都是在断奶后出现,随着日龄的增长,瘤胃内微生物区系逐渐丰富[11],瘤胃内微生物区系的改变对肌肉中脂肪酸的沉积具有重要影响[2]。
湖羊是我国的地方品种,具有肉质好,生长发育快等优点[12]。但到目前为止,关于湖羊不同断奶时间对肌肉中脂肪酸沉积影响的研究鲜有报道。本试验通过比较不同断奶时间(28日龄vs. 56日龄)对羔羊各生长阶段肌肉脂肪酸组成和瘤胃氢化菌数量的影响,明确湖羊羔羊肌肉脂肪酸沉积过程及断奶时间对脂肪酸组成的影响机制,为生产中通过营养与管理手段调控羊肉肌肉脂肪酸组成提供理论依据。
1 材料与方法 1.1 试验设计及饲粮本试验采用单因素试验设计,试验选取体重[(3.51±0.57) kg]接近、健康状况良好的54只初生湖羊公羔,饲养至28日龄后屠宰6只。将剩余的48只按照同质性原则分为28日龄断奶组[(8.21±0.97) kg]和56日龄断奶组[(8.06±0.53) kg],每组24只。所有试验动物从7日龄开始补饲开食料,59日龄换育肥料,换料过渡期为10 d。28日龄断奶组和56日龄断奶组在42、56、70、84日龄分别屠宰6只。试验所用羔羊均购于甘肃省金昌中天羊业有限公司。开食料的组成及营养水平见于表 1,育肥料组成及营养水平见于表 2。2种饲粮的压缩比均为1∶6,制粒直径均为2.5 mm。
|
|
表 1 开食料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the starter (air-dry basis) |
|
|
表 2 育肥料组成及营养水平(风干基础) Table 2 Composition and nutrient levels of the fattening diet (air-dry basis) |
羔羊与母羊共同饲养在同一圈栏内,圈栏内安有补饲栏。在每天08:00—10:00、12:00—14:00、18:00—20:00将羔羊关进补饲栏使其与母羊隔开,而在其余时间羔羊可跟随母羊自由吮乳。羔羊跟随母羊时不允许采食母羊料,但可采食补饲料及自由饮水。母羊料为羊场常规全混合日粮(TMR)(青贮玉米40%,燕麦草12%,苜蓿10%,大麦秸秆8%,油菜秸秆5%,豆渣13%,玉米9%,豆粕3%;营养水平为消化能7.38 MJ/kg,粗蛋白质7.60%,钙0.32%,磷0.25%),圈舍每隔15 d彻底消毒1次。
1.3 采样和测定指标及方法 1.3.1 采样试验动物屠宰后,采集背最长肌300 g左右,-20℃保存用于后期脂肪酸分析。
打开瘤胃后,取出瘤胃内容物,用匀浆机混匀,所有内容物过4层纱布得到瘤胃液,然后将瘤胃液装入冻存管后放入装有液氮的液氮罐中保存,带回实验室后将样品置于-80℃保存直至微生物DNA的提取。
1.3.2 肌肉脂肪酸组成测定 1.3.2.1 样品预处理样品总脂肪的提取及脂肪酸甲酯化参考O’Fallon等[13]的方法进行。1 g的半冷冻样品均匀地置于室温条件下的研磨机中研磨10~15 s,然后放置于1个16 mm×125 mm带螺帽耐热玻璃装有0.7 mL 10 mol/L的KOH溶液和6.3 mL的甲醇的培养管中。将培养管置于55℃水浴1.5 h,每20 min用力用手晃动管子5 s使样品正常渗透、溶解和水解。通过自来水水浴至室温后,加入0.58 mL 12 mol/L的H2SO4。培养管通过倒置混合,会产生K2SO4沉淀,然后继续置于55℃水浴1.5 h,每20 min用力晃动管子5 s。脂肪酸甲酯(FAME)形成后,培养管置于冰水中冰浴。加入3 mL正己烷,培养管涡旋5 min,然后将培养管离心5 min。将含有FAME的正己烷层抽取到气相色谱(GC)分析小瓶中。GC分析小瓶加盖置于-20℃下保存至分析。
1.3.2.2 GC分析方法制备好的脂肪酸甲酯进行GC分析(Trace 1300,Thermo Fisher),毛细色谱柱为100 m×0.25 mm×0.2μm(HP-88,Agilent)。程序升温条件为:初始温度166℃维持39 min,以10℃/min升至230℃, 维持10 min,以3℃/min升至235℃,维持8 min,进样口温度为250℃,火焰离子检测器(FID)温度为250℃,载气氮气(N2)流速为1.2 mL/min, 分流比25∶1。脂肪酸甲基酯标样均购于Sigma公司。
1.3.3 瘤胃氢化菌定量采用实时定量PCR (qRT-PCR)技术测定溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)、蛋白溶解梭菌(Clostridium proteoclasticum)相对于瘤胃总细菌(general bateria)的相对含量。
1.3.3.1 DNA提取瘤胃液样品中的总基因组DNA进行提取采用的是动物粪便基因组DNA提取试剂盒(Stool DNA Kit 50,Omega),提取按照说明书方法进行。
1.3.3.2 PCR引物设计瘤胃总细菌、溶纤维丁酸弧菌和蛋白溶解梭菌的PCR引物利用Primer 5.0进行设计,由生工生物工程(上海)股份有限公司合成。瘤胃总细菌PCR引物序列为:5′-CGGCAACGAGCGCAACCC-3′(上游), 5′-CCATTGTAGCACGTGTGTAGCC-3′(下游); 溶纤维丁酸弧菌PCR引物序列为:5′-GCCTCAGCGTCAGTAATCG-3′(上游), 5′-GGAGCGTAGGCGGTTTTAC-3′(下游); 蛋白溶解梭菌PCR引物序列为:5′-TCCGGTGGTATGAGATGGGC-3′(上游), 5′-GTCGCTGCATCAGAGTTTCC-3′(下游)。
1.3.3.3 qRT-RCR反应体系及条件qRT-RCR的操作仪器为Bio-Rad CFX 96型qRT-PCR检测系统。以SYBR Premix Ex TaqTM试剂(北京全式金生物技术有限公司)建立20μL反应体系, 包括SYBR GreenⅠ型荧光染料Mix 10μL、上游和下游引物分别0.4μL、DNA模板2μL及双蒸去离子水7.2μL。反应条件为:95℃预变性10 min;95℃变性15 s;60℃(总菌)/57℃(溶纤维丁酸弧菌)/55℃(蛋白溶解梭菌)退火30 s;72℃延伸30 s并采集突光信号,共40个循环。按仪器操作说明制作熔解曲线进行后续分析。
1.3.3.4 计算公式根据下列公式将2种瘤胃氢化菌数量表示为相对于瘤胃总细菌16S rDNA的含百分比:
目标菌含量(%)=2-(Ct目标菌-Ct总细菌)。
式中:Ct目标菌为目标菌引物所测循环阈值, Ct总细菌为以瘤胃总细菌为引物所测循环阈值。
1.4 统计分析所有数据首先用Excel 2010初步整理,然后用SPSS 18.0对日龄变化处理的组间试验数据进行单因素方差分析,并用Duncan氏法进行多重比较;对断奶时间处理的组间试验数据进行独立t检验统计分析。P>0.05为差异不显著,P<0.05为差异显著。
2 结果 2.1 断奶时间及日龄变化对羔羊背最长肌脂肪酸组成的影响断奶时间及日龄变化对羔羊背最长肌脂肪酸组成的影响见3。不同断奶时间对羔羊背最长肌PUFA和SFA含量在28、42与56日龄均不存在显著性差异(P>0.05),但在70与84日龄时56日龄断奶组显著高于28日龄断奶组(P < 0.05);对于奇数碳原子脂肪酸(OFA)和MUFA的含量,在42日龄时56日龄断奶组均显著低于28日龄断奶组(P < 0.05),OFA的含量在其他日龄2组之间均无显著性差异(P>0.05),而MUFA的含量在70和84日龄时56日龄断奶组均显著高于28日龄断奶组(P < 0.05);PUFA/SFA 2组之间在各个日龄均无显著性差异(P>0.05);n-6/n-3PUFA在70日龄时56日龄断奶组显著低于28日龄断奶组(P < 0.05),在84日龄时2组之间并无显著性差异(P>0.05)。
对于单种脂肪酸含量的对比,在42日龄时,C18∶0、C18∶3n-6和C18∶3n-3的含量56日龄断奶组显著高于28日龄断奶组(P < 0.05),C16∶0、C16∶0anteiso、C18∶1t11、C18∶2n-6、C20∶1、C20∶3、C22∶1和C20∶5n-3的含量56日龄断奶组显著低于28日龄断奶组(P < 0.05),其他脂肪酸的含量2组之间均无显著性差异(P>0.05);在56日龄时,只有C18∶1t11和C18∶3n-3的含量56日龄断奶组显著低于28日龄断奶组(P < 0.05),其他脂肪酸含量组间均无显著性差异(P>0.05);在70日龄时,C10∶0、C12∶0、C14∶0、C15∶0、C16∶0anteiso、C16∶0、C17∶0iso、C18∶2n-6、C18∶1c9、C20∶3、C22∶1和C20∶5n-3的含量56日龄断奶组显著高于28日龄断奶组(P < 0.05),C17∶0、C17∶1和C18∶1t11的含量56日龄断奶组显著低于28日龄断奶组(P < 0.05),而其他脂肪酸的含量2组之间均无显著性差异(P>0.05);在84日龄时,C16∶0、C17∶0iso、C17∶0、C18∶0、C18∶2n-6、C18∶3n-3及C22∶1的含量56日龄断奶组显著高于28日龄断奶组(P < 0.05),而C15∶0、C20∶0的含量56日龄断奶组显著低于28日龄断奶组(P < 0.05),其他脂肪酸的含量2组之间均无显著性差异(P>0.05)。
日龄变化对羔羊背最长肌脂肪酸组成也有很大的影响。对于28日龄断奶组,56和70日龄的OFA含量显著高于28和42日龄(P < 0.05);42、56和84日龄的MUFA含量显著高于28和70日龄(P < 0.05);56日龄的PUFA含量显著高于28、42和84日龄(P < 0.05);56日龄的SFA含量显著高于28、42、70和84日龄(P < 0.05),28日龄的SFA含量显著低于其他日龄(P < 0.05);PUFA/SFA在28日龄时显著高于42、56、70和84日龄(P < 0.05),其他日龄之间均无显著性差异(P>0.05);n-6/n-3PUFA在70日龄时显著高于其他日龄(P < 0.05),在28日龄时显著低于其他日龄(P < 0.05)。
对于56日龄断奶组,84日龄的OFA含量显著高于其他日龄(P < 0.05),而28和42日龄的OFA含量显著低于其他日龄(P < 0.05);70日龄的MUFA含量显著高于28、42和56日龄(P < 0.05),而28和42日龄的MUFA含量显著低于其他日龄(P < 0.05);70和84日龄的PUFA和SFA含量显著高于其他日龄(P < 0.05),28和42日龄的PUFA含量显著低于其他日龄(P < 0.05);PUFA/SFA在28日龄时显著高于42、56、70和84日龄(P < 0.05),其他日龄之间均无显著性差异(P>0.05);n-6/n-3PUFA在28日龄时显著低于42、56、70和84日龄(P < 0.05),其他日龄之间均无显著性差异(P>0.05)。
|
|
表 3 断奶时间及日龄变化对羔羊背最长肌脂肪酸组成的影响 Table 3 Effects of weaner time and days of age on fatty acid composition of longissimus of lambs |
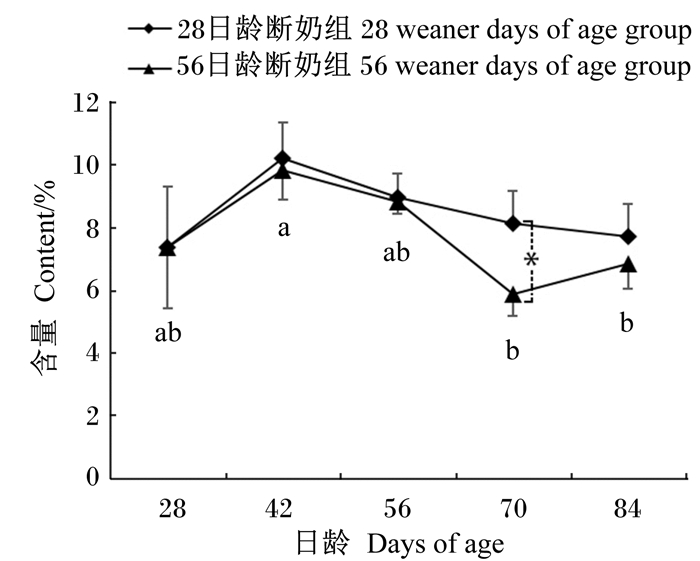
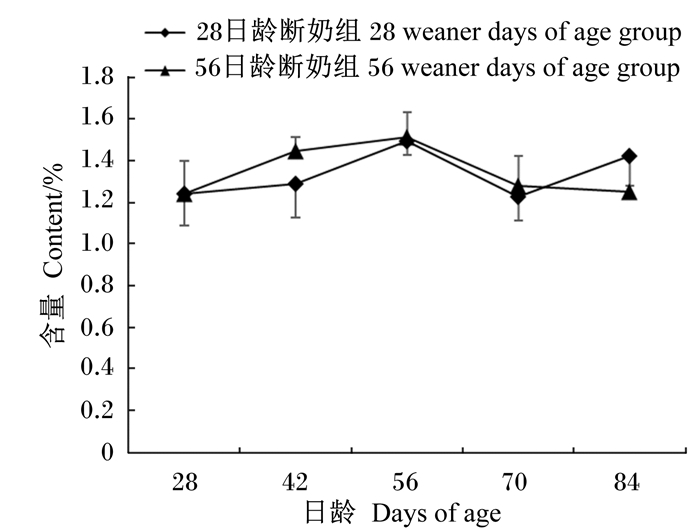
断奶时间及日龄变化对羔羊瘤胃中溶纤维丁酸弧菌和蛋白溶解梭菌数量的影响分别见图 1与图 2。70日龄时,28日龄断奶组的溶纤维丁酸弧菌含量显著高于56日龄断奶组(P < 0.05);在其他日龄2组之间无显著性差异(P>0.05)。而对于蛋白溶解梭菌的含量,2组之间在所有日龄都无显著性差异(P>0.05)。
|
同组数据标注不同小写字母表示差异显著(P < 0.05),同一日龄数据标注*表示差异显著(P < 0.05)。下图同。 Values of the same group with different small letters mean significant difference (P < 0.05), and values of the days of age with * mean significant difference (P < 0.05). The same as below. 图1 断奶时间及日龄变化对羔羊瘤胃中溶纤维丁酸弧菌含量的影响 Fig. 1 Effects of weaner time and days of age on Butyrivibrio fibrisolvens content in rumen of lambs |
|
图2 断奶时间及日龄变化对羔羊瘤胃中溶纤维丁酸弧菌含量的影响 Fig. 2 Effects of weaner time and days of age on Clostridium proteoclasticum content in rumen of lambs |
随着日龄的变化瘤胃内溶纤维丁酸弧菌和蛋白溶解梭菌的含量也产生了变化。对于28日龄断奶组,随着日龄增加,瘤胃内2种氢化菌的数量都没有出现显著性变化(P>0.05),但溶纤维丁酸弧菌的含量在42日龄达到最高,而蛋白溶解梭菌的含量在56日龄达到最高。对于56日龄断奶组,随着日龄增加,蛋白溶解梭菌的含量无显著变化(P>0.05),并在56日龄时其含量达到最高;但溶纤维丁酸弧菌的含量在42日龄时显著高于70和84日龄(P < 0.05),其他日龄之间均无显著性差异(P>0.05)。
3 讨论 3.1 营养物质各养分采食量在本课题组的另一项研究中,对同等条件下羔羊营养物质采食量进行了分析,由于羔羊随母羊群饲,养分采食量数据未进行统计分析。在1~28日龄时,28日龄断奶组和56日龄断奶组羔羊干物质采食量不高且接近(36.88 g/d vs. 40.01 g/d),在29~70日龄时28日龄断奶组采食量(205.05~643.62 g/d)高于56日龄断奶组(152.59~569.03 g/d),在71~84日龄时28日龄断奶组采食量低于28日龄断奶组(1 008.33 g/d vs. 1 156.41 g/d)[18]。
3.2 断奶时间与日龄变化对羔羊背最长肌脂肪酸组成的影响提高羔羊肉品质的目标是提高不饱和脂肪酸(UFA)并降低SFA在总脂肪酸中的比例。在本研究中,28日龄断奶组UFA在总脂肪酸中的比例高于56日龄断奶组。柴建民等[14]对比了羔羊30和60日龄断奶效果,90日龄屠宰后发现30日龄断奶组肌肉中UFA含量高于60日龄断奶组,这一点与我们的研究结果一致。出现这种结果可能是由于28日龄断奶组断奶时间早使得羔羊采食大量的固体料,而早期补饲固体料可加快瘤胃内微生物区系定植的进程[5],因此28日龄断奶组瘤胃内微生物区系必然比56日龄断奶组建立时间早,而幼龄反刍动物瘤胃内微生物区系建立时间越早动物肌肉中UFA的比例就越高[14]。28日龄断奶组PUFA/SFA与56日龄断奶组在各个日龄都无显著性差异,这说明断奶时间对PUFA/SFA无影响。56日龄断奶组在70日龄时n-6/n-3PUFA显著低于28日龄断奶组,并且均小于5。Enser等[15]研究发现膳食中n-6/n-3PUFA小于5能够预防某些癌症的发生。本研究还显示,在84日龄时56日龄断奶组C16∶0、C17∶0iso、C17∶0、C18∶0、C18∶2n-6、C18∶3n-3及C22∶1含量比28日龄断奶组分别高出138.83%、125.00%、127.71%、126.25%、144.59%、42.15%和28.39%。范志影[16]在研究不同能量水平的代乳粉对羔羊肉品质的影响时发现,高能组羔羊肌肉中UFA在总脂肪酸中的比例高于低能组。羔羊断奶时间的不同直接影响羔羊摄入的营养成分组成,尤其是能量水平。能量水平作为羔羊早期生长发育过程中极为重要的影响因素,其对羔羊肌肉中脂肪酸的发育具有重要的作用。本试验中,28日龄断奶组断奶后摄入固体料的能量水平(3.13 MJ/d)高于56日龄断奶组(2.32 MJ/d)[18],这一点我们与范志影[16]的研究结果一致。另外,饲粮中的蛋白质水平和来源以及粗精比也可以通过影响反刍动物瘤胃内微生物区系来改变动物肌肉中脂肪酸的组成[14]。Hadjipanayiotou等[17]研究了改变羔羊饲粮中蛋白质的水平对肌肉中脂肪酸的组成的影响,发现高蛋白质组中MUFA和PUFA的含量高于低蛋白组。本研究中,28日龄断奶组在断奶后42日龄肌肉中MUFA和PUFA的含量高于56日龄断奶组,而在42日龄时28日龄断奶组饲粮的粗蛋白质水平(42.06 g/d)高于56日龄断奶组(31.26 g/d)[18],这一点与Hadjipanayiotou等[17]的研究结果一致。Demirel等[10]研究表明,低精料组绵羊肌肉中PUFA在总脂肪酸中的比例高于高精料组,低精料组SFA在总脂肪酸中的比例低于高精料组。在本试验中羔羊断奶后饲粮立即由液体乳和开食料变为全部开食料,羔羊饲粮中蛋白质来源由乳源蛋白质和植物性蛋白质全部转化为植物性蛋白质,并且蛋白质水平也发生了改变,这必然会引起瘤胃内微生物区系的变化。而瘤胃内微生物,尤其是氢化菌,可直接改变瘤胃内UFA氢化的途径,从而使反刍动物肌肉中脂肪酸的组成发生改变[19]。
在本试验中,随着日龄的变化肌肉中脂肪酸的组成也产生了改变。李维红等[20]研究结果表明,日龄增长会使动物肌肉中脂肪酸含量升高,脂肪酸的种类增多。在本研究中,C15∶0、C17∶0iso和C17∶0在28日龄时羔羊肌肉中均没出现。对于28日龄断奶组,C15∶0、C17∶0iso和C17∶0在42日龄时羔羊肌肉中开始出现;而对于56日龄断奶组,C17∶0iso和C17∶0直到56日龄时羔羊肌肉中才检测到。随着日龄的增长,28日龄断奶组和56日龄断奶组羔羊肌肉中脂肪酸种类逐渐增多,这一点与李维红等[20]的结果一致。反刍动物肌肉中含有奇数和支链脂肪酸(OBCFA),而单胃动物肌肉中不含有,这与瘤胃中的微生物是密切相关的。瘤胃纤维分解菌富含支链脂肪酸(如C15∶0iso和C17∶0iso等),而淀粉分解菌含有丰富的奇数碳支链脂肪酸(如C15∶0和C17∶0等)[21]。这可能是由于28日龄断奶组断奶时间早导致瘤胃内与肌肉奇数和支链脂肪酸相关的微生物出现时间比56日龄断奶组早,所以才会出现28日龄断奶组奇数和支链脂肪酸在肌肉中出现的时间比56日龄断奶组早的结果。另外本研究结果显示,在28日龄断奶组中,84日龄时羔羊肌肉中MUFA、PUFA和SFA的含量与28日龄相比分别提高了55.14%、49.45%和287.48%;在56日龄断奶组中,84日龄时羔羊肌肉中MUFA、PUFA和SFA的含量与28日龄相比分别提高了123.25%、157.91%和770.95%。这与李维红等[20]研究的随着日龄增长脂肪酸含量升高的结果一致[19]。出现这种结果的原因可能是随着日龄的增长羔羊肌肉中脂肪酸的沉积量逐渐增多,导致羔羊肌肉中脂肪酸含量升高。羔羊在56日龄断奶更利于肌肉中脂肪酸的沉积,提示随着羔羊日龄增长合理地调控动物的饲粮营养组成变得尤其重要
3.3 断奶时间与日龄变化对羔羊瘤胃内氢化菌数量的影响本试验中,我们得出了断奶时间的不同及日龄的变化对蛋白溶解梭菌的数量无显著性影响,但是在70日龄时28日龄断奶组羔羊瘤胃内溶纤维丁酸弧菌的数量显著高于56日龄断奶组,另外56日龄断奶组日龄的变化也引起了瘤胃内溶纤维丁酸弧菌的数量差异。赵天章[19]的研究中观测到绵羊瘤胃内蛋白溶解梭菌的相对数量在不同处理间的变化幅度很小,这与我们研究所得出的蛋白溶解梭菌未受到断奶时间和日龄变化显著影响的结果一致。Jami[11]等通过qRT-PCR的方法检测犊牛从出生到成年瘤胃内细菌数量的变化时,发现犊牛断奶后瘤胃内溶纤维丁酸弧菌的数量有所下降。56日龄断奶组在断奶后采食量升高(由333.83 g/d升高为569.03 g/d)[18],28日龄断奶组与56日龄断奶组溶纤维丁酸弧菌在70日龄所产生的差异可能是由于采食量的升高导致瘤胃内pH降低,不利于溶纤维丁酸弧菌生长。
断奶对瘤胃中微生物区系具有很大的影响[22],另外,随着日龄的变化饲粮所做出的改变以及采食量的变化也会引起瘤胃内微生物区系的变化[23-24]。目前研究表明,对人类身体有诸多益处的共轭亚油酸(CLA)及其前体物C18∶1t11主要是由饲粮中的PUFA在瘤胃内不完全氢化产生的中间产物[24]。参与此途径主要是2类细菌,分为A类菌和B类菌。A类菌主要是由溶纤维丁酸弧菌属构成,主要是将C18∶3n-3和C18∶2n-6氢化成C18∶1t11;B类菌主要由蛋白溶解梭菌构成,主要是负责将C18∶1t11和C18∶1c9最终氢化为C18∶0[26]。从本研究溶纤维丁酸弧菌氢化途径的底物来看,在70日龄时28日龄断奶组羔羊肌肉中C18∶3n-3和C18∶2n-6的含量均显著低于56日龄断奶组;从氢化菌qRT-PCR的结果看,28日龄断奶组羔羊瘤胃中溶纤维丁酸弧菌的数量显著高于56日龄断奶组;从溶纤维丁酸弧菌氢化途径的产物来看,28日龄断奶组C18∶1t11的含量显著高于56日龄断奶组。这就说明溶纤维丁酸弧菌通过其氢化途径影响了羔羊肌肉中脂肪酸的组成。
4 结论①56日龄断奶组羔羊背最长肌大部分脂肪酸的含量在84日龄时仍显著高于28日龄断奶组,因此相对于56日龄断奶,28日龄断奶不利于羔羊肌肉中大部分脂肪酸的沉积。
②随着日龄的增长羔羊背最长肌中大部分种类的脂肪酸含量逐渐升高。
| [1] |
茅慧玲, 刘建新. 反刍动物肌肉脂肪酸营养调控研究进展[J].
饲料工业, 2010, 31(23): 30–34.
( 0) 0)
|
| [2] |
THOMPSON J M. The effects of marbling on flavour and juiciness scores of cooked beef, after adjusting to a constant tenderness[J].
Animal Production Science, 2004, 44(7): 645–652.
( 0) 0)
|
| [3] |
闫秋良, 金海国, 赵云辉, 等. 不同精粗比全混合日粮对育肥羔羊屠宰性能及肉品质的影响[J].
吉林农业科学, 2010, 35(6): 43–45.
( 0) 0)
|
| [4] |
梁大勇, 昝林森, 张双奇, 等. 日粮精粗比对荷斯坦青年公牛生长和肉质的影响[J].
西北农林科技大学学报:自然科学版, 2009(12): 63–67.
( 0) 0)
|
| [5] |
DEL CAMPO M, BRITO G, DE LIMA J M S, et al. Effects of feeding strategies including different proportion of pasture and concentrate, on carcass and meat quality traits in Uruguayan steers[J].
Meat Science, 2008, 80(3): 753–760.
( 0) 0)
|
| [6] |
YU H L, BI Y X, MA W W, et al. Long-term effects of high lipid and high energy diet on serum lipid, brain fatty acid composition, and memory and learning ability in mice[J].
International Journal of Developmental Neuroscience:the Official Journal of the International Society for Developmental Neuroscience, 2010, 28(3): 271–276.
( 0) 0)
|
| [7] |
DE SMET S, WEBB E C, CLAEYS E, et al. Effect of dietary energy and protein levels on fatty acid composition of intramuscular fat in double-muscled Belgian Blue bulls[J].
Meat Science, 2000, 56(1): 73–79.
( 0) 0)
|
| [8] |
SAÑUDO C, SIERRA I, OLLETA J, et al. Influence of weaning on carcass quality, fatty acid composition and meat quality in intensive lamb production systems[J].
Animal Science, 1998, 66(1): 175–187.
( 0) 0)
|
| [9] |
NUERNBERG K, NUERNBERG G, ENDER K, et al. N-3 fatty acids and conjugated linoleic acids of longissimus muscle in beef cattle[J].
European Journal of Lipid Science and Technology, 2002, 104(8): 463–471.
( 0) 0)
|
| [10] |
DEMIREL G, OZPINAR H, NAZLI B, et al. Fatty acids of lamb meat from two breeds fed different forage:concentrate ratio[J].
Meat Science, 2006, 72(2): 229–235.
( 0) 0)
|
| [11] |
JAMI E, ISRAEL A, KOTSER A, et al. Exploring the bovine rumen bacterial community from birth to adulthood[J].
The ISME Journal, 2013, 7(6): 1069–1079.
( 0) 0)
|
| [12] |
马志远, 李飞, 李发弟, 等. 早期断奶对湖羊羔羊生长性能及胃肠道发育的影响[J].
动物营养学报, 2015, 27(5): 1385–1393.
( 0) 0)
|
| [13] |
O'FALLON J V, BUSBOOM J R, NELSON M L, et al. A direct method for fatty acid methyl ester synthesis:application to wet meat tissues, oils, and feedstuffs[J].
Journal of Animal Science, 2007, 85(6): 1511–1521.
( 0) 0)
|
| [14] |
柴建民, 刁其玉, 屠焰, 等. 早期断奶时间对湖羊羔羊组织器官发育、屠宰性能和肉品质的影响[J].
动物营养学报, 2014, 26(7): 1838–1847.
( 0) 0)
|
| [15] |
ENSER M, HALLETT K G, HEWETT B, et al. Fatty acid content and composition of UK beef and lamb muscle in relation to production system and implications for human nutrition[J].
Meat Science, 1998, 49(3): 329–341.
( 0) 0)
|
| [16] |
范志影.代乳粉中蛋白质水平和来源对犊牛和羔羊肉质、血清指标和胃肠道发育的影响[D].硕士学位论文.北京:中国农业科学院, 2007.
( 0) 0)
|
| [17] |
HADJIPANAYIOTOU M, KOUMAS A, HADJIGAVRIEL G, et al. Feeding dairy ewes and goats and growing lambs and kids mixtures of protein supplements[J].
Small Ruminant Research, 1996, 21(3): 203–211.
( 0) 0)
|
| [18] |
马志远.早期断奶对湖羊羔羊生产性能及胃肠道发育的影响[D].硕士学位论文.兰州:兰州大学, 2015.
( 0) 0)
|
| [19] |
赵天章.日粮油脂类型对羊肉脂肪酸和肌内脂肪含量的影响及其机理[D].博士学位论文.北京:中国农业大学, 2014.
( 0) 0)
|
| [20] |
李维红, 吴建平, 王欣荣. 靖远滩羊体脂脂肪酸与肉品质关系的研究[J].
中国草食动物, 2005, 25(1): 54–55.
( 0) 0)
|
| [21] |
FRENCH E A, BERTICS S J, ARMENTANO L E. Rumen and milk odd-and branched-chain fatty acid proportions are minimally influenced by ruminal volatile fatty acid infusions[J].
Journal of Dairy Science, 2012, 95(4): 2015–2026.
( 0) 0)
|
| [22] |
DENMAN S E, MCSWEENEY C S. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J].
FEMS Microbiology Ecology, 2006, 58(3): 572–582.
( 0) 0)
|
| [23] |
CHERDTHONG A, WANAPAT M, SAENKAMSORN A, et al. Improving rumen ecology and microbial population by dried rumen digesta in beef cattle[J].
Tropical Animal Health and Production, 2015, 47(5): 921–926.
( 0) 0)
|
| [24] |
PETRI R M, FORSTER R J, YANG W, et al. Characterization of rumen bacterial diversity and fermentation parameters in concentrate fed cattle with and without forage[J].
Journal of Applied Microbiology, 2012, 112(6): 1152–1162.
( 0) 0)
|
| [25] |
LOCK A L, BAUMAN D E. Modifying milk fat composition of dairy cows to enhance fatty acids beneficial to human health[J].
Lipids, 2004, 39(12): 1197–1206.
( 0) 0)
|
| [26] |
HUWS S A, LEE M R F, MUETZEL S M, et al. Forage type and fish oil cause shifts in rumen bacterial diversity[J].
FEMS Microbiology Ecology, 2010, 73(2): 396–407.
( 0) 0)
|




