蹄是牛、羊等反刍动物重要的支持和运动器官,蹄的健康直接关系到这些动物的生产性能。蹄叶炎是动物蹄小叶(包括真皮小叶与角小叶)的一种弥散型的、非感染性的真皮损伤[1-2]。调查显示,蹄叶炎是当前集约化养殖下奶牛、绵羊及山羊常见疾病之一[3],尽管报道认为引发动物蹄叶炎的因素很多,但众多学者认为,饲喂高精料饲粮可能是诱发草食动物蹄叶炎的最主要原因之一。
目前有关高精料饲粮引发蹄叶炎的最主要证据来自于对马蹄叶炎的研究。研究表明,灌注寡果糖可导致马后肠发酵紊乱,肠道黏膜屏障受损,消化道内一些异常代谢产物如脂多糖(lpopolysaccharides, LPS)等可移位进入体内,使蹄组织中一类基质金属蛋白酶(matrix metalloproteinase,MMP)含量升高,由于MMP主要功能是降解细胞外基质和基膜[4-8],MMP活性升高可促进细胞外基质与基膜的降解,使表皮与真皮相连的蹄小叶组织被破坏,最终使蹄与真皮直接接触,导致蹄叶炎。由于这些结果均来自于马蹄叶炎的研究,其在牛、羊等反刍动物上是否有类似现象,并不清楚。
基于以上情况,本试验假设对山羊瘤胃灌注寡果糖能够引发急性酸中毒,继而诱发蹄叶炎。为此,本研究以寡果糖灌注山羊瘤胃,研究了其对山羊瘤胃发酵及蹄组织结构、炎症因子及金属蛋白酶表达的影响,旨在进一步了解反刍动物蹄叶炎的发病机制,并为建立一种低成本的蹄叶炎研究模型提供理论依据。
1 材料方法 1.1 试验动物及饲粮选用8头健康、体重相近、无蹄叶炎病史的2岁的安装有永久性瘤胃瘘管未阉割的波杂公山羊(波尔山羊×长江三角洲白山羊,体重约为26 kg,装有瘤胃瘘管),统一驱虫、单栏饲养。基础饲粮配制参照我国《肉羊饲养标准》NY/T 816—2004[9], 基础饲粮组成及营养水平见表 1,每头每天饲喂饲粮450 g。日喂2次(08:00和17:00),等量饲喂,自由饮水。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验于2015年9月在南京农业大学动物房进行。
试验开始后,将上述8头山羊随机分为对照组与试验组,每组4头。将寡果糖用去离子水溶解,按21 g/kg BW的剂量对试验组山羊通过瘤胃瘘管灌注,对照组则灌注等体积去离子水。为了让瘤胃微生物适应寡果糖,正试期开始前3 d,试验组山羊每天灌注正式剂量的5%作为过渡,每天灌注2次。正试期分别于灌注前0 h和灌注后4、8、12、24和48 h采集瘤胃液,同时于灌注前0 h和灌注后4、8、12、24和48 h通过颈静脉采集血液,灌注后48 h后立即屠宰。
1.3 样品采集在上述各取样时间点,利用自制负压装置,分别通过8头山羊瘤胃瘘管各采集20 mL瘤胃液,所采瘤胃液经4层纱布过滤后,将滤液置于洁净的烧杯中,混合均匀后,立即测定瘤胃液pH,而后将瘤胃液转入离心管中,-20℃冻存,备测挥发性脂肪酸、乳酸和LPS浓度。在上述时间点,利用负压采血管从山羊颈静脉采集血液,室温静置30 min后,将血液转入离心管中,3 500×g离心10 min,取上清,-20℃冻存,备测乳酸和LPS浓度。48 h后全部屠宰,屠宰后使用电锯锯下山羊蹄部[11],采集蹄部组织[6, 12],一部分蹄组织立即置于液氮罐中保存;另一部分立刻放入4%的福尔马林溶液中,备用于蹄小叶形态结构观测。
1.4 测定方法 1.4.1 瘤胃发酵参数的测定使用pH计(HI-9125,意大利HANNA公司)测定瘤胃液pH,采用气相色谱法(GC-14B气相色谱仪,日本岛津公司,柱温130℃,气化室温度180℃,检测器温度180℃)测定挥发性脂肪酸浓度[13],采用比色法测定瘤胃液和血液中乳酸的浓度[14],使用显色基质鲎试剂盒(厦门鲎试剂实验厂有限公司)测定瘤胃液和血液中的LPS浓度[15]。
1.4.2 组织切片的处理蹄组织用4%的多聚甲醛固定,而后经洗涤、酒精梯度脱水、浸蜡、包埋、切片、帖片、脱蜡复水、苏木精-伊红(HE)染色和封固后,切片在光镜下观察蹄小叶形态的变化。
1.4.3 总RNA的提取和cDNA的合成用TRIzol(日本TaKaRa公司)试剂从蹄部组织中提取总RNA[16],使用超微量分光光度计ND-1000 UV-Vis(美国Thermo公司)测量总RNA的浓度,样本的OD260 nm/OD280 nm在1.8~2.0,总RNA保存在-80℃冰箱中。使用PrimeScript RT试剂盒(日本TaKaRa公司)将提取的总RNA反转录成cDNA。
1.4.4 实时定量PCR炎症因子白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)的引物序列参照Liu等[17],MMP-2、MMP-9、膜型基质金属蛋白酶-1(membrane type-1 matrix metalloproteinases,MT1-MMP)和基质金属蛋白酶组织抑制物-1(tissue inhibitors of metalloproteinases-1,TIMP-1)则根据GenBank上牛和羊的保守核酸序列,应用Primer 3.0软件进行引物设计。所有引物序列如表 2所示。所有引物由上海英骏生物技术有限公司合成。采用实时定量PCR法(StepOnePlusTM Real-Time PCR System,美国Applied Biosystems公司)对目的基因及内参基因甘油醛-3-磷酸脱氢酶(GAPDH)进行定量。目的基因的相对表达量以GAPDH作为内参进行校正,基因表达量采用2-ΔΔCt法进行处理。
|
|
表 2 引物序列 Table 2 The primer sequences |
数据经Excel 2010初步整理后,瘤胃液pH、挥发性脂肪酸浓度、瘤胃液与血液中乳酸及LPS浓度采用SPSS 20.0的一般线性模型里的重复度量进行分析,而炎症因子及金属蛋白酶mRNA表达数据采用独立样本t检验进行统计分析,P < 0.05为差异显著, 基因相对表达量采用平均值和标准误的形式表示,其他数据采用平均值±标准差形式表示。
2 结果与分析 2.1 瘤胃液pH由图 1可见,试验组山羊的瘤胃液pH在灌胃后立即下降,在24 h达到最低点,24~48 h开始缓慢上升。与对照组相比,试验组瘤胃液pH平均值显著降低(P < 0.05)。瘤胃液pH < 5.6通常认为是酸中毒;pH在5.0~5.6之间为亚急性瘤胃酸中毒或慢性瘤胃酸中毒;而pH < 5.0接近4.5或是更低称为急性酸中毒,本试验中试验组瘤胃液pH在8 h后低于5,且持续至试验结束,显示试验组山羊发生了急性瘤胃酸中毒。
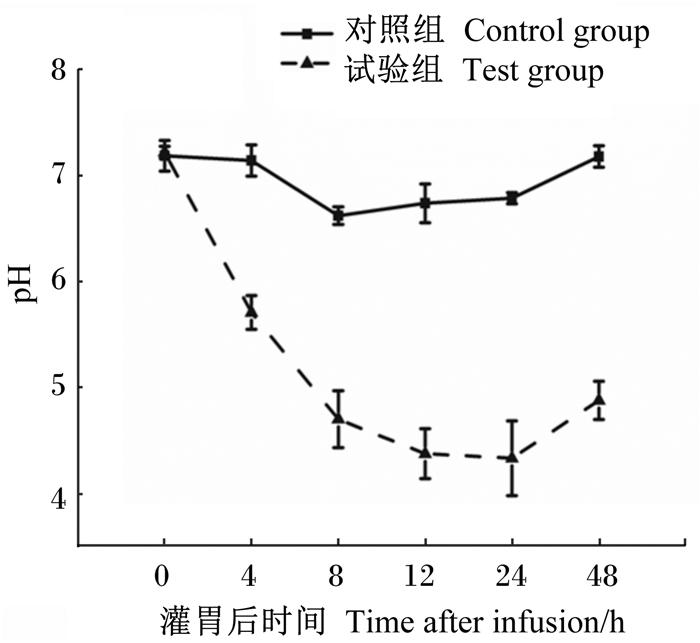
|
图1 灌胃寡果糖对山羊瘤胃液pH的影响 Fig. 1 Effects of intragastric administration of fructan on ruminal liquid pH of goats (n=4) |
由图 2可见,试验组的乙酸、丙酸、丁酸和戊酸浓度自灌注后4 h开始下降,乙酸浓度在12 h达到最低点,之后开始缓慢上升,丙酸、丁酸和戊酸浓度在灌注后24 h达最低点,之后保持不变;而异丁酸和异戊酸浓度从灌胃之后立即下降,在24 h达到最低点,之后浓度保持不变。较对照组比较,试验组山羊瘤胃内乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸浓度平均值均显著降低(P < 0.05)。
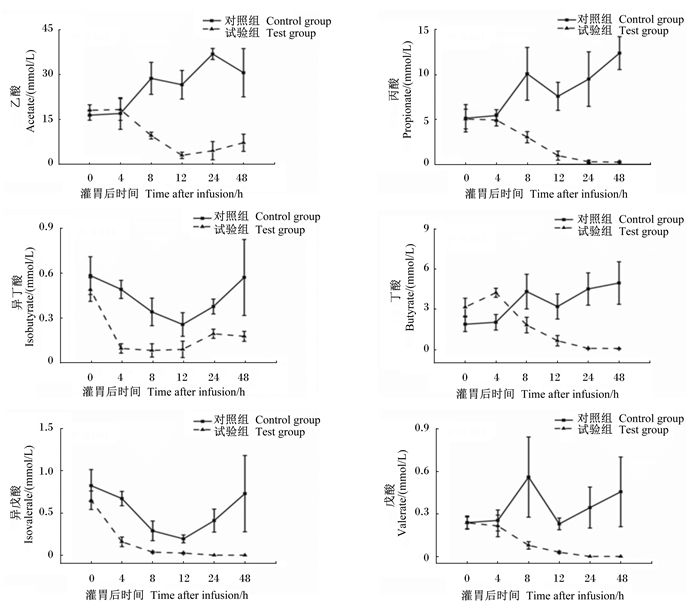
|
图2 急性酸中毒对山羊瘤胃液挥发性脂肪酸浓度的影响 Fig. 2 Effects of acute acidosis on concentrations of volatile fatty acids in ruminal liquid of goats |
由图 3可见,在0~24 h内,试验组的山羊瘤胃液中乳酸浓度持续上升,24 h乳酸浓度均值达12 mmol/L,同时血液中乳酸浓度也持续上升,48 h达峰值;试验组山羊瘤胃液及血液LPS浓度在灌注后0~12 h内持续上升,12 h达峰值,而后逐渐下降。较对照组比较,试验组血液与瘤胃液中乳酸和LPS浓度平均值均显著升高(P < 0.05)。
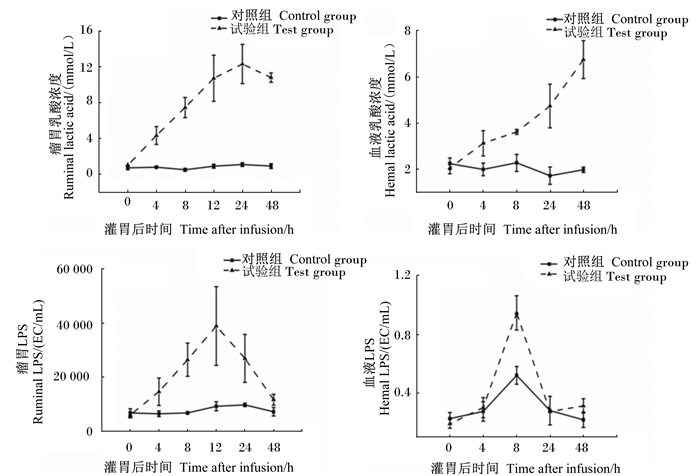
|
图3 急性酸中毒对山羊瘤胃液和血液中乳酸和LPS浓度的影响 Fig. 3 Effects of acute acidosis on concentrations of lactic acid and LPS in ruminal liquid and blood of goats |
由图 4可见,对照组可以明显地看出蹄小叶的组织结构分为初级表皮蹄小叶(primary epidermal lamellae, PEL)、次级表皮蹄小叶(secondary epidermal lamellae, SEL)、次级真皮蹄小叶(secondary dermal lamellae, SDL)和初级真皮蹄小叶(primary dermal lamellae, PDL)。与对照组相比,试验组山羊次级表皮蹄小叶和次级真皮蹄小叶的长度变短,并且形状变得不规则、不对称。
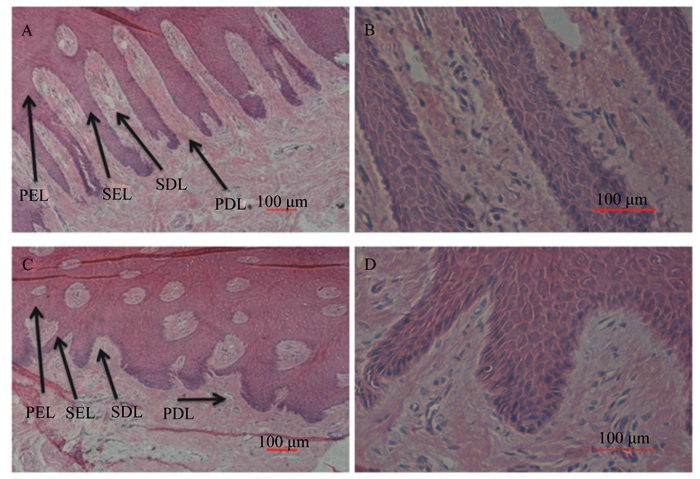
|
PEL:初级表皮蹄小叶primary epidermal lamellae;SEL:次级表皮蹄小叶secondary epidermal lamellae;PDL:初级真皮蹄小叶primary dermal lamellae;SDL:次级真皮蹄小叶secondary dermal lamellae。 A(10×)、B(40×):对照组Control group;C(10×)、D(40×):试验组Test group。 图4 急性酸中毒对山羊表皮蹄小叶和真皮蹄小叶的形态结构的影响 Fig. 4 Effects of acute acidosis on histologic appearance of dermal and epidermal lamellae in hooves of goats |
由表 3可见,与对照组比较,试验组的山羊蹄炎症因子IL-6的mRNA相对表达量显著升高(P < 0.05),但IL-1β和TNF-α的mRNA相对表达量无显著变化(P>0.05)。
|
|
表 3 急性酸中毒对山羊蹄小叶炎症因子mRNA相对表达量的影响 Table 3 Effects of acute acidosis on mRNA relative expression levels of inflammatory cytokines in lamellae of hooves of goats |
由表 4可见,与对照组比较,试验组山羊蹄小叶中的MMP-2、MT1-MMP的mRNA相对表达量均显著升高(P < 0.05),TIMP-1 mRNA相对表达量均显著降低(P < 0.05),而2组间MMP-9的mRNA相对表达量无显著差异(P>0.05)。
|
|
表 4 急性酸中毒对山羊蹄小叶基质金属蛋白酶mRNA相对表达量的影响 Table 4 Effects of acute acidosis on mRNA relative expression levels of matrix metalloproteinases in lamellae of hooves of goats |
本研究通过行为学观察结果发现,在灌注寡果糖后24 h,试验组山羊表现明显跛行行为,结合后序的HE染色观察蹄组织的形态学结果,试验结果显示本试验成功诱发山羊急性蹄叶炎。该结果也为未来深入研究反刍动物蹄叶炎提供了一种低成本的研究方法。
瘤胃酸中毒是反刍动物长期过多饲喂谷类或多糖类词料,导致瘤胃发酵异常产生大量乳酸和有机酸, 临床上是以酸中毒和瘤胃内某些微生物群活性降低为特征的瘤胃消化机能紊乱性疾病。根据瘤胃液pH变化范围, 瘤胃酸中毒又分为急性酸中毒(长期瘤胃液pH < 5.0)和亚急性酸中毒(pH长期在5.0~5.6范围内)[18-19]。本研究中,灌注寡果糖组山羊瘤胃液pH快速下降至5.0以下,并持续约40 h,表明试验组动物发生了急性瘤胃酸中毒。研究显示,急性酸中毒条件下瘤胃牛链球菌生长速度加快,产生大量乳酸,乳酸积累导致瘤胃液pH持续下降[20]。本研究中,试验组灌注寡果糖后瘤胃乳酸浓度持续上升,结果达到预期试验目的,也与上述报道一致。但到24 h后乳酸浓度开始下降,原因可能是碳水化合物被消耗完毕,抑或乳酸利用菌数量逐渐恢复,使乳酸被利用。LPS是革兰氏阴性菌细胞壁外膜的主要成份,我们以前的研究显示,饲喂高谷物饲粮导致瘤胃内LPS浓度增加,瘤胃上皮屏障功能受损[21]。本研究显示,试验组山羊瘤胃液与外周血液中LPS浓度显著升高,说明急性酸中毒导致瘤胃菌群紊乱,LPS浓度升高,同时消化道上皮屏障受损,引发LPS移位,最终致外周血液中LPS浓度显著升高。
对马蹄叶炎的研究结果表明,蹄叶炎条件下马蹄组织中金属蛋白酶活性显著升高。研究显示,金属蛋白酶的酶活性受基因水平的转录、酶原活化和酶活性抑制调节[22]。在转录水平上,前炎症细胞因子白细胞介素-1(IL-1)、IL-6、TNF-α等能诱导和/或刺激金属蛋白酶活性在转录水平上的表达[23-24]。在酶原活化上,金属蛋白酶活性以酶原形式在细胞内合成,并最终被分泌到细胞外,其必须依靠其他酶的激活,其中无活性的MMP-2酶原(ProMMP-2)必须通过游离的MT1-MMP作用,方能形成有活性的MMP-2;MMP-9活化过程为:首先由MT1-MMP激活ProMMP-13成为有活性的MMP-13,MMP-13进而活化ProMMP-9,形成有活性的MMP-9[25]。在酶活抑制上,MMP活性受基质金属蛋白酶组织抑制物(TIMP)的抑制,其基本原理是TIMP通过其氨基酸功能区的半胱氨酸残基与活化MMP的锌离子活性中心相结合以1∶1的比例形成复合体,从而阻断MMP与底物的结合,进而抑制MMP的酶活性。本研究结果显示,与对照组相比,试验组山羊蹄组织中IL-6的mRNA相对表达量显著升高;MMP-2和MT1-MMP的mRNA相对表达量也显著升高,而TIMP-1的mRNA相对表达量显著下降。结合LPS及乳酸的测定结果,本试验结果说明,瘤胃酸中毒下,外周循环中的致炎因子如LPS与乳酸等可能通过炎性因子如IL-6在转录水平上激活金属蛋白酶的表达,同时也可能通过调节MT1-MMP和TIMP-1的转录表达,进而提高MMP的活性,最终导致蹄小叶被降解,蹄组织被破坏,引发蹄叶炎。
4 结论瘤胃灌注寡果糖可以引起山羊急性瘤胃酸中毒,进而导致瘤胃与外周循环中LPS与乳酸浓度增加,这些致炎因子可能通过提高炎症因子的表达,进而影响蹄组织中金属蛋白酶的相对表达,最终破坏蹄小叶的正常结构,诱发急性蹄叶炎。
| [1] |
BICALHO R C, MACHADO V C, CAIXETA L S. Lameness in dairy cattle:a debilitating disease or a disease of debilitated cattle?A cross-sectional study of lameness prevalence and thickness of the digital cushion[J].
Journal of Dairy Science, 2009, 92(7): 3175–3184.
( 0) 0)
|
| [2] |
CHRISTODOULOPOULOS G. Foot lameness in dairy goats[J].
Research in Veterinary Science, 2009, 86(2): 281–284.
( 0) 0)
|
| [3] |
HEYMERING H W. A historical perspective of laminitis[J].
Veterinary Clinics of North America:Equine Practice, 2010, 26(1): 1–11.
( 0) 0)
|
| [4] |
JOHNSON P J, TYAGI S C, KATWA L C, et al. Activation of extracellular matrix metalloproteinases in equine laminitis[J].
Veterinary Record, 1998, 142(15): 392–396.
( 0) 0)
|
| [5] |
KYAW-TANNER M, POLLITT C. Equine laminitis:increased transcription of matrix metalloproteinase-2 (MMP-2) occurs during the developmental phase[J].
Equine Veterinary Journal, 2004, 36(3): 221–225.
( 0) 0)
|
| [6] |
LOFTUS J P, BELKNAP J K, BLACK S J. Matrix metalloproteinase-9 in laminae of black walnut extract treated horses correlates with neutrophil abundance[J].
Veterinary Immunology and Immunopathology, 2006, 113(3/4): 267–276.
( 0) 0)
|
| [7] |
MUNGALL B A, POLLITT C C. Zymographic analysis of equine laminitis[J].
Histochemistry and Cell Biology, 1999, 112(6): 467–472.
( 0) 0)
|
| [8] |
MALEMUD C J. Matrix metalloproteinases (MMPs) in health and disease:an overview[J].
Frontiers in Bioscience:A Journal and Virtual Library, 2006, 11: 1696–1701.
( 0) 0)
|
| [9] |
中华人民共和国农业部.NY/T 816-2004肉羊饲养标准[S].北京:中国农业出版社, 2004.
( 0) 0)
|
| [10] |
熊本海, 庞之洪, 赵峰, 等. 中国饲料成分及营养价值表(2014年第25版)制订说明[J].
中国饲料, 2014(21): 29–39.
( 0) 0)
|
| [11] |
POLLITT C C. Basement membrane pathology:a feature of acute equine laminitis[J].
Equine Veterinary Journal, 1996, 28(1): 38–46.
( 0) 0)
|
| [12] |
JOHNSON P J, KREEGER J M, KEELER M, et al. Serum markers of lamellar basement membrane degradation and lamellar histopathological changes in horses affected with laminitis[J].
Equine Veterinary Journal, 2000, 32(6): 462–468.
( 0) 0)
|
| [13] |
QIN W L. Determ naton of rumen volatile fatty acids by means of gas chromatography[J].
南京农业大学学报, 1982, 4: 110–116.
( 0) 0)
|
| [14] |
张龙翔, 张庭芳, 李令媛.
生化实验方法和技术[M]. 北京: 人民教育出版社, 1981 .
( 0) 0)
|
| [15] |
KHAFIPOUR E, KRAUSE D O, PLAIZIER J C. A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J].
Journal of Dairy Science, 2009, 92(3): 1060–1070.
( 0) 0)
|
| [16] |
CHOMCZYNSKI P, SACCHI N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction[J].
Analytical Biochemistry, 1987, 162(1): 156–159.
( 0) 0)
|
| [17] |
LIU J H, XU T T, LIU Y J, et al. A high-grain diet causes massive disruption of ruminal epithelial tight junctions in goats[J].
American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2013, 305(3): R232–R241.
( 0) 0)
|
| [18] |
OWENS F N, SECRIST D S, HILL W J, et al. Acidosis in cattle:a review[J].
Journal of Animal Science, 1998, 76(1): 275–286.
( 0) 0)
|
| [19] |
KRAUSE K M, OETZEL G R. Understanding and preventing subacute ruminal acidosis in dairy herds:a review[J].
Animal Feed Science and Technology, 2006, 126(3/4): 215–236.
( 0) 0)
|
| [20] |
刘丹, 吴跃明, 陈建海. 反刍动物瘤胃酸中毒及其防治研究进展[J].
中国饲料, 2004(4): 8–10.
( 0) 0)
|
| [21] |
张瑞阳, 王东升, 朱伟云, 等. 奶牛静脉血内毒素浓度及其与产奶量的相关性[J].
动物营养学报, 2012, 24(5): 822–827.
( 0) 0)
|
| [22] |
PIPERI C, PAPAVASSILIOU A G. Molecular mechanisms regulating matrix metalloproteinases[J].
Current Topics in Medicinal Chemistry, 2012, 12(10): 1095–1112.
( 0) 0)
|
| [23] |
SIWIK D A, CHANG D L F, COLUCCI W S. Interleukin-1βand tumor necrosis factor-αdecrease collagen synthesis and increase matrix metalloproteinase activity in cardiac fibroblasts in vitro[J].
Circulation Research, 2000, 86(12): 1259–1265.
( 0) 0)
|
| [24] |
NEE L E, MCMORROW T, CAMPBELL E, et al. TNF-αand IL-1β-mediated regulation of MMP-9 and TIMP-1 in renal proximal tubular cells[J].
Kidney International, 2004, 66(4): 1376–1386.
( 0) 0)
|
| [25] |
TOTH M, CHVYRKOVA I, BERNARDO M M, et al. Pro-MMP-9 activation by the MT1-MMP/MMP-2 axis and MMP-3:role of TIMP-2 and plasma membranes[J].
Biochemical and Biophysical Research Communications, 2003, 308(2): 386–395.
( 0) 0)
|




