微量元素可以分为必需微量元素与非必需微量元素两类,它们都是动物必需的营养素,具有不可替代的生理生化作用。微量元素在动物体内含量虽少,却直接或间接地参与机体几乎所有的生理和生化过程。锌是大多数动物所必需的一种微量元素,有“生命元素”之称[1-2],在机体内具有广泛的生理生化功能:1)参与蛋白质代谢。锌是许多酶的组成成分或激活剂,如碳酸酐酶、羧肽酶、碱性磷酸酶(alkaline phosphatase,AKP)、乳酸脱氢酶等,到20世纪90年代,已发现的含锌酶有250多种,在生物体内,其通过碳酸酐酶、乳酸脱氢酶、谷氨酸脱氢酶、DNA聚合酶等多种酶类参与能量代谢、蛋白质合成、氧化还原等生化代谢过程。2)参与免疫调节。锌具有调节机体抗氧化和免疫等重要功能,当锌缺乏时,会降低机体的免疫功能和对疾病抵抗的能力[3-4]。因此,研究人工配合饲料配方中锌的最适含量具有重要意义。
方格星虫,俗称沙虫,是广西特色经济海产品之一,它具有高蛋白质、低脂肪且营养丰富等特点,深受广大消费者的追捧[5-6]。目前在饲料与营养方面,已有关于方格星虫稚虫蛋白质、脂肪、糖及微量元素铁、锰、硒等适宜需求量的相关研究[7-12],为补充健全方格星虫对人工配合饲料中微量元素锌最适需求量的研究也必不可少。因此,本文开展了锌对方格星虫生长、体成分、体腔液中锌含量以及AKP活性的研究,为实现规模化养殖方格星虫的人工配合饲料配方的完善提供理论基础。
1 材料与方法 1.1 试验饲料制作饲料之前,分别对各原料进行粗蛋白质、 粗脂肪含量以及总能进行测定,作为制订和调整饲料配方的依据,试验饲料组成及营养水平见表 1。以蛋氨酸锌(锌含量为19%)为锌源,试验饲料蛋氨酸锌的添加量分别为0、105.25、210.55、421.05、842.10、1 684.20 mg/kg(干物质基础),换算为锌的添加量则分别为0、20、40、80、160、320 mg/kg(干物质基础),实测锌含量分别为9.3、31.7、49.9、90.1、168.6和326.5 mg/kg(干物质基础)。试验饲料制作加工过程参照Blair等[13]介绍的方法。先将主要原料粉碎过200目筛,按照添加量的多少从低至高逐级称重并混合均匀,与鱼油搓匀之后再加少量水搓匀,烘干粉碎制成过150目筛的微颗粒饲料,装袋标号备用。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
饲料制作完毕之后进入养殖试验阶段,养殖时间为2013年8—10月,养殖周期为8周。选用相同规格的18个水槽(65 cm×55 cm×45 cm),在水槽的底部均匀地铺设一薄层(3~4 cm厚)经淡水彻底清洗消毒并经海水浸泡1 d的细沙,加水深约20 cm,此为方格星虫稚虫的栖息地。选用健康无病、同一批苗种的方格星虫稚虫7 200条,平均体重为(14.54±0.10) mg,自然状态下体长在1.17~1.65 cm,以400条为1个重复,3个重复为1组,随机分为6组,分别饲喂6种锌含量不同的人工微颗粒饲料。投喂方法为过量投喂,即保证沙子表面有少量未食用完全的饲料。饲养采用自然光照周期,24 h连续微充氧,水温维持在26~30 ℃,盐度维持在18~22,溶解氧浓度大于5.0 mg/L。
1.3 指标测定饲养阶段结束后,将稚星虫转移至海水深为10 cm左右的无沙水槽中停食吐沙2~3 d,之后收集各水槽内的稚星虫并称重,同时记录稚星虫的成活条数,计算各组的成活率。
成活率(survival rate,SR,%)=100×Nt/N0;
增重率(weight gain rate,WGR,%)=100×(Wt-W0)/W0;
特定生长率(specific gain rate,SGR,%/d)=100×(lnWt-lnW0)/t。
式中:N0为初始条数;Nt为终末条数;W0为初始体重;Wt为终末体重;t为试验天数。
采用AOAC(1995)的方法测定稚星虫的体成分和饲料常规成分。采用105 ℃烘箱中烘干至恒重法测定水分含量,凯氏定氮法(Kjeltec 8400,瑞典)测定粗蛋白质含量,索氏抽提法(Soxtec 2050,瑞士)测定粗脂肪含量,以及550 ℃马福炉中灼烧12 h法测定粗灰分含量。稚星虫体腔液AKP活性采用南京建成生物工程研究所研制的试剂盒测定,酶活力用比活力(U/mg prot)表示。采用GB 13885—2003方法进行体腔液中锌含量的测定。
1.4 统计分析采用SPSS 19.0对所得数据进行方差分析,若差异达到显著水平,则进行Tukey’s多重比较,显著性水平为P<0.05。
2 结果与分析 2.1 饲料锌含量对方格星虫稚虫生长性能的影响由表 2可知,各组稚星虫的SR介于63.83%~85.50%,其中9.3与326.5 mg/kg锌组的SR均较低,且显著低于其余各组(P<0.05),说明锌含量过低或过高都对稚星虫的SR产生不利影响。随着饲料中锌含量的提高,稚星虫的WGR和SGR均呈先上升后下降的趋势,其中9.3与326.5 mg/kg锌组无显著差异(P>0.05),但均显著低于其他各组(P<0.05)。饲料锌含量为31.7、49.9、90.1和168.6 mg/kg的4个组,其SR、WGR和SGR均无显著差异(P>0.05)。
|
|
表 2 饲料锌含量对方格星虫稚星虫生长性能的影响 Table 2 Effects of dietary zinc content on growth performance of juvenile peanut worm, Sipunculus nudus Linnaeus |
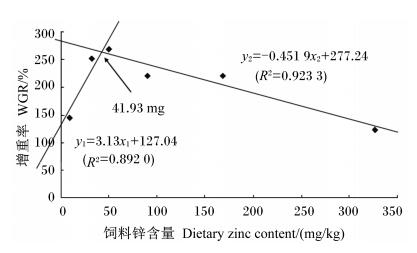
通过线性回归分析(图 1),以锌含量41.93 mg/kg为界,WGR(y1)可与饲料锌含量(x1,9.3、31.7和49.9 mg/kg)形成线性关系,其方程为y1=3.13x1+127.04(R2=0.892 0);此外,WGR(y2)与饲料锌含量(x2,31.7、49.9、90.1、168.6和326.5 mg/kg)形成线性关系,其方程为y2=-0.451 9x2+277.24(R2=0.923 3)。如图 1所示,当两线交汇可求出WGR最大(258.29%)时的饲料锌含量为41.93 mg/kg。
2.2 饲料锌含量对方格星虫稚虫体成分的影响由表 3可知,饲料锌含量对虫体粗脂肪和粗灰分含量有显著影响(P<0.05)。随着饲料锌含量 的提高,虫体粗脂肪含量呈现先上升后下降的趋势,当饲料锌含量达到90.1 mg/kg时,其虫体粗脂肪含量最大,为2.85%,并显著高于锌含量为326.5 mg/kg的组(P<0.05)。虫体粗灰分含量随着饲料锌含量的提高呈先下降后上升的趋势,当饲料锌含量为9.3 mg/kg时,虫体的粗灰分含量最高,其次是饲料锌含量为326.5 mg/kg时,且这2组的虫体粗灰分含量均显著高于其余各组(P<0.05),其他各组之间无显著差异(P>0.05)。虫体水分含量介于73.74%~74.53%,粗蛋白质含量介于60.46%~63.27%,各组之间无显著差异(P>0.05)。
|
图1 饲料锌含量与方格星虫稚虫的WGR之间的回归分析 Fig. 1 Regression analysis between dietary zinc content and WGR of juvenile peanut worm, Sipunculus nudus Linnaeus |
|
|
表 3 饲料锌含量对方格星虫稚虫体成分的影响 Table 3 Effects of dietary zinc content on body composition of juvenile peanut worm, Sipunculus nudus Linnaeus |
由表 4可知,随着饲料锌含量的提高,虫体的体腔液锌含量呈上升趋势。当饲料锌含量为9.3 mg/kg时,其体腔液锌含量最低,为11.32 mg/L,显著低于锌含量为90.1、168.6和326.5 mg/kg时(P<0.05);当饲料锌含量为326.5 mg/kg时,其体腔液锌含量最高,且显著高于其余各组(P<0.05)。而虫体的体腔液中AKP活性则随着饲料锌含量的提高而呈先上升后趋于稳定的趋势。当饲料锌含量为9.3 mg/kg时,虫体的体腔液中AKP活性最低,其次为锌含量为31.7 mg/kg时,上述2组均显著低于其余各组(P<0.05)。
|
|
表 4 饲料锌含量对方格星虫稚虫体腔液锌含量及AKP活性的影响 Table 4 Effects of dietary zinc content on coelomic fluid zinc content and AKP activity of juvenile peanut worm, Sipunculus nudus Linnaeus |
锌是细胞内最为丰富的微量元素,是多种酶的组成成分或激活剂,为生命不可或缺的必需微量元素之一[1]。饲料中添加的锌主要为2种形式,一种是无机锌,如ZnSO4、Zn(NO3)2、ZnCl2等,有研究表明,虹鳟(Oncorhynchus mykiss)对三者的利用率逐步降低[14];另一种是有机锌,通常为氨基酸螯合盐,如蛋氨酸锌,与氨基酸螯合后的锌能够利用肠道中的氨基酸吸收通道进行吸收利用,从而避免了在矿物质吸收通道中与其他微量元素的竞争和拮抗作用[12]。在斑点叉尾 (Ictalurus punctatus)的研究中发现,有机锌的利用率要远高于无机锌的利用率,精制饲料中添加蛋氨酸锌比添加硫酸锌的利用率高3~5倍[15]。因此,本试验选择蛋氨酸锌为锌源,添加进饲料中投喂方格星虫稚虫。
据前人的研究报道,水产动物对锌的需求有一个适宜的范围,饲料中锌含量过高或过低都将影响其生长发育[16-17]。乔永刚[18]在军曹鱼(Rachycentron canadum)的研究中发现WGR受到饲料中锌含量的影响,以蛋氨酸锌为锌源时,随着饲料中锌添加水平的上升,军曹鱼的WGR先上升后下降,以WGR为衡量指标,军曹鱼饲料中最适锌含量为41.7 mg/kg。另外,吴红岩等[16]在奥尼罗非鱼(Oreochromis niloticus×O. aureus)的研究中也发现,其WGR同样随着饲料中锌添加水平的上升先升后降,饲料锌添加水平为5~10 mg/kg时,鱼体的生长速度较快,并能增强鱼体的抗氧化能力。本试验的结果与上述研究相似,饲料中锌不足(饲料锌含量为9.3 mg/kg)时,方格星虫稚虫的WGR与SGR均较低。在饲料中添加蛋氨酸锌之后,方格星虫的生长状况得到明显改善,证明蛋氨酸锌能被方格星虫稚虫吸收利用。而持续增加饲料中蛋氨酸锌的添加量,使锌含量达到326.5 mg/kg时,其WGR与SGR却出现显著下降。从各组的数据来看,饲料锌含量为9.3 mg/kg与饲料锌含量为326.5 mg/kg的2组,其WGR与SGR均显著低于其余各组,这说明锌虽是方格星虫稚虫生长与发育所必需的一类微量元素,在饲料中必须添加足够的锌来满足方格星虫稚虫生长的需求,但方格星虫稚虫对锌的需要存在一个适宜剂量范围。在这个范围内,锌对生长起积极的作用;当饲料中锌含量过低时,可能会导致方格星虫吸收的锌过少,不能满足生长发育的需要;而饲料中锌含量过高时,一方面有可能导致矿物质之间发生拮抗作用,抑制方格星虫稚虫对铁和铜的吸收利用[12, 19-20];另一方面,方格星虫稚虫吸收了过量的锌,可能会影响虫体机能,产生一些不良反应,阻碍其对饲料营养物质的吸收[18],但是具体影响机制还有待进一步研究。
而在另一些水产动物,如大黄鱼(Pseudosciaena crocea)幼鱼[21]、鲈鱼(Lateolabrax japonicus)[22]、方斑东风螺(Babylonia areolate)[4]、日本沼虾(Macrobrachium nipponense)[23]等的研究中发现,随着饲料锌含量的上升,其WGR先呈上升的趋势,超出最适锌含量之后,与方格星虫稚虫的试验结果不同,WGR并未下降而是趋于平稳。
此外,本试验的SR较低,介于63.83%~85.50%,推测其原因除与饲料锌含量有关之外,还可能与本试验使用的是精制饲料,影响了方格星虫稚虫的适口性有关。
3.2 饲料锌含量对方格星虫稚虫体成分的影响在本试验中,随着饲料锌含量的提高,方格星虫稚虫虫体水分与粗蛋白质含量没有显著变化,与在军曹鱼[18]、大黄鱼[21]、鲈鱼[22]、方斑东风螺[4]等上的研究结果类似。饲料锌含量对方格星虫稚虫虫体粗脂肪和粗灰分含量有显著影响。饲料锌含量为326.5 mg/kg时,其粗灰分含量较高,同时其粗脂肪含量最低,推测原因可能是饲料锌含量过高使得方格星虫稚虫的生长发育受到抑制,各种营养物质代谢出现异常。饲喂不添加蛋氨酸锌的组同样拥有较高的粗灰分含量和较低的粗脂肪含量,推测原因可能为饲料锌含量过低满足不了方格星虫稚虫生长发育的需求,从而影响了其营养物质代谢[18]。饲料锌含量对方格星虫稚虫体成分影响的具体机制还有待进一步研究。
3.3 饲料锌含量对方格星虫稚虫体腔液锌含量及AKP活性的影响在矿物质的研究中,水产动物机体组织的矿物质含量是评价其对该种矿物质需求量的重要指标[17, 24-25]。崔立娇等[17]在星斑川鲽的研究中发现,随着饲料锌含量的增加,全鱼和脊椎中锌含量呈持续上升的趋势,其中饲料锌含量过低或者过高都会对全鱼和脊椎中锌含量产生较大影响。乔永刚[18]在军曹鱼幼鱼的研究中发现,饲料锌含量对其血清锌含量影响显著,饲料锌含量过高(328.2 mg/kg)组的血清锌含量显著高于饲料锌含量低(13.2、36.6、52.5 mg/kg)的各试验组。郭建林等[23]报道,随着饲料锌含量的增加,日本沼虾甲壳和全虾锌含量逐渐上升,并在锌含量为36.89 mg/kg的组达到最大值后趋于平稳;肝胰脏锌含量则在锌含量为33.00 mg/kg的组达到最大值后趋于平稳;而肌肉锌含量则相对较低并维持平稳。张佳明等[21]分别测定了大黄鱼脊椎骨、鱼体、血清以及肝脏中的锌含量,除肝脏外,其余各组织都随着饲料锌含量的增加而上升,并逐渐趋于稳定。
本试验结果与上述研究结果类似,饲喂基础饲料的方格星虫稚虫体腔液锌含量最低,随着饲料锌含量的增加,体腔液锌含量持续上升,在饲料锌含量为31.7~168.4 mg/kg时较为平稳,但是再继续升高饲料锌含量则使其体腔液锌含量显著增大。造成这种结果的原因可能是,蛋氨酸锌能被方格星虫稚虫吸收利用并在体腔液中富集,但是饲料中过高的锌含量会导致方格星虫稚虫的营养代谢发生紊乱,使得体腔液中锌含量过高而影响生长。
AKP属于同源二聚体蛋白,是一种能够将对应底物去磷酸化的酶,即通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基,其底物包括核酸、蛋白、生物碱等,专一性较低。AKP是生物体内一种含锌的重要代谢调控酶,能够较真实地反映养殖动物锌的营养状况[24]。在本试验中,随着饲料锌含量的不断上升,方格星虫稚虫体腔液锌含量也不断上升,但体腔液中AKP的活性却并非如此。经测定,体腔液中AKP活性呈先上升后趋于平稳的趋势,当饲料锌含量为9.3 mg/kg时,其AKP的活性最低,为5.61 U/mg prot,其次为锌含量为31.7 mg/kg时,这2组的体腔液AKP活性均显著低于其余各组。当饲料锌含量上升至49.9 mg/kg时,体腔液AKP活性最高,之后再添加锌,AKP的活性不再上升,饲料锌含量为49.9~326.5 mg/kg的各组之间差异不显著。在斑点叉尾 [26]、虹鳟[27]、方斑东风螺[4]和军曹鱼[18]的研究中也观察到AKP的活性在达到一定水平时趋于稳定。本试验在饲料锌含量较低时体腔液中AKP活性低的可能原因是方格星虫稚虫体内缺锌导致AKP合成不足;而当饲料中锌含量为49.9 mg/kg时,体腔液中AKP活性达到最高,之后再继续添加锌,AKP的活性不再有显著变化,可能原因在于AKP活性受机体调控,并不会随着体内锌含量的持续增加而增高,但具体调控机制还有待进一步的研究证明。
4 结论饲料中适宜含量的锌对方格星虫稚虫的WGR与SGR都极为有利,锌含量过高或过低的则会对方格星虫稚虫的生长起抑制作用,以WGR为评价指标,方格星虫稚虫饲料中适宜锌含量为41.93 mg/kg。
| [1] |
曹振杰, 王兰明, 董文, 等. 鱼虾类微量元素的需要量及其营养生理探讨[J].
黑龙江水产, 2006(4): 40–42.
( 0) 0)
|
| [2] |
陈琴, 程光平. 鱼虾类对微量矿物元素的需要[J].
中国饲料, 2001(20): 20–22.
( 0) 0)
|
| [3] |
王则民. 元素的生物选择规律[J].
自然杂志, 1997, 19(1): 47–49.
( 0) 0)
|
| [4] |
杨原志, 吴业阳, 董晓慧, 等. 方斑东风螺饲料中锌需要量的研究[J].
动物营养学报, 2013, 25(3): 643–650.
( 0) 0)
|
| [5] |
李凤鲁, 孔庆兰, 史贵田, 等. 中国沿海方格星虫属(星虫动物门)的研究[J].
青岛海洋大学学报, 1990, 20(1): 93–99.
( 0) 0)
|
| [6] |
张桂和, 李理, 赵谋明, 等. 方格星虫营养成分分析及抗疲劳作用研究[J].
营养学报, 2008, 30(3): 318–320.
( 0) 0)
|
| [7] |
张琴, 童万平, 董兰芳, 等. 饲料中脂肪水平对方格星虫稚虫生长性能、体组成及消化酶活性的影响[J].
渔业科学进展, 2011, 32(6): 99–106.
( 0) 0)
|
| [8] |
张琴, 童万平, 董兰芳, 等. 饲料蛋白水平对方格星虫稚虫生长和体组成的影响[J].
渔业科学进展, 2012, 33(1): 86–92.
( 0) 0)
|
| [9] |
许明珠, 张琴, 童万平, 等. 饲料糖水平对方格星虫稚虫生长、体组成和消化酶活性的影响[J].
动物营养学报, 2013, 25(3): 534–542.
( 0) 0)
|
| [10] |
许明珠, 张琴, 童潼, 等. 饲料中硒含量对方格星虫稚虫生长、体成分、组织硒含量及相关酶活性的影响[J].
动物营养学报, 2015, 27(6): 1733–1739.
( 0) 0)
|
| [11] |
许明珠, 张琴, 童潼, 等. 饲料铁水平对方格星虫稚虫生长性能、体成分、酶活性及组织铁含量的影响[J].
动物营养学报, 2014, 26(11): 3325–3331.
( 0) 0)
|
| [12] |
许明珠, 张琴, 童潼, 等. 饲料中锰含量对方格星虫稚虫生长性能、体成分、体腔液中锰超氧化物歧化酶活性及组织锰含量的影响[J].
动物营养学报, 2015, 27(10): 3077–3083.
( 0) 0)
|
| [13] |
BLAIR T, CASTELL J, NEIL S, et al. Evaluation of microdiets versus live feeds on growth,survival and fatty acid composition of larval haddock (Melanogrammus aeglefinus)[J].
Aquaculture, 2003, 225(1/2/3/4): 451–461.
( 0) 0)
|
| [14] |
佐藤秀一. 虹鳟对白鱼粉中的锌以及几种锌化合物的利用[J].
日本水产学会, 1987, 53(4): 63–65.
( 0) 0)
|
| [15] |
PARIPATANANONT T, LOVELL R T. Chelated zinc reduces the dietary zinc requirement of channel catfish,Ictalurus punetatus[J].
Aquaculture, 1995, 133(1): 73–82.
( 0) 0)
|
| [16] |
吴红岩, 陈孝煊, 阳会军, 等. 饲料中添加蛋氨酸锌对奥尼罗非鱼幼鱼生长和抗氧化功能的影响[J].
淡水渔业, 2007, 37(6): 28–32.
( 0) 0)
|
| [17] |
崔立娇, 张利民, 王际英, 等. 饲料锌水平对星斑川鲽幼鱼生长、组织积累和抗氧化功能的影响[J].
水产学报, 2010, 34(9): 1420–1428.
( 0) 0)
|
| [18] |
乔永刚.军曹鱼微量元素锌、铁、铜营养生理的研究[D].硕士学位论文.青岛:中国海洋大学,2007.
( 0) 0)
|
| [19] |
南旭阳. Cu2+对鲫鱼体内Zn2+和血红蛋白含量影响[J].
中国公共卫生, 2006, 22(1): 62–63.
( 0) 0)
|
| [20] |
HILTON J W. The interaction of vitamins,minerals and diet composition in the diet of fish[J].
Aquaculture, 1989, 79(1/2/3/4): 223–224.
( 0) 0)
|
| [21] |
张佳明, 艾庆辉, 麦康森, 等. 大黄鱼幼鱼对饲料中的锌需要量[J].
水产学报, 2008, 32(3): 417–424.
( 0) 0)
|
| [22] |
张佳明.鲈鱼和大黄鱼微量元素-锌、铁的营养生理研究[D].硕士学位论文.青岛:中国海洋大学,2007.
( 0) 0)
|
| [23] |
郭建林, 陈建明, 孙丽慧, 等. 日本沼虾幼虾对饲料中锌的需求量[J].
动物营养学报, 2013, 25(3): 661–668.
( 0) 0)
|
| [24] |
徐志雄, 董晓慧, 刘楚吾. 军曹鱼幼鱼日粮锌最适添加量的研究[J].
水产科学, 2007, 26(3): 138–141.
( 0) 0)
|
| [25] |
魏万权, 李爱杰, 李德尚. 饲料中添加锌对牙鲆生长和生化指标的影响[J].
青岛海洋大学学报, 1999, 29(1): 60–66.
( 0) 0)
|
| [26] |
GATLIN Ⅲ D M, WILSON R P. Dietary zinc requirement of fingerling channel catfish[J].
The Journal of Nutrition, 1983, 113(3): 630–635.
( 0) 0)
|
| [27] |
APINES M J, SATOH S, KIRON V, et al. Bioavailability of amino acids chelated and glass embedded zinc to rainbow trout,Oncorhynchus mykiss,fingerlings[J].
Aquaculture Nutrition, 2001, 7(4): 221–228.
( 0) 0)
|




