2. 吉林东鳌鹿业有限公司, 长春科技学院, 长春 130600
2. Jilin Dongao Deer Production Biotechnology Co., Ltd., Changchun Sci-Tech University, Changchun 130600 China
鹿茸是公认的自然界唯一能够完全再生的哺乳动物器官,也是生长最快的动物组织之一。鹿茸的发生和再生具有季节性,每年再生1次。鹿茸的发生开始于春季,角柄自鹿头部额外脊处开始发育,当角柄发育完成后,初角茸自角柄的尖部开始形成;夏季,初角茸快速发育;秋季,初角茸骨化。第2年春季,初角茸自角柄脱落,鹿茸再生开始,再生的鹿茸称为再生茸;夏季,再生茸快速发育;秋季,再生茸骨化。来年春季,再生茸脱落,起始新一轮的鹿茸再生。初角茸和再生茸是临时性,而角柄是永久性的。
鹿茸的发生和再生受激素的严格调控[1-5],但营养因素是也能够影响鹿茸是否按时发生,是否按照周期进入再生程序的关键因素。了解鹿茸发生和再生过程中的调节因素以及营养因素的调节途径,有助于从源头认识鹿茸发生发育规律,为从营养供给的角度调节鹿茸发育,提高鹿茸产量和性能提供理论依据。
1 鹿茸发生过程的营养调控鹿茸发生来源于生茸区骨膜(antlerogenic periosteum, AP)。对大多数鹿种来说,当鹿进入青春期(赤鹿为5~7月龄),生茸区骨膜开始逐步发育形成角柄,角柄顶端进而发育成初角茸。除性激素以外,角柄和初角茸的发生还受营养因素的严格控制。
1.1 营养与角柄发育的关系青春期是角柄开始发育的特定时期。角柄发育起始信号的激活需要满足2个条件[1]:一是进入青春期,随着血浆睾酮水平上升而启动发育[2-5];二是雄性仔鹿的体重需达到特定的体重阈值[6-7],本文将这一特定的体重阈值称为“角柄发生体重阈值”。
鹿个体达到其特异的角柄发生体重阈值的时间点主要取决于其营养状况。营养条件好的赤鹿雄性仔鹿达到角柄发生体重阈值的时间较早,角柄发生的时间也较早[8]。反之,在恶劣的营养条件下生活的鹿,达到角柄发生体重阈值的时间将会推迟,从而角柄的发生时间会推迟。例如:赤鹿雄性仔鹿在限饲条件下,即饲喂正常需要量的70%的饲料,则角柄的发生时间较自由采食的个体推迟12周,但是一旦限饲条件的个体达到其角柄发生体重阈值,角柄随即发生[7]。营养得不到满足的情况下,有些鹿种的角柄发生时间甚至推迟1年或者更长时间[9]。例如:雄性无茸的赤鹿称之为Hummel,是由于营养不良不能生成角柄或者角柄发育不全,从而不具备生茸能力[1]。角柄发生的起始来源于AP组织细胞层的增殖。Li等[10]通过对赤鹿AP组织的结构进行系统研究,发现AP组织的厚度和组织内细胞的密度与鹿的营养状况有关,营养条件好的鹿,其AP组织的厚度大且组织内细胞的密度高。在角柄发生前期,通过AP的组织学对比,发现正常赤鹿雄性仔鹿AP组织的厚度比雄性无茸赤鹿的大,尤其是细胞层差异极为显著[1]。以上研究结果说明,恶劣的营养条件限制了AP组织细胞的增殖,而角柄发生体重阈值正是鹿体营养水平的衡量指标。一旦鹿体重达到角柄发生体重阈值,AP组织内细胞开始增殖,角柄开始发育,这也是解释角柄发生为何需要达到角柄发生体重阈值的生理机理。
1.2 角柄发生体重阈值具有种属特异性和地域性同一地区不同鹿种的角柄发生体重阈值不同,生活在不同区域的同一鹿种也有一定的差异。在角柄发生体重阈值方面研究最为详细的鹿种是赤鹿。这主要由于赤鹿是世界上分布最广泛的鹿种之一,而且不同地区的赤鹿平均体重差异较大[11]。不同地区的试验得出的赤鹿的角柄发生体重阈值不同,目前已知在41~56 kg之间[6-7]。苏格兰赤鹿是世界上体型最小的赤鹿,它的平均体重为100 kg[8, 11]。从遗传因素来说,苏格兰赤鹿与其他地区的赤鹿一样,具有形成更大体型的潜力。但是由于当地草地植被贫瘠、食物匮乏,使其幼龄期机体发育受限,因而无法达到该物种遗传力能达到的体重值潜力[8]。因此,生活在该地区的赤鹿的角柄发生体重阈值也最小,仅为41 kg[7]。Fennessy等[6]试验确定新西兰赤鹿的角柄发生体重阈值为56 kg,是目前已知的角柄发生体重阈值最大的赤鹿。
赤鹿的平均体重呈现地域性的差异,主要是受地域性营养因素(地理环境、自然条件不同造成食物的区域性差异)的影响[11]。因此,本文推测角柄发生体重阈值与该地区成年鹿的平均体重有关。如果推测成立,本文建议采用“角柄发生值”(该地区角柄发生体重阈值的试验值与平均体重的比值)来衡量某鹿种角柄发生与体重的关系,来屏蔽角柄发生体重阈值的地域性差异。例如:苏格兰赤鹿的角柄发生值为0.41(41/100),那么新西兰赤鹿的角柄发生值也应该为0.41(56/X),也由此推断该地区赤鹿的平均体重的理论值应该为136 kg。“角柄发生值”描述是否非常准确,能否准确地用来评价角柄发生与体重的关系,还需要大量的试验验证和大样本统计学分析。
角柄发生体重阈值的存在,说明鹿机体系统通过识别自身体重来判断自身是否已经获得了足够的营养物质,用以支撑角柄和初角茸的发育。相比鹿茸发育来说,机体的发育具有优先权[8]。鹿如果生活在较差的营养条件下,其体重在达到角柄发生体重阈值之前,摄取的营养物质全部应用于机体发育和维持代谢,直到体重达到角柄发生体重阈值之后,才能将富于部分的营养物质用于角柄发育。用于角柄发育的营养物质最终作用于AP组织内细胞,启动细胞的增殖,AP组织开始增厚,标志着角柄发育的开始[12]。而鹿如果生活在充足的营养条件下,青春期前即能顺利达到角柄发生体重阈值,AP组织内细胞获得足够的营养物质,角柄在正常的时间点开始发育。
1.3 营养与初角茸发育的关系角柄长度达到种的特异性高度(赤鹿为5~6 cm,驯鹿约为3.5 cm)[6, 13]时,顶端开始发生初角茸。本文将“初角茸开始形成时的种属特异性的角柄长度”称为“初角茸发生角柄长度阈值”,简称“角柄长度阈值”。
与角柄发生一样,初角茸的发生时间同样受到营养水平的约束。如果角柄发生延迟,初角茸的发生也必然会延迟[6]。如果营养条件适宜,雄性仔鹿初角茸能够在角柄生长结束时发生;但营养水平低的情况下,由于角柄发育的延迟,初角茸的发生将被推迟。例如:营养条件得不到满足的赤鹿雄性仔鹿,由于不能形成完整的角柄,其初角茸的发生可能推迟到2~3岁[1, 9]。Suttie等[8]对苏格兰赤鹿雄性仔鹿进行不同营养水平的饲喂试验,发现高营养组(FWH)的仔鹿初角茸发生较低营养组(FWL)早(达到角柄长度阈值时间较早),生长速度更快,脱皮时重量更大(表 1);此外,高营养组还出现了初角茸的分枝现象(表 2),这说明营养因素不仅影响了初角茸的发生时间,而且能够影响初角茸的分枝状况,因为对绝大多数鹿种来说,初角茸并不分枝。
|
|
表 1 冬季营养状况对苏格兰赤鹿雄性仔鹿的体重和脱皮时茸重的影响 Table 1 Effects of nutritional status on body weight and antler weight when peeling of Scotland young male red deer in winter[8] |
|
|
表 2 冬季营养状况对赤鹿雄性仔鹿鹿茸发育的影响 Table 2 Effects of nutritional status on antler development of Scotland young male red deer in winter[8] |
营养因素控制着鹿茸的发生过程,然而营养因素如何调节鹿茸的再生过程相关研究较少,已有的研究多关注的是营养因素如何调节鹿茸发生过程,以及营养因素调控鹿茸生长发育以及鹿茸结构和组成成分,主要原因有2个方面:一是鹿科动物是唯一生长骨质角的动物,鹿茸再生与营养因素关系的研究数据无法借鉴其他动物方面的研究;二是鹿茸是整个机体的一部分,很难将其新陈代谢从鹿体的新陈代谢中脱离出来单独分析[14-15]。现有的研究结果证实,与鹿茸发生不同,营养因素对鹿茸再生的影响主要体现在鹿茸的生长速度方面,而对鹿茸再生周期影响不大。Suttie等[7]发现雄性赤鹿再生茸的生理周期与光照关系密切,而不受体重的严格限制。Fennessy等[6]对2周岁雄性赤鹿进行冬季(正处于鹿角发育期)低蛋白质饲粮饲喂,发现鹿茸和鹿角的重量均比高蛋白质组低(表 3);对4周岁雄性赤鹿于再生茸发育开始的65 d内饲喂不同营养水平的饲粮,发现低营养组鹿茸的生长速度较低(表 4)。上述试验结果说明营养因素影响再生茸的生长速度。
|
|
表 3 冬季饲喂低蛋白质饲粮对2周岁雄性赤鹿鹿茸和第2年脱落鹿角重的影响 Table 3 Effects of feeding low protein diet on antler weigh and falling off antler weight in the next year of 2-year-old male red deer (n=8)[6] |
|
|
表 4 4周岁雄性赤鹿再生茸发育开始的65 d内不同营养水平对鹿茸重的影响 Table 4 Effects of different nutrient levels in the first 65 days of antler regeneration on antler weight of 4-year-old male red deer (n=5)[6] |
关于营养因素对鹿茸发生和再生影响的差异,或许从进化的角度分析比较容易理解。对鹿茸发生来说,雄性仔鹿处于青春期,首要生理任务是发育身体,这是保证个体在自然界存活的先决条件。当营养条件不具备时,有限的营养主要供应于机体发育。只有在机体发育的生理需求获得满足后,额外的营养物质才能用以启动角柄和鹿茸的发生。处于鹿茸再生时期的雄性鹿已经度过青春期,具备了支撑鹿茸发育的身体条件,鹿茸的再生周期也就没有必要再受到营养因素的严格限制。尽管营养因素依然能够影响到再生茸的发育周期,但是这种影响微乎其微。Fennessy等[6]研究显示,冬季饲喂不同营养水平的饲粮影响了鹿角的脱落时间,但没有影响到鹿角的脱落,对鹿茸启动再生程序并不造成影响(表 5),可见这种影响并非“有或者无”的限制,不像“角柄发生体重阈值”对角柄发生的限制那样严格。
|
|
表 5 冬季补饲对鹿角脱落时间的影响 Table 5 Effects of supplementary feeding on falling off time of antler in winter[6] |
无论是角柄和初角茸的发生时间、初角茸的分枝状况,还是鹿茸的生长速度,均受到营养因素的调控。多年来,营养因素调控角柄和鹿茸发生、发育的机理一直是研究人员争论和探讨的焦点。目前最让人认可的是“胰岛素样生长因子-1(insulin-like growth factor 1, IGF1)学说”[1, 6, 16-17]。众所周知,IGF1是机体生长、发育和代谢的重要调控因子,能激活RNA聚合酶,促进非组蛋白磷酸化,刺激RNA和DNA的合成,从而促进细胞生长和分裂;IGF1还能提高蛋白质合成中氨基酸的利用率,抑制蛋白质降解,提高蛋白质的净增率,促进骨细胞和肌肉细胞的增殖,进而促进动物胚胎发育及骨的生长、修复与肌肉的生长。血浆中IGF1的水平是研究营养代谢的一个重要指标,营养水平能够影响血浆IGF1水平的峰值,IGF1的合成、释放和活性依赖于动物的营养状况。因此,营养因素对鹿茸发育方面的影响途径主要是丰足的营养提高了血浆IGF1的峰值,调控了鹿茸的生长速度。
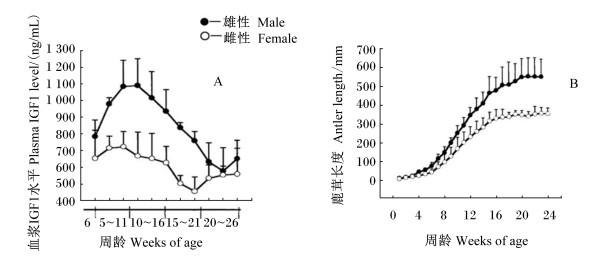
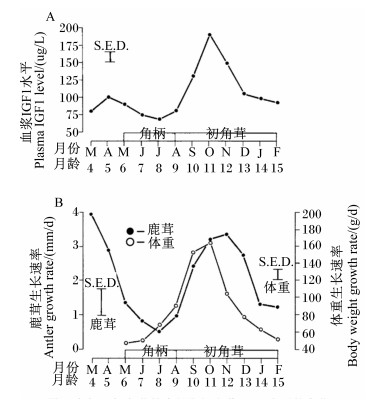
3.1 直接途径赤鹿雄性仔鹿角柄和鹿茸发育过程中伴随着血浆IGF1水平的规律性变化[6](表 6),且血浆IGF1水平的变化规律是季节性的,与鹿茸(包括再生茸)生长速度的变化规律一致。Suttie等[16]发现角柄形成前期雄性仔鹿血浆中存在一个IGFl水平的峰值。这可能是角柄发育开始的启动信号。驯鹿是唯一雌性也能生茸的鹿种,Blake等[13]对驯鹿雄性和雌性仔鹿(出生至21周龄,角柄和初角茸的发生期)的血浆IGF1水平和鹿茸长度进行了比较分析,发现前者血浆IGF1水平比后者高(图 1-A),这与两者鹿茸长度的差异一致(图 1-B),且两者IGF1水平峰值的时间点(图 1-A)与鹿茸生长速度最快的时间点(图 1-B)重合。
|
|
表 6 角柄和初角茸发育的4个不同时期血浆IGF1水平 Table 6 Plasma IGF1 level in four different periods of horn and initial antler development (n=6)[6] |
|
图 1 不同周龄鹿血浆IGF1水平和鹿茸长度 Figure 1 Plasma IGF1 level and antler length of different weeks old deer[16] |
细胞水平上的试验结果从一定程度上证实了IGF1能够促进鹿茸的发育。离体培养的鹿茸增生带的间充质和软骨细胞(合称生长中心细胞)的增殖速度依赖于IGF1水平的高低,且不同生长期的鹿茸,其生长中心细胞对IGF1刺激的敏感程度不一样,60 d(自鹿角脱落开始)时最为敏感[4];IGF1能刺激离体无血清培养的鹿茸尖部细胞的增殖和再生茸增生带细胞的增殖[18];IGF1能够以剂量依赖型方式刺激AP细胞的增殖[3]。细胞水平的上的试验结果说明,IGF1能够直接作用于AP细胞和鹿茸生长中心细胞,诱导细胞增值,引起角柄发育和鹿茸的快速生长。
鹿茸生长速度与血浆IGF1水平的规律性变化与营养因素有关:1)鹿茸的快速生长时期和血浆IGF1水平峰值的时间段均出现在食物丰富的夏季;2)营养试验发现,低营养组的4周岁赤鹿鹿茸的生长速度缓慢同时伴随着低水平的血浆IGF1[6];梅花鹿生茸期内血浆IGF1水平的变化趋势与其饲粮可消化蛋白质水平一致,慢性营养不良时,血浆IGF1水平降低[19-20];3)其他动物方面的研究证实营养因素与血浆IGF1水平之间存在因果关系,营养是血浆IGF1水平的主要调节因素之一[21-24]。因此,营养因素能够通过影响血浆IGF1水平的峰值直接控制鹿角柄和鹿茸的发生及快速生长。
3.2 间接途径营养因素除能够通过调节血浆IGF1的水平直接控制鹿角柄和鹿茸的发生及快速生长外,还能够通过IGF1作用于体重而起到间接的调控作用。众多研究证明,雄性鹿个体的体重直接影响鹿茸的重量和大小,个体较大的雄性鹿往往长有较大的鹿茸[25-26]。
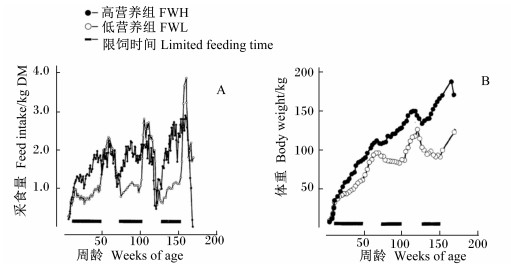
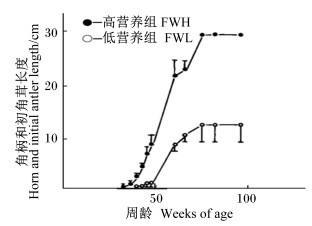
角柄发生体重阈值的存在就是角柄发育受体重控制的最明显的证明之一。营养因素与鹿体重、鹿茸大小三者之间的关系在角柄发生启动之前就有所体现。Suttie等[27]对捕获的野生赤鹿和苏格兰赤鹿的雄性仔鹿进行了限饲试验:1)捕获的野生雄性仔鹿从第1个冬季开始饲喂不同水平的饲粮,发现冬季限饲影响了鹿个体的发育,造成采食量降低(图 2-A),体重偏低(图 2-B);2)苏格兰赤鹿于23~46周龄(出生后的第1个冬季)饲喂不同营养水平的饲粮,发现体重增长取决于该时期的营养状况,营养条件较差的鹿,体格瘦小、体重较轻(如表 1所示)。上述限饲试验的结果除体重偏轻外,初角茸的长度(图 3)和重量(如表 2所示)也相对较小。Gaspar-López等[28]通过对赤鹿角柄与初角茸发生时间与体重关系进行研究,再次证明赤鹿初角茸的大小和重量与6月龄(角柄尚未形成)时体重有很大的关系,体重越大鹿茸长度和重量越大。初角茸发生之前的这段时间是鹿体格发育的黄金时期,营养不足的情况下,鹿体会为了机体的发育而牺牲鹿茸的发育。因为这一时期营养缺乏对鹿体重的影响无法通过后期的营养弥补[8, 29]。Hummel不产茸的主要原因也是因为幼年期较差的营养供应[1]。
|
图 2 冬季饲喂不同营养水平饲粮对鹿采食量和体重的影响 Figure 2 Effects of feeding different nutrient level diets on feed intake and body weight of deer in winter[27] |
|
图 3 不同周龄鹿角柄和初角茸长度 Figure 3 Horn and initial antler length of deer at different weeks old[27] |
成年鹿鹿茸大小也受到营养因素和体重的影响。Muir等[30]针对3~9周岁的赤鹿雄性鹿进行冬季补饲试验,发现冬季补饲能够提高发情期前体重,且发情期前体重每增加10 kg,鹿茸产量增加0.12 kg,说明营养因素对鹿茸生长速度的影响可能与血浆IGF1水平有关。
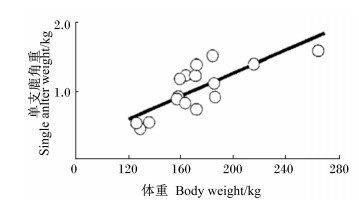
3.3 鹿茸、体重与营养的关系鹿角与体重和营养的关系也是鹿茸、体重与营养正相关的反映。赤鹿角的重量(鹿角脱落时的重量)与体重呈线性正相关(图 4)[4]。相同年龄段,鹿角长度和鹿体重之间也存在着正相关关系,体重越大鹿角长度也越大,且差异呈现极显著水平[31]。Stewart等[32]在驼鹿的研究中同样发现,驼鹿的体重与鹿角大小显著相关,并推测其原因如下:鹿茸生长需要大量的营养物质,体格大的个体能摄取更多的营养物质,除了满足身体生长需要外,更多的可用于鹿茸快速生长。
|
图 4 不同体重鹿的单支鹿角重 Figure 4 The single antler weight of deer at different body weight[4] |
众所周知,遗传因素是决定种间鹿体重和鹿茸大小、形状的主要因素。但就种内来说,虽然遗传因素和营养因素均能够造成个体体重差异,但是体重调控鹿茸发育的根源可能主要与营养因素有关。Hummel不产茸的主要原因是幼年期较差的营养供应,而非遗传所致(其后代能够正常产茸)[1]。Foerster等[25]经过30多年的研究,评价了遗传选择在赤鹿鹿茸发育过程的作用,结果证明:鹿茸的重量和大小与遗传性体格大小没有明显的正相关关系;也就是说,在一定程度上,遗传因素引起的个体体重差异对鹿茸发育的影响可以忽略。
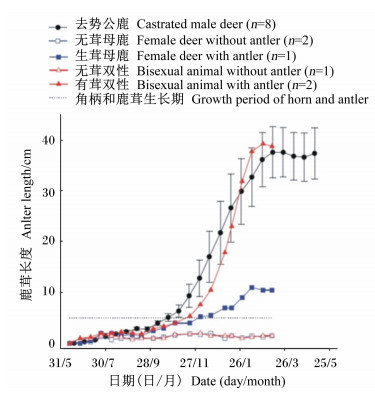
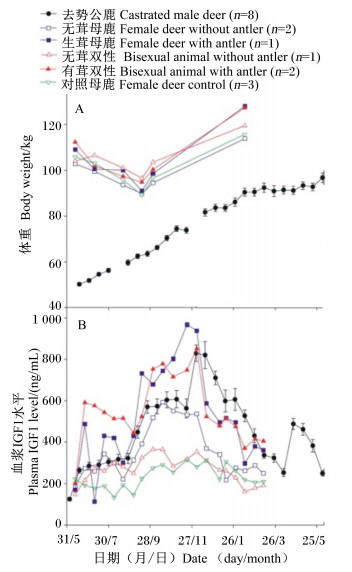
Suttie等[16]通过对4~15月龄的赤鹿雄性仔鹿的血浆IGF1水平、体重和鹿茸生长速度进行研究,发现在角柄和初角茸的生长期间,血浆IGFl水平的变化规律(图 5-A)、体重增长率的变化规律和鹿茸生长速率的变化规律(图 5-B)三者一致,呈显著正相关关系。Li等[33]于2003年通过对去势的雄性仔鹿、正常成年母鹿和成年双性鹿投放外源睾酮以刺激生茸,发现在外源睾酮刺激下:1)角柄和初角茸的生长速度(图 6)和体重变化(图 7-A)与血浆IGFl水平的变化一致(图 7-B);2)生茸母鹿和双性鹿血浆IGFl水平均高于无茸对照鹿。上述试验确定了血浆IGFl水平与鹿体重发育和鹿茸发育的因果关系,即血浆IGFl水平的上调导致了鹿生茸期体重的上调和鹿茸的快速生长。
|
S.E.D.:差别的标准误standard error of difference; 角柄: horn; 初角茸: initial antler; 鹿茸: antler; 体重: bodyweight; 月份: month; 月龄month of age。 图 5 角柄、初角茸生长期间血浆IGFl水平、鹿茸生长速率和体重生长速率的变化 Figure 5 The changes of plasma IGF1 level, mantler growth rate and body weight growth rate during growth of horn and initial antler[16] |
|
图 6 角柄和初角茸长度的变化 Figure 6 The change of horn and initial antler length[33] |
|
图 7 体重与血浆IGF1水平变化 Figure 7 The change of body weight and plasma IGF1 level[33] |
值得提及的特殊例子是,不同地区狍角的重量与体重的相关程度有很大的差异[26],推测原因如下:狍的茸很小,没有人工养殖价值,关于狍角与体重的相关数据均来源于野生狍(多半是人类猎杀获得)。与圈养和放牧相比,野生狍生存环境更为复杂,不同地理环境、不同气候条件下植被所含的营养成分不同。因此,营养因素通过2种方式同时作用于鹿茸的发育,当直接调控方式起主导作用时,鹿角的重量与体重的相关程度小一些;反之,相关程度大一些。
3.4 营养、IGF1、睾酮和生茸周期的关系尽管营养水平不能改变鹿茸再生周期,但其对茸皮的脱落时间和鹿角的脱落时间有一定程度的影响。苏格兰赤鹿于23~46周龄(出生后的第1个冬季)时饲喂不同营养水平的饲粮,至秋季屠宰时,高营养组中3/7的鹿茸已经脱皮变成裸露的鹿角,1/7的正在脱皮,3/7的尚未脱皮;低营养组只有1/5的鹿茸正在脱皮,4/5的未脱皮[8]。Fennessy等[6]对赤鹿雄性仔鹿的一系列研究证明了营养水平对鹿角脱落时间的影响:1)限饲试验发现低营养组的鹿茸脱皮时间比高营养组晚8周;冬季补饲试验(对鹿角发育期的4个鹿场的鹿进行冬季补饲),发现补饲组的鹿角脱落时间比对照组早(如表 5所示)。Muir等[30]通过对3~9周岁赤鹿雄性鹿进行冬季补饲试验再次证明了营养因素对鹿角脱落时间的影响,即冬季补饲的鹿的鹿角脱落时间更早。
睾酮和IGF1在鹿茸的形成生长过程中均起了重要作用,但其所起的作用不同[6]。鹿茸的发生和再生周期受睾酮的控制,如:鹿茸脱皮是由高水平的血浆睾酮引起的,而鹿茸的快速生长主要受IGF1的控制[18]。在苏格兰赤鹿限饲试验中,高营养组的鹿不仅鹿茸的脱皮时间早,睾丸也比低营养组的大[8];在离体培养的细胞水平上,只有IGF1存在的情况下AP细胞才能对睾酮产生应答,IGF1的作用呈剂量依赖性[1]。除此之外,本文引用的一系列试验结果均显示鹿的营养水平、血浆睾酮和IGF1水平存在一定的相关性,营养因素对茸皮和鹿角的脱落时间、鹿茸的生长速度产生了不可忽略的影响。因此,本文推测营养水平在影响鹿血浆IGF1水平的同时,也能影响到血浆睾酮水平,进而影响到鹿茸的脱皮时间和鹿角的脱落时间。
4 小结对于营养因素、体重、角柄和鹿茸发育的因果关系,综合以上研究成果,本文做出如下推测:营养因素通过2种方式调控着鹿茸的生长发育,除了通过IGF1直接作用之外,还通过IGF1影响个体体重而间接调控着鹿茸的生长发育。本推测能够很好的解释营养因素(而非遗传因素)造成的个体体重差异是调控鹿茸发育的根源的观点,因为营养因素能够引起血浆IGF1水平的变化。
深入研究营养因素对鹿茸发育的影响,分析营养因素通过内分泌调节鹿茸快速生长的分子机制,不仅会对提高鹿茸产量大有裨益,而且将对从营养的角度来探讨动物组织快速生长机制提供帮助,从而实现通过合理膳食而非应用药物来促进人组织损伤的快速修复,为人类健康事业服务。
| [1] |
LI C, SUTTIE J M. Histological examination of the antlerogenic region of red deer (Cervus elaphus) hummels[J].
LI C, SUTTIE J M. Histological examination of the antlerogenic region of red deer (Cervus elaphus) hummels[J]. New Zealand Veterinary Journal, 1996 , 44 (4) : 126 –130.
DOI: 10.1080/00480169.1996.35953 ( 0) 0)
|
| [2] |
BARTOS L, BUBENIK G A, KUZMOVA E. Endocrine relationships between rank-related behavior and antler growth in deer[J].
BARTOS L, BUBENIK G A, KUZMOVA E. Endocrine relationships between rank-related behavior and antler growth in deer[J]. Frontiers in Bioscience, 2012 , 4 : 1111 –1126.
( 0) 0)
|
| [3] |
LI C Y, LITTLEJOHN R P, SUTTIE J M. Effects of insulin-like growth factor 1 and testosterone on the proliferation of antlerogenic cells in vitro[J].
LI C Y, LITTLEJOHN R P, SUTTIE J M. Effects of insulin-like growth factor 1 and testosterone on the proliferation of antlerogenic cells in vitro[J]. Journal of Experimental Zoology, 1999 , 284 (1) : 82 –90.
DOI: 10.1002/(ISSN)1097-010X ( 0) 0)
|
| [4] |
SUTTIE J M, LINCOLN G A, KAY R N B. Endocrine control of antler growth in red deer stags[J].
SUTTIE J M, LINCOLN G A, KAY R N B. Endocrine control of antler growth in red deer stags[J]. The Journal of the Society for Reproduction and Fertility, 1984 , 71 (1) : 7 –15.
DOI: 10.1530/jrf.0.0710007 ( 0) 0)
|
| [5] |
SUTTIE J M, FENNESSY P F, LAPWOOD K R, et al. Role of steroids in antler growth of red deer stags[J].
SUTTIE J M, FENNESSY P F, LAPWOOD K R, et al. Role of steroids in antler growth of red deer stags[J]. Journal of Experimental Zoology, 1995 , 271 (2) : 120 –130.
DOI: 10.1002/(ISSN)1097-010X ( 0) 0)
|
| [6] |
FENNESSY P F, SUTTIE J M.Antler growth:nutritional and endocrine factors[M]//FENNESSY P F, DREW K R.Biology of deer production.Wellington:Royal Society of New Zealand Bulletin, 1985:112.
( 0) 0)
|
| [7] |
SUTTIE J M, KAY R N B.The influence of nutrition and photoperiod on the growth of antlers of young red deer[M]//BROWN R D.Antler development of cervidae.Kingsville:Caesar Kleberg Wildlife Research Institute, 1982:61-71.
( 0) 0)
|
| [8] |
SUTTIE J M, HAMILTON W J. The effect of winter nutrition on growth of young Scottish red deer (Cervus elaphus)[J].
SUTTIE J M, HAMILTON W J. The effect of winter nutrition on growth of young Scottish red deer (Cervus elaphus)[J]. Journal of Zoology, 1983 , 201 (2) : 153 –159.
( 0) 0)
|
| [9] |
CHAPMAN D I. Antlers-bones of contention[J].
CHAPMAN D I. Antlers-bones of contention[J]. Mammal Review, 1975 , 5 (4) : 121 –172.
DOI: 10.1111/j.1365-2907.1975.tb00194.x ( 0) 0)
|
| [10] |
LI C Y, SUTTIE J M. Light microscopic studies of pedicle and early first antler development in red deer (Cervus elaphus)[J].
LI C Y, SUTTIE J M. Light microscopic studies of pedicle and early first antler development in red deer (Cervus elaphus)[J]. The Anatomical Record, 1994 , 239 (2) : 198 –215.
DOI: 10.1002/(ISSN)1097-0185 ( 0) 0)
|
| [11] |
SUTTIE J M, WENHAM G, KAY R N. Simple in vivo method for determining calcium and phosphorus content of the metacarpus of red deer using radiography[J].
SUTTIE J M, WENHAM G, KAY R N. Simple in vivo method for determining calcium and phosphorus content of the metacarpus of red deer using radiography[J]. Veterinary Record, 1983 , 113 (17) : 393 –394.
DOI: 10.1136/vr.113.17.393 ( 0) 0)
|
| [12] |
LI C, SUTTIE J M, LITTLEJOHN R P. The design and use of a device to detect deer pedicle growth[J].
LI C, SUTTIE J M, LITTLEJOHN R P. The design and use of a device to detect deer pedicle growth[J]. New Zealand Veterinary Journal, 1994 , 42 (1) : 9 –15.
DOI: 10.1080/00480169.1994.35775 ( 0) 0)
|
| [13] |
BLAKE J E, ROWELL J E, SUTTIE J M. Characteristics of first-antler growth in reindeer and their association with seasonal fluctuations in steroid and insulin-like growth factor 1 levels[J].
BLAKE J E, ROWELL J E, SUTTIE J M. Characteristics of first-antler growth in reindeer and their association with seasonal fluctuations in steroid and insulin-like growth factor 1 levels[J]. Canadian Journal of Zoology, 1998 , 76 (11) : 2096 –2102.
DOI: 10.1139/z98-130 ( 0) 0)
|
| [14] |
BROWN R D.Nutrition and antler development[M]//BUBENIK G A, BUBENIK A B.Horns, Pronghorns, and Antlers.New York:Sptinger-Verlag, 1990:426-441.
( 0) 0)
|
| [15] |
GOSS R J. Future directions in antler research[J].
GOSS R J. Future directions in antler research[J]. The Anatomical Record, 1995 , 241 (3) : 291 –302.
DOI: 10.1002/(ISSN)1097-0185 ( 0) 0)
|
| [16] |
SUTTIE J M, FENNESSY P F, CORSON I D, et al. Pulsatile growth hormone, insulin-like growth factors and antler development in red deer (Cervus elaphus scoticus) stags[J].
SUTTIE J M, FENNESSY P F, CORSON I D, et al. Pulsatile growth hormone, insulin-like growth factors and antler development in red deer (Cervus elaphus scoticus) stags[J]. Journal of Endocrinology, 1989 , 121 (2) : 351 –360.
DOI: 10.1677/joe.0.1210351 ( 0) 0)
|
| [17] |
SUTTIE J M, GLUCKMAN P D, BUTLER J H, et al. Insulin-like growth factor 1(IGF-1) antler-stimulating hormone?[J].
SUTTIE J M, GLUCKMAN P D, BUTLER J H, et al. Insulin-like growth factor 1(IGF-1) antler-stimulating hormone?[J]. Endocrinology, 1985 , 116 (2) : 846 –848.
DOI: 10.1210/endo-116-2-846 ( 0) 0)
|
| [18] |
SADIGHI M, LI C, LITTLEJOHN R P, et al. Effects of testosterone either alone or with IGF-Ⅰon growth of cells derived from the proliferation zone of regenerating antlers in vitro[J].
SADIGHI M, LI C, LITTLEJOHN R P, et al. Effects of testosterone either alone or with IGF-Ⅰon growth of cells derived from the proliferation zone of regenerating antlers in vitro[J]. Growth Hormone & IGF Research, 2001 , 11 (4) : 240 –246.
( 0) 0)
|
| [19] |
李光玉.梅花鹿、马鹿营养、血清IGF-1浓度及鹿茸生长规律研究[D].博士学位论文.北京:中国农业科学院, 2005:38-42.
http://cdmd.cnki.com.cn/article/cdmd-82101-2005114958.htm
( 0) 0)
|
| [20] |
李光玉, 高秀华, 王凯英, 等. 梅花鹿、马鹿营养与其血清IGF-1浓度的关系研究[J].
李光玉, 高秀华, 王凯英, 等. 梅花鹿、马鹿营养与其血清IGF-1浓度的关系研究[J]. 特产研究, 2004 , 26 (1) :1 –6.
( 0) 0)
|
| [21] |
PELL J M, SAUNDERS J C, GILMOUR R S. Differential regulation of transcription initiation from insulin-like growth factor-Ⅰ(IGF-Ⅰ) leader exons and of tissue IGF-Ⅰexpression in response to changed growth hormone and nutritional status in sheep[J].
PELL J M, SAUNDERS J C, GILMOUR R S. Differential regulation of transcription initiation from insulin-like growth factor-Ⅰ(IGF-Ⅰ) leader exons and of tissue IGF-Ⅰexpression in response to changed growth hormone and nutritional status in sheep[J]. Endocrinology, 1993 , 132 (4) : 1797 –1807.
( 0) 0)
|
| [22] |
TAKENAKA A, MORI M, YAMADA S, et al. Nutritional regulation of gene expression of insulin-like growth factor-binding proteins and the acid-labile subunit in various tissues of rats[J].
TAKENAKA A, MORI M, YAMADA S, et al. Nutritional regulation of gene expression of insulin-like growth factor-binding proteins and the acid-labile subunit in various tissues of rats[J]. Journal of Endocrinology, 1996 , 150 (1) : 33 –41.
DOI: 10.1677/joe.0.1500033 ( 0) 0)
|
| [23] |
THISSEN J P, KETELSLEGERS J M, UNDERWOOD L E. Nutritional regulation of the insulin-like growth factors[J].
THISSEN J P, KETELSLEGERS J M, UNDERWOOD L E. Nutritional regulation of the insulin-like growth factors[J]. Endocrine Reviews, 1994 , 15 (1) : 80 –101.
( 0) 0)
|
| [24] |
ZULU V C, NAKAO T, SAWAMUKAI Y. Insulin-like growth factor-Ⅰas a possible hormonal mediator of nutritional regulation of reproduction in cattle[J].
ZULU V C, NAKAO T, SAWAMUKAI Y. Insulin-like growth factor-Ⅰas a possible hormonal mediator of nutritional regulation of reproduction in cattle[J]. Journal of Veterinary Medical Science, 2002 , 64 (8) : 657 –665.
DOI: 10.1292/jvms.64.657 ( 0) 0)
|
| [25] |
FOERSTER K, COULSON T, SHELDON B C, et al. Sexually antagonistic genetic variation for fitness in red deer[J].
FOERSTER K, COULSON T, SHELDON B C, et al. Sexually antagonistic genetic variation for fitness in red deer[J]. Nature, 2007 , 447 (7148) : 1107 –1110.
DOI: 10.1038/nature05912 ( 0) 0)
|
| [26] |
李春义, 赵世臻, 王文英.
鹿茸[M]. 北京: 中国农业科技出版社, 1988 : 15 .
( 0) 0)
|
| [27] |
SUTTIE J M, GOODALL E D, PENNIE K, et al. Winter food restriction and summer compensation in red deer stags (Cervus elaphus)[J].
SUTTIE J M, GOODALL E D, PENNIE K, et al. Winter food restriction and summer compensation in red deer stags (Cervus elaphus)[J]. British Journal of Nutrition, 1983 , 50 (3) : 737 –747.
DOI: 10.1079/BJN19830145 ( 0) 0)
|
| [28] |
GASPAR-LÓPEZ E, GARCÍA A J, LANDETE-CASTILLEJOS T, et al. Growth of the first antler in Iberian red deer(Cervus elaphus hispanicus)[J].
GASPAR-LÓPEZ E, GARCÍA A J, LANDETE-CASTILLEJOS T, et al. Growth of the first antler in Iberian red deer(Cervus elaphus hispanicus)[J]. European Journal of Wildlife Research, 2008 , 54 (1) : 1 –5.
DOI: 10.1007/s10344-007-0096-0 ( 0) 0)
|
| [29] |
FRENCH C E, MCEWEN L C, MAGRUDER N D, et al. Nutrient requirements for growth and antler development in the white-tailed deer[J].
FRENCH C E, MCEWEN L C, MAGRUDER N D, et al. Nutrient requirements for growth and antler development in the white-tailed deer[J]. The Journal of Wildlife Management, 1956 , 20 (3) : 221 –232.
DOI: 10.2307/3796954 ( 0) 0)
|
| [30] |
MUIR P D, SYKES A R. Effect of winter nutrition on antler development in red deer (Cervus elaphus):a field study[J].
MUIR P D, SYKES A R. Effect of winter nutrition on antler development in red deer (Cervus elaphus):a field study[J]. New Zealand Journal of Agricultural Research, 1988 , 31 (2) : 145 –150.
DOI: 10.1080/00288233.1988.10417938 ( 0) 0)
|
| [31] |
HARMEL D H, WILLIAMS J D, ARMSTRONG W E.Effects of genetics and nutrition on antler development and body size of white-tail deer[R].Federal Aid Report.Austin:Texas Parks and Wildlife, 1986:55.
( 0) 0)
|
| [32] |
STEWART K M, BOWYER R T, KIE J G, et al. Antler size relative to body mass in moose:tradeoffs associated with reproduction[J].
STEWART K M, BOWYER R T, KIE J G, et al. Antler size relative to body mass in moose:tradeoffs associated with reproduction[J]. Alces, 2000 , 36 : 77 –83.
( 0) 0)
|
| [33] |
LI C, LITTLEJOHN R P, CORSON I D, et al. Effects of testosterone on pedicle formation and its transformation to antler in castrated male, freemartin and normal female red deer (Cervus elaphus)[J].
LI C, LITTLEJOHN R P, CORSON I D, et al. Effects of testosterone on pedicle formation and its transformation to antler in castrated male, freemartin and normal female red deer (Cervus elaphus)[J]. General and Comparative Endocrinology, 2003 , 131 (1) : 21 –31.
DOI: 10.1016/S0016-6480(02)00625-1 ( 0) 0)
|




