硒(Se)是哺乳动物新陈代谢所必需的基本微量元素,在动物的生长、繁殖等方面起着重要作用。Se在动物体内主要以硒蛋白的形式来发挥其多种生理功能,在人中已分离得到了25种硒蛋白[1]。很多硒蛋白在动物体内是作为细胞重要的抗氧化防御系统,起着清除氧自由基、保护生物膜完整等功能[2-4]。在动物饲粮中添加一定量的Se可以增加体内硒蛋白的表达,从而增强动物机体的免疫及抗氧化功能等[3-4]。到目前还有很多硒蛋白的功能和作用机理不完全清楚,其中就包含硒蛋白x(Selx)。Selx也称为硒蛋白R(SelR)和蛋氨酸亚砜还原酶B1(MsrB1),在动物体内广泛存在,隶属于蛋氨酸亚砜还原酶(Msr)家族,定位于细胞核和细胞质中。Msr是一种氧化还原修复酶,它可修复被氧化的核糖体蛋白使其恢复蛋白质的功能[5]。活性氧(reactive oxygen species, ROS)的大量产生或不完全清除可以使生物机体产生氧化损伤,为了抵抗ROS的氧化损伤,机体拥有一定的防御体系,其中蛋氨酸亚砜还原酶就是一种修复酶和间接的ROS清除剂。蛋氨酸是蛋白质中最易被氧化的氨基酸残基之一,它可被过氧化氢(H2O2)、羟自由基、次氯酸钠、过氧亚硝酸盐阴离子(ONOO-)等氧化,生成蛋氨酸亚砜(MetO)[6]。同其他Msr一样,Selx可把生成的MetO还原为蛋氨酸,抵御机体受到氧化损伤,可抑制ONOO-诱导的细胞凋亡[7]。有研究表明,Selx基因沉默会诱导人晶状体上皮细胞(hLE)ROS水平的显著增加,从而激活细胞的保护机制[8];本实验室研究发现,Selx基因沉默可以降低人正常肝脏细胞(human normal hepatocyte,LO2)的活性,增加细胞的凋亡[9]。
硒蛋白是Se以硒代半胱氨酸(Sec)的形式存在,且Sec大多位于蛋白质的活性中心。Sec由密码子UGA编码,而该密码子在普通蛋白质合成中是终止密码子,Sec的插入依赖于硒蛋白mRNA自身3′-非编码区(3′-UTR)稳定的茎-环结构序列元件SECIS(selenocysteine insertion sequence)[2]。由于SECIS结构的特殊性,可针对硒蛋白的3′-UTR,利用沉默技术设计引物,使其基因沉默表达,从而探讨其功能。目前已有GPX4[10]、TR1[11]、SelW[12]、Sep15[13]等基因沉默的研究报道。
目前已知在人和哺乳动物中有25个硒蛋白基因,很多硒蛋白在维持机体内氧化还原平衡中起着重要作用,但硒蛋白之间是否具有功能互作尚不清楚,Selx基因沉默是否会对其他硒蛋白基因表达产生影响也未见报道。前期的研究表明,Selx基因在肝脏和肾脏中具有较高的表达[14]。本实验室已通过沉默技术,成功构建了LO2的Selx基因沉默细胞株(siSelx)和空载稳定转染LO2对照细胞株(CK)[9]。在此,本试验旨在考察Selx基因沉默对LO2细胞株生长速率及细胞形态的影响;同时比较Selx基因沉默和H2O2处理对LO2细胞株中25个硒蛋白mRNA表达的影响,及其对细胞中谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性和总抗氧化能力(T-AOC)的影响。研究结果可望为探索Selx与其他硒蛋白之间可能的调控关系提供线索,为探索Selx的生物学功能奠定基础,同时为进一步探讨硒蛋白如何在动物体内发挥Se的营养功能提供一定的线索。
1 材料与方法 1.1 主要仪器设备二氧化碳培养箱(Thermo)、生物安全柜(Thermo)、酶标仪(Molecular Devices)、5804R台式高速冷冻离心机(Eppendorf)、Milli Q Plus超级纯水仪(Millipore)、Nanodrop微量核酸分析仪(Thermo)、7900HT荧光定量PCR仪(ABI)、倒置荧光显微镜(Nikon TS100)。
1.2 主要试剂及细胞株主要试剂:DMEM/F12基础培养基(Gibco)、胎牛血清(Gibco)、TRIzol regent(Invitrogen)均购于Thermo Fisher公司;Prime ScriptTM逆转录试剂盒、TaqDNA聚合酶、SYBR Green Mix荧光染料均购于大连宝生物工程有限公司;引物由上海生工生物公司合成;GSH-Px活性测定试剂盒、SOD活性测定试剂盒和T-AOC测定试剂盒均购于南京建成生物工程研究所。
细胞株:siSelx和CK均为本实验室构建并保存。
1.3 siSelx和CK的培养将siSelx和CK分别接种于含10%胎牛血清、1%青霉素-链霉素和600μg/mL潮霉素B的DMEM/F12培养液中,置于37℃、5% CO2的培养箱中培养,每2 d更换培养液1次,细胞生长密度达到90%时用0.25%的胰蛋白酶消化传代。
1.4 siSelx和CK的生长速度比较用血球计数板法将siSelx和CK浓度调整在1×104个/mL左右,然后按200μL/孔接种于96孔培养板中,每排边上2孔为不加细胞只加培养液的空白对照孔,剩余10孔为siSelx和CK细胞株各5孔(n=5),其余7排与此相同。加样后,置于37℃、5% CO2的培养箱中培养,每2 d更换1次培养液。每间隔24 h,对一排的细胞进行处理,即弃培养液,加入新鲜基础培养基180μL/孔,然后加入噻唑兰(MTT)溶液(5 mg/mL)20μL/孔,37℃培养箱中继续孵育4 h。4 h后小心去掉孔内培养液,加入150μL/孔的二甲基亚砜(DMSO),反复吹打,使结晶物充分溶解。将孔内液体吸至另一新的96孔板中,测定其在570 nm波长处的吸收值,用空白孔调零,以时间为横轴,吸光度值为纵轴绘制细胞生长曲线。
1.5 siSelx和CK在H2O2处理前后的形态观察将siSelx和CK分别接种1个6孔培养板,将培养板置于37℃、5% CO2的培养箱中培养,每2 d更换1次培养液。当细胞长到70%培养板时,在显微镜下观察它们的形态特征;然后分别加入200μmol/L H2O2处理2.5 h后,再观察细胞的形态特征。
1.6 硒蛋白基因表达定量分析用血球计数板法将siSelx和CK浓度调整在2×104个/mL,按照0.5 mL/孔接种24孔培养板,每个细胞系各接种2板。将培养板置于37℃、5% CO2的培养箱中培养,每2 d更换1次培养液。当细胞长到90%培养板时,siSelx和CK分别加入H2O2终浓度为0或200μmol/L的完全培养基处理2.5 h,然后收集细胞[9]:先用预冷的磷酸缓冲盐溶液(PBS)清洗1次后,每孔加入200μL的TRIzol regent,将4个孔样品合并为1个样(n=6)。用TRIzol法提取总RNA[14],通过琼脂糖电泳和核酸测定仪检测其质量,合格后将RNA浓度调整到200 ng/μL,按照逆转录试剂盒说明书操作将其反转录成cDNA,用于基因定量分析。
25个硒蛋白基因和2个看家基因[β-肌动蛋白(β-actin)、甘油醛-3-磷酸脱氢酶(GAPDH)]序列均从NCBI GenBank数据库下载,采用ABI Primer Express 3.0软件设计定量引物,送上海生工生物公司合成,引物序列详见表 1。荧光定量PCR反应体系为10μL,包含:5.0μL 2×SYBR Green Mix,cDNA 0.5μL,上、下游引物混合液1.5μL(2μmol/L),H2O 3.0μL,每个样重复2次。荧光定量PCR(RT-PCR)反应条件为95℃变性30 s,40个循环(95℃5 s,60℃34 s),熔解曲线(95℃15 s,60℃60 s,95℃15 s)。定量数据采用ΔΔCt法计算分析,具体方法为:ΔCt值是目标基因和参比基因Ct值的差值(ΔCt=Cttarget-Ctreference),以空载CK中目标基因表达量为标准,假定其表达量为1,其ΔCt值定为ΔCtR,其他样品中目标基因的ΔCt值减去ΔCtreference值的差值即为ΔΔCt(ΔCttarget-ΔCtreference),根据基因PCR扩增是2n扩增的原理,则目标基因的相对表达量为2-ΔΔCt。
|
|
表 1 硒蛋白基因PCR引物序列 Table 1 Primer sequences used for PCR of selenoprotein genes |
用血球计数板法将siSelx和CK浓度调整在2×104个/mL,按照2 mL/孔接种6孔培养板,每个细胞株各接种8板。将培养板置于37℃、5% CO2的培养箱中培养,每2 d更换1次培养液。当细胞长到90%培养板时,siSelx和CK分别加入H2O2终浓度为0或200μmol/L的完全培养基处理2.5 h,然后收集细胞:用预冷的PBS清洗2次,然后每孔加入150μL的PBS,采用细胞刮刀收集细胞,将4个孔样品混合为1个样(n=6)。细胞收集后,用超声波破碎仪破碎细胞释放蛋白质,离心后取上清测定抗氧化剂酶活性,按照试剂盒的操作说明分别测定样品GSH-Px、SOD活性及T-AOC。
1.8 数据处理及分析数据采用SPSS Statistics 13.0统计软件进行统计分析,所有数据均以平均值±标准误表示。生长速率采用独立样本t检验分析,硒蛋白基因表达量及酶活性指标分析采用单因素方差分析(one-way ANOVA)比较各组之间的差异显著性,并结合Duncan氏法进行多重比较,P < 0.05为差异显著水平。
2 结果与分析 2.1 siSelx和CK生长速率分析活细胞线粒体中的琥珀脱氢酶能使外源的MTT还原为难溶性的蓝紫色结晶物并沉积在细胞中,而死细胞无此功能。DMSO能溶解细胞中的紫色结晶物,其在570 nm波长处有特异的光吸收峰,该吸光度值可间接反映细胞数量。siSelx和CK生长速率采用MTT法共连续测定8 d,结果见图 1。从图 1中可以看出,Selx基因沉默后,LO2细胞株在570 nm处的吸光度值从第3天开始出现差异,siSelx组生长速度在第3至7天均显著低于对照组,随着培养时间增加,在第8天时2组在570 nm的吸光度值无差异。
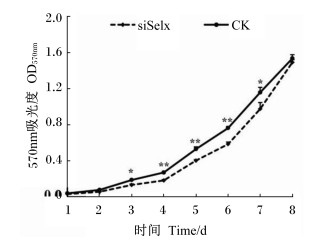
|
siSelx: LO2的Selx基因沉默细胞株; CK:对照细胞株。下图或表同。 siSelx: The LO2 cells with Selx knockdown; CK: con-trol cells.The same as below. 图 1 siSelx和CK生长速率的分析比较 Figure 1 Comparison of growth rate between siSelx and CK (n=5) |
Selx基因沉默及H2O2处理对LO2细胞株形态的影响结果见图 2。从图中可以看出,Selx基因沉默后对LO2细胞株的形态没有影响,CK和siSelx在形态上没有明显区别;经200μmol/L H2O2处理2.5 h后,CK和siSelx均出现了一定程度形态变圆的变化。
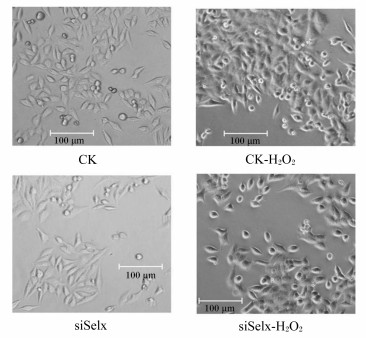
|
CK-H2O2: H2O2处理对照细胞株; siSelx-H2O2: H2O2处理LO2的Selx基因沉默细胞株。下图或表同。 siSelx: H2O2 challenge the LO2 cells with Selx knock-down; CK: H2O2 challenge control cells.The same as below. 图 2 Selx基因沉默和H2O2处理对LO2细胞株形态的影响 Figure 2 Effects of Selx knockdown and H2O2 challenge on the morphology of LO2 cells |
Selx基因沉默及H2O2处理对细胞硒蛋白基因表达的影响结果见图 3。从图中可看出,Selx基因在siSelx中基因的表达量显著低于对照组(P < 0.05),其表达量只有对照组的26%。在LO2细胞株中,Selx基因沉默使Gpx6、Txnrd2和Seli基因的表达量显著上调(P < 0.05),使Dio2、Dio3、Selm和Sepw1基因的表达量显著下调(P < 0.05);H2O2处理显著上调了Dio1基因的表达量(P < 0.05),显著下调了Gpx2基因的表达量(P < 0.05);Selx基因沉默后H2O2处理细胞2.5 h,显著上调了Gpx6、Txnrd2和Dio1基因的表达量(P < 0.05),显著下调了Txnrd3、Dio2、Selm、Sepw1和Selv基因的表达量(P < 0.05)。
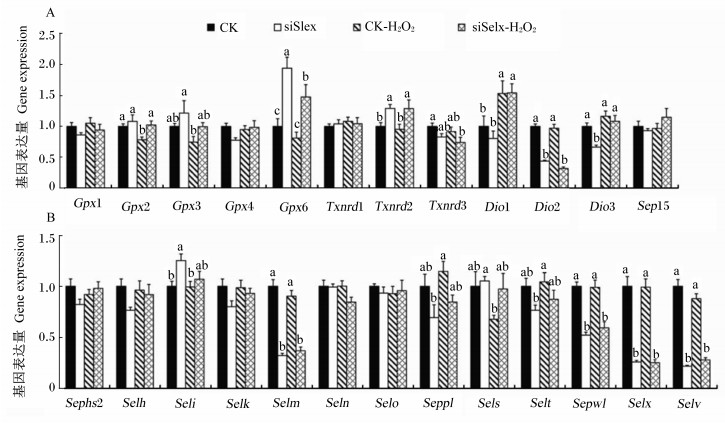
|
数据柱标不同小写字母表示差异显著(P < 0.05)。 Data columns with different small letter superscripts mean significant difference (P < 0.05). 图 3 Selx基因沉默和H2O2处理对LO2细胞硒蛋白基因表达的影响 Figure 3 Effects of Selx knockdown and H2O2 challenge on selenoprotein gene expression in LO2 cells (n=6) |
Selx基因沉默和H2O2处理对LO2细胞株中GSH-Px、SOD活性和T-AOC的影响结果见表 2。从表中可看出,Selx基因沉默显著提高了LO2细胞株中GSH-Px的活性(P < 0.05),提高了66.6%;显著提高了SOD的活性(P < 0.05),提高了51.9%;对T-AOC无显著影响(P>0.05)。H2O2处理对LO2细胞株中GSH-Px、SOD活性和T-AOC均无显著影响(P>0.05)。Selx基因沉默后进行H2O2处理,LO2细胞株中GSH-Px的活性与CK相比,显著提高了1.97倍(P < 0.05);SOD活性与CK相比无显著影响(P>0.05),但与siSelx相比却显著降低了19.8%(P < 0.05);T-AOC的活性与CK及siSelx相比均无显著影响(P>0.05)。
|
|
表 2 Selx基因沉默和H2O2处理对LO2细胞株GSH-Px、SOD活性和T-AOC影响 Table 2 Effects of Selx knockdown and H2O2 challenge on GSH-Px, SOD activities and T-AOC in LO2 cells (n=6) |
基因沉默是研究基因功能的重要手段,由于硒蛋白基因3′-UTR在不同基因之间的序列同源性低,因此利用沉默技术针对硒蛋白基因3′-UTR设计引物对其沉默表达,成为研究硒蛋白基因功能的重要手段[11]。本研究在前期成功获得Selx基因稳定沉默LO2细胞株基础上,进一步探讨Selx基因沉默对细胞中其他硒蛋白基因表达的影响。已知硒蛋白在维护机体正常生长、繁殖、抗氧化等方面起着重要作用。有研究发现硒蛋白基因沉默后影响细胞生长速度,Txnrd1基因沉默后降低TMCK-1细胞生长速率约10%左右[11];Sep15基因沉默后显著降低HCT116和HT29细胞生长速率[13]。在本研究中,Selx基因沉默后显著降低第3~7天LO2细胞株的生长速率,但对细胞株的形态没有影响,H2O2处理明显导致CK和siSelx形态发生改变。
硒蛋白是一类特殊蛋白,目前在任何哺乳动物中已经鉴定出25种硒蛋白[1],研究表明,硒蛋白在动物体内起着重要功能。但硒蛋白相互之间是否存在功能互补或相互调控尚不清楚,在此本研究考察了Selx基因沉默后对其他硒蛋白基因表达的影响,结果表明,Selx基因沉默上调了Gpx6、Txnrd2和Seli基因的表达量,下调了Dio2、Dio3、Selm和Sepw1基因的表达量。在上调的硒蛋白基因中,Gpx6基因在机体内主要起抗氧化保护机体的功能[15];Txnrd2基因主要存在于动物体的肝脏、肾脏以及心脏组织中,其主要功能是依赖还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)催化各种氧化还原系统(主要是核糖核苷酸还原酶的DNA合成、转录因子调节、细胞生长等),减少氧化的硫氧还蛋白[2]。下调的硒蛋白基因中,Dio2和Dio3基因都隶属于脱碘酶家族,主要功能是参与动物体内甲状腺激素的调节,从而影响物质、能量的代谢[2];Selx基因沉默后显著降低LO2细胞株的生长速率,但是否是通过下调Dio2和Dio3基因而起作用尚不清楚;SelM基因具有硫醇-二硫化物异构酶的活性,可能参与了内质网内二硫键的形成;SelW基因具有抗氧化剂或氧化还原的功能。基因在细胞中通常受到网络状调控,相互之间可能存在功能互作效应,一个基因受抑制,可能其他基因会增加表达,以弥补功能不足。Selx基因沉默导致其他硒蛋白基因在LO2细胞株中上调或下调表达,预示着这些基因与Selx基因之间可能存在功能互补或相互调控作用,但其调控机理有待进一步研究。肝脏是重要代谢器官,Selx基因沉默是否影响肝细胞抗氧化损伤尚不清楚。ROS过量产生是细胞氧化损伤的主要因素,而H2O2是ROS的主要成分[16],不同的细胞类型对H2O2诱导的氧化应激的敏感性不同,同时还受H2O2的浓度和处理时间的影响[12]。本试验考察了LO2细胞中Selx基因沉默后,再进行H2O2氧化应激处理,对其他硒蛋白基因表达的影响。结果显示在Selx基因沉默条件下进行H2O2应激处理,导致LO2细胞株中Gpx6、Txnrd2和Dio1的表达量上调,Txnrd3、Dio2、Selm、Sepw1和Selv的表达量下调。其中Gpx6、Txnrd2、Dio1、Dio2、Selm和Sepw1在Selx基因沉默或H2O2处理中就有显著差异表达,预示着Selx基因沉默和H2O2对LO2细胞株的氧化应激损伤可能具有一定的叠加作用;单独H2O2应激处理时下调Gpx2表达量,Selx基因沉默影响Seli和Dio3表达量,但这3个基因在Selx基因沉默并伴随H2O2应激处理中无显著差异表达(相对CK),这预示着Selx基因沉默和H2O2对LO2细胞株的氧化损伤可能存在一定互补效应。
Selx作为重要的氧化还原酶,在抵御机体受到氧化损伤中起着重要作用[7]。我们前期研究发现,Selx基因沉默后进行H2O2处理,显著提高了LO2细胞株的凋亡率[9]。本研究中发现,Selx基因沉默或Selx基因沉默并伴随H2O2处理均显著提高了LO2细胞株中GSH-Px和SOD的活性,这可能是Selx基因沉默后,LO2细胞株的氧化还原功能减弱,反馈性增加了GSH-Px和SOD的分泌来维护机体的代谢平衡。H2O2单独处理对LO2细胞株中GSH-Px和SOD的活性没有显著影响,这与H2O2处理人脐静脉内皮细胞[17]、HLE细胞[18]和PC12细胞[19],使细胞中GSH-Px和SOD活性均显著下降结果不一致,这可能是由于本试验H2O2使用浓度较低以及处理时间较短所致。
4 结论①Selx基因沉默后显著降低了肝脏LO2细胞株的生长速率。
②Selx基因沉默及H2O2处理影响了肝脏LO2细胞株中其他硒蛋白基因的表达。
③Selx基因沉默及H2O2处理影响了肝脏LO2细胞株GSH-Px、SOD活性。
| [1] |
KRYUKOV G V, CASTELLANO S, NOVOSELOV S V, et al. Characterization of mammalian selenoproteomes[J].
KRYUKOV G V, CASTELLANO S, NOVOSELOV S V, et al. Characterization of mammalian selenoproteomes[J]. Science, 2003 , 300 (5624) : 1439 –1443.
DOI: 10.1126/science.1083516 ( 0) 0)
|
| [2] |
MOGHADASZADEH B, BEGGS A H. Selenoproteins and their impact on human health through diverse physiological pathways[J].
MOGHADASZADEH B, BEGGS A H. Selenoproteins and their impact on human health through diverse physiological pathways[J]. Physiology, 2006 , 21 (5) : 307 –315.
DOI: 10.1152/physiol.00021.2006 ( 0) 0)
|
| [3] |
HUANG Z, ROSE A H, HOFFMANN P R. The role of selenium in inflammation and immunity:from molecular mechanisms to therapeutic opportunities[J].
HUANG Z, ROSE A H, HOFFMANN P R. The role of selenium in inflammation and immunity:from molecular mechanisms to therapeutic opportunities[J]. Antioxidants & Redox Signaling, 2012 , 16 (7) : 705 –743.
( 0) 0)
|
| [4] |
RAYMAN M P. Selenium and human health[J].
RAYMAN M P. Selenium and human health[J]. The Lancet, 2012 , 379 (9822) : 1256 –1268.
DOI: 10.1016/S0140-6736(11)61452-9 ( 0) 0)
|
| [5] |
MARCHETTI M A, PIZARRO G O, SAGHER D, et al. Methionine sulfoxide reductases B1, B2, and B3 are present in the human lens and confer oxidative stress resistance to lens cells[J].
MARCHETTI M A, PIZARRO G O, SAGHER D, et al. Methionine sulfoxide reductases B1, B2, and B3 are present in the human lens and confer oxidative stress resistance to lens cells[J]. Investigative Ophthalmology & Visual Science, 2005 , 46 (6) : 2107 –2112.
( 0) 0)
|
| [6] |
VOGT W. Oxidation of methionyl residues in proteins:tools, targets, and reversal[J].
VOGT W. Oxidation of methionyl residues in proteins:tools, targets, and reversal[J]. Free Radical Biology and Medicine, 1995 , 18 (1) : 93 –105.
DOI: 10.1016/0891-5849(94)00158-G ( 0) 0)
|
| [7] |
JIA Y, LI Y, DU S Q, et al. Involvement of MsrB1 in the regulation of redox balance and inhibition of peroxynitrite-induced apoptosis in human lens epithelial cells[J].
JIA Y, LI Y, DU S Q, et al. Involvement of MsrB1 in the regulation of redox balance and inhibition of peroxynitrite-induced apoptosis in human lens epithelial cells[J]. Experimental Eye Research, 2012 , 100 : 7 –16.
DOI: 10.1016/j.exer.2012.04.008 ( 0) 0)
|
| [8] |
JIA Y, ZHOU J, LIU H M, et al. Effect of methionine sulfoxide reductase B1(SelR) gene silencing on peroxynitrite-induced F-actin disruption in human lens epithelial cells[J].
JIA Y, ZHOU J, LIU H M, et al. Effect of methionine sulfoxide reductase B1(SelR) gene silencing on peroxynitrite-induced F-actin disruption in human lens epithelial cells[J]. Biochemical and Biophysical Research Communications, 2014 , 443 (3) : 876 –881.
DOI: 10.1016/j.bbrc.2013.12.055 ( 0) 0)
|
| [9] |
TANG J Y, CAO L, LI Q, et al. Selenoprotein X gene knockdown aggravated H2O2-induced apoptosis in liver LO2 cells[J].
TANG J Y, CAO L, LI Q, et al. Selenoprotein X gene knockdown aggravated H2O2-induced apoptosis in liver LO2 cells[J]. Biological Trace Element Research, 2016 .
DOI: 10.1007/s12011-016-0653-z ( 0) 0)
|
| [10] |
GAUTREY H, NICOL F, SNEDDON A A, et al. A T/C polymorphism in the GPX43'UTR affects the selenoprotein expression pattern and cell viability in transfected Caco-2 cells[J].
GAUTREY H, NICOL F, SNEDDON A A, et al. A T/C polymorphism in the GPX43'UTR affects the selenoprotein expression pattern and cell viability in transfected Caco-2 cells[J]. Biochimica et Biophysica Acta:General Subjects, 2011 , 1810 (6) : 284 –291.
DOI: 10.1016/j.bbagen.2011.03.016 ( 0) 0)
|
| [11] |
YOO M H, XU X M, TURANOV A A, et al. A new strategy for assessing selenoprotein function:siRNA knockdown/knock-in targeting the 3'-UTR[J].
YOO M H, XU X M, TURANOV A A, et al. A new strategy for assessing selenoprotein function:siRNA knockdown/knock-in targeting the 3'-UTR[J]. RNA, 2007 , 13 (6) : 921 –929.
DOI: 10.1261/rna.533007 ( 0) 0)
|
| [12] |
HAN Y H, ZHANG Z W, Su J, et al. Effects of chicken selenoprotein W on H2O2-induced apoptosis in CHO-K1 cells[J].
HAN Y H, ZHANG Z W, Su J, et al. Effects of chicken selenoprotein W on H2O2-induced apoptosis in CHO-K1 cells[J]. Biological Trace Element Research, 2012 , 147 (1/2/3) : 395 –402.
( 0) 0)
|
| [13] |
TSUJI P A, NARANJO-SUAREZ S, CARLSON B A, et al. Deficiency in the 15 kDa selenoprotein inhibits human colon cancer cell growth[J].
TSUJI P A, NARANJO-SUAREZ S, CARLSON B A, et al. Deficiency in the 15 kDa selenoprotein inhibits human colon cancer cell growth[J]. Nutrients, 2011 , 3 (9) : 805 –817.
( 0) 0)
|
| [14] |
ZHAO H, LI K, TANG J Y, et al. Expression of selenoprotein genes is affected by obesity of pigs fed a high-fat diet[J].
ZHAO H, LI K, TANG J Y, et al. Expression of selenoprotein genes is affected by obesity of pigs fed a high-fat diet[J]. The Journal of Nutrition, 2015 , 145 (7) : 1394 –1401.
DOI: 10.3945/jn.115.211318 ( 0) 0)
|
| [15] |
PAPPAS A C, ZOIDIS E, SURAI P F, et al. Selenoproteins and maternal nutrition[J].
PAPPAS A C, ZOIDIS E, SURAI P F, et al. Selenoproteins and maternal nutrition[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2008 , 151 (4) : 361 –372.
DOI: 10.1016/j.cbpb.2008.08.009 ( 0) 0)
|
| [16] |
SIMON H U, HAJ-YEHIA A, LEVI-SCHAFFER F. Role of reactive oxygen species (ROS) in apoptosis induction[J].
SIMON H U, HAJ-YEHIA A, LEVI-SCHAFFER F. Role of reactive oxygen species (ROS) in apoptosis induction[J]. Apoptosis, 2000 , 5 (5) : 415 –418.
DOI: 10.1023/A:1009616228304 ( 0) 0)
|
| [17] |
丁黎敏, 黄小民, 张卓一, 等. 原花青素对过氧化氢损伤内皮细胞SOD、GSH-Px活性的影响[J].
丁黎敏, 黄小民, 张卓一, 等. 原花青素对过氧化氢损伤内皮细胞SOD、GSH-Px活性的影响[J]. 中国中医急症, 2013 , 22 (5) :714 –716.
( 0) 0)
|
| [18] |
ZHOU Y F, GUO B, YE M J, et al. Protective effect of rutin against H2O2-induced oxidative stress and apoptosis in human lens epithelial cells[J].
ZHOU Y F, GUO B, YE M J, et al. Protective effect of rutin against H2O2-induced oxidative stress and apoptosis in human lens epithelial cells[J]. Current Eye Research, 2015 : 1 –10.
DOI: 10.3109/02713683.2015.1082186 ( 0) 0)
|
| [19] |
CHEN L, SUN L J, LIU Z N, et al. Protection afforded by quercetin against H2O2-induced apoptosis on PC12 cells via activating PI3K/Akt signal pathway[J].
CHEN L, SUN L J, LIU Z N, et al. Protection afforded by quercetin against H2O2-induced apoptosis on PC12 cells via activating PI3K/Akt signal pathway[J]. Journal of Receptors and Signal Transduction, 2016 , 36 (1) : 98 –102.
DOI: 10.3109/10799893.2015.1049363 ( 0) 0)
|




