2. 四川农业大学, 实验动物工程技术中心, 雅安 625014
2. Engineering and Technology Center for Laboratory Animals, Sichuan Agricultural University, Ya'an 625014, China
肥胖症是遗传与环境因素共同作用所致的营养代谢障碍性疾病,肥胖者患Ⅱ型糖尿病、血管粥样硬化、高血压、脂肪肝等风险增加[1]。然而,肥胖及相关疾病在亚洲国家发生率较低,这可能和亚洲人饮食中含有较多的大豆以及大豆相关食物有关[2]。研究表明,亚洲人每日异黄酮的摄入量为25~40 mg,远大于美国人日摄入量[3-4]。大豆异黄酮(soy isoflavone, SIF)是一种植物性雌激素,具有与雌激素相似的分子结构和分子量,能与雌激素受体结合,具弱雌激素样作用。在多个信号通路的作用下,可以减少前脂肪细胞,改善血脂和血糖代谢[5-7],达到减肥降脂的功效[8]。相关资料证实SIF能显著改善机体瘦素(leptin, Lep)水平并调控机体能量代谢[9-10]。Lep是一种由脂肪细胞分泌并能感知和调节机体自身能量的功能性多肽[11],主要生理功能是调节摄食和能量输出。Lep与长型瘦素受体(obese receptor b, OB-Rb)结合后,能够磷酸化激活内源性酪氨酸激酶Janus激酶2(Janus kinase 2, JAK2)分子,活化的JAK2能使受体特定部位的酪氨酸残基(Tyr985和Tyr1138)磷酸化,其中p-Tyr1138是磷酸化的信号转导与转录激活因子3(phosphorylated signal transducer and activator of transcription 3, p-STAT3)的锚定位点,p-STAT3分子被磷酸化后,形成二聚体,进入细胞核内,调节特异的基因转录和蛋白质合成[12-13],影响膜电位和动作电位发放频率,改变神经递质和神经肽Y(neuropeptide Y, NPY)的释放,进而达到调节肥胖的作用。而在哺乳动物细胞系中,细胞因子信号3抑制因子(suppressor of cytokine signaling 3, SOCS3)过量表达时,通过与JAK2分子结合,抑制JAK2所诱导的自身磷酸化和受体磷酸化,能够阻断Lep作用。在外周系统中,肠道无疑是Lep作用的重要部位。因此,为了研究SIF调控肥胖大鼠肠道中OB-Rb及Janus激酶(Janus kinase,JAK)/信号转导与转录激活因子(phosphorylated signal transducer and activator of transcription,STAT)信号转导通路相关因子的变化,探讨SIF对肥胖的干预机制,本试验利用免疫组织化学链霉亲和素-生物素复合物(SABC)染色法,检测在不同剂量SIF干预下大鼠肠道中OB-Rb、JAK2、p-STAT3、SOCS3和NPY分布和表达的变化,以期通过SIF调节脂质代谢,减弱Lep抵抗,改善动物体重。
1 材料与方法 1.1 试验材料 1.1.1 试验动物试验动物为80只5周龄SD雄性大鼠,体重为(140±10) g,购自于四川省人民医院实验动物研究所[使用许可证:SCXK(川)2013-15]。
1.1.2 试验物品及试剂试验大鼠专用基础饲粮、高脂饲粮、垫料均购自四川普莱美生物科技有限公司,试验饲粮组成及营养水平见表 1;SIF提取物购自西安天丰生物科技有限公司,产品批号NF-20140806,高效液相色谱法检测SIF纯度为80%;兔抗鼠OB-Rb、JAK2、p-STAT3、SOCS3、NPY抗体试剂盒均购自北京博奥森生物技术有限公司;即用型SABC-AP试剂盒、二氨基联苯胺(DAB)显色试剂均购自武汉博士德生物工程有限公司。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
Leica冷冻切片机(德国徕卡有限公司)、Nikon50i-BF荧光生物数码显微镜(日本尼康公司)、江苏捷达801形态分析软件(江苏省捷达科技发展有限公司)、超净工作台等。
1.2 试验方法 1.2.1 动物处理将80只大鼠随机分笼,在昼夜交替的自然光下饲养,自由饮水进食,试验期间室内温度保持在(20±2)℃,湿度保持在50%~60%。动物适应环境1周后,随机抓取大鼠分为基础饲粮组(12只)和高脂饲粮组(68只),分别饲喂基础饲粮和高脂饲粮。饲喂8周后,将高脂饲粮组体重大于基础饲粮组大鼠平均体重加1.4倍标准差的大鼠选出(共40只),并随机分为4组,即SIF干预低、中、高剂量组和肥胖对照组,每组10只。低、中、高剂量组大鼠分别灌胃低、中、高剂量(50、150、450 mg/kg BW)的SIF提取物,SIF提取物用0.5%羧甲基钎维素钠溶液溶解,基础饲粮组和肥胖对照组大鼠灌胃不含SIF提取物的0.5%羧甲基钎维素钠溶液,各组大鼠均按照2 mL/kg BW的灌注量进行灌胃。SIF干预5周,记录每周各组大鼠的体重变化。试验中对动物的处置符合中华人民共和国科学技术部《关于善待实验动物的指导性意见》的规定。
1.2.2 取材和切片13周末将大鼠用4%戊巴比妥腹腔注射麻醉后全部处死,迅速分离出各肠段,于4%多聚甲醛溶液进行固定。将固定的组织流水冲洗过夜后,依次梯度酒精脱水、石蜡包埋、切片(厚4~5μm)、烘片后备用。
1.2.3 样品染色与分析每只大鼠选取常规石蜡切片5张,进行苏木精-伊红(HE)染色,光学显微镜下观察组织结构。
取每只大鼠肠道组织常规石蜡切片,进行免疫组织化学SABC染色后检测OB-Rb、JAK2、p-STAT3、SOCS3、NPY的分布与表达。免疫组织化学SABC染色步骤:常规石蜡切片脱蜡后,将切片侵入浓度为3%新鲜配制的过氧化氢(H2O2)中避光反应30 min,然后用磷酸盐缓冲液(PBS)洗3次,95℃抗原修复15 min,10%山羊血清37℃封闭30 min,PBS洗3次,PBS稀释一抗4℃过夜(稀释比例均为1∶200),阴性对照不加一抗,PBS洗3次,PBS稀释二抗1 h(稀释比例均为1∶100),PBS洗3次后滴加SABC 37℃孵育20 min,PBS洗4次后DAB显色,镜下控制反应时间,双蒸水终止显色后双蒸水洗4次,最后脱水、透明、封片、镜检。试验均设阴性对照。
1.2.4 图像采集以及数据处理用光学显微镜观察组织切片,用Nikon50i-BF荧光生物数码显微镜进行照相,每个组织选择5张切片,每张片子随机选择5个视野进行图像采集。在光镜200倍视野面积(4 000μm2)内测定肠道各因子的积分光密度值,并进行组间比较。用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA)。柱状图数据以平均值±标准差(x±SD)表示,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 肥胖大鼠模型的建立从第4周开始,高脂饲粮组大鼠的体重开始大于基础饲粮组大鼠。到第8周末,高脂饲粮组大鼠的平均体重大于基础饲粮组大鼠的平均体重加1.4标准差,达到肥胖大鼠判定标准[14],表明高脂饲粮诱导的大鼠肥胖模型建立成功。
2.2 SIF对膳食诱导肥胖大鼠体重的影响从表 2可知,在SIF干预试验初期(第9周),SIF干预组(低、中、高剂量组)大鼠的体重与肥胖对照组无显著差异(P>0.05)。试验各时期基础饲粮组大鼠体重均极显著低于肥胖对照组(P<0.01)。随着时间的推移,各SIF干预组大鼠体重的增长幅度明显低于肥胖对照组。SIF干预5周后(第13周),与肥胖对照组相比,各SIF干预组大鼠体重均下降,并表现出剂量依赖性,其中中、高剂量组极显著低于肥胖对照组(P < 0.01)。
|
|
表 2 大豆异黄酮干预各时期大鼠体重 Table 2 Body weight of rats at each period of administration of SIF |
HE染色后,光学显微镜下观察发现各组大鼠各肠道组织结构清晰,细胞核染色鲜艳,组织切片完整均匀,各组均没有明显异常病理变化(图 1)。
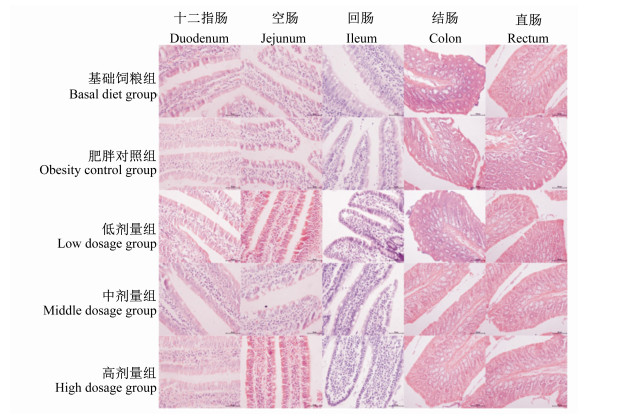
|
图 1 HE染色结果 Figure 1 The results of HE staining (400×) |
光学显微镜下对切片进行观察发现,OB-Rb表达阳性细胞呈现黄褐色,OB-Rb阳性物质多表达于胞质中(图 2,因各组大鼠表现一致,本文仅展示了中剂量组),肠道从外至内的各层组织中以黏膜层中的固有层表达最为丰富,尤以十二指肠较明显。
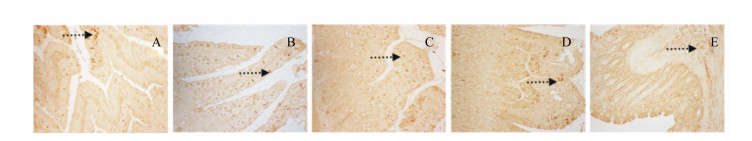
|
图 2 OB-Rb在十二指肠(A)、空肠(B)、回肠(C)、结肠(D)、直肠(E)中的分布 Figure 2 The distribution of OB-Rb in duodenum (A), jejunum (B), ileum (C), colon (D) and rectum (E) (200×) |
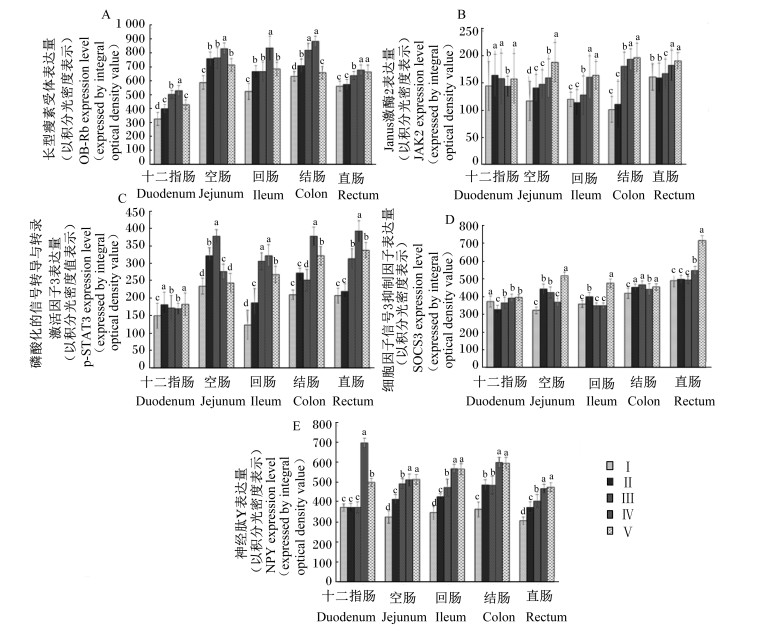
如图 3-A所示,基础饲粮组大鼠OB-Rb在各肠段中的表达量均显著高于肥胖对照组(P<0.05)。OB-Rb的表达量在十二指肠和直肠中表现为随SIF剂量的增加而显著增加(P<0.05);在空肠和回肠中表现为高剂量组显著高于中、低剂量组(P<0.05);而结肠中则表现为高、中剂量组显著高于低剂量组(P<0.05)。
|
Ⅰ:肥胖对照组;Ⅱ:低剂量组;Ⅲ:中剂量组;Ⅳ:高剂量组;Ⅴ:基础饲粮组。同部位数据柱标注相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。 Ⅰ: obesity control group; Ⅱ: low dosage group; Ⅲ: middle dosage group; Ⅳ: high dosage group; Ⅴ: basal diet group. In the same part, data columns with the same small letters mean no significant difference (P > 0.05), and with different small letters mean significant difference (P<0.05). 图 3 大豆异黄酮对大鼠十二指肠、空肠、回肠、结肠、直肠中OB-Rb、JAK2、p-STAT3、SOCS3、NPY表达的影响 Figure 3 Effects of SIF on OB-Rb, JAK2, p-STAT3, SOCS3 and NPY expression in duodenum, jejunum, ileum, colon and rectum of rats |
光学显微镜下观察发现,整个肠道中均有JAK2的表达(图 4,因各组大鼠表现一致,本文仅展示了中剂量组),JAK2阳性反应呈棕褐色或棕黄色。JAK2在肠道各段阳性表达于肠腺、肠绒毛上,黏膜下层也有表达。
|
图 4 JAK2在十二指肠(A)、空肠(B)、回肠(C)、结肠(D)、直肠(E)中的分布 Figure 4 The distribution of JAK2 in duodenum (A), jejunum (B), ileum (C), colon (D) and rectum (E) (200×) |
如图 3-B所示,基础饲粮组大鼠JAK2在各肠段中的表达量均显著高于肥胖对照组(P<0.05)。JAK2在的表达量在十二指肠中表现为低、中剂量组显著高于高剂量组(P<0.05);在空肠中表现为高剂量组显著高于中、低剂量组(P<0.05);在回肠、结肠和直肠中则表现为随SIF剂量的增加而显著增加(P<0.05)。
2.4.3 p-STAT3在肠道中的表达光学显微镜下观察发现,p-STAT3阳性反应的细胞体呈棕褐色或棕黄色(图 5,因各组大鼠表现一致,本文仅展示了中剂量组)。对整个肠道进行观察,发现肠道各段均有p-STAT3的表达,且肠道各段阳性产物表达多分布于肠腺、肠绒毛、黏膜下层上。
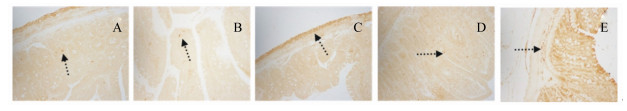
|
图 5 p-STAT3在十二指肠(A)、空肠(B)、回肠(C)、结肠(D)、直肠(E)中的分布 Figure 5 The distribution of p-STAT3 in duodenum (A), jejunum (B), ileum (C), colon (D) and rectum (E) (200×) |
如图 3-C所示,除空肠外,基础饲粮组大鼠p-STAT3在各肠段中的表达量均显著高于肥胖对照组(P<0.05)。p-STAT3的表达量在十二指肠中表现为低剂量组显著高于中、高剂量组(P<0.05);在空肠中表现为中剂量组显著高于低、高剂量组(P<0.05),低剂量组显著高于高剂量组(P<0.05);在回肠中表现为中、高剂量组显著高于低剂量组(P<0.05);在结肠中表现为高剂量组显著高于低、中剂量组(P<0.05),低剂量组显著高于中剂量组(P<0.05);而在直肠中则表现为随SIF剂量的增加而显著增加(P<0.05)。
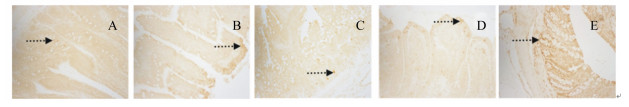
2.4.4 SOCS3在肠道中的表达光学显微镜下观察发现,SOCS3阳性染色呈棕褐色或棕黄色,主要定位于细胞质(图 6,因各组大鼠表现一致,本文仅展示了中剂量组)。在整个肠道中均有SOCS3阳性表达产物,阳性产物集中表达在黏膜层中的固有层。
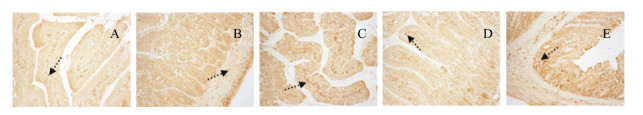
|
图 6 SOCS3在十二指肠(A)、空肠(B)、回肠(C)、结肠(D)、直肠(E)中的分布 Figure 6 The distribution of SOCS3 in duodenum (A), jejunum (B), ileum (C), colon (D) and rectum (E) (200×) |
如图 3-D所示,基础饲粮组大鼠SOCS3在各肠段中的表达量均显著高于肥胖对照组(P<0.05)。SOCS3的表达量在十二指肠中表现为高、中剂量组显著高于低剂量组(P<0.05);在空肠中表现为低、中剂量组显著高于高剂量组(P<0.05);在回肠中表现为低剂量组显著高于中、高剂量组(P<0.05);在结肠中表现为低、中剂量组显著高于高剂量组(P<0.05);在直肠中表现为高剂量组显著高于低、中剂量组(P<0.05)。
2.4.5 NPY在肠道中的表达光学显微镜下观察发现,NPY阳性反应呈棕褐色或棕黄色(图 7,因各组大鼠表现一致,本文仅展示了中剂量组)。在各肠道的浆膜至黏膜下层以及十二直肠区域均有粗大的NPY阳性神经纤维,而在回肠区域NPY阳性神经纤维开始减少。NPY阳性神经纤维分布密度与神经丛的分布可能直接相关,存在小血管的地方几乎都有NPY阳性神经纤维的伴行。
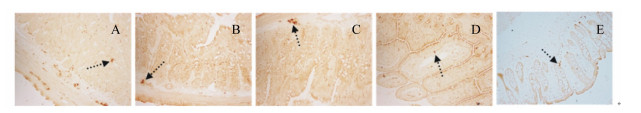
|
图 7 NPY在十二指肠(A)、空肠(B)、回肠(C)、结肠(D)、直肠(E)中的分布 Figure 7 The distribution of NPY in duodenum (A), jejunum (B), ileum (C), colon (D) and rectum (E) (200×) |
如图 3-E所示,基础饲粮组大鼠NPY在各肠段中的表达量均显著高于肥胖对照组(P<0.05)。NPY的表达量在十二指肠和结肠中表现为高剂量组显著高于中、低剂量组(P<0.05);在空肠、回肠和直肠中则表现为随SIF剂量的增加而显著增加(P<0.05)。
3 讨论 3.1 SIF对膳食诱导肥胖大鼠体重的影响近年来,肥胖及相关疾病的患病率迅速增加,尤以西方国家更为明显,肥胖已成为危害公共健康的一个风险因素,因此如何有效减轻或防止肥胖具有重要意义。本研究中SIF干预后可显著降低肥胖大鼠的体重,这与Ali等[9]、Ørgaard等[15]研究结果相一致,肥胖大鼠体重随SIF剂量增加而降低,表明SIF具有减重作用并呈剂量依赖性。研究表明,SIF可显著降低甘油三酯、总胆固醇以及低密度脂蛋白含量,同时提高高密度脂蛋白含量以及低密度脂蛋白和高密度脂蛋白的比值[15-16]。因此,在畜牧业应用中,可将SIF作为一种饲料添加剂,通过抑制脂肪细胞分化[17],缩小脂肪细胞面积[18],减少脂肪沉积[19],降低Lep抵抗,从而改善动物肥胖状态。
3.2 SIF对肥胖大鼠肠道OB-Rb、JAK2、p-STAT3、SOCS3和NPY表达的影响El-Haschimi等[20]调查发现,大多数肥胖患者血清Lep水平显著高于正常人群,称作高Lep血症,但高水平的血清Lep并未使患者体重减轻,提示发生Lep抵抗,并推断这种抵抗是肥胖的根本原因。目前认为Lep抵抗涉及中枢和外周抵抗2种机制[21-25]。数据显示,在饮食诱导肥胖中,Lep抵抗主要发生在血脑屏障缺陷和受体信号转导通路缺陷2个环节[26]。
本试验结果表明,在SIF干预的肥胖大鼠肠道中,OB-Rb、JAK2、p-STAT3、SOCS3以及NPY均有表达,这与Cammisotto等[26]的研究相一致。研究显示SIF是一种相对较强的雌激素受体激动剂,具有潜在的减少前脂肪细胞的作用,其发挥肥胖逆转作用与Lep有关[27],因为脂肪组织是Lep的主要来源,Lep能够穿过血脑屏障为大脑提供机体脂肪储备信息,并进行负反馈调节[28],同时脂肪也会干扰Lep、OB-Rb以及NPY。作为Lep的主要功能受体,OB-Rb在中枢和外周系统均有分布,但主要分布在下丘脑[29],其主要作用是控制饱腹感、能量消耗以及其他神经内分泌功能[30]。JAK/STAT是Lep生物学作用的主要信号通路[31],在啮齿类动物上,下丘脑STAT磷酸化和STAT转录结合的水平常被作为Lep的信号标记。本研究发现,在高脂饲粮诱导的肥胖对照组大鼠的各肠段中,OB-Rb、JAK2、p-STAT3以及NPY的表达量均显著低于基础饲粮组,这可能与肥胖大鼠脂肪的增加密切相关,由于Lep是由脂肪细胞分泌并感知和调节机体自身能量的功能性多肽,随着体内脂肪含量的增加,Lep分泌加速,从而激活JAK/STAT信号通路对脂肪进行负反馈调节。SIF干预肥胖大鼠后肠道OB-Rb表达增加,加快了JAK2的活化以及STAT的磷酸化,从而抑制肠道消化液分泌及物质吸收,减弱Lep抵抗,由此产生抑食和减重效应。SOCS3诱导Lep抵抗的作用已被广泛研究,现已证实,SOCS3在脑中特异性的缺乏能在一定程度上抑制肥胖[32-34]。本试验中SOCS3在各肠段表达不一致,不同剂量间差异不明显,说明SOCS3作为Lep的负性调节因子,在肠道中抑制JAK/STAT的信号通路作用不显著,从而在一定程度上减弱了Lep抵抗作用,缓解了肥胖症状。NPY作为一种食欲刺激神经肽,在食物摄入和能量消耗调节中起着重要的作用,其过度表达会诱导大鼠体重增加[35]。在本试验中,OB-Rb表达量的升高并没有抑制NPY这种促食肽的表达,其反而呈现剂量依赖性的增加,但并没有导致体重的增加。究其原因,虽然NPY表达增加,但作用效果可能不如OB-Rb介导JAK/STAT信号通路对肠道消化吸收的调节。然而Ob-Rb是否参与SIF的调节作用,OB-Rb、JAK2、p-STAT3、SOCS3以及NPY在肠道是否存在相互作用,还需更细致和深入的试验来探寻。
4 结论①SIF可增加肠道OB-Rb的表达,激发JAK/STAT信号转导通路,改善能量代谢,减弱肥胖大鼠Lep抵抗状态。
②SIF对膳食诱导的肥胖大鼠具有减重作用,并在50~450 mg/kg BW范围内呈现剂量依赖性。
| [1] |
MARQUES M D, SANTOS R D, PARGA J R, et al. Relation between visceral fat and coronary artery disease evaluated by multidetector computed tomography[J].
MARQUES M D, SANTOS R D, PARGA J R, et al. Relation between visceral fat and coronary artery disease evaluated by multidetector computed tomography[J]. Atherosclerosis, 2010 , 209 (2) : 481 –486.
DOI: 10.1016/j.atherosclerosis.2009.10.023 ( 0) 0)
|
| [2] |
LLANEZA P, GONZÁLEZ C, FERNANDEZ-IÑARREA J, et al. Soy isoflavones,diet and physical exercise modify serum cytokines in healthy obese postmenopausal women[J].
LLANEZA P, GONZÁLEZ C, FERNANDEZ-IÑARREA J, et al. Soy isoflavones,diet and physical exercise modify serum cytokines in healthy obese postmenopausal women[J]. Phytomedicine, 2011 , 18 (4) : 245 –250.
DOI: 10.1016/j.phymed.2010.07.011 ( 0) 0)
|
| [3] |
WAKAI K, EGAMI I, KATO K, et al. Dietary intake and sources of isoflavones among Japanese[J].
WAKAI K, EGAMI I, KATO K, et al. Dietary intake and sources of isoflavones among Japanese[J]. Nutrition and Cancer, 1999 , 33 (2) : 139 –145.
DOI: 10.1207/S15327914NC330204 ( 0) 0)
|
| [4] |
CHEN Z, ZHENG W, CUSTER L J, et al. Usual dietary consumption of soy foods and its correlation with the excretion rate of isoflavonoids in overnight urine samples among Chinese women in Shanghai[J].
CHEN Z, ZHENG W, CUSTER L J, et al. Usual dietary consumption of soy foods and its correlation with the excretion rate of isoflavonoids in overnight urine samples among Chinese women in Shanghai[J]. Nutrition and Cancer, 1999 , 33 (1) : 82 –87.
DOI: 10.1080/01635589909514752 ( 0) 0)
|
| [5] |
朱翠凤, 张帆, 徐晓燕, 等. 大豆异黄酮等复合抗氧化剂对2型糖尿病患者血脂代谢的影响[J].
朱翠凤, 张帆, 徐晓燕, 等. 大豆异黄酮等复合抗氧化剂对2型糖尿病患者血脂代谢的影响[J]. 中国临床康复, 2004 , 8 (9) :1674 –1676.
( 0) 0)
|
| [6] |
毛光明, 陈江, 夏勇, 等. 大豆异黄酮对大鼠脂质的影响及减肥作用研究[J].
毛光明, 陈江, 夏勇, 等. 大豆异黄酮对大鼠脂质的影响及减肥作用研究[J]. 浙江预防医学, 2007 , 19 (7) :10 –11.
( 0) 0)
|
| [7] |
CEDERROTH C R, VINCIGUERRA M, GJINOVCI A, et al. Dietary phytoestrogens activate AMP-activated protein kinase with improvement in lipid and glucose metabolism[J].
CEDERROTH C R, VINCIGUERRA M, GJINOVCI A, et al. Dietary phytoestrogens activate AMP-activated protein kinase with improvement in lipid and glucose metabolism[J]. Diabetes, 2008 , 57 (5) : 1176 –1185.
DOI: 10.2337/db07-0630 ( 0) 0)
|
| [8] |
MEZEI O, BANZ W J, STEGER R W, et al. Soy isoflavones exert antidiabetic and hypolipidemic effects through the PPAR pathways in obese zucker rats and murine RAW 264.7 cells[J].
MEZEI O, BANZ W J, STEGER R W, et al. Soy isoflavones exert antidiabetic and hypolipidemic effects through the PPAR pathways in obese zucker rats and murine RAW 264.7 cells[J]. The Journal of Nutrition, 2003 , 133 (5) : 1238 –1243.
( 0) 0)
|
| [9] |
ALI A A, VELASQUEZ M T, HANSEN C T, et al. Effects of soybean isoflavones,probiotics,and their interactions on lipid metabolism and endocrine system in an animal model of obesity and diabetes[J].
ALI A A, VELASQUEZ M T, HANSEN C T, et al. Effects of soybean isoflavones,probiotics,and their interactions on lipid metabolism and endocrine system in an animal model of obesity and diabetes[J]. The Journal of Nutritional Biochemistry, 2004 , 15 (10) : 583 –590.
DOI: 10.1016/j.jnutbio.2004.04.005 ( 0) 0)
|
| [10] |
龚华芳, 张亚兴, 王晓东, 等. 大豆异黄酮对卵巢切除大鼠糖脂代谢和血清瘦素、抵抗素表达的影响[J].
龚华芳, 张亚兴, 王晓东, 等. 大豆异黄酮对卵巢切除大鼠糖脂代谢和血清瘦素、抵抗素表达的影响[J]. 暨南大学学报:自然科学版, 2011 , 32 (3) :324 –327.
( 0) 0)
|
| [11] |
ZHANG Y Y, PROENCA R, MAFFEI M, et al. Positional cloning of the mouse obese gene and its human homologue[J].
ZHANG Y Y, PROENCA R, MAFFEI M, et al. Positional cloning of the mouse obese gene and its human homologue[J]. Nature, 1994 , 372 (6505) : 425 –432.
DOI: 10.1038/372425a0 ( 0) 0)
|
| [12] |
BANKS A S, DAVIS S M, BATES S H, et al. Activation of downstream signals by the long form of the leptin receptor[J].
BANKS A S, DAVIS S M, BATES S H, et al. Activation of downstream signals by the long form of the leptin receptor[J]. Journal of Biological Chemistry, 2000 , 275 (19) : 14563 –14572.
DOI: 10.1074/jbc.275.19.14563 ( 0) 0)
|
| [13] |
DARNELL J E, J r. STATs and gene regulation[J].
DARNELL J E, J r. STATs and gene regulation[J]. Science, 1997 , 277 (5332) : 1630 –1635.
DOI: 10.1126/science.277.5332.1630 ( 0) 0)
|
| [14] |
HUANG C, PANG D J, LUO Q H, et al. Soy lsoflavones regulate lipid metabolism through an AKT/mTORC1 pathway in diet-induced obesity (DIO) Male Rats.[J].
HUANG C, PANG D J, LUO Q H, et al. Soy lsoflavones regulate lipid metabolism through an AKT/mTORC1 pathway in diet-induced obesity (DIO) Male Rats.[J]. Molecules, 2016 , 21 (5) : 1 –13.
( 0) 0)
|
| [15] |
ØRGAARDA, JENSENL. The effects of soy isoflavones on obesity[J].
ØRGAARDA, JENSENL. The effects of soy isoflavones on obesity[J]. Experimental Biology and Medicine, 2008 , 233 (9) :1066 –1080.
( 0) 0)
|
| [16] |
LIN Y, MEIJER G W, VERMEER M A, et al. Soy protein enhances the cholesterol-lowering effect of plant sterol esters in cholesterol-fed hamsters[J].
LIN Y, MEIJER G W, VERMEER M A, et al. Soy protein enhances the cholesterol-lowering effect of plant sterol esters in cholesterol-fed hamsters[J]. The Journal of Nutrition, 2004 , 134 (1) : 143 –148.
( 0) 0)
|
| [17] |
TAXVIG C, SPECHT I O, BOBERG J, et al. Dietary relevant mixtures of phytoestrogens inhibit adipocyte differentiation in vitro[J].
TAXVIG C, SPECHT I O, BOBERG J, et al. Dietary relevant mixtures of phytoestrogens inhibit adipocyte differentiation in vitro[J]. Food and Chemical Toxicology, 2013 , 55 : 265 –271.
DOI: 10.1016/j.fct.2012.12.060 ( 0) 0)
|
| [18] |
罗启慧, 刘芸, 唐秀莹, 等. 大豆异黄酮对肥胖大鼠弓状核及垂体α-MSH、POMC、Ob-Rb表达的影响[J].
罗启慧, 刘芸, 唐秀莹, 等. 大豆异黄酮对肥胖大鼠弓状核及垂体α-MSH、POMC、Ob-Rb表达的影响[J]. 华北农学报, 2015 , 30 (4) :84 –89.
( 0) 0)
|
| [19] |
NAAZ A, YELLAY S, ZAKROCZYMSKI M A, et al. The soy isoflavone genistein decreases adipose deposition in mice[J].
NAAZ A, YELLAY S, ZAKROCZYMSKI M A, et al. The soy isoflavone genistein decreases adipose deposition in mice[J]. Endocrinology, 2003 , 114 (8) : 3315 –3320.
( 0) 0)
|
| [20] |
EL-HASCHIMI K, PIERROZ D D, HILEMAN S M, et al. Two defects contribute to hypothalamic leptin resistance in mice with diet-induced obesity[J].
EL-HASCHIMI K, PIERROZ D D, HILEMAN S M, et al. Two defects contribute to hypothalamic leptin resistance in mice with diet-induced obesity[J]. Journal of Clinical Investigation, 2000 , 105 (12) : 1827 –1832.
DOI: 10.1172/JCI9842 ( 0) 0)
|
| [21] |
翟玲玲, 姚兴家, 王博, 等. 瘦素和神经肽Y mRNA与肥胖抵抗的关系[J].
翟玲玲, 姚兴家, 王博, 等. 瘦素和神经肽Y mRNA与肥胖抵抗的关系[J]. 中国公共卫生, 2005 , 21 (3) :259 –260.
( 0) 0)
|
| [22] |
秦培洁, 仝小林. 肥胖的瘦素抵抗机制研究进展[J].
秦培洁, 仝小林. 肥胖的瘦素抵抗机制研究进展[J]. 医学综述, 2010 , 16 (5) :662 –665.
( 0) 0)
|
| [23] |
刘红, 胡永华. 瘦素受体基因和抵抗素基因与超重和肥胖关系的遗传流行病学研究进展[J].
刘红, 胡永华. 瘦素受体基因和抵抗素基因与超重和肥胖关系的遗传流行病学研究进展[J]. 中国慢性病预防与控制, 2008 , 16 (5) :544 –546.
( 0) 0)
|
| [24] |
李晓环, 邹宁. 瘦素信号转导与瘦素抵抗研究进展[J].
李晓环, 邹宁. 瘦素信号转导与瘦素抵抗研究进展[J]. 中国儿童保健杂志, 2009 , 17 (2) :179 –180.
( 0) 0)
|
| [25] |
崔朝辉, 马冠生. 瘦素抵抗发生机制的研究进展[J].
崔朝辉, 马冠生. 瘦素抵抗发生机制的研究进展[J]. 国外医学卫生学分册, 2004 , 31 (2) :101 –104.
( 0) 0)
|
| [26] |
CAMMISOTTO P G, RENAUD C, GINGRAS D, et al. Endocrine and exocrine secretion of leptin by the gastric mucosa[J].
CAMMISOTTO P G, RENAUD C, GINGRAS D, et al. Endocrine and exocrine secretion of leptin by the gastric mucosa[J]. Journal of Histochemistry & Cytochemistry, 2005 , 53 (7) : 851 –860.
( 0) 0)
|
| [27] |
BU L H, SETCHELL K D R, LEPHART E D. Influences of dietary soy isoflavones on metabolism but not nociception and stress hormone responses in ovariectomized female rats[J].
BU L H, SETCHELL K D R, LEPHART E D. Influences of dietary soy isoflavones on metabolism but not nociception and stress hormone responses in ovariectomized female rats[J]. Reproductive Biology and Endocrinology, 2005 , 3 : 58 .
DOI: 10.1186/1477-7827-3-58 ( 0) 0)
|
| [28] |
BRENNAN A M, MANTZOROS C S. Drug insight:the role of leptin in human physiology and pathophysiology-emerging clinical applications[J].
BRENNAN A M, MANTZOROS C S. Drug insight:the role of leptin in human physiology and pathophysiology-emerging clinical applications[J]. Nature Clinical Practice Endocrinology & Metabolism, 2006 , 2 (6) : 318 –327.
( 0) 0)
|
| [29] |
汪晓洲, 马爱群, 王军, 等. 正常大鼠中枢神经瘦素受体的分布[J].
汪晓洲, 马爱群, 王军, 等. 正常大鼠中枢神经瘦素受体的分布[J]. 中华高血压杂志, 2007 , 15 (1) :66 –69.
( 0) 0)
|
| [30] |
ZIGMAN J M, ELMQUIST J K. Minireview:from anorexia to obesity-the yin and yang of body weight control[J].
ZIGMAN J M, ELMQUIST J K. Minireview:from anorexia to obesity-the yin and yang of body weight control[J]. Endocrinology, 2003 , 144 (9) : 3749 –3756.
DOI: 10.1210/en.2003-0241 ( 0) 0)
|
| [31] |
HEGYI K, FVLÖP K, KOVÁCS K, et al. Leptin-induced signal transduction pathways[J].
HEGYI K, FVLÖP K, KOVÁCS K, et al. Leptin-induced signal transduction pathways[J]. Cell Biology International, 2004 , 28 (3) : 159 –169.
DOI: 10.1016/j.cellbi.2003.12.003 ( 0) 0)
|
| [32] |
HOWARD J K, CAVE B J, OKSANEN L J, et al. Enhanced leptin sensitivity and attenuation of diet-induced obesity in mice with haploinsufficiency of Socs3[J].
HOWARD J K, CAVE B J, OKSANEN L J, et al. Enhanced leptin sensitivity and attenuation of diet-induced obesity in mice with haploinsufficiency of Socs3[J]. Nature Medicine, 2004 , 10 (7) : 734 –738.
DOI: 10.1038/nm1072 ( 0) 0)
|
| [33] |
MORI H, HANADA R, HANADA T, et al. Socs3 deficiency in the brain elevates leptin sensitivity and confers resistance to diet-induced obesity[J].
MORI H, HANADA R, HANADA T, et al. Socs3 deficiency in the brain elevates leptin sensitivity and confers resistance to diet-induced obesity[J]. Nature Medicine, 2004 , 10 (7) : 739 –743.
DOI: 10.1038/nm1071 ( 0) 0)
|
| [34] |
ZAMPIERI T T, RAMOS-LOBO A M, FURIGO I C, et al. SOCS3 deficiency in leptin receptor-expressing cells mitigates the development of pregnancy-induced metabolic changes[J].
ZAMPIERI T T, RAMOS-LOBO A M, FURIGO I C, et al. SOCS3 deficiency in leptin receptor-expressing cells mitigates the development of pregnancy-induced metabolic changes[J]. Molecular Metabolism, 2015 , 4 (3) : 237 –245.
DOI: 10.1016/j.molmet.2014.12.005 ( 0) 0)
|
| [35] |
MAHMOODI M, GARDINER J V, ASADI KARAM G R, et al. Implantation of fibre encapsulated RIN 1056a cells transfected with NPY cDNA into the lateral ventricle of rats alters body weight[J].
MAHMOODI M, GARDINER J V, ASADI KARAM G R, et al. Implantation of fibre encapsulated RIN 1056a cells transfected with NPY cDNA into the lateral ventricle of rats alters body weight[J]. Regulatory Peptides, 2005 , 132 (1/2/3) : 80 –84.
( 0) 0)
|




