2. 生命科学研究所, 北京 102206
2. Institute of Life Sciences, Beijing 102206, China
与单胃动物相比,奶牛的生理特点是具有瘤胃,瘤胃可以为多种微生物提供栖息地,而奶牛瘤胃发酵的本质是瘤胃内微生物对饲料纤维素、蛋白质等物质进行发酵、降解,以实现更有效的利用[1],但瘤胃发酵同时会造成能量与氨态氮(NH3-N)的损失以及产生甲烷等,造成环境污染[2]。因此,选择科学、有效的饲料添加剂调控瘤胃发酵是发掘奶牛营养潜力,提高饲料转化率,改善乳品质的重要环节。
茶皂素又称茶皂苷,是一种从茶树种子(茶籽、茶叶籽)中提取的五环三萜类糖甙化合物[3],由7种配基、4种糖体和2种有机羧酸组成[4]。茶皂素已广泛应用于农药生产[5]、化工业[6]、动物养殖[7]等方面,研究表明,茶皂素不仅是一种天然的表面活性剂,而且具有广泛的生物活性作用,可用作反刍动物瘤胃发酵调控剂,改善动物生产性能[8]。来海良等[9]研究报道,在饲粮中添加茶皂素可抑制原虫生长,改善反刍动物的生产性能。Hu等[10]的体外产气试验报道,将8 mg茶皂素添加到30 mL发酵液中,瘤胃发酵液原虫数量可减少79%。王洪荣等[11]研究报道,在山羊饲粮中添加茶皂素和丝兰皂苷混合物可降低瘤胃液pH,降低乙酸/丙酸。Zhou[12]研究结果表明,反刍动物饲粮中添加茶皂素,总挥发性脂肪酸(TVFA)产量没有显著变化,甲烷产量减少,改变了瘤胃发酵模式。综合来看,目前关于茶皂素对奶牛瘤胃发酵模式的调控研究还鲜见报道,尤其是对奶牛瘤胃发酵及瘤胃微生物区系的影响。因此,本试验对泌乳期奶牛灌服茶皂素,研究其对奶牛瘤胃发酵与瘤胃微生物区系的影响,为茶皂素作为奶牛瘤胃发酵添加剂提供试验依据。
1 材料与方法 1.1 试验动物与管理本试验于2014年8月至2014年9月在北京市三元绿荷奶牛养殖中心南口二分场进行。选取12头体况良好、体重为(550±30) kg,日产奶量约为35 kg/d,胎次为2~4胎的健康荷斯坦奶牛。按产奶量、胎次、泌乳期等相近原则随机分为4组,每组3头奶牛。试验期间,饲喂饲粮参考牛场的全混合日粮(total mixed ration, TMR)饲喂方案,试验牛每天07:30、14:30、21:30饲喂和挤奶。TMR饲喂后,试验牛自由运动和饮水。TMR组成及营养水平表 1。
|
|
表 1 TMR组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the TMR (DM basis) |
对照组和试验组均饲喂TMR,由于茶皂素适口性差,试验牛不能固定采食,因此选择每天晨饲前灌服茶皂素,20、30、40 g茶皂素事先分别溶于200 mL水中。试验组分别于晨饲前通过灌服20、30、40 g/d茶皂素,整个试验期共49 d,其中预试期14 d,正试期内每7 d于晨饲前1 h采集瘤胃液。
1.3 样品采集和测定 1.3.1 瘤胃液的采集晨饲前1 h用口腔采样器采集瘤胃液,4层纱布过滤后用便携pH测定仪测定瘤胃液pH。其他样品存入液氮中用于其他瘤胃发酵指标和微生物区系的测定。
1.3.2 瘤胃液NH3-N、挥发性脂肪酸(VFA)、微生物蛋白(MCP)浓度的测定瘤胃液解冻后5 000×g离心10 min,收集上清液用于NH3-N、VFA和MCP浓度的测定。瘤胃液NH3-N浓度采用分光光度计,按照Broderick等[13]的方法测定。瘤胃液MCP浓度采用比色法按照周奕毅[14]的方法测定。瘤胃液VFA浓度以2-乙基丁酸(2-EB)为内标采用气相色谱法,按照胡伟莲等[15]方法测定。
1.3.3 瘤胃液中瘤胃微生物含量的测定 1.3.3.1 瘤胃微生物总DNA的提取采用珠磨-十六烷基三甲基溴化铵(CTAB)法提取总DNA[16],取1.5 mL瘤胃液1 000×g离心弃上清液,加入800μL CTAB缓冲液和灭菌锆珠(0.3 g 0.1 mm, 0.1 g 0.5 mm)后置于珠磨仪上破碎2 min,70℃水浴20 min后13 000×g离心10 min,取500μL上清液与500μL饱和酚/氯仿/异戊醇(25 : 24 : 1)混合后13 000×g离心10 min,取300μL上清液与280μL异丙醇混匀后室温静置5 min沉淀DNA,离心后用TE缓冲液溶解DNA,用微量紫外可见分光光度计测定提取的总DNA浓度和纯度,-20℃保存。
1.3.3.2 实时定量PCR(qRT-PCR)的反应条件及引物的设计与合成qRT-PCR的反应条件参照SYBR Premix Ex TaqTM试剂建立20μL反应体系及反应条件[17]。qRT-PCR的引物参照文献[18-20]报道的瘤胃总细菌总菌(total bacteria)、真菌(fungi)、甲烷菌(methanogen)、原虫(protozoa)、产琥珀酸丝状杆菌(Fibrobacter succinogenes)、黄色瘤胃球菌(Ruminococcus flavefaciens)、溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)、白色瘤胃球菌(Ruminococcus albus)引物序列(表 2)。
|
|
表 2 qRT-PCR引物信息 Table 2 Information of primers for qRT-PCR |
从瘤胃微生物总DNA中扩增细菌16S rDNA检测引物特异性。qRT-PCR反应体系:Premix TaqTM (Ex TaqTM Version 2.0) 10μL,上、下游引物各0.5μL,模板DNA 0.5μL,灭菌双蒸水8.5μL,总体积为20μL。qRT-PCR反应参数:95℃变性7 min;95℃1 min,55℃l min,72℃1 min,35个循环;72℃延伸7 min。
1.4 数据统计与分析根据qRT-PCR测得的阈值循环(Ct)和以下公式将目标菌含量表示为相对于瘤胃总菌16S rDNA的百分比:
目标菌含量(%)=100×2-(Ct目标菌-Ct总细菌)[17]。
使用Excel整理试验数据,采用SAS 9.2软件中的one-way ANOVE进行单因素方差分析,采用Duncan氏法进行平均值的多重比较,P < 0.05为差异显著性判定标准。
2 结果 2.1 茶皂素对瘤胃发酵的影响灌服茶皂素后所得瘤胃发酵参数如表 3所示。与对照组相比,添加30、40 g/d茶皂素均显著降低了瘤胃液pH(P < 0.05),添加20、30、40 g/d茶皂素均显著降低了瘤胃液NH3-N浓度(P < 0.05),添加40 g/d茶皂素显著降低了瘤胃液乙酸/丙酸(P < 0.05),添加30、40 g/d茶皂素均显著提高了瘤胃液MCP浓度(P < 0.05),30 g/d茶皂素组与对照组相比MCP提高了20.20%,添加20、30、40 g/d茶皂素均显著提高了瘤胃液丙酸和丁酸浓度(P < 0.05),TVFA和乙酸浓度各组间差异不显著(P>0.05)。
|
|
表 3 茶皂素对瘤胃发酵参数的影响 Table 3 Effects of tea saponin on ruminal fermentation parameters |
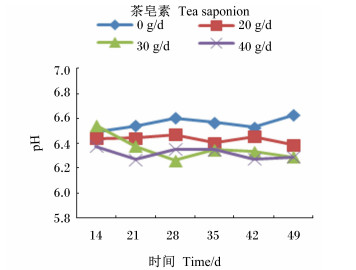
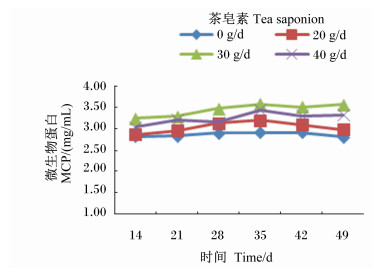
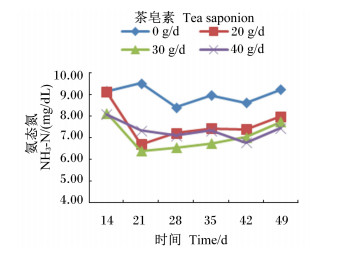
由图 1至图 3可见,茶皂素在各个时间点均可以降低瘤胃液pH、NH3-N浓度,可升高MCP浓度,但pH、NH3-N浓度均未超出正常的生理范围,并且随着时间的变化,变化规律并不一致。其中pH、NH3-N浓度变化没有明显的规律,MCP产量在30 g/d组最高。
|
图 1 茶皂素对瘤胃液pH的影响 Figure 1 Effect of tea saponin on rumen fluid pH |
|
图 2 茶皂素对瘤胃液MCP浓度的影响 Figure 2 Effect of tea saponin on rumen fluid MCP concentration |
|
图 3 茶皂素对瘤胃液NH3-N浓度的影响 Figure 3 Effect of tea saponin on rumen fluid NH3-N concentration |
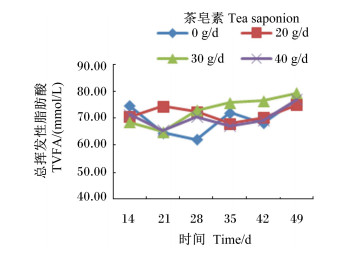
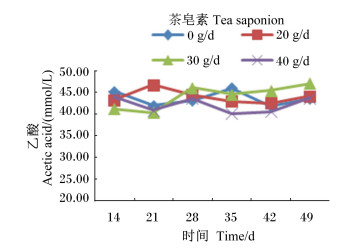
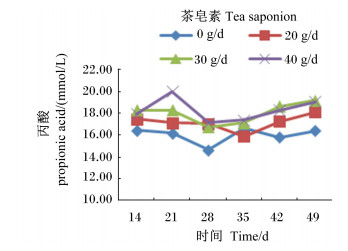
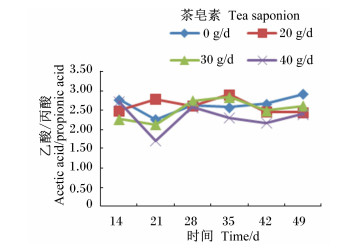
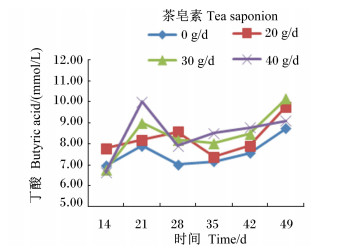
由图 4至图 8可见,茶皂素可升高各时间点丙酸、丁酸浓度,总体上降低乙酸/丙酸,而TVFA、乙酸浓度没有明显变化。随着时间的变化,丙酸、丁酸浓度有先增加后降低,再升高的趋势,而乙酸/丙酸没有明显的变化规律,在40 g/d茶皂素组相对较低。
|
图 4 茶皂素对瘤胃液总挥发性脂肪酸浓度的影响 Figure 4 Effect of tea saponin on rumen fluid TVFA concentration |
|
图 5 茶皂素对瘤胃液乙酸浓度的影响 Figure 5 Effect of tea saponin on rumen fluid acetic acid concentration |
|
图 6 茶皂素对瘤胃液丙酸浓度的影响 Figure 6 Effect of tea saponin on rumen fluid propionic acid concentration |
|
图 7 茶皂素对瘤胃液乙酸/丙酸的影响 Figure 7 Effect of tea saponin on rumen fluid acetic acid/propionic acid |
|
图 8 茶皂素对瘤胃液丁酸浓度的影响 Figure 8 Effect of tea saponin on rumen fluid butyric acid concentration |
利用1.5%琼脂糖凝胶电泳对反转录PCR产物进行检测的结果见图 9。每个扩增产物均与预期扩增片段大小相符,并且扩增所得的目的片段均呈1条的亮带,无杂带和拖尾现象,说明设计的引物及提取的基因组DNA均可用于qRT-PCR。
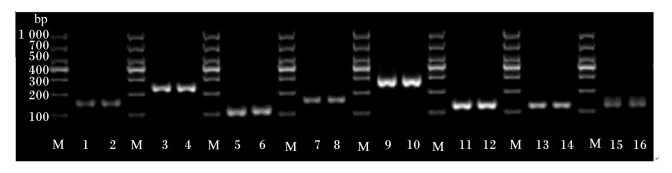
|
M:DNA分子质量标准;1、2:总菌(130 bp);3、4:原虫(250 bp);5、6:真菌(120 bp);7、8:黄色瘤胃球菌(190 bp);9、10:白色瘤胃球菌(270 bp);11、12:甲烷菌(140 bp);13、14:产琥珀酸丝状杆菌(134 bp);15、16:溶纤维丁酸弧菌(136 bp)。 M: DNA molecular weight marker; lanes l and 2: total bacteria (130 bp); lanes 3 and 4: protozoa (250 bp); lanes 5 and 6: fungi (120 bp); lanes 7 and 8: Ruminococcus flavefaciens (190 bp); lanes 9 and 10: Ruminococcus albus (270 bp); lanes 11 and 12: methanogens (140 bp); lanes 13 and 14: Fibrobacter succinogenes (134 bp); lanes 15 and 16: Butyrivibrio fibrisolvens (136 bp). 图 9 瘤胃细菌、真菌和原虫DNA反转录PCR结果 Figure 9 Reverse transcription PCR results of DNA of bacteria, fungi and protozoa in rumen |
灌服茶皂素后对瘤胃微生物含量的影响如表 4所示。与对照组相比,添加20、30、40 g/d茶皂素组与对照组相比均显著降低了瘤胃液原虫、溶纤维丁酸弧菌含量(P < 0.05),对真菌、甲烷菌、黄色瘤胃球菌、白色瘤胃球菌、产琥珀酸丝状杆菌含量没有显著影响(P>0.05)。
|
|
表 4 茶皂素对瘤胃微生物含量的影响 Table 4 Effects of tea saponin on rumen microorganism contents |
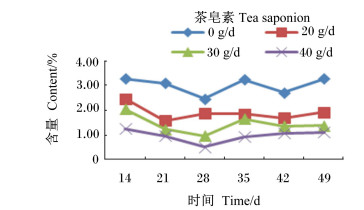
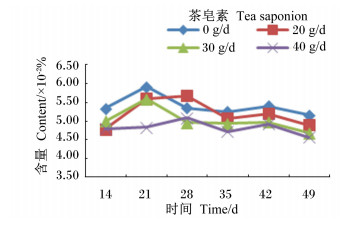
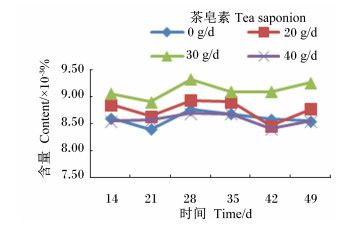
由图 10至图 16可知,茶皂素对各个时间点的原虫、溶纤维丁酸弧菌均有明显的抑制作用,真菌、甲烷菌、白色瘤胃球菌、产琥珀酸丝状杆菌含量没有明显变化。随着时间的变化,真菌、白色瘤胃球菌含量有先升高后下降的趋势,其他各菌没有明显的变化规律,但随着茶皂素剂量的增加,原虫、溶纤维丁酸弧菌含量下降明显,黄色瘤胃球菌、白色瘤胃球菌、甲烷菌、产琥珀酸丝状杆菌含量变化趋势没有明显的规律。
|
图 10 茶皂素对瘤胃液原虫含量的影响 Figure 10 Effect of tea saponin on rumen fluid protozoa content |
|
图 11 茶皂素对瘤胃液真菌含量的影响 Figure 11 Effect of tea saponin on rumen fluid fungi content |
|
图 12 茶皂素对瘤胃液黄色瘤胃球菌含量的影响 Figure 12 Effect of tea saponin on rumen fluid Ruminococcus flavefaciens content |
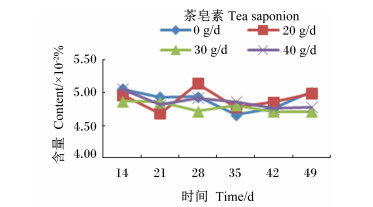
|
图 13 茶皂素对瘤胃液甲烷菌含量的影响 Figure 13 Effect of tea saponin on rumen fluid methanogen content |
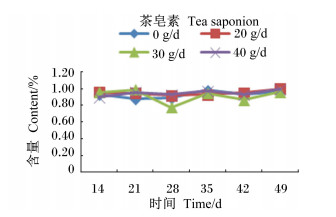
|
图 14 茶皂素对瘤胃液产琥珀酸丝状杆菌含量的影响 Figure 14 Effect of tea saponin on rumen fluid Fibrobacter succinogenes content |
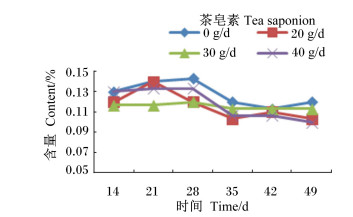
|
图 15 茶皂素对瘤胃液白色瘤胃球菌含量的影响 Figure 15 Effect of tea saponin on rumen fluid Ruminococcus albus content |
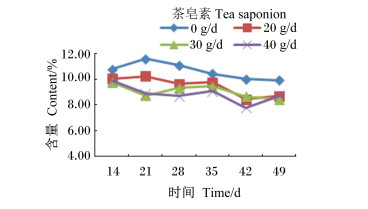
|
图 16 茶皂素对瘤胃液溶纤维丁酸弧菌含量的影响 Figure 16 Effect of tea saponin on rumen fluid Butyrivibrio fibrisolvens content |
瘤胃液pH是评价瘤胃发酵状况的基本指标,主要受到饲粮精粗比等因素的影响[21]。瘤胃是瘤胃微生物发酵的直接场所,pH过高或过低对于瘤胃微生物正常生长、发育及发酵均有不利的影响[22]。原虫、厌氧性真菌、细菌生存的最适pH分别为5.8、7.5和6~7,而正常的奶牛瘤胃液的pH在5.5~6.8变化,最佳pH在6.0~6.3[23],可见中性至弱酸性环境是奶牛瘤胃微生物生存的最佳环境。研究证明,在反刍动物的饲粮中添加茶皂素,可显著影响瘤胃液pH。周奕毅[14]报道添加茶皂素,可显著降低湖羊瘤胃液pH,这与叶均安等[24]、Hu等[25]的研究结果一致。本试验发现,添加30、40 g/d茶皂素均显著降低了奶牛瘤胃液pH,但各试验组瘤胃液pH在6.32~6.42内波动,且均处于正常生理范围之内,因此对奶牛瘤胃微生物正常代谢不会产生不利影响。瘤胃液pH变化的原因可能是去除瘤胃原虫影响了淀粉和可溶性糖的爆发性发酵,其产物丁酸、乳酸增多,而瘤胃壁的吸收速度较慢[26],因此原虫数量的降低可造成瘤胃液pH的下降。
反刍动物瘤胃中有55%~95%的碳水化合物经过瘤胃发酵,分解转化为丙酮酸,进一步分解为VFA。VFA是反刍动物重要能量来源,为反刍动物提供70%~80%的能量,瘤胃代谢活动水平就是以VFA浓度及组成比例作为衡量指标[11]。研究发现,在反刍动物的饲粮中添加茶皂素,可以改变其瘤胃发酵模式。叶均安[27]研究报道,茶皂素在湖羊体外试验中,能显著增加丙酸浓度。林波等[28]研究报道,茶皂素通过改变瘤胃发酵产生的VFA组成调控瘤胃发酵模式,其正效应的原理主要是由于降低了乙酸/丙酸,这与张婷婷[29]瘤胃发酵研究一致。本试验研究发现,对奶牛灌服茶皂素,显著增高了丙酸与丁酸浓度,降低了乙酸/丙酸,TVFA浓度无显著变化。由此可见,茶皂素可以通过改变奶牛瘤胃发酵模式,提供更多能量,改善饲料转化率。
NH3-N是奶牛瘤胃代谢过程中重要的产物,其浓度是瘤胃内环境好坏的重要指标。在瘤胃微生物中,约有80%的细菌是以NH3-N为生长的唯一氮源,而瘤胃原虫不能利用NH3-N合成所需的蛋白质,但可以产生大量的NH3-N[30]。有研究表明,茶皂素可以通过抑制原虫的活性降低瘤胃NH3-N的浓度[31]。叶均安[27]报道,在体外培养时添加0.25%、0.50%和1.00%的茶皂素,可不同程度地降低培养底物中的NH3-N浓度。苑文珠[32]报道,在湖羊瘤胃培养液中添加茶皂素,可显著降低培养底物中的NH3-N浓度。本试验研究发现,对奶牛灌服不同浓度茶皂素,均显著降低了NH3-N的浓度,但均在正常范围内。韩正康等[33]认为,当瘤胃液NH3-N浓度为8.5 mg/dL时,瘤胃微生物合成蛋白质的能力达到饱和,即使超过这一浓度也不会提高MCP产量。NH3-N浓度过高,NH3-N会被瘤胃壁吸收,导致血浆中尿素氮浓度过高,加重机体对氮的代谢负担[34]。奶牛灌服茶皂素,能降低NH3-N浓度,会减轻其对瘤胃微生物的负效应[35]。
MCP是反刍动物主要的氮源供应者[36],能提供动物营养所需的40%~80%的氮源量。因此,MCP代谢的好坏决定了瘤胃微生物区系的营养代谢水平[37]。瘤胃微生物中细菌可利用瘤胃发酵产物合成MCP,随食糜进入真胃为机体提供一半以上所需的反刍动物蛋白质。原虫不能自身合成蛋白质,只能靠吞噬细菌作为氮源,而在其自溶前到达真胃的比例很小[38]。因此去除原虫,无疑将会降低蛋白质的瘤胃发酵作用,增加蛋白质的利用效率。Bird等[39]研究证实,去除原虫可明显提高十二指肠中总氮、非NH3-N、各类氨基酸以及总氨基酸的流通率,使瘤胃MCP的排出量提高20%。苑文珠等[40]研究报道,饲粮添加茶皂素到湖羊瘤胃培养液中,可抑制原虫活性,提高MCP的产量,0.8%的剂量效果最佳,与胡伟莲[41]对波尔山羊研究结果一致。本试验研究发现,在奶牛饲养过程,辅以灌服茶皂素,MCP浓度显著升高,而茶皂素对奶牛瘤胃液MCP浓度的影响机制还有待深入研究。
3.2 茶皂素对奶牛瘤胃微生物区系的影响反刍动物瘤胃中栖息着大量、种类多样的微生物,主要有瘤胃原虫、细菌和真菌[42],而瘤胃发酵的实质为瘤胃微生物帮助动物机体消化纤维素、半纤维素等植物物质,因此,瘤胃微生物及其之间的关系成了瘤胃发酵调控的研究的重要部分。
目前对于原虫去留有2种观点,一种认为瘤胃原虫可降解纤维素,并具有稳定pH的作用,因此有保留的必要性;另一种则认为,瘤胃原虫吞噬细菌占瘤胃微生物关系的主导地位,并且其自溶而亡,无法为宿主提供大量MCP,所以去除原虫对动物生产更有利。研究发现,茶皂素对反刍动物瘤胃原虫具有显著抑制作用。叶均安等[43]发现在体外培养底物中分别添加0.25%、0.50%和1.00%茶皂素,瘤胃原虫生长受到可不同程度地抑制,瘤胃发酵状况得到改善。郭兴凤等[44]证实茶皂素能显著降低瘤胃液原虫数量,将10、20、30、40 g茶皂素分别添加到每千克培养基上可使瘤胃原虫数量分别降低19%、25%、45%和79%。Daiz等[45]在绵羊饲粮(315 g/只)中分别添加25和50 g的植物皂素,结果发现与对照组相比,原虫数量分别降低了57%和84%。本试验研究发现,对奶牛灌服茶皂素,奶牛瘤胃液原虫含量显著降低。分析茶皂素的抗虫作用原理可能是,茶皂素通过与瘤胃原虫隔膜表面胆固醇复合,使其无法修复或脱落,导致细胞膜破坏,使细胞内容物渗漏,达到抗虫效果[46]。
细菌与真菌在反刍动物降解饲粮中纤维物质过程中发挥了80%的作用。有研究报道,在体外,瘤胃液真菌纤维素分解酶活性比瘤胃主要纤维素分解细菌产生的酶活性高[47],但是由于真菌相对于细菌繁殖速度来说较慢,使得真菌在瘤胃发酵中并不占主导地位,瘤胃细菌在纤维消耗中占主要地位。瘤胃内纤维降解细菌主要是产琥珀酸丝状杆菌、白色瘤胃球菌、黄色瘤胃球菌和溶纤维丁酸弧菌[48]。Mao等[37]发现添加茶皂素对黄色瘤胃球菌和产琥珀酸丝状杆菌的数量均无影响。张婷婷等[49]研究报道,添加茶皂素对真菌数量几乎没有影响。本试验研究发现,茶皂对瘤胃细菌和真菌的影响作用具有选择性,奶牛灌服茶皂素,溶纤维丁酸弧菌含量显著减少,产琥珀酸丝状杆菌、白色瘤胃球菌、黄色瘤胃球菌含量没有显著变化,真菌含量有减少的趋势,但差异不显著。对于这种结果的原因,可能是因为琥珀酸丝状杆菌为革兰氏阴性菌,其细胞壁有双层膜,Wang等[50]报道革兰氏阴性菌要比瘤胃球菌这种革兰氏阳性菌对外界物质有着更高的耐受力。虽然黄色瘤胃球菌、白色瘤胃球菌是革兰氏阳性菌,但这2种细菌的细胞膜外也有类似于革兰氏阴性细菌的脂多糖层[51],可以阻止茶皂素这样的外源物质。
反刍动物瘤胃发酵产生甲烷的来源有2个,一个是原虫自身代谢过程产生,另一个是甲烷菌产生。研究发现,反刍动物瘤胃内,有10%~20%的甲烷菌是和原虫共生的[52],这部分甲烷菌依附于原虫表面既有利于产生甲烷,又有利于原虫的生长,两者为互利共生关系。Vogels等[53]研究表明,原虫数量的减少,以及产甲烷菌合成甲烷的原料氢气产量的降低,都抑制了甲烷的产生。本试验研究发现,在奶牛瘤胃中添加茶皂素,甲烷菌的含量差异不显著,但Guo等[54]研究发现,茶皂素抑制了甲烷菌的甲烷合成关键酶基因mcrA的表达,降低了甲烷菌的活性。研究分析可知,茶皂素对甲烷菌的影响方式可能是通过2种方式,一种是通过抑制与其共生的瘤胃原虫,进而影响甲烷菌;另一种是直接作用于甲烷菌,降低其活性,但对其数量无显著影响。茶皂素对甲烷产量的影响机理有待深入研究。
4 结论①茶皂素可显著降低奶牛瘤胃液pH、NH3-N浓度,但均未超出正常生理范围,可显著提高牛奶瘤胃液丙酸、丁酸、MCP浓度,降低乙酸/丙酸,TVFA浓度无显著变化。
②茶皂素可显著降低奶牛瘤胃液原虫、溶纤维丁酸弧菌含量,而对瘤胃液真菌、产琥珀酸丝状杆菌、白色瘤胃球菌、黄色瘤胃球菌、甲烷菌含量无显著影响。
③综合认为,30 g/d茶皂素的剂量对奶牛较为适宜。
| [1] |
王超, 刘国道. 瘤胃微生物降解纤维素的研究进展[J].
王超, 刘国道. 瘤胃微生物降解纤维素的研究进展[J]. 安徽农业科学, 2007 , 35 (13) :3771 –3722.
( 0) 0)
|
| [2] |
JOHNSON K, HUYLER M, WESTBERG H, et al. Measurement of methane emissions from ruminant livestock using a sulfur hexafluoride tracer technique[J].
JOHNSON K, HUYLER M, WESTBERG H, et al. Measurement of methane emissions from ruminant livestock using a sulfur hexafluoride tracer technique[J]. Environmental Science & Technology, 1994 , 28 (2) : 359 –362.
( 0) 0)
|
| [3] |
李俊, 张爱玉, 齐永杰, 等. 茶树油粕中茶皂素研究进展[J].
李俊, 张爱玉, 齐永杰, 等. 茶树油粕中茶皂素研究进展[J]. 食品科学, 2012 , 33 (1) :276 –279.
( 0) 0)
|
| [4] |
张开慧. 茶皂素的国内外研究进展[J].
张开慧. 茶皂素的国内外研究进展[J]. 西部大开发, 2011 (2) :33 –34.
( 0) 0)
|
| [5] |
夏春华, 杨钟鸣, 朱伯荣, 等. 茶皂素在农药工业中应用研究进展[J].
夏春华, 杨钟鸣, 朱伯荣, 等. 茶皂素在农药工业中应用研究进展[J]. 茶叶科学, 2000 , 20 (2) :82 –88.
( 0) 0)
|
| [6] |
张国运, 曾丽云, 吴建鹏, 等. 茶皂素提取工艺及其应用研究进展[J].
张国运, 曾丽云, 吴建鹏, 等. 茶皂素提取工艺及其应用研究进展[J]. 日用化学工业, 2006 , 36 (3) :174 –177.
( 0) 0)
|
| [7] |
杨强, 张石蕊. 茶皂素在动物生产中的应用[J].
杨强, 张石蕊. 茶皂素在动物生产中的应用[J]. 中国饲料, 2007 , 7 (8) :8 –10.
( 0) 0)
|
| [8] |
WANG J K, YE J A, LIU J X. Effects of tea saponins on rumen microbiota, rumen fermentation, methane production and growth performance-a review[J].
WANG J K, YE J A, LIU J X. Effects of tea saponins on rumen microbiota, rumen fermentation, methane production and growth performance-a review[J]. Tropical Animal Health and Production, 2012 , 44 (4) : 697 –706.
DOI: 10.1007/s11250-011-9960-8 ( 0) 0)
|
| [9] |
来海良, 王一义. 茶皂素对湖羊瘤胃培养物发酵的影响[J].
来海良, 王一义. 茶皂素对湖羊瘤胃培养物发酵的影响[J]. 现代农业科技, 2010 (23) :300, 302 .
( 0) 0)
|
| [10] |
HU W L, LIU J X, YE J A, et a1. Effect of tea saponin on rumen fermentation in vitro[J].
HU W L, LIU J X, YE J A, et a1. Effect of tea saponin on rumen fermentation in vitro[J]. Animal Feed Science and Technology, 2005 , 120 (3/4) : 333 –339.
( 0) 0)
|
| [11] |
王洪荣, 陈旭伟, 王梦芝. 茶皂素和丝兰皂苷对山羊人工瘤胃发酵和瘤胃微生物的影响[J].
王洪荣, 陈旭伟, 王梦芝. 茶皂素和丝兰皂苷对山羊人工瘤胃发酵和瘤胃微生物的影响[J]. 中国农业科学, 2011 , 44 (8) :1710 –1719.
( 0) 0)
|
| [12] |
ZHOU Y Y, MAO H L, JIANG F, et al. Inhibition of rumen methanogenesis by tea saponins with reference to fermentation pattern and microbial communities in Hu sheep[J].
ZHOU Y Y, MAO H L, JIANG F, et al. Inhibition of rumen methanogenesis by tea saponins with reference to fermentation pattern and microbial communities in Hu sheep[J]. Animal Feed Science and Technology, 2011 , 166-167 : 93 –100.
DOI: 10.1016/j.anifeedsci.2011.04.007 ( 0) 0)
|
| [13] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J].
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980 , 63 (1) : 64 –75.
DOI: 10.3168/jds.S0022-0302(80)82888-8 ( 0) 0)
|
| [14] |
周奕毅.茶皂素抑制湖羊甲烷生成的微生物学机制研究[D].硕士学位论文.杭州:浙江大学, 2009.
http://cdmd.cnki.com.cn/article/cdmd-10335-2010144304.htm
( 0) 0)
|
| [15] |
胡伟莲, 王佳堃, 吕建敏, 等. 瘤胃体外发酵产物中的甲烷和有机酸含量的快速测定[J].
胡伟莲, 王佳堃, 吕建敏, 等. 瘤胃体外发酵产物中的甲烷和有机酸含量的快速测定[J]. 浙江大学学报:农业与生命科学版, 2006 , 32 (2) :217 –221.
( 0) 0)
|
| [16] |
BVRGMANN H, PESARO M, WIDMER F, et al. A strategy for optimizing quality and quantity of DNA extracted from soil[J].
BVRGMANN H, PESARO M, WIDMER F, et al. A strategy for optimizing quality and quantity of DNA extracted from soil[J]. Journal of Microbiological Methods, 2001 , 45 (1) : 7 –20.
DOI: 10.1016/S0167-7012(01)00213-5 ( 0) 0)
|
| [17] |
刘薇, 辛杭书, 张永根, 等. 海南霉素对瘤胃发酵模式、甲烷生成和微生物区系的影响[J].
刘薇, 辛杭书, 张永根, 等. 海南霉素对瘤胃发酵模式、甲烷生成和微生物区系的影响[J]. 畜牧兽医学报, 2012 , 43 (2) :242 –249.
( 0) 0)
|
| [18] |
DENMAN S E, MCSWEENEY C S. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J].
DENMAN S E, MCSWEENEY C S. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J]. FEMS Microbiology Ecology, 2006 , 58 (3) : 572 –582.
DOI: 10.1111/fem.2006.58.issue-3 ( 0) 0)
|
| [19] |
DENMAN S E, TOMKINS N W, MCSWEENEY C S. Quantitation and diversity analysisof ruminal methanogenic populations in response to the antimethanogenic compound bromochloromethane[J].
DENMAN S E, TOMKINS N W, MCSWEENEY C S. Quantitation and diversity analysisof ruminal methanogenic populations in response to the antimethanogenic compound bromochloromethane[J]. FEMS Microbiology Ecology, 2007 , 62 (3) : 313 –322.
DOI: 10.1111/fem.2007.62.issue-3 ( 0) 0)
|
| [20] |
赵玉华.瘤胃微生物Real Time PCR定量方法的建立及其应用[D].博士学位论文.北京:中国农业科学院, 2005.
http://cdmd.cnki.com.cn/article/cdmd-82101-2005114962.htm
( 0) 0)
|
| [21] |
汪水平, 王加启, 龚月生, 等. 日粮精粗比对泌乳奶牛瘤胃及小肠pH值的影响[J].
汪水平, 王加启, 龚月生, 等. 日粮精粗比对泌乳奶牛瘤胃及小肠pH值的影响[J]. 中国奶牛, 2007 (增刊) :37 –40.
( 0) 0)
|
| [22] |
HU W L, LIU J C, WU Y M, et al. Effects of tea saponins on in vitro ruminal fermentation and growth performance in growing Boer goat[J].
HU W L, LIU J C, WU Y M, et al. Effects of tea saponins on in vitro ruminal fermentation and growth performance in growing Boer goat[J]. Archives of Animal Nutrition, 2006 , 60 (1) : 89 –97.
DOI: 10.1080/17450390500353119 ( 0) 0)
|
| [23] |
王庆丽, 田兰英, 赵仁义, 等. 影响奶牛瘤胃pH值的因素[J].
王庆丽, 田兰英, 赵仁义, 等. 影响奶牛瘤胃pH值的因素[J]. 河南畜牧兽医:综合版, 2008 , 29 (10) :36 –37.
( 0) 0)
|
| [24] |
叶均安, 板桥久雄, 刘建新, 等. 茶皂素对瘤胃培养物发酵的影响[J].
叶均安, 板桥久雄, 刘建新, 等. 茶皂素对瘤胃培养物发酵的影响[J]. 中国畜牧杂志, 2001 , 37 (5) :29 –30.
( 0) 0)
|
| [25] |
HU W L, WU Y M, LIU J X, et al. Tea saponins affect in vitro fermentation and methanogenesis in faunated and defaunated rumen fluid[J].
HU W L, WU Y M, LIU J X, et al. Tea saponins affect in vitro fermentation and methanogenesis in faunated and defaunated rumen fluid[J]. Journal of Zhejiang University Science B, 2005 , 6 (8) : 787 –792.
( 0) 0)
|
| [26] |
张庆茹. 瘤胃原虫对瘤胃营养物质代谢的影响研究进展[J].
张庆茹. 瘤胃原虫对瘤胃营养物质代谢的影响研究进展[J]. 中国牛业科学, 2006 , 32 (1) :49 –51.
( 0) 0)
|
| [27] |
叶均安. 茶皂素对湖羊生产性能的影响[J].
叶均安. 茶皂素对湖羊生产性能的影响[J]. 饲料研究, 2001 (6) :33 .
( 0) 0)
|
| [28] |
林波, 陆燕. 植物提取物调控反刍动物瘤胃发酵的研究进展[J].
林波, 陆燕. 植物提取物调控反刍动物瘤胃发酵的研究进展[J]. 饲料工业, 2009 , 30 (19) :27 –31.
( 0) 0)
|
| [29] |
张婷婷.茶皂甙对瘤胃发酵、甲烷产量及毒性机理研究[D].硕士学位论文.泰安:山东农业大学, 2011:4-64.
http://cdmd.cnki.com.cn/article/cdmd-10434-1011098004.htm
( 0) 0)
|
| [30] |
王欢莉.山羊瘤胃原虫与细菌之间氮周转规律与机制的研究[D].博士学位论文.扬州:扬州大学, 2014:21-28.
http://cdmd.cnki.com.cn/article/cdmd-11117-1014355864.htm
( 0) 0)
|
| [31] |
邓代君, 王金合, 杜晋平, 等. 植物提取物对瘤胃发酵的调控作用[J].
邓代君, 王金合, 杜晋平, 等. 植物提取物对瘤胃发酵的调控作用[J]. 饲料工业, 2009 , 30 (8) :5 –6.
( 0) 0)
|
| [32] |
苑文珠.茶皂素对湖羊生产性能及瘤胃发酵的影响[D].硕士学位论文.杭州:浙江大学, 2002:1-32.
http://cdmd.cnki.com.cn/article/cdmd-10335-2003041007.htm
( 0) 0)
|
| [33] |
韩正康, 陈杰.
反刍动物瘤胃的消化和代谢[M]. 北京: 科学出版社, 1988 : 1 -244.
( 0) 0)
|
| [34] |
COTTA M A, RUSSELL J B. Effect of peptides and amino acids on efficiency of rumen bacterial protein synthesis in continuous culture[J].
COTTA M A, RUSSELL J B. Effect of peptides and amino acids on efficiency of rumen bacterial protein synthesis in continuous culture[J]. Journal of Dairy Science, 1982 , 65 (2) : 226 –234.
DOI: 10.3168/jds.S0022-0302(82)82181-4 ( 0) 0)
|
| [35] |
韦学玉, 阎宏. 反刍动物瘤胃功能调控技术的研究进展[J].
韦学玉, 阎宏. 反刍动物瘤胃功能调控技术的研究进展[J]. 养殖与饲料, 2006 (7) :34 –37.
( 0) 0)
|
| [36] |
BARAN M, BOD'A K, SIROKA P. The effect of monensin on rumen fermentation in sheep fed on all-roughage and barley/roughage diets[J].
BARAN M, BOD'A K, SIROKA P. The effect of monensin on rumen fermentation in sheep fed on all-roughage and barley/roughage diets[J]. Animal Feed Science and Technology, 1986 , 15 (1) : 7 –12.
DOI: 10.1016/0377-8401(86)90033-7 ( 0) 0)
|
| [37] |
MAO H L, WANG J K, ZHOU Y Y, et al. Effects of addition of tea saponins and soybean oil on methane production, fermentation and microbial population in the rumen of growing lambs[J].
MAO H L, WANG J K, ZHOU Y Y, et al. Effects of addition of tea saponins and soybean oil on methane production, fermentation and microbial population in the rumen of growing lambs[J]. Livestock Science, 2010 , 129 (1/2/3) : 56 –62.
( 0) 0)
|
| [38] |
张婷婷, 杨在宾. 茶皂素对瘤胃发酵和甲烷减排的影响[J].
张婷婷, 杨在宾. 茶皂素对瘤胃发酵和甲烷减排的影响[J]. 山东畜牧兽医, 2010 (增刊) :122 –126.
( 0) 0)
|
| [39] |
BIRD S H, LENG R A. Further studies on the effects of the presence or absence of protozoa in the rumen on live-weight gain and wool growth of sheep[J].
BIRD S H, LENG R A. Further studies on the effects of the presence or absence of protozoa in the rumen on live-weight gain and wool growth of sheep[J]. British Journal of Nutrition, 1984 , 52 (3) : 607 –611.
DOI: 10.1079/BJN19840127 ( 0) 0)
|
| [40] |
苑文珠, 刘建新, 叶均安. 茶皂素作为瘤胃发酵调控剂的研究[J].
苑文珠, 刘建新, 叶均安. 茶皂素作为瘤胃发酵调控剂的研究[J]. 饲料博览, 2002 (9) :4 –5.
( 0) 0)
|
| [41] |
胡伟莲.皂甙对瘤胃发酵与甲烷产量及动物生产性能影响的研究[D].博士学位论文.杭州:浙江大学, 2005:4-93.
( 0) 0)
|
| [42] |
茅慧玲, 王佳堃, 刘建新. 日粮中添加茶皂素和豆油对羔羊瘤胃细菌区系的影响[J].
茅慧玲, 王佳堃, 刘建新. 日粮中添加茶皂素和豆油对羔羊瘤胃细菌区系的影响[J]. 营养饲料, 2010 , 46 (21) :43 –46.
( 0) 0)
|
| [43] |
叶均安, 刘建新, 板桥久雄. 茶皂素对瘤胃原虫的抑制效果[J].
叶均安, 刘建新, 板桥久雄. 茶皂素对瘤胃原虫的抑制效果[J]. 中国饲料, 2001 , 1 (2) :30 .
( 0) 0)
|
| [44] |
郭兴凤, 阮丽红, 谈天. 茶皂苷对大豆蛋白发泡能力影响研究[J].
郭兴凤, 阮丽红, 谈天. 茶皂苷对大豆蛋白发泡能力影响研究[J]. 河南工业大学学报:自然科学版, 2009 , 30 (3) :12 –15.
( 0) 0)
|
| [45] |
DAIZ A, AVENDANO M, ESCOBAR A. Evaluation of Sapindus saponaria as a defaunating agent and its effects on different ruminal digestion parameters[J].
DAIZ A, AVENDANO M, ESCOBAR A. Evaluation of Sapindus saponaria as a defaunating agent and its effects on different ruminal digestion parameters[J]. Livestock Research for Rural Development, 1993 , 5 (2) : 5560 .
( 0) 0)
|
| [46] |
WALLACE R J, MCEWAN N R, MCINTOSH F M, et al. Natural products as manipulators of rumen fermentation[J].
WALLACE R J, MCEWAN N R, MCINTOSH F M, et al. Natural products as manipulators of rumen fermentation[J]. Asian-Australasian Journal of Animal Sciences, 2002 , 15 (10) : 1458 –1468.
DOI: 10.5713/ajas.2002.1458 ( 0) 0)
|
| [47] |
JOBLIN K N.Physical disruption of plant fibre by rumen fungi of the sphaeromonas group[M]//NOLAN J V, LENG R A, DEMEYER D I.The role of protozoa and fungi in ruminant digestion.Armidale:Penambul Books, 1989:259-260.
( 0) 0)
|
| [48] |
陈旭伟.不同皂苷对山羊瘤胃原虫和细菌种属变化以及纤维降解的影响[D].硕士学位论文.扬州:扬州大学, 2009:4-85.
http://cdmd.cnki.com.cn/article/cdmd-11117-2009192881.htm
( 0) 0)
|
| [49] |
张婷婷, 杨在宾, 刘建新, 等.茶皂素对体外瘤胃发酵和甲烷生成及微生物区系的影响[C]//第六次全国饲料营养学术研讨会论文集.北京:中国畜牧兽医学会, 2010:406.
( 0) 0)
|
| [50] |
WANG Y, MCALLISTER T A, YANKE L J, et al. Effect of steroidal saponin from Yucca schidigera extract on ruminal microbes[J].
WANG Y, MCALLISTER T A, YANKE L J, et al. Effect of steroidal saponin from Yucca schidigera extract on ruminal microbes[J]. Journal of Applied Microbiology, 2000 , 88 (5) : 887 –896.
DOI: 10.1046/j.1365-2672.2000.01054.x ( 0) 0)
|
| [51] |
RUSSELL J B, HOULIHAN A J. Ionophore resistance of ruminal bacteria and its potential impact on human health[J].
RUSSELL J B, HOULIHAN A J. Ionophore resistance of ruminal bacteria and its potential impact on human health[J]. FEMS Microbiology Reviews, 2003 , 27 (1) : 65 –74.
DOI: 10.1016/S0168-6445(03)00019-6 ( 0) 0)
|
| [52] |
张婷婷, 杨在宾, 刘建新, 等. 茶皂素对甲烷产量和瘤胃发酵影响的研究进展[J].
张婷婷, 杨在宾, 刘建新, 等. 茶皂素对甲烷产量和瘤胃发酵影响的研究进展[J]. 家畜生态学报, 2011 , 32 (2) :96 –99.
( 0) 0)
|
| [53] |
VOGELS G D, HOPPE W F, STUMM C K. Association of methanogenic bacteria with rumen ciliates[J].
VOGELS G D, HOPPE W F, STUMM C K. Association of methanogenic bacteria with rumen ciliates[J]. Applied and Environmental Microbiology, 1980 , 40 (3) : 608 –612.
( 0) 0)
|
| [54] |
GUO Y Q, LIU J X, LU Y, et al. Effect of tea saponin on methanogenesis, microbial community structure and expression of mcrA gene, in cultures of rumen micro-organisms[J].
GUO Y Q, LIU J X, LU Y, et al. Effect of tea saponin on methanogenesis, microbial community structure and expression of mcrA gene, in cultures of rumen micro-organisms[J]. Letters in Applied Microbiology, 2008 , 47 (5) : 421 –426.
DOI: 10.1111/lam.2008.47.issue-5 ( 0) 0)
|




