2. 江苏优仕生物科技发展有限公司, 宿迁 223831;
3. 安徽科技学院动物科学学院, 凤阳 233100;
4. 扬州大学动物科学与技术学院, 扬州 225009
2. Jiangsu Unison Biotechnology Development Co., Ltd., Suqian 223831, China;
3. College of Animal Science, Anhui Science and Technology University, Fengyang 233100, China;
4. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China
乳酸菌具有调节机体胃肠道微生态平衡、有益于畜禽健康、改善畜禽生产性能、减少环境污染、替代饲用抗生素等重要作用,在动物生产中的应用日益广泛。然而,乳酸杆菌为厌氧菌,抗逆性差、不耐氧、易失活,应用效果不稳定,而球菌较杆菌具有更强的抗逆性,菌株活性损失较低,未来球菌尤其是肠球菌的应用将更普遍。
γ-氨基丁酸(GABA)又称氨酪酸[1],分子式为C4H9NO2,是哺乳动物中枢神经系统一种主要的抑制性神经递质,介导40%以上的抑制性神经传导[2-3]。GABA对人具有调节血压、改善脑部机能、增强记忆力、抗焦虑、镇痛等生理活性,对畜禽具有促进采食、抗应激、镇静、改善生产性能等功效[4],尤其是抗热应激作用显著。GABA合成制备的方法主要有化学合成、微生物发酵等,目前畜禽生产上应用的GABA多为化学合成提纯品,成本昂贵,颇少见应用微生物发酵产生的GABA[5]。
长期以来,学者致力于研究乳酸菌等单一功能的微生态制剂与化学合成提纯的GABA,已清楚乳酸菌和GABA均是重要的功能性添加剂[6]。但有关能分泌GABA的乳酸菌的研究较少。屎肠球菌(Enterococcus faecium)属肠球菌属,又称屎链球菌,可分成许多群,屎肠球菌属于D群,D群链球菌中的肠球菌包括粪肠球菌、屎肠球菌和坚忍肠球菌。自然界存在的肠球菌所能分泌的GABA量很少或不能分泌,需要摸索适宜生长条件以提高其GABA产量,目前对产GABA屎肠球菌的研究颇少。为此,本试验开展高产GABA屎肠球菌的筛选与鉴定,既能应用绿色微生态和微生物发酵所产天然GABA,降低GABA添加成本,又能叠加发挥GABA抗应激与乳酸菌微生态平衡调控的双重功效,旨在为开发功能性微生态制剂及其在养殖中的应用提供理论基础。
1 材料与方法 1.1 菌株及培养基菌株来自泡菜(购自农贸市场)、酸奶(蚌埠市双华乳品有限公司产品)、土壤(取自安徽科技学院西校区)、新鲜牛奶(购自安徽科技学校畜牧科技园)。
MRS固体培养基制备[7]:蛋白胨10 g、牛肉膏10 g、酵母提取物5 g、葡萄糖20 g、三水合醋酸钠5 g、柠檬酸二胺2 g、吐温80.1 g、磷酸氢二钾2 g、七水硫酸镁0.58 g、四水硫酸锰0.25 g、碳酸钙7.5 g、琼脂22.5 g,用去离子水定容至1 000 mL,pH 6.5,121℃灭菌40 min。
MRS液体培养基:除不含碳酸钙、琼脂外,其他成分与MRS固体培养基相同,再用蒸馏水定容至1 000 mL,pH 6.5。
分离培养基:牛肉膏10 g、酵母膏10 g、蛋白胨10 g、葡萄糖5 g、吐温80.5 g、番茄汁200 g、溴甲酚绿0.1 g、碳酸钙20 g、琼脂20 g,蒸馏水定容至1 000 mL,pH 6.5。
1.2 目的菌株的分离、纯培养与活化传代取泡菜、酸奶、土壤、新鲜牛奶样品各1 g,分别接种于装有MRS液体培养基的150 mL三角烧瓶中,35℃静止培养48 h;无菌操作将培养液接种于分离培养基中,35℃条件下静止培养48 h;无菌操作挑取分离培养基中周围呈现黄色的疑似单个菌落,接种于MRS液体培养基中,37℃静止培养48 h。
取1 mL MRS液体培养液与无菌生理盐水10倍梯度稀释成10-6、10-7、10-8 3个浓度梯度,取100μL 10-8浓度梯度溶液均匀涂布MRS固体培养基平板,37℃培养48 h。无菌操作挑取出现圆形乳白色并有溶钙圈的单个菌落,进行分离纯化。
将所筛菌株接种于MRS斜面培养基上,35℃培养48 h,4℃保存,菌株每20 d传代1次。将保藏菌株接种于MRS固体培养基中,35℃培养48 h,再转接至MRS液体培养基中培养22 h用作发酵种子菌株。
1.3 目的菌株的革兰氏染色鉴定对目的菌株进行革兰氏染色,观察菌株的形态特征。
1.4 目的菌株的分子生物学鉴定取10 mL菌株培养液,低速离心获得菌体。用细菌基因组DNA提取试剂盒(DP302,上海生工生物工程有限公司)提取细菌总DNA。以10 ng纯化的细菌总DNA作为模板,扩增16S rDNA基因。所用引物为原核生物16S rDNA基因的通用引物:上游引物为5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物为5′-CTACGGCTACCTTGTTACGA-3′,引物由上海生工生物工程有限公司合成。PCR扩增体系为50μL,包括:1.0μL DNA模板,5.0μL 10×Buffer,2.0μL dNTP,1.0μL上游引物(10 pmol/μL),1.0μL下游引物(10 pmol/μL),1.0μL Taq DNA聚合酶,1.4μL Mg2+,补重蒸水(ddH2O)至50μL。扩增条件:94℃,5 min;94℃,1 min,56℃,1 min,72℃,2 min,30个循环;72℃延伸5 min,4℃终止反应。PCR产物全序列由上海生工生物工程有限公司测定。
1.5 序列分析及系统发育树的构建根据16S rDNA基因测序结果,使用核算序列对比检索(nucleotide basic local alignment search tool,N-BLAST)比对初步确定菌种。结合GenBank中乳酸菌属(Lactobacillus)中其他菌种的16S rDNA基因序列,利用MEGA 3.0软件绘制系统发育树。
1.6 目的菌株所产GABA的定性测定将上述所得种子液以3.5%接种量无菌操作接种于发酵培养基中,37℃恒温培养48 h,取发酵液5 mL,4 500 r/min离心5 min,取上清采用改良纸层析法检测发酵液中是否含有GABA。改良纸层析的测定方法是:按0.55%的比例将显色剂茚三酮加入展开剂中,展开剂组成为正丁醇:冰醋酸:水=5 : 3 : 1(体积比),取待测液10μL进行点样,GABA配成浓度5 g/L做参比,展开后85℃显色8 min。若纸层析反应体系中存在与GABA标准品相对迁移率一致的茚三酮显色斑点,说明样品中含有GABA,则该菌即为筛选到的产GABA的菌株,将筛选得到的产GABA目的菌株进行保藏。
1.7 目的菌株所产GABA的定量测定高效液相色谱(HPLC)法定量测定菌液中GABA含量的原理:在菌液中加β-巯基乙醇,使GABA与邻苯二甲醛迅速反应,生成邻苯二甲醛(OPA)衍生物;在紫外区338 nm处,根据OPA衍生物的吸收峰,通过测定其吸光度值精确测定样品中的GABA含量。
GABA标准溶液的配制:用电子天平准确称量GABA标准品,配制浓度分别为0、0.05、0.10、0.15、0.20、0.25 mg/mL的标准GABA溶液。
HPLC检测条件如下:仪器型号为Waters-1525;色谱柱为Hypersil ODS-2 C18(150 mm×4.0 mm,5μm及相应的保护柱);检测器为紫外检测器;进样量为20μL;流动相A为20 mmol/L醋酸钠缓冲液(醋酸钠2.72 g、三乙胺200μL,加超纯水至1 L,调节pH为7.3),0.22μm滤膜过滤,脱气;流动相B为乙腈,流动相A :流动相B=4 : 1;流速为1 mL/min;柱温为40℃;衍生试剂为OPA 20 mg,加β-巯基乙醇20μL、乙腈5 mL混匀即可。衍生反应:取硼酸缓冲液100μL(硼酸24.7 g,加超纯水1 L,调节pH至10.4),OPA衍生剂20μL,样品20μL,混合均匀后室温反应5 min后开始测定。
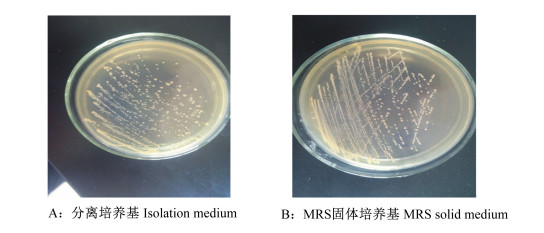
2 结果与分析 2.1 目的菌株的菌落特征从泡菜、酸奶、土壤、新鲜牛奶中分离得到多个菌株,选取其中的1个菌株F6进行形态学观察鉴定。菌株F6菌落光滑、圆形、直径1~2 mm、边缘整齐、乳白色,表面细腻(图 1)。在分离培养基上培养生长的F6菌落使其周边的培养基变成黄色,菌落周围形成透明圈(图 1-A),这是由于乳酸菌生长过程中产生乳酸,能使含有溴甲酚绿的分离培养基变成黄色,推测F6是一株乳酸菌。在MRS固体培养基上培养生长的F6菌落不透明,周围有透明圈(图 1-B)。
|
图 1 菌株F6的菌落形态 Figure 1 Colony morphology of the bacterial strain F6 |
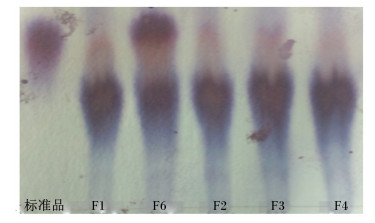
改良纸层析法分析结果显示,目的株菌F6具有与GABA标准品相同Rf值(即指比移值,斑点中心距原点的距离与溶剂展开前沿距原点距离的比值)的斑点,层析斑点较深,表明GABA产量较高,图 2为目的株菌的改良纸层析图谱。
|
图 2 菌株F6的发酵液改良纸层析图谱 Figure 2 The improved paper chromatography map of the bacterial strain F6's fermentation broth |
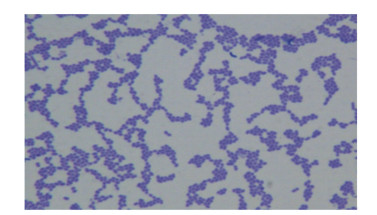
菌株F6的染色结果如图 3所示,菌体形态呈圆或椭圆形,直径0.5~1.0μm,大多数呈双或短链状排列,通常不运动,革兰氏染色呈阳性。
|
图 3 菌株F6的显微结构图 Figure 3 Microscopic structure of bacterial strain F6 (1 600×) |
菌株F6的16S rDNA基因测序后,提交到DNA序列数据库GenBank。将测得的菌株F6的16S rDNA序列在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)主页上进行N-BLAST分析比对,结果如图 4所示。菌株F6的16S rDNA基因序列与GenBank数据库中屎肠球菌的相似性大于99%,表明两者均为屎肠球菌的不同菌株。

|
图 4 菌株F6的16S rDNA基因序列 Figure 4 16S rDNA gene sequence of bacterial strain F6 |
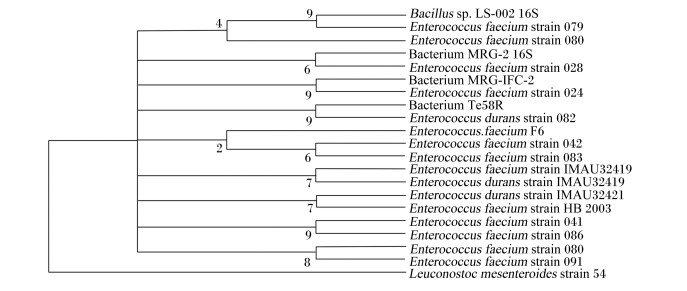
菌株F6的16S rDNA基因序列与NCBI主页GenBank数据库中部分细菌的16S rDNA基因序列进行同源性比对,为显示菌株F6与相似菌种之间的亲缘关系及其系统地位,用MEGA 3.0软件构建系统发育树(图 5)。结果显示,菌株F6与屎肠球菌的亲缘关系最近,其次是坚忍肠球菌。由此确定菌株F6为屎肠球菌。
|
Bacillus sp.:芽孢杆菌;Enterococcus faecium:屎肠球菌;Bacterium:细菌;Enterococcus durans:坚忍肠球菌;Leuconostoc mesenteroides:肠系膜明串珠菌;strain:品种。 图 5 以菌株F6的16S rDNA基因序列为基础的系统发育树 Figure 5 Phylogenetic tree based on 16S rDNA gene sequences of bacterial strain F6 |
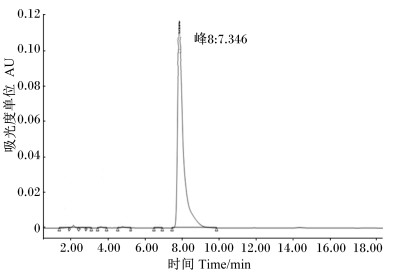
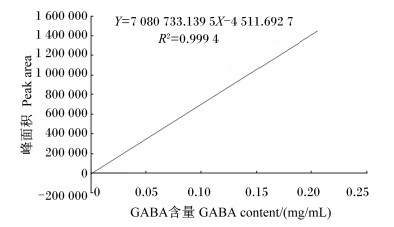
采用HPLC法精确测定标准液中GABA含量[8-9],GABA标准液中的GABA峰形如图 6所示。以峰面积对GABA含量作图,准确绘制出标准曲线(图 7)。结果显示,峰面积和GABA含量呈强相关的线性关系,线性方程为:Y=7 080 733.139 5X-4 511.692 7(R2=0.999 4)。
|
图 6 标准液中GABA的HPLC检测图 Figure 6 GABA detection map in the standard solution by HPLC |
|
图 7 HPLC法建立的GABA的标准曲线 Figure 7 Standard cure of GABA standed by HPLC method |
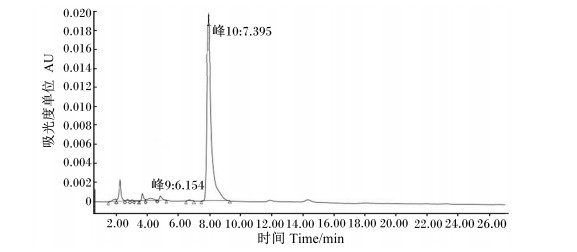
采用HPLC法精确测定菌株F6发酵液的色谱图峰面积,如图 8所示。根据上述得到的线性方程Y=7 080 733.139 5X-4 511.692 7,计算出菌株F6发酵液中GABA含量为7.1 g/L,保留时间为7~10 min,峰面积为50 268 693.6,吸光度值为0.12。
|
图 8 菌株F6发酵液中GABA的HPLC检测图 Figure 8 GABA detection map in the bacterial strain F6 fermented solution by HPLC |
从酸奶、土壤、牛奶、泡菜中均分离得到产GABA的菌株,其中自酸奶样品中筛选得到的一菌株产GABA量相对较高,命名F6,表明从自然界中筛选高产GABA目的菌株是可行的。本试验在对目的菌株传统表型特征、生物学特性等进行快速筛选的基础上,采用改良纸层析法对目的菌株代谢产物GABA进行定性检测,准确、快速确定了菌株产GABA的能力。改良后纸层析法为按0.55%的比例将显色剂茚三酮加入展开剂中,展开剂组成为正丁醇:冰醋酸:水=5 : 3 : 1(体积比),展开后85℃显色8 min,相比一般纸层析法显色时间15~20 min有明显优势[10],对快速筛选高产GABA目的菌株有一定参考价值。本试验通过分子生物学方法,将菌株F6的16S rDNA基因序列与GenBank数据库中部分细菌的16S rDNA基因序列进行同源性比对,其与屎肠球菌的相似性大于99%,确定目的菌株F6为屎肠球菌,这为通过基因工程菌大量制备GABA提供了目的菌株。
3.2 GABA的制备方法GABA的制备方法有化学合成法和生物合成法2种[10]。化学合成法成本较高,得率较低,并且在生产工艺中使用危险溶剂,甚至是有毒溶剂,因此化学合成法制备的GABA不能用于食品和饲料,也不能认为是一种天然的食品或饲料添加剂[11-12]。生物合成GABA是应用纯的微生物技术,通过筛选优良高产的安全菌种发酵生产得到,是天然食品与饲料添加剂,公认使用的安全菌为乳酸菌,如短小乳杆菌[10],而筛选的产GABA屎肠球菌颇少。生物合成法获得的GABA虽然纯度不高,但动物的吸收率比高纯度化学合成法的GABA有较大提高,并且产GABA乳酸菌可不经提纯, 直接添加到动物饲粮中。本试验以屎肠球菌为目标菌株,较乳酸杆菌的抗逆性更强,因此可发挥乳酸菌的微生态平衡调控和GABA抗应激的双重作用,功效叠加。
3.3 乳酸菌的GABA产量自然界中直接筛选的乳酸菌合成GABA产量一般都不高,为5~7 g/L[13-14],所用菌株多为乳酸杆菌类。冯志彬等[15]研究短小乳杆菌A8菌株后发现,初始pH 4.5、温度33℃、接种量20%、发酵时间3 d为该菌株的最佳发酵条件,GABA产量最高可达19.2 g/L,并发现培养基的pH是影响GABA产量的主要因素。本试验目的菌株为屎肠球菌,发酵液中GABA含量为7.1 g/L;最佳发酵条件为发酵温度36℃、原始pH 6.4、接种量4.5%、种龄20~23 h、发酵时间60 h,在最佳培养、发酵条件下,屎肠球菌F6发酵液中GABA的含量可提高到9.5 g/L,这可能与不同培养条件影响目的菌株谷氨酸脱羧酶(glutamate decarboxylase,GAD)的活性有关。
利用传统诱变技术筛选能够提高乳酸菌的GABA产量。夏江等[16]先后使用紫外线和γ-射线对产GABA的短乳杆菌进行诱变处理,使GABA平均产量提高142.9%,经诱变处理的短乳杆菌虽然GABA产量提高,但乳酸菌的固有功能作用降低,并且因不确定性、盲目性和遗传不稳定性,利用诱变乳酸菌所产GABA尚有潜在安全风险。
近几年,有文献报道利用重组大肠杆菌表达提取GAD,以固定化酶的方式生产GABA,但是转化效率普遍不高[17]。已清楚GABA的生物合成途径是谷氨酸脱羧酶将L-谷氨酸转化为GABA。本后续试验拟通过增加现有菌株F6中GAD基因表达盒的数量,提高菌株细胞内GAD的表达,进而提高GABA的合成量[18-20],这尚在研究中。
3.4 屎肠球菌所产GABA的定量测定本试验首先对发酵液中GABA进行定性测定,即采用改良纸层析法检测发酵液中是否含有GABA。按0.55%的比例将显色剂茚三酮加入到展开剂中,展开后85℃显色8 min,通过观察斑点快速定性确定GABA的存在。
本试验采用HPLC法测定发酵液中GABA的含量,GABA在β-巯基乙醇存在条件下能与邻苯二甲醛迅速反应,生成OPA衍生物,而OPA不会干扰检测,色谱图基线较稳定,标准曲线的R2为0.999 4,因此本试验采用的HPLC法简单、快速、灵敏,得到的结果可靠。
4 结论本试验筛选得到的菌株F6为屎肠球菌,是一株功能性乳酸菌,具有高产GABA的能力。
| [1] |
张传贵. 增塑剂污染及其对人体的影响[J].
张传贵. 增塑剂污染及其对人体的影响[J]. 生物学通报, 1999 , 34 (2) :20 .
( 0) 0)
|
| [2] |
堀江典子, 菅美奈子, 金武祚. GABA(γ-氨基丁酸)的功能性[J].
堀江典子, 菅美奈子, 金武祚. GABA(γ-氨基丁酸)的功能性[J]. 中国食品添加剂, 2010 (6) :169 –173.
( 0) 0)
|
| [3] |
梁恒宇, 邓立康, 林海龙, 等. 新资源食品——γ-氨基丁酸(GABA)的研究进展[J].
梁恒宇, 邓立康, 林海龙, 等. 新资源食品——γ-氨基丁酸(GABA)的研究进展[J]. 食品研究与开发, 2013 , 34 (15) :119 –123.
( 0) 0)
|
| [4] |
MORTEZA Z, VAHHAB B, HOSSEIN J. Effects of central histamine receptors blockade on GABAA agonist-induced food intake in broiler cockerels[J].
MORTEZA Z, VAHHAB B, HOSSEIN J. Effects of central histamine receptors blockade on GABAA agonist-induced food intake in broiler cockerels[J]. Pakistan Journal of Biological Sciences, 2008 , 11 (3) : 416 –421.
DOI: 10.3923/pjbs.2008.416.421 ( 0) 0)
|
| [5] |
白松, 林向阳, 阮榕生, 等. γ-氨基丁酸的分布和制备[J].
白松, 林向阳, 阮榕生, 等. γ-氨基丁酸的分布和制备[J]. 现代食品科技, 2005 , 21 (2) :202 –205.
( 0) 0)
|
| [6] |
耿敬章. γ-氨基丁酸(GABA)在食品工业中的应用研究[J].
耿敬章. γ-氨基丁酸(GABA)在食品工业中的应用研究[J]. 饮料工业, 2012 , 15 (1) :11 –14.
( 0) 0)
|
| [7] |
李丽微, 谷新晰, 卢海强, 等. 发酵山药酸奶益生乳酸菌菌株的筛选[J].
李丽微, 谷新晰, 卢海强, 等. 发酵山药酸奶益生乳酸菌菌株的筛选[J]. 中国食品学报, 2015 (11) :78 –82.
( 0) 0)
|
| [8] |
BUCK K, VOEHRINGER P, FERGER B. Rapid analysis of GABA and glutamate in microdialysis samples using high performance liquid chromatography and tandem mass spectrometry[J].
BUCK K, VOEHRINGER P, FERGER B. Rapid analysis of GABA and glutamate in microdialysis samples using high performance liquid chromatography and tandem mass spectrometry[J]. Journal of Neuroscience Methods, 2009 , 182 (1) : 78 –84.
DOI: 10.1016/j.jneumeth.2009.05.018 ( 0) 0)
|
| [9] |
JÁMBOR A, MOLNÁR-PERL I. Amino acid analysis by high-performance liquid chromatography after derivatization with 9-fluorenylmethyloxycarbonyl chloride:literature overview and further study[J].
JÁMBOR A, MOLNÁR-PERL I. Amino acid analysis by high-performance liquid chromatography after derivatization with 9-fluorenylmethyloxycarbonyl chloride:literature overview and further study[J]. Journal of Chromatography A, 2009 , 1216 (15) : 3064 –3077.
DOI: 10.1016/j.chroma.2009.01.068 ( 0) 0)
|
| [10] |
汪祥燕, 徐海燕, 辛国芹, 等. γ-氨基丁酸产生菌的分离及发酵条件优化[J].
汪祥燕, 徐海燕, 辛国芹, 等. γ-氨基丁酸产生菌的分离及发酵条件优化[J]. 中国饲料, 2016 (4) :27 –31.
( 0) 0)
|
| [11] |
杨晶晶, 曲媛, 崔秀明. γ-氨基丁酸的制备方法与含量测定研究进展[J].
杨晶晶, 曲媛, 崔秀明. γ-氨基丁酸的制备方法与含量测定研究进展[J]. 食品工业科技, 2014 , 35 (3) :351 –356.
( 0) 0)
|
| [12] |
CHOI S I, LEE J W, PARK S M., et al. Improvement ofγ-aminobutyric acid (GABA) production using cell entrapment of Lactobacillus brevis GABA 057[J].
CHOI S I, LEE J W, PARK S M., et al. Improvement ofγ-aminobutyric acid (GABA) production using cell entrapment of Lactobacillus brevis GABA 057[J]. Journal of Microbiology and Biotechnology, 2006 , 16 (4) : 562 –568.
( 0) 0)
|
| [13] |
缪存影, 蒋冬花, 徐晓波, 等. 酸菜中高产γ-氨基丁酸乳酸菌的筛选和鉴定[J].
缪存影, 蒋冬花, 徐晓波, 等. 酸菜中高产γ-氨基丁酸乳酸菌的筛选和鉴定[J]. 微生物学杂志, 2010 , 30 (2) :28 –32.
( 0) 0)
|
| [14] |
王超凯, 刘绪, 张磊, 等. 产γ-氨基丁酸乳酸菌的筛选及发酵条件初步优化[J].
王超凯, 刘绪, 张磊, 等. 产γ-氨基丁酸乳酸菌的筛选及发酵条件初步优化[J]. 食品与发酵科技, 2012 , 48 (1) :36 –39.
( 0) 0)
|
| [15] |
冯志彬, 吴思颖, 张玉香, 等. 短乳杆菌产γ-氨基丁酸发酵条件的优化[J].
冯志彬, 吴思颖, 张玉香, 等. 短乳杆菌产γ-氨基丁酸发酵条件的优化[J]. 鲁东大学学报:自然科学版, 2012 , 28 (3) :248 –251.
( 0) 0)
|
| [16] |
夏江, 梅乐和, 黄俊, 等. 产γ-氨基丁酸的乳酸菌株筛选及诱变[J].
夏江, 梅乐和, 黄俊, 等. 产γ-氨基丁酸的乳酸菌株筛选及诱变[J]. 核农学报, 2006 , 20 (5) :379 –382.
( 0) 0)
|
| [17] |
田灵芝, 徐美娟, 饶志明. 一株重组大肠杆菌/pET-28a-lpgad的构建及其高效生产γ-氨基丁酸转化条件的优化[J].
田灵芝, 徐美娟, 饶志明. 一株重组大肠杆菌/pET-28a-lpgad的构建及其高效生产γ-氨基丁酸转化条件的优化[J]. 生物工程学报, 2012 , 28 (1) :65 –75.
( 0) 0)
|
| [18] |
KOOK M C, SEO M J, CHEIGH C I, et al. Enhancement ofγ-amminobutyric acid production by Lactobacillus sakei B2-16 expressing glutamate decarboxylase from Lactobacillus plantarum ATCC 14917[J].
KOOK M C, SEO M J, CHEIGH C I, et al. Enhancement ofγ-amminobutyric acid production by Lactobacillus sakei B2-16 expressing glutamate decarboxylase from Lactobacillus plantarum ATCC 14917[J]. Journal of the Korean Society for Applied Biological Chemistry, 2010 , 53 (6) : 816 –820.
DOI: 10.3839/jksabc ( 0) 0)
|
| [19] |
KOMATSUZAKI N, SHIMA J, KAWAMOTO S, et al. Production ofγ-aminobutyric acid (GABA) by Lactobacillus paracasei isolated from traditional fermented foods[J].
KOMATSUZAKI N, SHIMA J, KAWAMOTO S, et al. Production ofγ-aminobutyric acid (GABA) by Lactobacillus paracasei isolated from traditional fermented foods[J]. Food Microbiology, 2005 , 22 (6) : 497 –504.
DOI: 10.1016/j.fm.2005.01.002 ( 0) 0)
|
| [20] |
LIU T T, YANG T W, ZhANG S C, et al. Screening, identification and primary optimizing of a strain producingγ-aminobutyric acid from L-glutamic acid[J].
LIU T T, YANG T W, ZhANG S C, et al. Screening, identification and primary optimizing of a strain producingγ-aminobutyric acid from L-glutamic acid[J]. Journal of Food Science and Biotechnology, 2010 , 29 (5) : 742 –747.
( 0) 0)
|




