2. 北京大北农科技集团股份有限公司, 饲用微生物工程国家重点实验室, 北京 100192
2. State Key Laboratory of Direct-Fed Microbial Engineering, Beijing Dabeinong Technology Group Co., Ltd., Beijing 100192, China
血液是家禽肉类加工的副产物,占体重的6%~8%,其营养价值丰富,蛋白质含量高(17%~22%),脂肪含量低(0.15%~0.20%),素有“液态肉”的美誉[1-2]。中国是畜禽养殖大国,2013年家禽出栏数为119亿羽,血液产量高达119万t,除部分被加工成血豆腐、血粉等低附加值的产品及用于生化制药生产血红素、超氧化物歧化酶、蛋白胨外,开发的产品较单调,深加工程度低,浪费了宝贵的蛋白质资源。血球蛋白是血液中最主要的蛋白质,约占总蛋白质的2/3,由于其色泽猩红、金属味重、难贮藏以及消化利用率低,而难以开发利用。利用酶工程水解蛋白质目前已成为血球蛋白高效利用的重要方向,它可以将难以消化利用的大分子蛋白质水解成肽及L-氨基酸,水解后获得的血球短肽还具有血管紧张素转换酶(angiotensin-converting enzyme,ACE)抑制[3-4]、阿片样活性[5-6]、刺激细菌生长[7]、止痛[8]、抗菌[9-10]及抗氧化[11-12]等生理活性,大大提高其营养价值和功能特性。综上可见,优化建立血球酶解工艺,研发高功能性短肽产品,探讨其营养特性、功能性质与抗氧化性能,对家禽血液的高值化利用与推广具有重要的理论与实际意义。由于酶法具有反应条件温和、水解过程易于控制、产物营养价值高等特点,大量研究学者采用蛋白酶水解不同蛋白质以制备高附加值产物。邓佳等[13]采用中性蛋白酶和木瓜蛋白酶对猪血红蛋白进行复合水解以及条件优化,水解10 h后得到水解度19.1%的酶解液;Guo等[14]证实,胰酶(pancreatin)和复合风味蛋白酶(flavourzyme)组合酶水解猪血红蛋白,总氮得率高达97.69%,水解液的分子质量散乱分布在>15 ku与< 1 ku,短肽含量有待进一步提高;Sun等[15]采用不同蛋白酶水解猪血红蛋白,碱性蛋白酶(alcalase)水解效果最好,胃蛋白酶(pepsin)次之,说明酸碱条件有助于提高蛋白质水解效果,且水解液中含有抗氧化活性的肽段;于美娟等[1]研究了中性蛋白酶与木瓜蛋白酶复合水解猪血红蛋白,水解度(DH)达24.5%,总氮得率为74.64%;In等[16]研究表明,98%左右的亚铁血红素存在于低pH(3~5)、高水解度(>20%)的蛋白质沉淀物中,说明酸性条件下高度水解有助于去除血红素铁以改善水解液色泽。目前的研究目标大多集中于血球蛋白潜在的生理活性探讨,而因其含有亚铁血红素而导致的“色泽差、适口性差、消化性差”等问题仍未得到妥善解决。如何利用酶解反应获得更多颜色浅、无异味、高水解度的短肽,已成为生产工艺中亟待解决的技术难题。此外,关于酶解鸭血球蛋白制备短肽并探讨其功能性质与抗氧化能力的研究还是有限的。本研究以鸭血球蛋白为原料,通过考察酶种类、酶用量、pH、酶解温度、时间对水解度和水解物产量的影响,采用正交试验设计优化鸭血球蛋白酶解的最佳工艺,以期获得色泽佳、无异味、易吸收、氨基酸平衡性好的血球短肽,并考察该产品的功能特性与抗氧化活性,为血球短肽的产业化提供理论依据和技术支持。
1 材料与方法 1.1 试验材料新鲜鸭血球蛋白,由北京鸿顺养源生物科技有限公司提供,-20℃避光保存备用,使用前置于4℃过夜解冻。
酸性蛋白酶(5×104 U/g)购于北京东华强盛生物技术有限公司;中性蛋白酶(4×104 U/g)、碱性蛋白酶(4×104 U/g)、木瓜蛋白酶(8×104 U/g)和风味蛋白酶(1×104 U/g)购于南宁庞博生物工程有限公司;对苯二甲醛(OPA)购自国药集团化学试剂有限公司;十二烷基磺酸钠(SDS)、二硫苏糖醇(DTT)、1, 1-二苯基-2-苦基肼自由基(DPPH·)、邻苯三酚购自美国Sigma公司;其他试剂均为化学纯。
1.2 主要仪器SD-BASIC喷雾干燥仪,英国LabPlant公司;GL-20G-C高速冷冻离心机,上海安亭科学仪器厂;HYG-A恒温振荡器,江苏省太仓市实验设备厂;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 试验方法 1.3.1 蛋白酶的筛选以蛋白质水解度为指标,对5种蛋白酶(酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶和风味蛋白酶)进行筛选。将血球蛋白配成16%溶液,温度45℃,其中酸性蛋白酶初始pH为3.0,碱性蛋白酶初始pH为8.0,其他蛋白酶的初始pH为7.0,水解时间均为5 h,分别检测蛋白质的水解度。试验处理设3次重复。
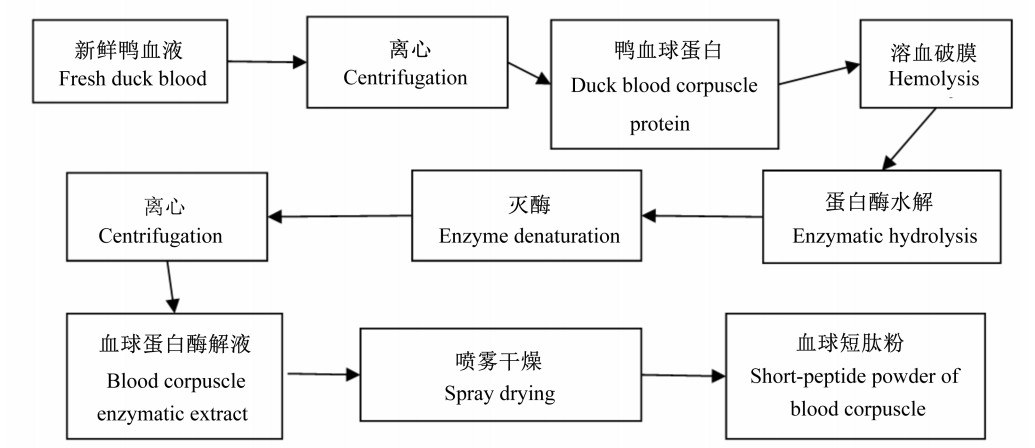
1.3.2 工艺流程鸭血球蛋白酶法水解工艺中关键的步骤是水解度的控制,基本流程见图 1,工艺要点如下。
|
图 1 酶法水解鸭血球蛋白工艺流程 Figure 1 The process chart of enzymatic hydrolysis of duck blood corpuscle protein |
1) 溶血破膜:血球蛋白溶于0.1 mol/L HCl(血球蛋白: HCl=3 : 2,m/v)和去离子水中,制备蛋白质浓度16%的溶液,混合均匀后,置于40℃、200 r/min振荡器中反应30 min,使血球破壁及蛋白质变性。
2) 酶解:溶血后的溶液冷却至室温,85%乳酸或4 mol/L NaOH调节至预定pH,加入适量蛋白酶,放入转速为200 r/min的恒温振荡器中进行酶解。
3) 灭酶:反应结束后,90℃水浴15 min灭酶。
4) 离心:6 000 r/min、4℃条件下离心10 min,去除非溶性物质取上清,得到鸭血球蛋白酶解液。
5) 喷雾干燥:上清液于进口温度110~130℃、出口温度60~80℃的条件下进行喷雾干燥成血球短肽粉。
1.3.3 水解度测定蛋白质的水解度是指蛋白质水解反应过程中被裂开的肽键的百分数。采用OPA法[17]进行水解度测定,取稀释适宜倍数的水解液0.4 mL加入3 mL OPA试剂精确反应2 min,340 nm测定吸光值。
1.3.4 水解物产量采用Low等[18]方法测定水解物产量(HY)。称重离心后的水解上清液,其所占的重量百分比即为水解物产量。
1.3.5 肽分子质量分布检测采用高效液相色谱法检测血球蛋白以及血球肽的分子质量分布,配制的多肽样品与标准品(分子质量分别为6 500、13 700、43 000 u),进样量为100μL,检测时间50 min,根据峰值与峰面积计算肽分子质量所占百分比。
1.3.6 色度检测参照Bhaskar等[19]的方法用Minolta CR-410色度仪(日本)分别测定血球蛋白粉和血球短肽粉的色度,亮度(L*)值表示黑-白(亮)度,L*值越大则越白(亮);红度(a*)值表示绿-红色,a*值越大则越红;黄度(b*)值表示蓝-黄色,b*值越大则越黄。白度(whiteness index,WI)计算公式如下:
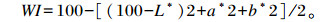
|
采用AminoPac PA10氨基酸分析柱,用积分安培离子色谱法测定样品中氨基酸含量。
1.3.8 血球短肽的苦味评价苦味评价包含2部分:一是氨基酸疏水性分析,根据血球短肽的氨基酸组成,按照Ney[20]的Q准则可计算出其中各个氨基酸的疏水性值△Q,则蛋白质的疏水性值Q就等于各个氨基酸疏水性值△Q的和;二是感官评价,称取1 g血球短肽溶于10 mL无菌水,挑选6名感官评定人员对血球短肽溶液进行品尝,鉴定该产物是否含有苦味。
1.3.9 功能特性测定 1.3.9.1 溶解度的测定方法参照Liu等[21]方法,称取干粉0.30 g溶于30 mL去离子水中,用6 mol/L HCl或6 mol/L NaOH调节pH(3~8),搅拌30 min,3 000 r/min离心15 min,采用Bradford法测上清液含氮量,其占总氮含量的百分比即为溶解度。
1.3.9.2 乳化性及乳化稳定性的测定方法采用浊度法[18]。不同pH(3~8)的0.2%(m/v)样品15 mL与5 mL植物油混合,室温下20 000 r/min离心1 min,立即吸取50μL底部乳状液与5 mL 0.1%SDS混合,500 nm处测吸光值A0。静置15 min后按同样方法测定吸光值A15,按如下公式计算乳化性及乳化稳定性:
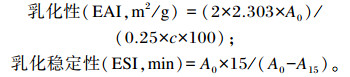
|
式中:c为样品的蛋白质浓度。
1.3.9.3 起泡性及泡沫稳定性的测定方法[21]0.5%(m/v)干粉溶于30 mL、0.02 mol/L柠檬酸磷酸盐缓冲液(pH 3~8),混合均匀,20 000 r/min匀浆1 min,静置10 min。记录匀浆前后溶液的体积。起泡性和泡沫稳定性表示如下:
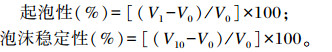
|
式中:V0为匀浆前溶液的体积;V1为匀浆结束后溶液的体积;V10为静置10 min后溶液的体积。
1.3.10 抗氧化活性测定 1.3.10.1 DPPH·清除率测定[22]1.5 mL不同浓度的肽溶液与1.5 mL DPPH·溶液(1.0 mmol/L)混合,室温避光反应30 min,517 nm处测吸光值。
1.3.10.2 超氧阴离子清除率测定[23]0.1 mL不同浓度的肽粉溶液加入2.8 mL Tris-HCl-乙二胺四乙酸(EDTA)(pH 8.2)缓冲液,25℃水浴保温10 min后加入0.1 mL、3 mmol/L邻苯三酚溶液,迅速混匀,325 nm每30 s测吸光值,5 min结束。作吸光值随时间变化的回归方程,求其斜率。超氧阴离子清除率表示如下:
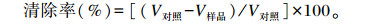
|
式中:V对照为对照组邻苯三酚自氧化速率(△A/min);V样品为样品组邻苯三酚氧化速率(△A/min)。
1.3.10.3 还原力测定[11]1.0 mL样品与1.0 mL磷酸钠溶液(pH 6.6)及1.0 mL、1%铁氰化钾混合,50℃孵化20 min。加入1.0 mL 10%三氯乙酸(TCA)溶液,5 000 r/min离心10 min。2.0 mL上清液与2.0 mL去离子水、0.4 mL、0.1%三氯化铁混合,室温静置10 min,700 nm测吸光值。
1.4 统计分析试验数据用平均值±标准差表示,应用JMP 10.0对试验进行设计及数据分析,采用Origin Pro 9.0软件绘制图形。
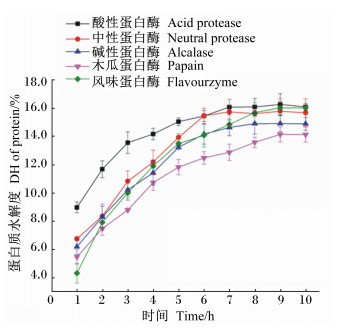
2 结果与分析 2.1 酶的筛选以水解度为指标,对5种蛋白酶进行筛选,其结果如图 2所示。整体而言,在相同条件下,风味蛋白酶的初始水解度最低,但水解速率明显较其他蛋白酶快;酸性蛋白酶的初始及总体水解度最高,中性蛋白酶次之。因中性蛋白酶成本较高,水解上清颜色为红棕色需使用其他方法辅助脱色,故而选用酸性蛋白酶作为工具酶进行后续试验。
|
图 2 不同蛋白酶对蛋白质水解度的影响 Figure 2 Effects of different proteases on DH of protein |
在前期单因素试验的基础上,设计正交试验,确定水解鸭血球蛋白的最优条件。试验选择的4个因素分别为:酶用量、pH、水解温度和水解时间,详见表 1。K、k值分别代表各因素水平蛋白质水解度与水解物产量的总值、平均值,R值为各因素水平蛋白质水解度和水解物产量的极差。较大的K或k值表示优先考虑的因素水平,较大的R值表示该因素的影响力较大。
|
|
表 1 酶解血球蛋白的正交试验结果 Table 1 Enzymatic hydrolysis of blood corpuscle protein in the orthogonal experiment |
对水解度来说,各试验因素对血球蛋白水解程度的影响主次顺序为水解时间(D)>温度(A)>酶用量(C)>pH(B),即最大影响因素为水解时间,最小影响因素是pH。此外,由直观分析的结果可知,酸性蛋白酶水解血球蛋白最佳因素组合为:酶用量6 000 U/g,温度50℃,pH 3.5,水解时间7 h。对于水解物产量来说,影响最大的因素是pH,各因素影响能力依次是pH(B)>温度(A)>酶用量(C)>时间(D),最佳因素组合与水解度的最优组合一致。综合上述结果,最佳条件是:温度50℃,pH 3.5,酶用量6 000 U/g,水解时间7 h。由表 1可知,该条件与第16个组合一致,即在最优条件下蛋白质水解度为(25.10±0.65)%,水解物产量为(60.09±1.77)%。
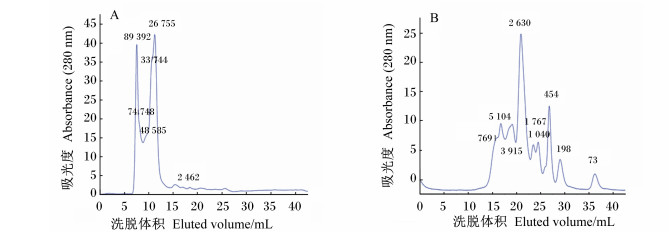
2.3 血球蛋白与血球短肽的分子质量分布采用高效液相色谱(HPLC)对血球短肽分子质量分布进行分析,结果见图 3。从图 3可以看出,血球蛋白洗脱时间短,洗脱峰相对单一,主要以大分子质量(>10 ku)肽段为主,约占82.34%。血球蛋白经过酸性蛋白酶水解,随着洗脱液体积的增加,样品分子质量(20~80 ku)向低分子质量(< 10 ku)分布迁移(表 2)。大分子质量的蛋白质被水解为分子质量较小的肽段,小分子质量肽含量明显增加,小于10 ku占97.65%,百分含量比未酶解时提高了80%;而其中以小于3 ku的小分子肽约81.89%,约为未水解的血球蛋白的6.1倍,尤其是低于1 ku的小肽含量明显增加,寡肽含量丰富。
|
A:血球蛋白blood corpuscle protein;B:血球短肽blood corpuscle short peptide。 图 3 血球蛋白与血球短肽的分子质量分布图 Figure 3 Molecule weight distribution of blood corpuscle protein and blood corpuscle short peptide |
|
|
表 2 血球蛋白与血球短肽的分子质量分布比较 Table 2 Comparison of molecule weight distribution between blood corpuscle protein and blood corpuscle short peptide |
表 3列出了鸭血球蛋白及血球短肽中常见的17种氨基酸含量。与鸭血球蛋白氨基酸相比,血球短肽的必需氨基酸种类齐全,含量丰富,总结有以下几个特点:1)异亮氨酸及蛋氨酸含量明显提高,有效弥补血液及其产品中限制性氨酸(蛋氨酸、异亮氨酸)含量低的缺陷;2)天冬氨酸、谷氨酸、甘氨酸和丙氨酸等呈味氨基酸含量约占总氨基酸的31%,这是肽粉呈现圆润柔和的甜味及鲜味的主要物质基础;3)血球短肽中赖氨酸的含量较丰富,可作为一种很好的谷物蛋白质互补物,这对提高动物性蛋白质源的利用率及改善饲粮营养具有重要意义;4)血球短肽的必需氨基酸含量占总氨基酸量的一半以上(53.31%),与非必需氨基酸的比值为1.24,均高于联合国粮农组织/世界卫生组织(FAO/WHO)规定的40%必需氨基酸/总氨基酸(EAA/TAA)与60%必需氨基酸/非必需氨基酸(EAA/NAA)理想蛋白质模式,说明该血球短肽粉具有较高的营养价值;5)与NRC推荐的必需氨基酸模式相比较,多数必需氨基酸评分大于1,基本满足甚至超过肉仔鸡以及幼鲤的氨基酸需要。无论1~3周龄肉鸡还是幼鲤模式,血球短肽的第一限制性氨基酸均为蛋氨酸,因此使用血球短肽时需要补充添加适量的蛋氨酸。相关学者[19, 23]认为,氨基酸含量高于最低需要量的30%即表明该蛋白质水解物是营养价值丰富的成分。就此而言,血球短肽因氨基酸平衡且必需氨基酸含量高可作为饲料添加剂应用于猪、家禽、水产等养殖领域。
|
|
表 3 血球短肽的氨基酸组成 Table 3 Amino acid composition of blood corpuscle short peptide |
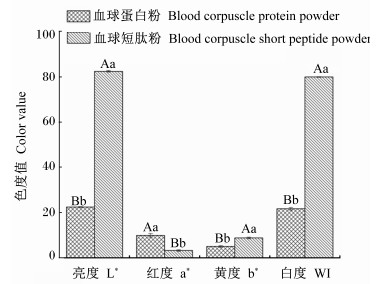
鸭血球蛋白经喷雾干燥制成的血球蛋白粉呈现红棕色,具有刺激的血腥味。与鸭血球蛋白粉相比,血球短肽粉的外观发生明显变化,呈乳白色,无明显的血腥味,触感细腻黏滑。采用Minolta CR-410色度仪分别测定血球蛋白粉和血球短肽粉的色度,结果见图 4。血球短肽粉的L*值与白度(WI)值是血球蛋白粉L*、WI值4倍左右,差异极显著(P<0.01),说明血球蛋白经酶解后脱色效果明显,血球短肽粉趋近于乳白色。a*值越大,表示红色度值越大,红色度明显,血球蛋白粉的a*值为9.95,而经酶解的血球短肽粉a*值降低了67.23%;经酸性蛋白酶处理后的血球短肽粉b*值极显著高于血球蛋白粉(P<0.01),这表明酸性蛋白酶水解有助于血球蛋白颜色由红色向黄色转变。酸性蛋白酶酶解有助于血球蛋白脱色,这主要归因于在酸性pH条件下,血红蛋白肽键经蛋白酶作用而断裂,亚铁血红素或富含亚铁血红素的肽段被释放出来,且亚铁血红素难溶于低pH(3.0~5.0)溶液而被滞留在沉淀中,因此获得乳白色血球短肽粉。
|
数据柱标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。 Value columns with different small letter superscripts mean significant difference (P < 0. 05), and with different capital letter superscripts mean significant difference (P < 0.01). 图 4 酶解前后血球蛋白粉和血球短肽粉色度差异 Figure 4 Color difference between blood corpuscle protein power and blood corpuscle short peptide powder before and after enzymatic hydrolysis |
在制取短肽过程中,经蛋白酶修饰的蛋白产物的口感和风味往往会发生变化,易产生苦味进而限制了水解产物的推广使用。这主要是是因为酶水解致使疏水性氨基酸侧链充分暴露出来形成苦味肽。对血球肽粉进行感官评价发现其不具有苦味或涩味等不良风味。为避免主观偏见引起的误差,对产物的氨基酸及其疏水性值进行分析客观评判水解液的苦味度。由表 2可知,血球短肽中亮氨酸、苯丙氨酸、缬氨酸等疏水性氨基酸均有不同程度地降低。且按照Ney[20]的Q准则得出血球短肽的Q值为4 304 J/mol,远小于5 443 J/mol,说明血球蛋白经酸性蛋白酶水解后产物不具有苦味。由上可知,经感官评定及疏水性分析,血球蛋白经酸性蛋白酶水解不会产生苦味活涩味等不良风味。
2.6 血球短肽的功能性质评价 2.6.1 溶解性在最佳酶解工艺条件下,血球短肽的溶解性如图 5-A所示。与血球蛋白相比,血球短肽的溶解度均在60%以上,明显优于血球蛋白。随着溶液pH的逐渐增加,血球短肽和血球蛋白的溶解度均呈现先下降后增加的趋势,在pH为6.0时溶解度最低。另外,pH 6.0最接近血球蛋白的等电点,酶解产物在等电点附近具有较低的溶解度,这与文献报道结果[24]相似。
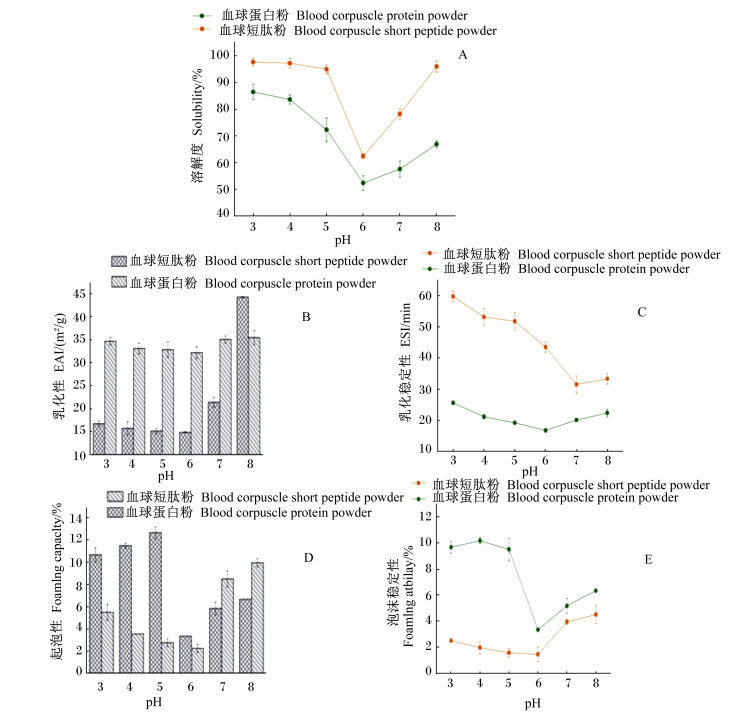
|
图 5 pH对蛋白质功能性质的影响 Figure 5 Effects of pH on functionality of proteins |
图 5-B和图 5-C是血球短肽与血球蛋白的乳化性及其稳定性随pH变化的趋势图。由图 5-B和图 5-C可知,血球短肽表现的乳化能力低于血球蛋白,水解产生小分子肽导致血球短肽的乳化性能降低,这与Liu等[21]、Turgeon等[25]的结果一致。在pH 6.0时,血球短肽和血球蛋白的乳化值最低,说明pH 6.0很可能是蛋白质的等电点,造成大分子物质沉淀或其净电荷丢失,进而导致乳化能力降低。相比较之下,血球蛋白的乳化稳定性较差,而鸭血球蛋白经酶解获得的血球短肽的乳化稳定性的改善非常明显,酸性环境中有较好的乳化稳定性。
2.6.3 起泡性泡沫是由持久的液体或水相和分散的气体或空气相形成的两相胶状系统,而蛋白质会引起两相界面的表面张力降低,从而产生起泡性。血球短肽和血球蛋白的起泡性及泡沫稳定性随pH变化的趋势见图 5-D和图 5-E。与血球蛋白相比,血球短肽在酸性环境中(pH < 7)起泡性较差,但在中性及碱性环境中的起泡效果较好,这很可能与酸性蛋白酶水解产生的小肽链使得酶解物的表面活性减小的缘故。此外,血球短肽的泡沫稳定性低于6%,效果不佳,酸性环境对血球短肽的起泡性及其稳定性影响较大。
2.7 血球短肽抗氧化活性分析血球短肽的抗氧化能力随蛋白质浓度变化的趋势见图 6。虽然喷雾干燥时瞬间高温破坏了血球短肽的部分活性物质,但其仍表现出较强的DPPH·清除能力、超氧阴离子清除能力和还原力。当蛋白质浓度为2%时,血球肽粉清除DPPH·的能力超过了80%,之后随着蛋白质浓度的提升,其清除DPPH·的能力接近100%。相比DPPH·清除率,血球短肽清除超氧阴离子的能力相对较弱,但总体趋势是清除能力随蛋白质浓度的增加而增强。通常而言,样品的抗氧化能力与还原力呈正相关,根据还原力的测定方法,吸光值越大则样品的还原力越强。由血球短肽的还原力曲线可以看出,还原力与蛋白质浓度呈正相关,蛋白质浓度为8%时,还原力最大为2.02,展现出极佳的还原力。
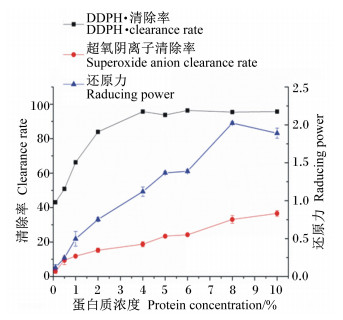
|
图 6 蛋白质浓度对血球短肽抗氧化活性的影响 Figure 6 Effects of protein concentration on antioxidant activity of blood corpuscle peptide powder |
家禽血液是一种高营养价值的蛋白质源,蛋白质含量高达20%左右,其中60%以上的蛋白质来自于血球。本研究表明,血球蛋白含量约占血球重量的38%,赖氨酸等必需氨基酸含量丰富。而血球蛋白主要存在于红细胞中,虽然红细胞在自然状态下会因血液水分、外界压力等作用发生自溶,挤破细胞膜,产生少量血红蛋白,但自溶现象发生率较低,关联因素复杂而难以控制。因此,蛋白酶水解血球的首要步骤是对红细胞进行人工溶血处理,破碎细胞膜以释放蛋白质。本研究采用化学渗透法改变红细胞膜的通透性,结合水溶胀的方式改变渗透压,并利用温度及机械震荡加速破膜,提高细胞破碎效率。选用乳酸调节溶液pH进一步深化破膜度,蛋白质充分外溢,为后续的蛋白酶水解血球蛋白与脱色奠定了基础。
本文采用5种蛋白酶(酸性蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、风味蛋白酶)对鸭血球蛋白进行酶法水解,采用水解度对各蛋白酶水解进程进行评价。综合考虑成本和水解效率,笔者选择酸性蛋白酶作为酶解鸭血球蛋白的工具酶。酸性蛋白酶是由黑曲霉发酵精炼而成的内切性蛋白酶,因其安全性高、活性强而广泛应用于食品与饲料领域。刘鹏宇等[26]采用6种商业酶水解蟹壳,酸性蛋白酶水解蟹壳蛋白的效率最高。冯琬帧等[27]用酸性蛋白酶对咸蛋清进行酶解及工艺优化,酶解48 h获得的酶解液中肽(< 3 ku)约占85.01%,其中分子质量小于1 ku约占35.73%,而本研究酶解鸭血球蛋白7 h得到分子质量3 ku以下的小分子肽约占81.89%,与文献值相近,而分子质量1 ku以下的肽约占62.82%,优于文献值。肽理论表明,小分子肽吸收具有速度快、耗能低、载体不易饱和等特点,比蛋白质和氨基酸更容易被肠道吸收,而且肽在机体内合成蛋白质率比氨基酸高,由此可知血球短肽粉具有良好的消化吸收率。此外,在动物饲粮中添加适宜的血球短肽可促进其对氨基酸吸收,避免氨基酸间的吸收竞争。
本研究获得的最佳血球蛋白水解度为(25.10±0.65)%,略高于中性蛋白酶酶解猪血红蛋白的效率[28],与木瓜蛋白酶和中性蛋白酶双酶水解血红蛋白的程度相接近[1]。此外,研究表明致使血液呈棕红色的亚铁血红素在酸性、高水解度的产物中呈难溶状态[16],离心可去除富含亚铁血红素的沉淀进而达到脱色的目的。这恰好与本文研究结果相符,鸭血球蛋白经酸性蛋白酶水解后脱色效果明显,其短肽粉趋近于乳白色,L*值与WI值约是血球蛋白粉的4倍。通常酶解过程伴有苦味肽生成,致使水解液呈苦味或涩味,而本研究得到的血球短肽经品尝没有苦味,且其氨基酸疏水性值Q低于5 443 J/mol,说明酸性蛋白酶水解并未对产物风味造成不良影响。
血球短肽的赖氨酸等必需氨基酸含量丰富,呈味氨基酸约占总氨基酸的31%,可作为一种很好的谷物蛋白互补物,也可适量补充蛋氨酸应用于家禽、水产等饲料中。为深入了解血球酶解产物的应用价值,本文对血球短肽的功能特性与抗氧化特性进行评价。与多数蛋白质水解研究相似[29-31],高水解强度下获得的血球短肽具有较高的溶解性。这主要归因于酶解使得血球的二级结构破坏,肽链长度缩短,与水结合形成强烈的氢键,从而增加其溶解性[24, 29]。本试验中,pH对血球短肽的溶解性影响较大,且在等电点pH 6.0时溶解性最低,这主要是因为pH影响肽段的静电荷数量的变化,在弱酸环境(pH 6.0)中侧链基团的电荷释放受限,进而导致蛋白质或肽段在此沉淀性增强。血球短肽起泡性及其稳定性在酸碱环境中波动较大,乳化能力整体偏低,但易被吸附在油水界面形成的黏膜上而产生较好的乳化稳定性,这或许与水解产生小分子肽有关[20, 25]。血球短肽具有良好的乳化稳定性,这可能是因为酸性蛋白酶水解血球蛋白产生的小肽易被吸附在油水界面形成的黏膜上,或是酸性水解环境降低了小肽与油水膜间的电荷排斥作用,导致乳化稳定性能提高。
酶的种类影响酶解产物的抗氧化性。江勇等[32]分别使用5种商业蛋白酶水解鲨鱼皮明胶,酸性蛋白酶水解产物具有最佳的抗氧化活性,本试验有类似的结果。鸭血球蛋白酶解产物具有自由基清除能力,随浓度增加而清除自由基能力愈强。血球短肽还具有较高的还原能力,这主要归功于酸性蛋白酶水解使血球蛋白断裂产生许多小分子肽段或氨基酸残基成分(< 3 ku约占82%)。由此可见,血球短肽具有较强的抗氧化活性,可以作为自由基稳定剂和氢供体抑制脂质氧化及预防食物腐败变性。此外,血球短肽中含有少量的糖类和脂质,经喷雾干燥发生美拉德反应抑制油脂类自动氧化,有助于延长贮藏时间,提高产品稳定性。由此可见,血球短肽可以作为一种功能性原料应用于食品或者饲料中。
4 结论① 采用水解度和水解物产量双指标衡量正交试验结果,优化确定了酸性蛋白酶水解鸭血球蛋白制备短肽的工艺条件为:酶用量6 000 U/g,温度50℃,pH 3.5,水解时间7 h。在此条件下,蛋白水解度为(25.10±0.65)%,水解物产量为(60.09±1.77)%。
② 与血球蛋白粉相比,鸭血球短肽粉呈乳白色且无异味,L*值与WI值较高,且其小分子肽含量高,3 ku以下的占81.89%,1 ku以下的占62.82%,有利于动物的消化吸收。
③ 血球短肽氨基酸种类齐全,必需氨基酸含量丰富,约占总氨基酸的53.31%,异亮氨酸、蛋氨酸等血球限制性氨基酸含量均有不同幅度的增加,且赖氨酸含量高,可作为一种很好的谷物蛋白质互补物。
④ 经酸性蛋白酶改性的鸭血球蛋白具有良好的溶解性(>60%)、乳化稳定性及清除自由基、还原力等抗氧化活性,功能特性良好,可作为功能性原料应用于饲料与食品行业中。
| [1] |
于美娟, 马美湖, 单杨, 等. 采用两酶复合水解猪血红蛋白(Hb)制备水解蛋白的研究[J].
于美娟, 马美湖, 单杨, 等. 采用两酶复合水解猪血红蛋白(Hb)制备水解蛋白的研究[J]. 食品科学, 2007 , 28 (1) :196 –200.
( 0) 0)
|
| [2] |
OFORI J A, HSIEH Y H P. Issues related to the use of blood in food and animal feed[J].
OFORI J A, HSIEH Y H P. Issues related to the use of blood in food and animal feed[J]. Critical Reviews in Food Science and Nutrition, 2014 , 54 (4) : 687 –697.
( 0) 0)
|
| [3] |
YU Y K, HU J E, MIYAGUCHI Y, et al. Isolation and characterization of angiotensin I-converting enzyme inhibitory peptides derived from porcine hemoglobin[J].
YU Y K, HU J E, MIYAGUCHI Y, et al. Isolation and characterization of angiotensin I-converting enzyme inhibitory peptides derived from porcine hemoglobin[J]. Peptides, 2006 , 27 (11) : 2950 –2956.
DOI: 10.1016/j.peptides.2006.05.025 ( 0) 0)
|
| [4] |
DENG H L, ZHENG J, ZHANG F S, et al. Isolation of angiotensinⅠ-converting enzyme inhibitor from pepsin hydrolysate of porcine hemoglobin[J].
DENG H L, ZHENG J, ZHANG F S, et al. Isolation of angiotensinⅠ-converting enzyme inhibitor from pepsin hydrolysate of porcine hemoglobin[J]. European Food Research and Technology, 2014 , 239 (6) : 933 –940.
DOI: 10.1007/s00217-014-2290-0 ( 0) 0)
|
| [5] |
NYBERG F, SANDERSON K, GLÄMSTA E L. The hemorphins:a new class of opioid peptides derived from the blood protein hemoglobin[J].
NYBERG F, SANDERSON K, GLÄMSTA E L. The hemorphins:a new class of opioid peptides derived from the blood protein hemoglobin[J]. Biopolymers, 1997 , 43 (2) : 147 –156.
DOI: 10.1002/(SICI)1097-0282(1997)43:2<>1.0.CO;2-6 ( 0) 0)
|
| [6] |
ZHAO Q Y, GARREAU I, SANNIER F, et al. Opioid peptides derived from hemoglobin:hemorphins[J].
ZHAO Q Y, GARREAU I, SANNIER F, et al. Opioid peptides derived from hemoglobin:hemorphins[J]. Biopolymers, 1997 , 43 (2) : 75 –98.
DOI: 10.1002/(SICI)1097-0282(1997)43:2<>1.0.CO;2-6 ( 0) 0)
|
| [7] |
ZHAO Q Y, MOLINA P, PIOT J M. Peptic peptide mapping by HPLC, on line with photodiode array detection, of a hemoglobin hydrolysate produced at pilot-plant scale from an ultrafiltration process[J].
ZHAO Q Y, MOLINA P, PIOT J M. Peptic peptide mapping by HPLC, on line with photodiode array detection, of a hemoglobin hydrolysate produced at pilot-plant scale from an ultrafiltration process[J]. Journal of Liquid Chromatography & Related Technologies, 1997 , 20 (11) : 1717 –1739.
( 0) 0)
|
| [8] |
TAKAGI H, SHIOMI H, FUKUI K, et al. Isolation of a novel analgesic pentapeptide, neo-kyotorphin, from bovine brain[J].
TAKAGI H, SHIOMI H, FUKUI K, et al. Isolation of a novel analgesic pentapeptide, neo-kyotorphin, from bovine brain[J]. Life Sciences, 1982 , 31 (16/17) : 1733 –1736.
( 0) 0)
|
| [9] |
DAOUD R, DUBOIS V, BORS-DODITA L, et al. New antibacterial peptide derived from bovine hemoglobin[J].
DAOUD R, DUBOIS V, BORS-DODITA L, et al. New antibacterial peptide derived from bovine hemoglobin[J]. Peptides, 2005 , 26 (5) : 713 –719.
DOI: 10.1016/j.peptides.2004.12.008 ( 0) 0)
|
| [10] |
NEDJAR-ARROUME N, DUBOIS-DELVAL V, ADJE E Y, et al. Bovine hemoglobin:an attractive source of antibacterial peptides[J].
NEDJAR-ARROUME N, DUBOIS-DELVAL V, ADJE E Y, et al. Bovine hemoglobin:an attractive source of antibacterial peptides[J]. Peptides, 2008 , 29 (6) : 969 –977.
DOI: 10.1016/j.peptides.2008.01.011 ( 0) 0)
|
| [11] |
CHANG C Y, WU K C, CHIANG S H. Antioxidant properties and protein compositions of porcine haemoglobin hydrolysates[J].
CHANG C Y, WU K C, CHIANG S H. Antioxidant properties and protein compositions of porcine haemoglobin hydrolysates[J]. Food Chemistry, 2007 , 100 (4) : 1537 –1543.
DOI: 10.1016/j.foodchem.2005.12.019 ( 0) 0)
|
| [12] |
SUN Q, LUO Y K, SHEN H X, et al. Purification and characterisation of a novel antioxidant peptide from porcine haemoglobin hydrolysate[J].
SUN Q, LUO Y K, SHEN H X, et al. Purification and characterisation of a novel antioxidant peptide from porcine haemoglobin hydrolysate[J]. International Journal of Food Science & Technology, 2012 , 47 (1) : 148 –154.
( 0) 0)
|
| [13] |
邓佳, 刘学文, 邓冕. 猪血血红蛋白酶解的优化研究[J].
邓佳, 刘学文, 邓冕. 猪血血红蛋白酶解的优化研究[J]. 食品科技, 2007 , 32 (11) :210 –213.
( 0) 0)
|
| [14] |
GUO S G, ZHAO M M, CUI C, et al. Optimized nitrogen recovery and non-bitter hydrolysates from porcine hemoglobin[J].
GUO S G, ZHAO M M, CUI C, et al. Optimized nitrogen recovery and non-bitter hydrolysates from porcine hemoglobin[J]. Food Science and Technology Research, 2008 , 14 (1) : 39 –48.
DOI: 10.3136/fstr.14.39 ( 0) 0)
|
| [15] |
SUN Q, SHEN H X, LUO Y K. Antioxidant activity of hydrolysates and peptide fractions derived from porcine hemoglobin[J].
SUN Q, SHEN H X, LUO Y K. Antioxidant activity of hydrolysates and peptide fractions derived from porcine hemoglobin[J]. Journal of Food Science and Technology, 2011 , 48 (1) : 53 –60.
DOI: 10.1007/s13197-010-0115-0 ( 0) 0)
|
| [16] |
IN M J, KIM D C, CHAE H J, et al. Effects of degree of hydrolysis and pH on the solubility of heme-iron enriched peptide in hemoglobin hydrolysate[J].
IN M J, KIM D C, CHAE H J, et al. Effects of degree of hydrolysis and pH on the solubility of heme-iron enriched peptide in hemoglobin hydrolysate[J]. Bioscience, Biotechnology, and Biochemistry, 2003 , 67 (2) : 365 –367.
DOI: 10.1271/bbb.67.365 ( 0) 0)
|
| [17] |
NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J].
NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science, 2001 , 66 (5) : 642 –646.
DOI: 10.1111/jfds.2001.66.issue-5 ( 0) 0)
|
| [18] |
LOW A, LAY M, VERBEEK J, et al. Decoloring hemoglobin as a feedstock for second-generation bioplastics[J].
LOW A, LAY M, VERBEEK J, et al. Decoloring hemoglobin as a feedstock for second-generation bioplastics[J]. Preparative Biochemistry and Biotechnology, 2012 , 42 (1) : 29 –43.
DOI: 10.1080/10826068.2011.563401 ( 0) 0)
|
| [19] |
BHASKAR N, MAHENDRAKAR N S. Protein hydrolysate from visceral waste proteins of Catla (Catla catla):optimization of hydrolysis conditions for a commercial neutral protease[J].
BHASKAR N, MAHENDRAKAR N S. Protein hydrolysate from visceral waste proteins of Catla (Catla catla):optimization of hydrolysis conditions for a commercial neutral protease[J]. Bioresource Technology, 2008 , 99 (10) : 4105 –4111.
DOI: 10.1016/j.biortech.2007.09.006 ( 0) 0)
|
| [20] |
NEY K H. Prediction of bitterness of peptides from their amino acid composition[J].
NEY K H. Prediction of bitterness of peptides from their amino acid composition[J]. Zeitschrift für Lebensmittel-Untersuchung und Forschung, 1971 , 147 (2) : 64 –68.
DOI: 10.1007/BF01879606 ( 0) 0)
|
| [21] |
LIU Q, KONG B H, XIONG Y L, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J].
LIU Q, KONG B H, XIONG Y L, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry, 2010 , 118 (2) : 403 –410.
DOI: 10.1016/j.foodchem.2009.05.013 ( 0) 0)
|
| [22] |
KOU X H, GAO J, XUE Z H, et al. Purification and identification of antioxidant peptides from chickpea (Cicer arietinum L.) albumin hydrolysates[J].
KOU X H, GAO J, XUE Z H, et al. Purification and identification of antioxidant peptides from chickpea (Cicer arietinum L.) albumin hydrolysates[J]. LWT-Food Science and Technology, 2013 , 50 (2) : 591 –598.
DOI: 10.1016/j.lwt.2012.08.002 ( 0) 0)
|
| [23] |
LI Y H, JIANG B, ZHANG T, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J].
LI Y H, JIANG B, ZHANG T, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J]. Food Chemistry, 2008 , 106 (2) : 444 –450.
DOI: 10.1016/j.foodchem.2007.04.067 ( 0) 0)
|
| [24] |
POPINEAU Y, MASSON P, THEBAUDIN J Y.Enzymatic processing of wheat proteins[M]//GODON B.Bioconversion of Cereal Products.New York:VCH Publishers, 1993:129-131.
( 0) 0)
|
| [25] |
TURGEON S L, GAUTHIER S F, PAQUIN P. Interfacial and emulsifying properties of whey peptide fractions obtained with a two-step ultrafiltration process[J].
TURGEON S L, GAUTHIER S F, PAQUIN P. Interfacial and emulsifying properties of whey peptide fractions obtained with a two-step ultrafiltration process[J]. Journal of Agricultural and Food Chemistry, 1991 , 39 (4) : 673 –676.
DOI: 10.1021/jf00004a009 ( 0) 0)
|
| [26] |
刘鹏宇, 胡建恩, 卢航, 等. 酶法水解蟹壳蛋白的工艺研究[J].
刘鹏宇, 胡建恩, 卢航, 等. 酶法水解蟹壳蛋白的工艺研究[J]. 食品科技, 2014 , 39 (2) :220 –224.
( 0) 0)
|
| [27] |
冯琬帧, 崔春, 任娇艳, 等. 咸蛋清蛋白深度酶解工艺优化研究[J].
冯琬帧, 崔春, 任娇艳, 等. 咸蛋清蛋白深度酶解工艺优化研究[J]. 食品工业科技, 2014 , 35 (2) :146 –149.
( 0) 0)
|
| [28] |
胡刚, 王春维, 周海, 等. 酶解猪血红蛋白工艺条件的研究[J].
胡刚, 王春维, 周海, 等. 酶解猪血红蛋白工艺条件的研究[J]. 饲料工业, 2009 , 30 (23) :18 –22.
( 0) 0)
|
| [29] |
孔祥珍, 周惠明, 钱海峰. 小麦面筋蛋白酶解物的制备及其功能性质研究[J].
孔祥珍, 周惠明, 钱海峰. 小麦面筋蛋白酶解物的制备及其功能性质研究[J]. 中国农业科学, 2006 , 39 (3) :593 –598.
( 0) 0)
|
| [30] |
DONG S Y, ZENG M Y, WANG D F, et al. Antioxidant and biochemical properties of protein hydrolysates prepared from Silver carp (Hypophthalmichthys molitrix)[J].
DONG S Y, ZENG M Y, WANG D F, et al. Antioxidant and biochemical properties of protein hydrolysates prepared from Silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2008 , 107 (4) : 1485 –1493.
DOI: 10.1016/j.foodchem.2007.10.011 ( 0) 0)
|
| [31] |
KONG B H, XIONG Y L. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J].
KONG B H, XIONG Y L. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J]. Journal of Agricultural and Food Chemistry, 2006 , 54 (16) : 6059 –6068.
DOI: 10.1021/jf060632q ( 0) 0)
|
| [32] |
江勇, 汪少芸, 饶平凡. 鲨鱼皮明胶水解肽的制备、分离纯化与抗氧化活性研究[J].
江勇, 汪少芸, 饶平凡. 鲨鱼皮明胶水解肽的制备、分离纯化与抗氧化活性研究[J]. 中国食品学报, 2012 , 12 (3) :28 –33.
( 0) 0)
|




