2. 重庆优宝生物技术股份有限公司, 重庆 400711
2. Chongqing Unibio Biotechnology Co., Ltd., Chongqing 400711, China
鸡蛋是廉价的动物性蛋白质来源。我国鸡蛋总产量和人均占有量都达到了世界第一[1]。但与此同时,鸡蛋也成为人感染沙门氏菌最重要的媒介之一。自1985年至1999年,美国371例已知感染源的沙门氏菌病爆发中就有298起与鸡蛋相关[2]。加之,近年来全球鸡蛋沙门氏菌感染事件频发,如何有效控制鸡蛋沙门氏菌感染至关重要。
已有研究表明微生态制剂和酸化剂能够改善鸡体健康和生产性能。胡顺珍等[3]用复合微生态制剂饲喂肉鸡显著提高了肉鸡生产性能、盲肠乳酸杆菌数以及血浆总抗氧化能力。Machado等[4]对15日龄科宝肉鸡进行沙门氏菌攻毒,发现在饮水中添加有机酸可显著降低22、42日龄肉鸡盲肠、嗉囊沙门氏菌阳性率。Higgins等[5]用乳酸杆菌饲喂沙门氏菌攻毒后的蛋鸡,显著降低了沙门氏菌阳性率(24 h后对照组85%、试验组15%)。徐刚[6]研究发现0.3%酸化剂和0.2%益生菌联合使用能显著降低肉鸡全期料重比,降低率达8.57%,且表现出显著的互作效应。因此,合理应用酸化剂和微生态制剂有望成为改善蛋鸡健康和控制鸡蛋沙门氏菌感染的重要方法。
由于酸化剂和微生态制剂的组成和配伍不同,效果不尽一致。因此,本试验通过探讨复合酸化剂和微生态制剂以及两者联用对蛋鸡健康以及鸡蛋沙门氏菌感染的影响,旨在为其在蛋鸡生产中的应用提供更多理论依据。
1 材料与方法 1.1 试验材料试验用的复合酸化剂和微生态制剂由重庆优宝生物技术股份有限公司提供。复合酸化剂含甲酸、乳酸、丙酸、丁酸、乳酸和缓冲体系;微生态制剂含乳酸杆菌、芽孢杆菌以及酵母细胞壁多糖。
1.2 试验设计试验采用单因素完全随机设计,设4个处理,分别为对照组、微生态制剂组、复合酸化剂组以及微生态制剂与复合酸化剂联用组。对照组为基础饲粮,微生态制剂组在基础饲粮中添加300 g/t微生态制剂,复合酸化剂组隔日在饮水中添加0.1%复合酸化剂,微生态制剂与复合酸化剂联用组在基础饲粮中添加300 g/t微生态制剂并隔日在饮水中添加0.1%复合酸化剂。每组10个重复,每个重复15只鸡,共600只蛋鸡。饲养试验期为16周,然后再进行为期13 d的沙门氏菌攻毒试验,试鸡为对照组蛋鸡。
1.3 基础饲粮试验用基础饲粮为玉米-豆粕型,参照我国农业行业标准NY/T 33—2004中蛋鸡营养成分推荐值配制,基础饲粮组成及营养水平见表 1,饲粮为粉料。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验选取600只50周龄健康罗曼粉壳蛋鸡,采用3层笼养,每笼3只鸡,连续5笼为1个重复。以产蛋率为基础进行随机分配。光照16 h,自由饮水和采食。
1.5 测定指标 1.5.1 生产性能产蛋率:每日以重复为单位记录产蛋枚数、破蛋数、脏蛋数,并准确称重,计算产蛋率、入舍鸡产蛋率、破蛋率、脏蛋率和平均蛋重。
采食量和料蛋比:每周记录饲粮消耗情况,计算每个重复的平均日采食量和料蛋比。
死亡率:每天以重复为单位记录死亡只数,计算死亡率。
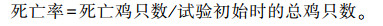
|
在试验第12周时,每个重复随机挑选1只健康蛋鸡从翅静脉抽取血液,测定血常规指标(白细胞数、血红蛋白含量、红细胞数等)及免疫球蛋白G(IgG)含量。血常规指标送至雅安第四军医院测定;IgG含量采用酶联免疫吸附试验法测定,试剂盒购于南京建成生物工程研究所。
1.5.3 生殖器官抗氧化指标鸡只采血后屠宰,采集鸡输卵管膨大部、狭部、卵巢,保存于-20℃冰箱,备测抗氧化指标,包括总抗氧化能力(T-AOC)、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性,分别采用还原法、硫代巴比妥酸(TBA)法、黄嘌呤氧化酶法测定,试剂盒均购于南京建成生物工程研究所。
1.5.4 蛋鸡及鸡蛋沙门氏菌阳性率 1.5.4.1 试验第12周的阳性率每组随机选择4只鸡进行解剖采样,取5个器官(肝脏、脾脏、盲肠、输卵管、胆囊);每组随机取鸡蛋7枚。样品送四川大学动物疾病防控与食品安全四川省重点实验室检测沙门氏菌,方法包括传统分离培养法、环介导等温扩增技术(LAMP)、缓冲蛋白胨水-大豆肉汤(BPW-RVS)增菌PCR和优化选择性增菌液(SEM)PCR等4种检测方法。
1.5.4.2 沙门氏菌攻毒后的输卵管及鸡蛋沙门氏菌阳性率在饲养试验16周结束后,从对照组中选择56只健康蛋鸡,分为4个处理(每个处理14只鸡),分别为:对照组饲喂基础饲粮,微生态制剂组在基础饲粮中添加300 g/t微生态制剂,复合酸化剂组隔日在饮水中添加0.1%复合酸化剂,微生态制剂与复合酸化剂联用组在基础饲粮中添加300 g/t微生态制剂并隔日在饮水中添加0.1%复合酸化剂;另选5只鸡在试验开始时采样作为空白对照。鸡只采用单笼饲养。在试验开始前3 d,每天水服庆大霉素以清除原有沙门氏菌的干扰,然后口腔接种肠炎沙门氏菌1 mL,含量为1.3×108 CFU。肠炎沙门氏菌由四川农业大学动物医学院黄勇教授惠赠,分离自当地蛋鸡场粪便。
于试验第7天和第14天早上每个处理屠宰7只鸡,取输卵管检测沙门氏菌阳性率,同时每个处理收集第10~13天鸡蛋各7枚,检测沙门氏菌阳性率。检测由四川大学动物疫病防控与食品安全四川省重点实验室完成,方法为传统分离培养法。
1.6 统计分析结果采用SPSS 17.0软件对数据进行单因素方差分析(one-way ANOVA),Duncan氏法进行多重比较。试验结果用平均值±标准差表示。P < 0.05作为差异显著性评判标准,0.05≤P < 0.10表示具有差异显著趋势。沙门氏菌阳性率采用SPSS 17.0对数据进行卡方检验。
2 结果与分析 2.1 复合酸化剂和微生态制剂对蛋鸡生产性能的影响从表 2可见,各组蛋鸡的生产性能均无显著差异(P>0.05),但平均日采食量的差异趋于显著(P=0.089)。总体上,以微生态制剂与复合酸化剂联用组蛋鸡的生产性能较好。
|
|
表 2 复合酸化剂和微生态制剂对蛋鸡生产性能的影响 Table 2 Effects of compound acidifier and probiotics on performance of laying hens |
从表 3可见,复合酸化剂和微生态制剂的添加对平均蛋重和破蛋率无显著影响(P>0.05),但显著影响脏蛋率(P<0.05),3个试验组的脏蛋率均显著低于对照组(P<0.05)。
|
|
表 3 复合酸化剂和微生态制剂对平均蛋重、脏蛋率和破蛋率的影响 Table 3 Effects of compound acidifier and probiotics on average egg weight, dirty egg percent and cracked egg percent |
从表 4可见,不同试验组的蛋鸡血液白细胞数、血红蛋白含量、红细胞数和IgG含量差异不显著(P>0.05),但与对照组相比,微生态制剂组的蛋鸡白细胞数显著降低(P<0.05),IgG含量有提高的趋势(P=0.061)。
|
|
表 4 复合酸化剂和微生态制剂对蛋鸡血液生化指标的影响 Table 4 Effects of compound acidifier and probiotics on blood biochemical indices of laying hens |
从表 5可见,不同试验组对蛋鸡输卵管膨大部、峡部和卵巢的SOD活性和T-AOC均无显著影响(P>0.05);在输卵管膨大部,微生态制剂组MDA含量显著高于其他3组(P<0.05);而在输卵管峡部,复合酸化剂组、微生态制剂与复合酸化剂联用组MDA含量均显著低于对照组(P<0.05);试验各处理对卵巢MDA含量影响趋于显著(P=0.096)。
|
|
表 5 复合酸化剂和微生态制剂对蛋鸡生殖器官抗氧化指标的影响 Table 5 Effects of compound acidifier and probiotics on reproductive organ antioxidant indices of laying hens |
从表 6可见,在试验的第12周,仅有对照组的1只鸡的盲肠用BPW-RVS增菌PCR检测出了沙门氏菌,其余均未检测出沙门氏菌。
|
|
表 6 复合酸化剂和微生态制剂对蛋鸡和鸡蛋沙门氏菌阳性率的影响 Table 6 Effects of compound acidifier and probiotics on the Salmonella positive ratio of laying hens and eggs |
从表 7可见,在沙门氏菌攻毒后第7天,与对照组相比,3个试验组均降低了蛋鸡输卵管沙门氏菌阳性率,其中复合酸化剂组达到显著水平(P<0.05);在攻毒后第14天,仅复合酸化剂组蛋鸡输卵管沙门氏菌阳性率极显著降低(P<0.01);各组间鸡蛋样品中沙门氏菌阳性率差异不显著(P>0.05),其中微生态制剂与复合酸化剂联用组未检出沙门氏菌。
|
|
表 7 复合酸化剂和微生态制剂对沙门氏菌攻毒后蛋鸡输卵管和鸡蛋沙门氏菌阳性率的影响 Table 7 Effects of compound acidifier and probiotics on the Salmonella positive ratio of oviduct and eggs in Salmonella enteritidis challenged laying hens |
复合酸化剂和微生态制剂主要是通过改善机体健康以及抑制有害菌的生长而促进生产性能的改善。Yesilbag等[7]用添加0.5%、1.0%和1.5%有机酸复合制剂的饲粮饲喂20~37周龄罗曼蛋鸡,结果显示有机酸复合制剂对体增重和采食量无影响,部分周龄产蛋率显著上升,本试验与其研究结果相似。脏蛋率的高低反映蛋鸡肠道健康程度。本试验发现复合酸化剂能够显著降低脏蛋率,可能是由于其降低了肠道pH,提高了酶活,抑制了诸如大肠杆菌、沙门氏菌之类有害菌的生长,改变了消化道微生物结构[8],从而改善了肠道健康。本试验条件下,微生态制剂对蛋鸡生产性能无显著影响,显著降低了脏蛋率,原因可能是嗜酸性乳酸杆菌能够通过激活促细胞分裂蛋白激酶,从肠上皮细胞抗炎症和细胞凋亡效应2个方面有效地保护肠上皮[10-11],从而提高蛋鸡肠道健康,减少脏蛋率。
复合酸化剂会使机体肠道pH降低,抑制有害菌的生长,帮助微生态制剂中的益生菌建立优势菌群。微生态制剂由多种耐酸菌组成,适当的酸性有助于其增殖,且其产酸作用也有助于稳定和增加复合酸化剂在消化道内的酸化效果[6, 12]。由于受到鸡品种、周龄、酸化剂和益生菌的配伍以及酸化剂与益生菌组合的不同,复合酸化剂和微生态制剂的使用效果也不尽一致。孙冰锋[12]用不同比例组合的酸化剂与微生态制剂饲喂1日龄艾维茵肉鸡,结果显示0.1%酸化剂与0.4%益生菌联用效果最好,显著提高了体增重和采食量,显著降低了料重比和死亡率。本试验中,微生态制剂与复合酸化剂联用组虽然对产蛋率的提高程度未达到显著水平,但高于其他各组,且平均日采食量也高于其他各组,而且脏蛋率较低,这表明微生态制剂和复合酸化剂联用对蛋鸡生产性能提高效果更好。
3.2 复合酸化剂和微生态制剂对蛋鸡血液生化指标的影响血细胞是机体免疫系统的重要组成部分,其数量的变化情况可以在一定程度上反映机体的免疫状态[13]。IgG抗体是血液中非常重要的抗体,它能够中和病毒,且与抗原结合使其更利于吞噬细胞。IgG含量多少很大程度上反映了机体免疫能力的大小。靳二辉等[13]用以芽孢杆菌为主的复合益生菌饲喂1~42日龄爱拔益加肉鸡,发现400 mg/kg复合益生菌能显著降低21、42日龄肉鸡血液红细胞数以及42日龄白细胞数,但对其他血细胞数没有影响;同时,该研究认为适当补充芽孢杆菌可降低白细胞数,抑制炎症反应。赵德建[14]用中草药制剂饲喂鼠伤寒沙门氏菌攻毒肉鸡,发现对照组肉鸡红细胞数显著高于试验组,并认为沙门氏菌会攻击红细胞,导致红细胞数的减少,使用添加剂后,可以减少有害菌的危害,使红细胞数维持在较正常水平。本试验微生态制剂组的血液白细胞数显著低于对照组,表明微生态制剂可以抑制炎症反应;同时微生态制剂组的血液IgG含量有高于对照组的趋势,说明了微生态制剂可以提高蛋鸡免疫力。
3.3 复合酸化剂和微生态制剂对蛋鸡生殖器官抗氧化指标的影响抗氧化能力的大小与机体的健康程度有着密切的关系。脂质过氧化物MDA含量、T-AOC以及SOD活性是反映机体抗氧化能力及健康程度的重要指标。陈家祥等[15]用地衣芽孢杆菌饲喂1~28日龄的麻羽肉鸡,发现在28日龄时50 mg/kg地衣芽孢杆菌能显著提高肉鸡血清SOD和谷胱甘肽过氧化物酶活性,显著降低血清MDA含量,但随着添加量的提升,其改善效果反而没有那么明显。本试验中,微生态制剂的添加显著提高了输卵管膨大部MDA含量,可能与微生态制剂的添加量有一定关系,具体原因需要更深层次的研究。本试验进行时正处于夏天,气温偏高。在热应激条件下,脂质过氧化容易发生,机体的T-AOC会显著降低[16],酸化剂可以通过调节酸碱平衡,缓解热应激[17]。本试验中微生态制剂与复合酸化剂联用组均能够显著降低输卵管峡部MDA含量,表明可缓解因过热造成的蛋鸡脂质过氧化。
3.4 复合酸化剂和微生态制剂对蛋鸡和鸡蛋沙门氏菌感染的影响沙门氏菌感染蛋鸡,会导致鸡白痢、伤寒、副伤寒的发生,轻则引起生产性能下降,重则死亡。当沙门氏菌进入蛋鸡体内,其会攻击肠道上皮细胞并触发和渗透进免疫细胞中,主要是巨噬细胞,而沙门氏菌具有在免疫细胞中生存和复制的能力,随巨噬细胞一起在宿主体内传播,从而到达生殖器官,可能随着鸡蛋的形成过程相应进入鸡蛋的相应部位[2]。所以,蛋鸡生殖系统附植沙门氏菌的阳性率很大程度上可以决定鸡蛋的沙门氏菌阳性率。用酸化剂和微生态制剂抑制有害菌的生长前人有过很多报道,由于各个复合制剂的组成与配伍不同,其对有害菌的抑制效果也参差不齐,但大部分都有改善效果[5, 18-19]。
本试验通过饲喂微生态制剂、复合酸化剂或两者联用后12周,经过4种方法检测蛋鸡生殖道和鸡蛋,仅其中1种方法在对照组中的1个样品检出沙门氏菌,表明本试验鸡群基本上为沙门氏菌阴性鸡群。通过人工接种沙门氏菌攻毒发现,攻毒后第7天复合酸化剂组的输卵管沙门氏菌阳性率显著低于对照组,同时在第14天极显著低于对照组,说明复合酸化剂对沙门氏菌有显著的抑制作用;但与微生态剂联用使用没有产生显著的效果,具体原因尚有待进一步研究。
鸡蛋沙门氏菌阳性率方面,在统计学上各组鸡蛋沙门氏菌阳性率差异不显著。参照前人的研究,人工接种沙门氏菌鸡蛋的阳性率不会很高,一般就在10%左右[20-23]。本试验鸡蛋的阳性率与前人的研究相一致,且相较于其他3个组14.3%的阳性率,微生态制剂与复合酸化剂联用组的阳性率为0,降低效果十分明显。家禽肠道任何部位的感染都可能引起沙门氏菌系统性地传播,继而通过生殖系统感染鸡蛋[2]。而复合酸化剂和微生态制剂的联用更有利于全肠道的沙门氏菌净化,从而减少鸡蛋沙门氏菌阳性率。
4 结 论①复合酸化剂能显著降低鸡蛋脏蛋率,降低输卵管MDA的产生,缓解脂质过氧化反应,且能显著抑制输卵管沙门氏菌的生长。
②微生态制剂能降低鸡蛋脏蛋率,有提高血液IgG含量的趋势,能显著降低血液白细胞数,抑制炎症反应。
③复合酸化剂和微生态制剂联用可显著降低攻毒后鸡蛋沙门氏菌阳性率。
| [1] |
赵一夫, 薛莉, 秦富. 我国蛋鸡产业生产状况及发展形势分析[J].
赵一夫, 薛莉, 秦富. 我国蛋鸡产业生产状况及发展形势分析[J]. 中国家禽, 2010 , 32 (4) :1 –7.
( 0) 0)
|
| [2] |
GANTOIS I, DUCATELLE R, PASMANS F, et al. Mechanisms of egg contamination by Salmonella enteritidis[J].
GANTOIS I, DUCATELLE R, PASMANS F, et al. Mechanisms of egg contamination by Salmonella enteritidis[J]. FEMS Microbiology Reviews, 2009 , 33 (4) : 718 –738.
DOI: 10.1111/j.1574-6976.2008.00161.x ( 0) 0)
|
| [3] |
胡顺珍, 张建梅, 谢全喜, 等. 复合微生态制剂对肉鸡生产性能、肠道菌群、抗氧化指标和免疫功能的影响[J].
胡顺珍, 张建梅, 谢全喜, 等. 复合微生态制剂对肉鸡生产性能、肠道菌群、抗氧化指标和免疫功能的影响[J]. 动物营养学报, 2012 , 24 (2) :334 –341.
( 0) 0)
|
| [4] |
MACHADO JUNIOR P C, BEIRÃO B C B, FILHO T F, et al. Use of blends of organic acids and oregano extracts in feed and water of broiler chickens to control Salmonella enteritidis persistence in the crop and ceca of experimentally infected birds[J].
MACHADO JUNIOR P C, BEIRÃO B C B, FILHO T F, et al. Use of blends of organic acids and oregano extracts in feed and water of broiler chickens to control Salmonella enteritidis persistence in the crop and ceca of experimentally infected birds[J]. The Journal of Applied Poultry Research, 2014 , 23 (4) : 671 –682.
DOI: 10.3382/japr.2014-00979 ( 0) 0)
|
| [5] |
HIGGINS S E, HIGGINS J P, WOLFENDEN A D, et al. Evaluation of a Lactobacillus-based probiotic culture for the reduction of Salmonella enteritidis in neonatal broiler chicks[J].
HIGGINS S E, HIGGINS J P, WOLFENDEN A D, et al. Evaluation of a Lactobacillus-based probiotic culture for the reduction of Salmonella enteritidis in neonatal broiler chicks[J]. Poultry Science, 2008 , 87 (1) : 27 –31.
DOI: 10.3382/ps.2007-00210 ( 0) 0)
|
| [6] |
徐刚.肉仔鸡用四种绿色饲料添加剂的应用效果及其组合效应研究[D].硕士学位论文.杨凌:西北农林科技大学, 2007.
http://cdmd.cnki.com.cn/Article/CDMD-10712-2007188243.htm
( 0) 0)
|
| [7] |
YESILBAG D, ÇOLPAN I. Effects of organic acid supplemented diets on growth performance, egg production and quality and on serum parameters in laying hens[J].
YESILBAG D, ÇOLPAN I. Effects of organic acid supplemented diets on growth performance, egg production and quality and on serum parameters in laying hens[J]. Revue de Médecine Vétérinaire, 2006 , 157 (5) : 280 –284.
( 0) 0)
|
| [8] |
WANG J P, YOO J S, LEE J H, et al. Effects of phenyllactic acid on production performance, egg quality parameters, and blood characteristics in laying hens[J].
WANG J P, YOO J S, LEE J H, et al. Effects of phenyllactic acid on production performance, egg quality parameters, and blood characteristics in laying hens[J]. The Journal of Applied Poultry Research, 2009 , 18 (2) : 203 –209.
DOI: 10.3382/japr.2008-00071 ( 0) 0)
|
| [9] |
KURTOGLU V, KURTOGLU F, SEKER E, et al. Effect of probiotic supplementation on laying hen diets on yield performance and serum and egg yolk cholesterol[J].
KURTOGLU V, KURTOGLU F, SEKER E, et al. Effect of probiotic supplementation on laying hen diets on yield performance and serum and egg yolk cholesterol[J]. Food Additives & Contaminants, 2004 , 21 (9) : 817 –823.
( 0) 0)
|
| [10] |
YAN F, CAO H W, COVER T L, et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth[J].
YAN F, CAO H W, COVER T L, et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth[J]. Gastroenterology, 2007 , 132 (2) : 562 –575.
DOI: 10.1053/j.gastro.2006.11.022 ( 0) 0)
|
| [11] |
RESTA-LENERT S, BARRETT K E. Probiotics and commensals reverse TNF-α-and IFN-γ-induced dysfunction in human intestinal epithelial cells[J].
RESTA-LENERT S, BARRETT K E. Probiotics and commensals reverse TNF-α-and IFN-γ-induced dysfunction in human intestinal epithelial cells[J]. Gastroenterology, 2006 , 130 (3) : 731 –746.
DOI: 10.1053/j.gastro.2005.12.015 ( 0) 0)
|
| [12] |
孙冰锋.酸化剂、益生素及其组合添加对肉仔鸡的影响及作用机理研究[D].硕士学位论文.杨凌:西北农林科技大学, 2005.
http://cdmd.cnki.com.cn/article/cdmd-10712-2005111534.htm
( 0) 0)
|
| [13] |
靳二辉, 陈耀星, 王群, 等. 芽孢杆菌类益生素对肉鸡血细胞及免疫器官组织结构的影响[J].
靳二辉, 陈耀星, 王群, 等. 芽孢杆菌类益生素对肉鸡血细胞及免疫器官组织结构的影响[J]. 畜牧兽医学报, 2013 , 44 (5) :778 –787.
( 0) 0)
|
| [14] |
赵德建.中药组方对鼠伤寒沙门氏菌的抑菌作用研究[D].硕士学位论文.泰安:山东农业大学, 2013.
http://cdmd.cnki.com.cn/article/cdmd-10434-1014156721.htm
( 0) 0)
|
| [15] |
陈家祥, 张仁义, 王全溪, 等. 地衣芽孢杆菌对肉鸡生长性能、抗氧化指标和血液生化指标的影响[J].
陈家祥, 张仁义, 王全溪, 等. 地衣芽孢杆菌对肉鸡生长性能、抗氧化指标和血液生化指标的影响[J]. 动物营养学报, 2010 , 22 (4) :1019 –1023.
( 0) 0)
|
| [16] |
SOHAIL M U, RAHMAN Z U, IJAZ A, et al. Single or combined effects of mannan-oligosaccharides and probiotic supplements on the total oxidants, total antioxidants, enzymatic antioxidants, liver enzymes, and serum trace minerals in cyclic heat-stressed broilers[J].
SOHAIL M U, RAHMAN Z U, IJAZ A, et al. Single or combined effects of mannan-oligosaccharides and probiotic supplements on the total oxidants, total antioxidants, enzymatic antioxidants, liver enzymes, and serum trace minerals in cyclic heat-stressed broilers[J]. Poultry Science, 2011 , 90 (11) : 2573 –2577.
DOI: 10.3382/ps.2011-01502 ( 0) 0)
|
| [17] |
ABBAS G, KHAN S H, REHMAN H U. Effects of formic acid administration in the drinking water on production performance, egg quality and immune system in layers during hot season[J].
ABBAS G, KHAN S H, REHMAN H U. Effects of formic acid administration in the drinking water on production performance, egg quality and immune system in layers during hot season[J]. Avian Biology Research, 2013 , 6 (3) : 227 –232.
DOI: 10.3184/175815513X13740707043279 ( 0) 0)
|
| [18] |
VAN IMMERSEEL F, DE BUCK J, BOYEN F, et al. Medium-chain fatty acids decrease colonization and invasion through hilA suppression shortly after infection of chickens with Salmonella enterica serovar enteritidis[J].
VAN IMMERSEEL F, DE BUCK J, BOYEN F, et al. Medium-chain fatty acids decrease colonization and invasion through hilA suppression shortly after infection of chickens with Salmonella enterica serovar enteritidis[J]. Applied and Environmental Microbiology, 2004 , 70 (6) : 3582 –3587.
DOI: 10.1128/AEM.70.6.3582-3587.2004 ( 0) 0)
|
| [19] |
KUBENA L F, BYRD J A, MOORE R W, et al. Effects of drinking water treatment on susceptibility of laying hens to Salmonella enteritidis during forced molt[J].
KUBENA L F, BYRD J A, MOORE R W, et al. Effects of drinking water treatment on susceptibility of laying hens to Salmonella enteritidis during forced molt[J]. Poultry Science, 2005 , 84 (2) : 204 –211.
DOI: 10.1093/ps/84.2.204 ( 0) 0)
|
| [20] |
KELLER L H, BENSON C E, KROTEC K, et al. Salmonella enteritidis colonization of the reproductive tract and forming and freshly laid eggs of chickens[J].
KELLER L H, BENSON C E, KROTEC K, et al. Salmonella enteritidis colonization of the reproductive tract and forming and freshly laid eggs of chickens[J]. Infection and Immunity, 1995 , 63 (7) : 2443 –2449.
( 0) 0)
|
| [21] |
GAST R K, HOLT P S. Assessing the frequency and consequences of Salmonella enteritidis deposition on the egg yolk membrane[J].
GAST R K, HOLT P S. Assessing the frequency and consequences of Salmonella enteritidis deposition on the egg yolk membrane[J]. Poultry Science, 2001 , 80 (7) : 997 –1002.
DOI: 10.1093/ps/80.7.997 ( 0) 0)
|
| [22] |
GAST R K, GUARD-PETTER J, HOLT P S. Effect of prior serial in vivo passage on the frequency of Salmonella enteritidis contamination in eggs from experimentally infected laying hens[J].
GAST R K, GUARD-PETTER J, HOLT P S. Effect of prior serial in vivo passage on the frequency of Salmonella enteritidis contamination in eggs from experimentally infected laying hens[J]. Avian Diseases, 2003 , 47 (3) : 633 –639.
DOI: 10.1637/6098 ( 0) 0)
|
| [23] |
DE BUCK J, VAN IMMERSEEL F, MEULEMANS G, et al. Adhesion of Salmonella enterica serotype enteritidis isolates to chicken isthmal glandular secretions[J].
DE BUCK J, VAN IMMERSEEL F, MEULEMANS G, et al. Adhesion of Salmonella enterica serotype enteritidis isolates to chicken isthmal glandular secretions[J]. Veterinary Microbiology, 2003 , 93 (3) : 223 –233.
DOI: 10.1016/S0378-1135(03)00038-5 ( 0) 0)
|




