2. 浙江省农业科学院畜牧兽医研究所, 杭州 310021
2. Institute of Animal Science, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China
胰高血糖素样肽-2(glucagon-like peptide-2,GLP-2)通过特异性促进肠上皮细胞增殖、抑制肠上皮细胞凋亡[1]、增加肠道血液供应[2]、降低肠道渗透性[3]、抑制胃酸分泌[4]等方式来促进损伤肠黏膜结构的恢复以及吸收功能和屏障功能的改善。但猪GLP-2(porcine glucagon-like peptide-2,pGLP-2)极易被血液中的二肽酰肽酶-Ⅳ(dipeptidyl peptidase-Ⅳ,DPP-Ⅳ)快速降解[5],在体内的半衰期只有8.4 min,需频繁用药。已在临床中应用的替度鲁肽[6]、处于研究阶段的延伸重组多肽(extended recombinant polypeptide,XTEN)修饰[7]及聚乙二醇(polyethylene glyeol,PEG)修饰[8-9]均有效地延长了pGLP-2在生物体内的释放时间。本课题组Qi等[9]使用单甲氧基聚乙二醇琥珀酰亚胺丙酸酯(mPEG-SPA)对pGLP-2进行修饰,使用一步阳离子交换层析法成功分离得到的mPEG-Lys30-p[Gly2]GLP-2体外半衰期是用甘氨酸残基取代pGLP-2氨基末端第2位丙氨酸残基后形成的p[Gly2]GLP-2的16倍,可有效缓解小鼠的结肠炎病变。Wu等[10]制备的p[Gly2]GLP-2微球在单次注射后能显著抑制结肠炎小鼠的体重下降及结肠变短,提高黏膜完整性、降低肠道炎症及促进小肠生长。以上研究证明对pGLP-2给药的探索是正确可行的,但其在动物机体的分布、消除等规律仍不明确。
本试验旨在考察p[Gly2]GLP-2、PEG修饰p[Gly2]GLP-2(PEG-p[Gly2]GLP-2)和p[Gly2]GLP-2微球在大鼠体内的药代动力学特征,为PEG-p[Gly2]GLP-2治疗肠道损伤、p[Gly2]GLP-2微球预防肠道损伤提供参考依据。
1 材料与方法 1.1 材料与仪器mPEG-SPA[分子质量(MW)5 ku,北京凯正生物技术公司];p[Gly2]GLP-2(MW 3 990.1 ku,肽序列HGDGSFSDEMNTVLDNLATRDFINWLLHTKITDSL,杭州中肽生化有限公司);CM Sepharose Fast Flow树脂(瑞士GE医疗生物科技公司);超滤离心管(MW 3 000 ku,美国Millipore公司);酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(美国Millipore公司);二甲基亚砜(DMSO,上海生物工程有限公司);乳酸羟基乙酸共聚物(PLGA,乳酸/乙酸50∶50,MW 14 000~17 000 ku,Sigma公司);聚乙烯醇(PVA,MW 65 000~75 000 ku,上海生物工程有限公司);PEG(MW 6 000 ku,上海生物工程有限公司);IKA RH basic1磁力搅拌器(德国IKA公司);PRO200型均质机(美国PRO Science公司);EPOCH酶标仪(美国Bioteck公司)。
1.2 PEG-p[Gly2]GLP-2的制备参考Qi等[9]的方法,1.2 mg/mL p[Gly2]GLP-2溶解于50 mmol/L三(羟甲基)氨基甲烷(Tris-HCl)缓冲液(pH 8.5),与mPEG-SPA以1∶6的摩尔比室温下反应30 min,1%的三氟乙酸(TFA)终止反应。用一步阳离子交换层析法进行分离得到mPEG-Lys30-p[Gly2]GLP-2(MW 8 867 ku)。
1.3 微球的制备在参考Wu等[10]方法的基础上将载药量调为2%制备微球,制备工艺如下:1 mg p[Gly2]GLP-2冻干粉溶解于12.5μL DMSO后,将其与500μL含50 mg PLGA、5 mg PEG的二氯甲烷溶液混合,高速均质30 s制成初乳,并迅速倒入20 mL含2%(m/v)PVA、5% NaCl的水溶液中,2 000 r/min磁力搅拌3 min得到复乳,将复乳倒入100 mL蒸馏水中400 r/min低速搅拌3 h,离心收集微球,蒸馏水洗涤数遍,冷冻干燥。微球的粒径为(31.17±8.17)μm,包封率为74.15%,突释率为20.36%,实际载药量为0.74%,体外9 d累计释放37%。
1.4 试验动物试验在浙江大学实验动物中心进行。将18只280 g左右的雄性SD大鼠按体重随机分为3组,每组6只,单笼饲养。
1.5 ELISA测定 1.5.1 ELISA试剂盒的测定条件①设定空白对照。
②QC1(GLP2-107)和QC2(GLP2-207)测定的质量浓度分别在2.9~7.7 ng/mL和13~28 ng/mL之间。
③消除背景色的影响,样品在与pGLP-2检测抗体结合后,需要在450和590 nm的波长下测定其OD值,其中,450 nm为检测波长,而590 nm波长下的OD值是背景色的误差。
④此ELISA试剂盒的测量范围为1~64 ng/mL。
只有当以上所有条件都满足时,才认为ELISA试剂盒检测出的结果有效。
1.5.2 标准曲线标准品(75 ng/mL),倍比稀释为1.172、2.344、4.688、9.375、18.750、37.500 ng/mL标准样品。按照试剂盒的方法进行操作,以去除OD(空白对照)和OD(590 nm)后的OD值为纵坐标,以标准样品的质量浓度(ng/mL)为横坐标,拟合的曲线符合logistic方程(四参数)。
1.6 大鼠体内的药代动力学试验试验前SD大鼠禁食12 h,自由饮水。p[Gly2]GLP-2组皮下注射5.64 nmol/kg的p[Gly2]GLP-2溶液后分别于4、8、12、16、30、45、60、90、150 min时通过眼底静脉丛取血0.5 mL;PEG-p[Gly2]GLP-2组皮下注射同剂量的PEG-p[Gly2]GLP-2后分别于5、15、20、30、45、60、120、240、360 min时取血0.5 mL;p[Gly2]GLP-2微球组的注射剂量为15 mg/只,采血时间为10、20、30、60、120、180、360 min和1、2、3、4、5、6、7、8、9 d。由于p[Gly2]GLP-2易被血中的DPP-Ⅳ酶降解,故需将血样与5μL的DPP-Ⅳ抑制剂混合均匀,并于4℃3 000 r/min离心15 min,取上层血清,于-80℃冰箱中保存。
血清样品按ELISA试剂盒的方法进行测定,测得的OD值代入标准曲线,求得不同时间点的血药浓度。
1.7 数据处理运用WinNonlin 5.2.1版软件(Pharsight公司,美国)对血药浓度与时间进行药代动力学拟合计算,获得各种给药下的血药浓度-时间曲线及相关的药代动力学参数。
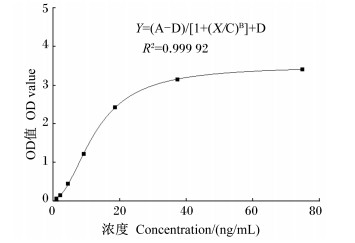
2 结果 2.1 ELISA测定的准确性pGLP-2的标准曲线见图 1,为Y=(A-D)/[1+(X/C)B]+D,R2=0.999 92,其中,A=3.489 43,B=-2.066 66,C=12.817 06,D=0.044 83。QC1的浓度为6.197 ng/mL,QC2的浓度为23.44 ng/mL,在有效范围内。
|
图 1 pGLP-2的标准曲线 Figure 1 Standard curve of pGLP-2 |
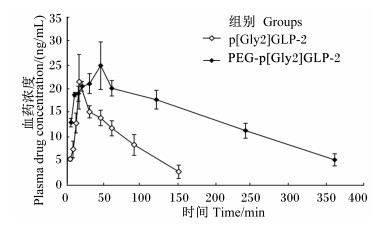
皮下注射p[Gly2]GLP-2和PEG-p[Gly2]GLP-2后,血药浓度-时间曲线见图 2,主要药代动力学参数见表 1。由图 2可知,注射后,p[Gly2]GLP-2组血药浓度迅速上升,在16 min左右达到峰值,随后迅速下降;PEG-p[Gly2]GLP-2组血药浓度上升趋势平缓,在30~45 min达到最高,之后缓慢下降。分析药代动力学参数并结合血药浓度-时间曲线可知,PEG-p[Gly2]GLP-2的半衰期(t1/2)是p[Gly2]GLP-2的4倍,血药浓度-时间曲线下面积(AUC0-t)和平均滞留时间(MRT0-t)是p[Gly2]GLP-2的3倍,清除率(CL)是p[Gly2]GLP-2的1/2。此外,达峰浓度(Cmax)相差不大,PEG-p[Gly2]GLP-2的达峰时间(Tmax)滞后于p[Gly2]GLP-2。
|
图 2 p[Gly2]GLP-2和PEG-p[Gly2]GLP-2的血药浓度-时间曲线 Figure 2 The plasma drug concentration-time profiles of p[Gly2]GLP-2 and PEG-p[Gly2]GLP-2 |
|
|
表 1 p[Gly2]GLP-2和PEG-p[Gly2]GLP-2在大鼠体内的药代动力学参数 Table 1 Pharmacokinetic parameters in rats of p[Gly2]GLP-2 and PEG-p[Gly2]GLP-2 |
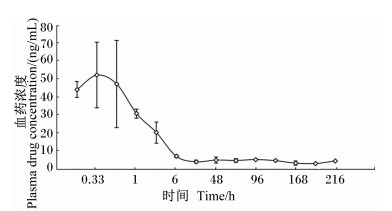
皮下注射微球溶液后,血药浓度-时间曲线见图 3,主要药代动力学参数见表 2。分析药代动力学参数并结合血药浓度-时间曲线可知,p[Gly2]GLP-2微球的达峰时间与p[Gly2]GLP-2、PEG-p[Gly2]GLP-2相差不大,但是半衰期为(72.20±6.02) h,平均滞留时间为(90.66±7.41) h,具有很好的缓释效果。
|
图 3 p[Gly2]GLP-2微球的血药浓度-时间曲线 Figure 3 The plasma drug concentration-time profile of p[Gly2]GLP-2 microspheres |
|
|
表 2 p[Gly2]GLP-2微球在大鼠体内的药代动力学参数 Table 2 Pharmacokinetic parameters in rats of p[Gly2]GLP-2 microspheres |
自Drucker等[11]首次报道了GLP-2具有特异性促进肠黏膜生长与损伤修复的作用后,大量的试验[1-4]也验证了这一结论,且发现GLP-2的作用效果要强于以往发现的其他非特异的肠生长因子。但是pGLP-2与其他蛋白多肽类药物一样,由于极易降解、水溶性差、体内循环半衰期短、生物利用度低等缺点而发展受限。特别是蛋白多肽易被机体免疫系统识别清除,导致血浆半衰期缩短,为了维持疗效,不得不增加剂量、频繁给药,从而使得操作繁琐、成本增加,更是加剧了免疫原性和毒性,增加了机体的应激。Boushey等[12]连续6 d,2次/d给小鼠注射80μg/kg的人[Gly2]GLP-2;Drucker等[13]则连续10 d,2次/d给小鼠注射17.5μg/kg的人[Gly2]GLP-2;Alavi等[14]则连续14 d每天给大鼠静脉注射50μg/kg GLP-2,才可缓解试验动物的炎性反应。若要将GLP-2应用于仔猪上,不仅耗时耗力,更会加剧“仔猪断奶综合征”的应激。
为了克服蛋白多肽的种种限制,人们采取了许多措施,其中,最成功的便是将水溶性的PEG作为改性聚合物,与药物蛋白连接[15-16],即PEG修饰。蛋白多肽经PEG修饰后拥有了一种屏障,不仅不易被蛋白酶水解,也降低了抗原与抗体的结合从而抑制免疫反应的发生,减少肾小球的过滤,降低肾清除率,增加了疏水性分子的溶解性,延长药物在体内的半衰期[17-18]。目前已经临床使用的PEG化的药物有:PEG-胰岛素,PEG-天冬酰胺酶,PEG-干扰素等。Qi等[8-9]制备的mPEG-Lys30-p[Gly2]GLP-2体外半衰期是p[Gly2]GLP-2的16倍,可有效缓解小鼠的结肠炎病变和断奶仔猪的肠道损伤。但是其在动物机体的分布、消除等规律仍不明确,有待于进一步探究。
药代动力学是一门用数学手段分析药物体内动态变化过程的科学,具有重大的理论和实用价值。Lee等[19]给大鼠静脉注射1μg/kg的胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和赖氨酸被PEG修饰的GLP-1(PEG2K-Lys-GLP-1)后,发现PEG2K-Lys-GLP-1的半衰期是GLP-1的10倍,平均滞留时间是GLP-1的16倍;而皮下注射10μg/kg的GLP-1和PEG2K-Lys-GLP-1后,发现PEG2K-Lys-GLP-1的血药浓度-时间曲线下面积是GLP-1的7.5倍,半衰期是GLP-1的2.5倍,达峰时间是GLP-1的3倍。本试验发现,PEG-p[Gly2]GLP-2的半衰期是p[Gly2]GLP-2的4倍,即PEG修饰可以延长蛋白质及肽类的半衰期,也就是说PEG-p[Gly2]GLP-2在大鼠体内停留的时间更久,消除的更慢,有利于药效的发挥。PEG-p[Gly2]GLP-2的平均滞留时间是p[Gly2]GLP-2的3倍,这也意味着PEG-p[Gly2]GLP-2比p[Gly2]GLP-2在体内停留的时间更久,能更好的发挥药效。PEG-p[Gly2]GLP-2的血药浓度-时间曲线下面积是p[Gly2]GLP-2的3倍,说明PEG-p[Gly2]GLP-2在体内的吸收程度更大,生物利用度更高。两者的达峰浓度相差不大,但PEG-p[Gly2]GLP-2的达峰时间滞后很多。PEG-p[Gly2]GLP-2的清除率是p[Gly2]GLP-2的1/2,p[Gly2]GLP-2的血药浓度下降的很快,而PEG-p[Gly2]GLP-2在给药后很长时间都维持一个较高的血药浓度。由此可知,经PEG修饰后p[Gly2]GLP-2的药代动力学行为发生了很大的改变:半衰期延长、达峰时间滞后、平均滞留时间延长、血浆清除减慢、生物利用度更高。这些改变极大地改善了蛋白多肽药物在机体内清除快、有效血药浓度持续时间短、需要频繁给药等缺点。
3.2 p[Gly2]GLP-2微球的药代动力学微球给药系统是近年来较为热门的给药方式,能够改变药物的运程、减少体内酶的降解、增加药物的作用时间、减少给药频率。经美国食品药品监督管理局(FDA)批准的专用于治疗前列腺癌的第1个多肽微球制剂——醋酸亮丙瑞林微球,可在人体内持续作用30 d。Choi等[20]制得的GLP-1微球在糖尿病大鼠体内持续稳定释放2周,使其体内的血糖水平维持在正常水平。刘琳娜等[21]研究了GLP-2微球在体内的缓释性能。Wu等[10]的研究已经证明,结肠炎小鼠单次腹腔注射10 mg的p[Gly2]GLP-2微球,能有效抑制体重下降、结肠变短及炎性反应。
基于p[Gly2]GLP-2微球便利的给药方式和持续而稳定的释放方式,有望将其用于预防断奶仔猪的“仔猪断奶综合征”,但其在动物体内的释放方式及机制还是未知的。张海松等[22]发现,大鼠灌胃给予胸腺肽微球后的血药浓度、血药浓度-时间曲线下面积均大于胸腺肽胶囊,半衰期延长,生物利用度显著提高。陆蕾[23]给大鼠皮下注射干扰素α-2b-PLGA缓释微球和干扰素α-2b注射剂后发现,2组的达峰时间分别为4、1.5 h,达峰浓度分别为5 490.228、25 315.32 pg/mL,平均滞留时间分别为6.855、0.099 d,血药浓度-时间曲线下面积分别为23 149.018、2 309.497(pg·d)/mL,且微球经过突释达到峰浓度,随后药物浓度缓慢下降,并长时间维持较低水平。肖田安等[24]发现伊维菌素聚乳酸(poly lactic acid, PLA)及PLGA 2种微球在比格犬体内均有明显缓释特性。Wu等[10]制备的p[Gly2]GLP-2微球在单次注射后能显著抑制结肠炎小鼠的体重下降及结肠变短、提高黏膜完整性、降低肠道炎症、促进小肠生长。但是微球在动物体内的过程以及其作用机制依然未知。本试验发现p[Gly2]GLP-2微球的半衰期为(72.20±6.02) h,平均滞留时间为(90.66±7.41) h,远远大于p[Gly2]GLP-2和PEG-p[Gly2]GLP-2组,达峰时间则相差不大。观察血药浓度-时间曲线发现,给药后20 min左右,血药浓度达到一个高峰,这是由于微球表面黏附的p[Gly2]GLP-2所致的突释效应及少量p[Gly2]GLP-2从微球扩散而共同导致的,其后缓慢下降,到第6 h浓度基本不再下降,之后的9 d,血药浓度都在此浓度(4.5 ng/mL)上下波动,这是因为微球具有缓释作用,在其能够测定的消除相可能仍有部分缓释药物释放。
微球的制造工艺不稳定,无法准确计算实际给药量,故不便与p[Gly2]GLP-2的药代动力学参数进行比较。但其独特的血药浓度-时间曲线,持续而稳定的释放方式及便利的给药方式,使其在预防断奶仔猪肠道疾病方面大有可为。
4 结论①经PEG修饰后p[Gly2]GLP-2药代动力学行为发生了很大的改变,半衰期延长、达峰时间滞后、平均滞留时间延长、血浆清除减慢、生物利用度更高,极大地改善了多肽药物在机体内清除快、有效血药浓度持续时间短、需要频繁给药等缺点。
②p[Gly2]GLP-2微球半衰期长,且持续稳定地释放,具有很好的缓释效果。这些特性决定了p[Gly2]GLP-2微球操作便利,减少了机体产生应激的可能。
| [1] |
TSAI C H, HILL M, ASA S L, et al. Intestinal growth-promoting properties of glucagon-like peptide-2 in mice[J].
TSAI C H, HILL M, ASA S L, et al. Intestinal growth-promoting properties of glucagon-like peptide-2 in mice[J]. American Journal of Physiology-Endocrinology and Metabolism, 1997 , 273 (1) : E77 –E84.
( 0) 0)
|
| [2] |
GUAN X F, STOLL B, LU X F, et al. GLP-2-mediated up-regulation of intestinal blood flow and glucose uptake is nitric oxide-dependent in TPN-fed piglets[J].
GUAN X F, STOLL B, LU X F, et al. GLP-2-mediated up-regulation of intestinal blood flow and glucose uptake is nitric oxide-dependent in TPN-fed piglets[J]. Gastroenterology, 2003 , 125 (1) : 136 –147.
DOI: 10.1016/S0016-5085(03)00667-X ( 0) 0)
|
| [3] |
BENJAMIN M A, MCKAY D M, YANG P C, et al. Glucagon-like peptide-2 enhances intestinal epithelial barrier function of both transcellular and paracellular pathways in the mouse[J].
BENJAMIN M A, MCKAY D M, YANG P C, et al. Glucagon-like peptide-2 enhances intestinal epithelial barrier function of both transcellular and paracellular pathways in the mouse[J]. Gut, 2000 , 47 (1) : 112 –119.
DOI: 10.1136/gut.47.1.112 ( 0) 0)
|
| [4] |
WØJDEMANN M, WETTERGREN A, HARTMANN B, et al. Inhibition of sham feeding-stimulated human gastric acid secretion by glucagon-like peptide-2[J].
WØJDEMANN M, WETTERGREN A, HARTMANN B, et al. Inhibition of sham feeding-stimulated human gastric acid secretion by glucagon-like peptide-2[J]. The Journal of Clinical Endocrinology & Metabolism, 1999 , 84 (7) : 2513 –2517.
( 0) 0)
|
| [5] |
PEDERSEN N B, HJOLLUND K R, JOHNSEN A H, et al. Porcine glucagon-like peptide-2:structure, signaling, metabolism and effects[J].
PEDERSEN N B, HJOLLUND K R, JOHNSEN A H, et al. Porcine glucagon-like peptide-2:structure, signaling, metabolism and effects[J]. Regulatory Peptides, 2008 , 146 (1/2/3) : 310 –320.
( 0) 0)
|
| [6] |
JEPPESEN P B, PERTKIEWICZ M, MESSING B, et al. Teduglutide reduces need for parenteral support among patients with short bowel syndrome with intestinal failure[J].
JEPPESEN P B, PERTKIEWICZ M, MESSING B, et al. Teduglutide reduces need for parenteral support among patients with short bowel syndrome with intestinal failure[J]. Gastroenterology, 2012 , 143 (6) : 1473 –1481.
DOI: 10.1053/j.gastro.2012.09.007 ( 0) 0)
|
| [7] |
ALTERS S E, MCLAUGHLIN B, SPINK B, et al. GLP2-2G-XTEN:a pharmaceutical protein with improved serum half-life and efficacy in a rat Crohn's disease model[J].
ALTERS S E, MCLAUGHLIN B, SPINK B, et al. GLP2-2G-XTEN:a pharmaceutical protein with improved serum half-life and efficacy in a rat Crohn's disease model[J]. PLoS One, 2012 , 7 (11) : 50630 .
DOI: 10.1371/journal.pone.0050630 ( 0) 0)
|
| [8] |
QI K K, WU J, DENG B, et al. PEGylated porcine glucagon-like peptide-2 improved the intestinal digestive function and prevented inflammation of weaning piglets challenged with LPS[J].
QI K K, WU J, DENG B, et al. PEGylated porcine glucagon-like peptide-2 improved the intestinal digestive function and prevented inflammation of weaning piglets challenged with LPS[J]. Animal, 2015 , 9 (9) : 1481 –1489.
DOI: 10.1017/S1751731115000749 ( 0) 0)
|
| [9] |
QI K K, WU J, WAN J, et al. Purified PEGylated porcine glucagon-like peptide-2 reduces the severity of colonic injury in a murine model of experimental colitis[J].
QI K K, WU J, WAN J, et al. Purified PEGylated porcine glucagon-like peptide-2 reduces the severity of colonic injury in a murine model of experimental colitis[J]. Peptide, 2014 , 52 : 11 –18.
DOI: 10.1016/j.peptides.2013.11.012 ( 0) 0)
|
| [10] |
WU J, QI K K, XU Z W, et al. Glucagon-like peptide-2-loaded microspheres as treatment for ulcerative colitis in the murine model[J].
WU J, QI K K, XU Z W, et al. Glucagon-like peptide-2-loaded microspheres as treatment for ulcerative colitis in the murine model[J]. Journal of Microencapsulation, 2015 , 32 (6) : 598 –607.
DOI: 10.3109/02652048.2015.1065923 ( 0) 0)
|
| [11] |
DRUCKER D J, ERILICH P, ASA S L, et al. Induction of intestinal epithelial proliferation by glucagon-like peptide 2[J].
DRUCKER D J, ERILICH P, ASA S L, et al. Induction of intestinal epithelial proliferation by glucagon-like peptide 2[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996 , 93 (15) : 7911 –7916.
( 0) 0)
|
| [12] |
BOUSHEY R P, YUSTA B, DRUCKER D J. Glucagon-like peptide 2 decreases mortality and reduces the severity of indomethacin-induced murine enteritis[J].
BOUSHEY R P, YUSTA B, DRUCKER D J. Glucagon-like peptide 2 decreases mortality and reduces the severity of indomethacin-induced murine enteritis[J]. American Journal of Physiology:Endocrinology and Metabolism, 1999 , 277 (5) : E937 –E947.
( 0) 0)
|
| [13] |
DRUCKER D J, YUSTA B, BOUSHEY R P, et al. Human[J].
DRUCKER D J, YUSTA B, BOUSHEY R P, et al. Human[J]. American Journal of Physiology:Gastrointestinal and Live Physiology, 1999 , 276 (1) : G79 –G91.
( 0) 0)
|
| [14] |
ALAVI K, SCHWARTZ M Z, PALAZZO J P, et al. Treatment of inflammatory bowel disease in a rodent model with the intestinal growth factor glucagon-like peptide-2[J].
ALAVI K, SCHWARTZ M Z, PALAZZO J P, et al. Treatment of inflammatory bowel disease in a rodent model with the intestinal growth factor glucagon-like peptide-2[J]. Journal of Pediatric Surgery, 2000 , 35 (6) : 847 –851.
DOI: 10.1053/jpsu.2000.6861 ( 0) 0)
|
| [15] |
BAILON P, WON C Y. PEG-modified biopharmaceuticals[J].
BAILON P, WON C Y. PEG-modified biopharmaceuticals[J]. Expert Opinion on Drug Delivery, 2009 , 6 (1) : 1 –16.
DOI: 10.1517/17425240802650568 ( 0) 0)
|
| [16] |
HARRIS J M, CHESS R B. Effect of pegylation on pharmaceuticals[J].
HARRIS J M, CHESS R B. Effect of pegylation on pharmaceuticals[J]. Nature Reviews Drug Discovery, 2003 , 2 (3) : 214 –221.
DOI: 10.1038/nrd1033 ( 0) 0)
|
| [17] |
VERONESE F M, PASUT G. PEGylation, successful approach to drug delivery[J].
VERONESE F M, PASUT G. PEGylation, successful approach to drug delivery[J]. Drug Discovery Today, 2005 , 10 (21) : 1451 –1458.
DOI: 10.1016/S1359-6446(05)03575-0 ( 0) 0)
|
| [18] |
FEE C J, ALSTINE J M V. PEG-proteins:reaction engineering and separation issues[J].
FEE C J, ALSTINE J M V. PEG-proteins:reaction engineering and separation issues[J]. Chemical Engineering Science, 2006 , 61 (3) : 924 –939.
DOI: 10.1016/j.ces.2005.04.040 ( 0) 0)
|
| [19] |
LEE S H, LEE S, YOUN Y S, et al. Synthesis, characterization and pharmacokinetic studies of PEGylated glucagon-like peptide-1[J].
LEE S H, LEE S, YOUN Y S, et al. Synthesis, characterization and pharmacokinetic studies of PEGylated glucagon-like peptide-1[J]. Bioconjugate Chemistry, 2005 , 16 (2) : 377 –382.
DOI: 10.1021/bc049735+ ( 0) 0)
|
| [20] |
CHOI S, BAUDYS M, KIM S W. Control of blood glucose by novel GLP-1 delivery using biodegradable triblock copolymer of PLGA-PEG-PLGA in type 2 diabetic rats[J].
CHOI S, BAUDYS M, KIM S W. Control of blood glucose by novel GLP-1 delivery using biodegradable triblock copolymer of PLGA-PEG-PLGA in type 2 diabetic rats[J]. Pharmaceutical Research, 2004 , 21 (5) : 827 –831.
DOI: 10.1023/B:PHAM.0000026435.27086.94 ( 0) 0)
|
| [21] |
刘琳娜, 李欣, 张琰, 等. 胰高血糖素样肽-2/聚乳酸-羟基乙酸微球的制备及其体外释药性质研究[J].
刘琳娜, 李欣, 张琰, 等. 胰高血糖素样肽-2/聚乳酸-羟基乙酸微球的制备及其体外释药性质研究[J]. 中国药房, 2010 (29) :2755 –2757.
( 0) 0)
|
| [22] |
张海松, 刘卫红, 张基展, 等. 口服胸腺肽微球在大鼠体内的药代动力学和生物利用度[J].
张海松, 刘卫红, 张基展, 等. 口服胸腺肽微球在大鼠体内的药代动力学和生物利用度[J]. 中国生化药物杂志, 2000 , 21 (1) :15 –17.
( 0) 0)
|
| [23] |
陆蕾.干扰素α-2b PLGA缓释微球药代动力学及药效学研究[D].硕士学位论文.上海:第二军医大学, 2006:18-29.
( 0) 0)
|
| [24] |
肖田安, 怀彬彬, 李帅鹏, 等. 伊维菌素PLA及PLGA微球混悬液在犬体内的药代动力学研究[J].
肖田安, 怀彬彬, 李帅鹏, 等. 伊维菌素PLA及PLGA微球混悬液在犬体内的药代动力学研究[J]. 华南农业大学学报, 2014 , 35 (3) :8 –12.
( 0) 0)
|




