卵巢是雌性动物主要繁殖器官,位于卵泡内的颗粒细胞在维持卵巢繁殖功能上发挥着极其重要的作用。家禽的卵泡壁结构上主要由卵黄膜周围层、颗粒细胞层、卵泡膜内层、卵泡膜外层以及外围的结缔组织和生殖上皮层构成(图 1)。卵泡壁主要功能是为卵母细胞的生长提供营养物质、合成和分泌类固醇激素,从而调控卵泡生长发育及排卵[1]。研究表明,家禽产蛋性能很大程度上取决于卵泡的发育状况[1],卵泡中颗粒细胞可通过合成激素与生长因子(如孕酮、干细胞生长因子和表皮生长因子等)参与卵泡调控,包括原始卵泡的启动、生长卵泡的发育、优势卵泡的选择及成熟卵泡的排卵[2]。研究表明,颗粒细胞凋亡是导致卵泡闭锁的根本原因,而由于闭锁卵泡的数量直接影响到产蛋率的高低[2],因此颗粒细胞的发育决定着卵泡的生长和蛋禽最终产蛋性能。理论上,建立原代颗粒细胞体外培养模型是探索家禽卵巢内分泌功能及调控机制和卵泡发育机制的重要途径,这不仅有助于研究颗粒细胞在卵泡闭锁时的作用,而且对为生产提供提高禽繁殖能力的相应措施具有重要指导意义。
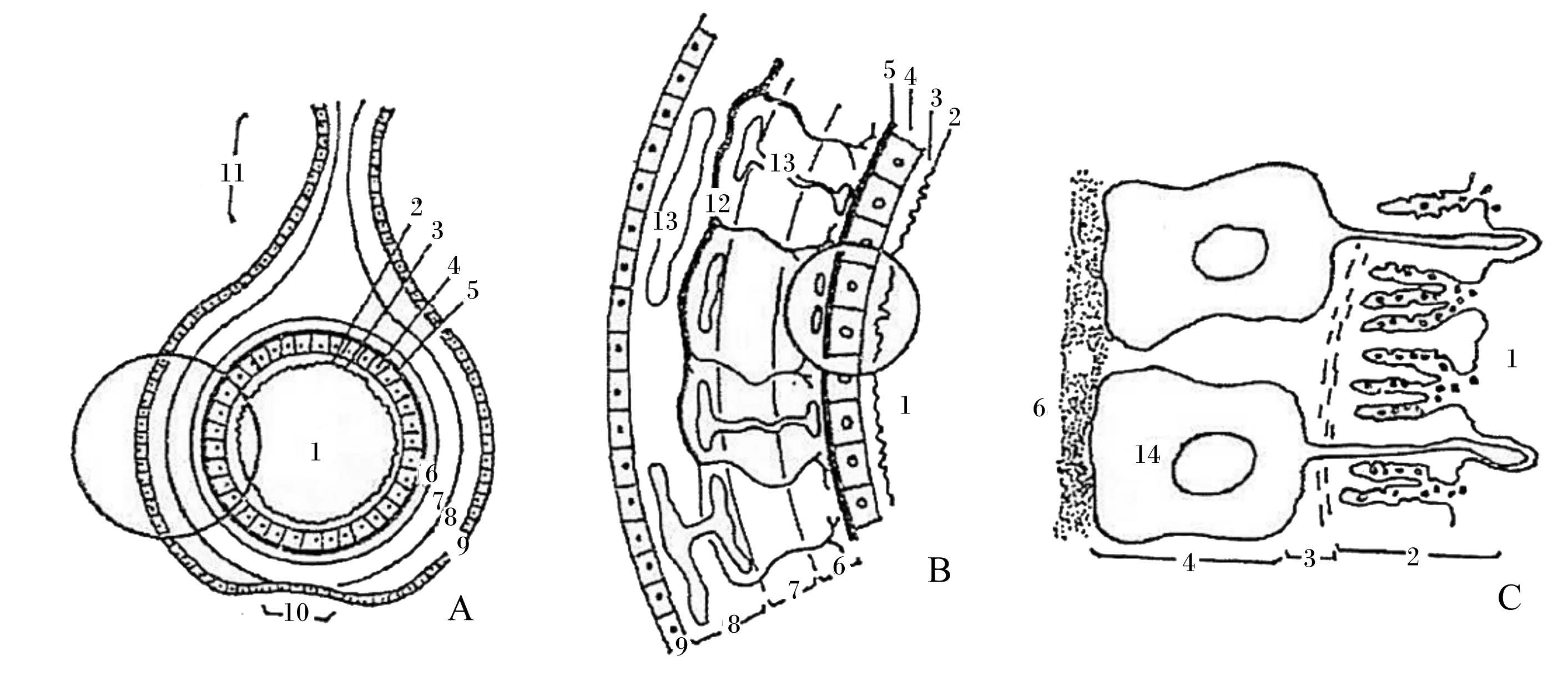
|
A:整个成熟卵泡 The whole mature follicle;B:A中圆圈部分放大图 A larger version of the circle part of Fig.A;C:B中圆圈部分放大图 A larger version of the circle part of Fig.B;1:初级卵母细胞 Primary oocyte;2:卵黄膜和放射带 Vitelline membrane and zona radiata;3:卵黄膜周围层 Enveloping layer of the vitelline membrane;4:颗粒细胞层 Stratum granulosum;5:基膜 Bsilemma;6:卵泡膜内层 Theca folliculi interna;7:卵泡膜外层 Theca folliculi externa;8:结缔组织层 The connective tissue layer;9:生殖上皮层 Reproductive epithelial layer;10:卵泡带 Follicles band;11:卵泡柄 Follicles handle;12:动脉 Artery;13:静脉 Vein;14:颗粒细胞 Granulosa cells。 图 1 家禽成熟卵泡结构示意图 Figure 1 Schematic diagram of poultry mature follicle structure[1] |
家禽原始卵泡发育成生长卵泡的过程不依赖于激素的调节,而是通过颗粒细胞分泌的干细胞因子与卵母细胞中c-Kit受体结合,从而启动原始卵泡募集,促进卵母细胞的生长[2]。细胞因子如胰岛素样生长因子家族、表皮生长因子家族和转化生长因子-β超家族能促进颗粒细胞的增殖和孕酮分泌,参与维持卵母细胞和颗粒细胞间的功能性偶联,进而促进卵母细胞的发育成熟[3]。卵母细胞通过间隙连接从周围的颗粒细胞中摄取小分子代谢物,并且通过与颗粒细胞间的离子交换得以调节卵母细胞内pH。卵母细胞和颗粒细胞之间通过缝隙连接蛋白相互影响,颗粒细胞可通过缝隙连接相互传递信息,促进卵母细胞的成熟和发育;同时,卵母细胞也可分泌细胞因子,反馈性促进颗粒细胞的增殖、分化。为了改善卵母细胞体外成熟的环境,体外培养最开始会加入颗粒细胞之类的卵泡膜层细胞共同培养[4]。Fukui等[5]研究发现颗粒细胞与卵母细胞体外共同培养可以 促进卵母成熟。可见,颗粒细胞与卵母细胞的互相作用决定着卵泡的发育命运[6]。
卵泡闭锁是一种正常的繁殖生理过程,是指卵泡从发育到排卵前所发生的退化并最终被清除的生理过程。而在家禽中,闭锁卵泡的数量直接影响到产蛋率的高低。有研究先后在鸡、大鼠、猪、牛和绵羊等动物卵泡闭锁中发现颗粒细胞的凋亡,当发育卵泡中10%以上的颗粒细胞发生凋亡时,则表明该卵泡已经或正在发生闭锁,且卵泡一旦进入闭锁就不能再回到正常的发育轨道中[7]。在关于哺乳动物体外培养的颗粒细胞的研究发现孕酮具有抑制卵泡颗粒细胞凋亡的作用,而禽类的孕酮主要由卵泡颗粒细胞产生[2],因此禽类的颗粒细胞调控着卵泡闭锁的发生。大量研究通过使用不同激素或药物对体外培养颗粒细胞进行诱导,根据颗粒细胞凋亡状况来探讨该激素或药物对卵泡闭锁的影响。其中李彩萍[8]的体外培养水牛卵泡颗粒细胞试验发现,促卵泡激素可以显著地抑制颗粒细胞凋亡。
综上可见,卵泡颗粒细胞是成熟卵泡中最大的细胞群,其包围且滋养着卵母细胞,在家禽卵泡的成熟过程中具有重要的调节作用,研究颗粒细胞的生物学调节具有重要意义。颗粒细胞体外培养是对其研究的一项很好的试验方法,但目前由于颗粒细胞至今尚无建立的细胞系,仅能通过卵泡中细胞分离获得原代细胞。
2 颗粒细胞的分离与体外培养 2.1 颗粒细胞的提取分离建立原代颗粒细胞体外培养的主要目标是获得数量充足、活力较好的卵泡颗粒细胞。根据国内外文献可大致将颗粒细胞层分离方法分为2种,其方法的选择是根据卵泡的大小而定。
方法1:家禽大卵泡一般使用Gilbert等[9]首次发表的关于家禽卵泡颗粒细胞分离的方法。具体为处死动物后,无菌环境摘取卵巢。用镊子夹住卵泡,迅速切开卵泡,将卵泡翻转在装有液体培养基的培养皿中,吹洗卵黄,将复合膜从卵黄中分离出来。得到的复合膜由卵黄周围层、颗粒细胞层和基膜组成。方法2:小黄卵泡中颗粒细胞层的分离则是在Gilbert等[9]的方法基础上改进。在卵黄释放后,将复合膜翻转在无菌生理盐水中,振荡,让颗粒细胞层分离并沉降,收集沉淀物为颗粒细胞层和散在的颗粒细胞。目前禽类卵泡颗粒细胞分离方法得到的并不是纯颗粒细胞,会包含卵黄和卵泡内膜细胞。方法1在分离颗粒细胞层时,颗粒细胞层比较松散,常跟卵黄混在一起,卵黄能通过细胞清洗减少,而方法2振荡复合膜还可能影响细胞活性。
颗粒细胞层分离后需进一步提取可获得颗粒细胞,其提取方法可分为机械分离法和酶消化分离法[10]。机械分离法:将获得的颗粒细胞层放入预冷的磷酸缓冲盐溶液(PBS)中。用眼科剪剪切颗粒细胞层,过筛得到颗粒细胞[11]。酶消化分离法:在颗粒细胞层中加入含有胶原蛋白酶的培养液中消化,终止离心后,沉淀为颗粒细胞。Asem等[10]总结发现机械方法分离培养在Earle's平衡盐溶液(EBSS)中的颗粒细胞激素刺激应答分泌的孕酮要明显少于酶消化方法分离培养在M199培养液中的颗粒细胞。近年来,国内外报道通常采用机械分离法和酶消化分离法相结合来提取颗粒细胞,即在机械分离获得颗粒细胞层后,直接用眼科剪剪成碎片(不添加缓冲溶液),随后加入含有胶原蛋白酶Ⅱ的培养液消化,消化终止后过筛。消化完成后建议裂解红细胞,由图 1可知分离得到的复合膜层含有静脉,提取的颗粒细胞中还会含有血细胞,这将影响细胞形态观察,但是红细胞裂解可能影响细胞活性,因此,可根据试验目的进行调整。
2.2 颗粒细胞的培养方法颗粒细胞的培养通常在细胞培养液中添加血清(主要为胎牛血清),其目的是为细胞提供基本营养物质,并提供结合蛋白、促接触和伸展因子使细胞贴壁免受机械损伤。根据试验需要,禽类颗粒细胞培养液中胎牛血清的补充一般范围在0~10%,一些试验中会在无血清或低血清培养基中添加0.1%牛血清白蛋白(albumin from bovine serum,BSA)[6, 12-18]。然而Chiang等[19]研究发现BSA可能改变颗粒细胞生理反应,如添加BSA可使颗粒细胞内电压激活性钙离子电流快速增加。因此,在研究颗粒细胞功能时不建议添加BSA。Picton等[20]研究发现无血清培养基能维持体外培养的猪卵泡颗粒细胞正常分化。尽管不添加血清可减少对试验处理的干扰,但在一定程度上影响到细胞的生长(血清中含有促细胞生长因子)。为兼顾细胞生长和试验处理,研究者多采用含5%血清培养液培养观察贴壁后,换掉原培养液用无血清培养液继续培养24~48 h,再进行试验处理,从而减少血清中未知物质对试验造成的干扰[21]。浙江大学张才乔教授实验室建立的鸡颗粒细胞体外研究实验模型是小黄卵泡颗粒细胞在低浓度(0.5%)胎牛血清培养16 h后换成无血清培养液[6]。
温度是维持细胞生长的必要条件,因细胞类型不同其适宜培养温度也存在着差异性。一般而言,在培养温度达到细胞耐受上限之前,细胞活力随温度升高而增加;而当温度超过耐受上限时,细胞活力则受到抑制,细胞功能受到影响[22]。不同动物卵泡中颗粒细胞的体外培养温度存在一定差异。人和猪的颗粒细胞体外培养温度为37 ℃[23-24],大鼠和小鼠的体外培养温度一般为37 ℃,而牛、绵羊体外培养温度则需38.0~38.5 ℃。家禽的体温较哺乳动物的高,因此推断38.5~41.0 ℃培养的家禽卵泡颗粒细胞增殖率可能高于37 ℃。例如,Wen等[14]采用38.5 ℃培养鹅F1~F3卵泡颗粒细胞;Rangel等[23]则选择41 ℃培养鸡F1卵泡颗粒细胞,但也有较多研究者选择37 ℃进行培养。
细胞生长除需适宜温度外,还依赖于营养的供给。在培养液选择方面,哺乳动物颗粒细胞培养液因种属差异而不同。大鼠或小鼠选择杜尔伯科改良伊格尔培养基(DMEM)效果较好,羊选用M199培养液颗粒细胞的存活率更高[21];Asem等[10]比较不同培养基发现,对鸡的卵泡颗粒细胞采用M199或者F12培养液培养细胞时,其分泌的孕酮最多[7];而Wen等[14]体外培养鹅卵泡颗粒细胞时使用DMEM/F12培养液[14];大部分禽类颗粒细胞研究中多选择M199培养液[21]。
2.3 颗粒细胞的鉴定获取得到卵泡颗粒细胞后,首先需采用台盼蓝染色法检测颗粒细胞活性[14],一般要求细胞活力达到90%以上。同时可采用噻唑蓝(MTT)法[25]或者细胞计数试剂盒-8(cell counting kit-8,CCK-8)法[14]检测细胞增殖率,观测细胞增殖情况。MTT法中,由于不同裂解液的溶解能力及其产生的背景信号对光密度(OD)值的测量结果的影响,和实际操作中容易带走部分细胞,而导致误差增大。而在使用CCK-8试剂时,实际操作时细胞损失少,误差较小[26]。
分离获得的颗粒细胞可通过促卵泡激素受体(follicle-stimulating hormone receptor,FSHR)免疫组化或抗缪勒氏管激素(AMH)免疫组化来进行鉴定。颗粒细胞是卵巢组织中唯一表达FSHR的细胞,众多研究选择FSHR免疫组化染色对卵泡颗粒细胞进行鉴定。AMH是转化生长因子-β超家族的一员,主要在生长卵泡的颗粒细胞中表达,但闭锁卵泡颗粒细胞和内膜细胞不表达,因此也有研究选择AMH免疫组化染色鉴定颗粒细胞[27]。
3 小 结颗粒细胞体外培养研究始于20世纪70年代初,人与哺乳动物的颗粒细胞体外培养方法经不断改进、完善,现已成为研究生殖生理和内分泌等的一种重要手段,并逐渐被应用到家禽颗粒细胞及卵泡发育调控研究中来。相比动物试验,卵泡颗粒细胞体外培养具有费用低、周期短、易于重复的优点,对应用于卵泡细胞甾体激素的生成和调节的研究具有较明显的优势。颗粒细胞体外培养能避免其他细胞因子的干扰,更有利于深入研究颗粒细胞的生理学调控机制。卵泡颗粒细胞体外培养不仅可用于分析促卵泡激素等激素的生理活性,也可用于探讨某些因子或药物对卵巢的作用。然而,家禽卵泡分离提取获得的颗粒细胞并未用FSHR免疫组化检测细胞纯度,亦未研究其纯化方法,因而采用原代细胞提取的颗粒细胞中可能含有卵母细胞、膜内层细胞和卵黄等物质,分离培养的颗粒细胞仍存有许多问题,如细胞是否能长期维持其活性、增殖力和特征性表型。研究发现,长时期培养的原代颗粒细胞,形态逐渐类似于成纤维细胞,多数细胞在培养第7天左右就开始出现退行性反应[28]。因此,如何优化纯化颗粒细胞方法、延长体外颗粒细胞原代培养时细胞的生长时间,阻止细胞出现退行性反应,是颗粒细胞体外培养方法的重要研究方向。其目标的实现必将为更深入研究促性腺激素、甾体类激素及多肽类生长因子等对颗粒细胞功能的影响提供可靠方法。
| [1] |
林金杏.局部性促生长因子对鸡卵泡发育的调控及其机理的研究[D].博士学位论文.杭州:浙江大学,2011.
( 0) 0)
|
| [2] |
张昊, 陈芳, 梁振华, 等. 家禽卵泡闭锁研究进展[J].
张昊, 陈芳, 梁振华, 等. 家禽卵泡闭锁研究进展[J]. 湖北畜牧兽医, 2014 , 35 (10) :61 –65.
( 0) 0)
|
| [3] |
黄华云,李春苗,黎寿丰,等.家禽卵泡发育研究进展[C]//中国畜牧兽医学会家禽学分会第九次代表会议暨第十六次全国家禽学术讨论会论文集.扬州:中国畜牧兽医学会,2013.
( 0) 0)
|
| [4] |
YOON J D, JEON Y, CAI L, et al. Effects of coculture with cumulus-derived somatic cells on in vitro maturation of porcine oocytes[J]. Theriogenology, 2015 , 83 (2) : 294 –305.
DOI: 10.1016/j.theriogenology.2014.09.025 ( 0) 0)
|
| [5] |
FUKUI Y, ONO H. Effects of sera,hormones and granulosa cells added to culture medium for in-vitro maturation,fertilization,cleavage and development of bovine oocytes[J]. Journal of Reproduction and Fertility, 1989 , 86 (2) : 501 –506.
DOI: 10.1530/jrf.0.0860501 ( 0) 0)
|
| [6] |
金艳梅.鸡等级前卵泡颗粒细胞发育的激素和营养调控及机理研究[D].博士学位论文.杭州:浙江大学,2007.
( 0) 0)
|
| [7] |
王星, 罗光彬, 刘永, 等. 哺乳动物颗粒细胞凋亡研究进展[J].
王星, 罗光彬, 刘永, 等. 哺乳动物颗粒细胞凋亡研究进展[J]. 安徽农业科学, 2007 , 35 (12) :3554 –3555.
( 0) 0)
|
| [8] |
李彩萍.生殖激素对体外培养的水牛卵泡颗粒细胞凋亡的影响研究[D].硕士学位论文.南宁:广西大学,2006.
( 0) 0)
|
| [9] |
GILBERT A B, EVANS A J, PERRY M M, et al. A method for separating the granulosa cells,the basal lamina and the theca of the preovulatory ovarian follicle of the domestic fowl (Gallus domesticus)[J]. Journal of Reproduction and Fertility, 1977 , 50 (1) : 179 –181.
DOI: 10.1530/jrf.0.0500179 ( 0) 0)
|
| [10] |
ASEM E K, ZAKAR T, BIELLIER H V, et al. Progesterone production in granulosa cells of the domestic fowl:effects of incubation media,pH,cell density and some other factors[J]. Domestic Animal Endocrinology, 1984 , 1 (3) : 235 –249.
DOI: 10.1016/0739-7240(84)90004-3 ( 0) 0)
|
| [11] |
HAMMOND R W, TODD H, HERTELENDY F. Effects of mammalian gonadotropins on progesterone release and cyclic nucleotide production by isolated avian granulosa cells[J]. General and Comparative Endocrinology, 1980 , 41 (4) : 467 –476.
DOI: 10.1016/0016-6480(80)90051-9 ( 0) 0)
|
| [12] |
ASEM E K, FENG S L, STINGLEY-SALAZAR S R, et al. Basal lamina of avian ovarian follicle:influence on morphology of granulosa cells in-vitro[J]. Comparative Biochemistry and Physiology Part C: Pharmacology Toxicology and Endocrinology, 2000 , 125 (2) : 189 –201.
DOI: 10.1016/S0742-8413(99)00100-0 ( 0) 0)
|
| [13] |
VANMONTFORT D, ROMBAUTS L, DECUYPERE E, et al. Source of immunoreactive inhibin in the chicken ovary[J]. Biology of Reproduction, 1992 , 47 (6) : 977 –983.
DOI: 10.1095/biolreprod47.6.977 ( 0) 0)
|
| [14] |
WEN R, HU S Q, XIAO Q H, et al. Leptin exerts proliferative and anti-apoptotic effects on goose granulosa cells through the PI3K/Akt/mTOR signaling pathway[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2015 , 149 : 70 –79.
DOI: 10.1016/j.jsbmb.2015.01.001 ( 0) 0)
|
| [15] |
WOJTUSIK J, JOHNSON P A. Vitamin D regulates anti-Mullerian hormone expression in granulosa cells of the hen[J]. Biology of Reproduction, 2012 , 86 (3) : 91 .
DOI: 10.1095/biolreprod.111.094110 ( 0) 0)
|
| [16] |
XIE Y L, PAN Y E, CHANG C J, et al. Palmitic acid in chicken granulosa cell death-lipotoxic mechanisms mediate reproductive inefficacy of broiler breeder hens[J]. Theriogenology, 2012 , 78 (9) : 1917 –1928.
DOI: 10.1016/j.theriogenology.2012.07.004 ( 0) 0)
|
| [17] |
ASEM E K, QIN W, RANE S G. Effect of basal lamina of ovarian follicle on T-and L-type Ca2+ currents in differentiated granulosa cells[J]. American Journal of Physiology-Endocrinology and Metabolism, 2002 , 282 (1) : E184 –E196.
( 0) 0)
|
| [18] |
WALTHER N, EINSPANIER A, JANSEN M. Expression of granulosa cell-specific genes and induction of apoptosis in conditionally immortalized granulosa cell lines established from H-2Kb-tsA58 transgenic mice[J]. Biology of Reproduction, 1999 , 60 (5) : 1078 –1086.
DOI: 10.1095/biolreprod60.5.1078 ( 0) 0)
|
| [19] |
CHIANG M, STRONG J A, ASEM E K. Bovine serum albumin enhances calcium currents in chicken granulosa cells[J]. Molecular and Cellular Endocrinology, 1993 , 94 (1) : 27 –36.
DOI: 10.1016/0303-7207(93)90048-O ( 0) 0)
|
| [20] |
PICTON H M, CAMPBELL B K, HUNTER M G. Maintenance of oestradiol production and expression of cytochrome P450 aromatase enzyme mRNA in long-term serum-free cultures of pig granulosa cells[J]. Journal of Reproduction and Fertility, 1999 , 115 (1) : 67 –77.
DOI: 10.1530/jrf.0.1150067 ( 0) 0)
|
| [21] |
丁海雷.鸡精原干细胞和支持细胞的分离培养与鉴定[D].硕士学位论文.扬州:扬州大学,2008.
( 0) 0)
|
| [22] |
叶婧, 丁婷, 杜小芳, 等. 不同分离方法对人卵巢颗粒细胞体外培养的影响[J].
叶婧, 丁婷, 杜小芳, 等. 不同分离方法对人卵巢颗粒细胞体外培养的影响[J]. 中国现代医学杂志, 2013 , 23 (17) :1 –5.
( 0) 0)
|
| [23] |
邓红惠, 耿果霞, 贺亚媚, 等. 猪三种不同直径卵泡中颗粒细胞的比较研究[J].
邓红惠, 耿果霞, 贺亚媚, 等. 猪三种不同直径卵泡中颗粒细胞的比较研究[J]. 家畜生态学报, 2014 , 35 (12) :58 –62.
( 0) 0)
|
| [24] |
RANGEL P L, RODRÍGUEZ A, GUTIERREZ C G. Testosterone directly induces progesterone production and interacts with physiological concentrations of LH to increase granulosa cell progesterone production in laying hens (Gallus domesticus)[J]. Animal Reproduction Science, 2007 , 102 (1/2) : 56 –65.
( 0) 0)
|
| [25] |
郭小虎, 张宏馨, 陈辉, 等. 维生素E对蛋种鸡卵巢等级前颗粒细胞增殖的影响[J].
郭小虎, 张宏馨, 陈辉, 等. 维生素E对蛋种鸡卵巢等级前颗粒细胞增殖的影响[J]. 中国家禽, 2013 , 35 (4) :10 –13.
( 0) 0)
|
| [26] |
熊建文, 肖化, 张镇西. MTT法和CCK-8法检测细胞活性之测试条件比较[J].
熊建文, 肖化, 张镇西. MTT法和CCK-8法检测细胞活性之测试条件比较[J]. 激光生物学报, 2007 , 16 (5) :559 –562.
( 0) 0)
|
| [27] |
TIAN Y, SHEN W, LAI Z W, et al. Isolation and identification of ovarian theca-interstitial cells and granulose cells of immature female mice[J]. Cell Biology International, 2015 , 39 (5) : 584 –590.
DOI: 10.1002/cbin.v39.5 ( 0) 0)
|
| [28] |
杨永梅, 陈娟, 陈洋, 等. 哺乳动物卵泡颗粒细胞体外培养研究概况[J].
杨永梅, 陈娟, 陈洋, 等. 哺乳动物卵泡颗粒细胞体外培养研究概况[J]. 中国畜牧兽医, 2011 , 38 (3) :135 –138.
( 0) 0)
|




