2. 泰安市中心医院, 泰安 271000
2. Tai'an Central Hospital, Tai'an 271000, China
雌性动物生产力的高低通过繁殖性能来体现,子宫作为哺乳类动物胎儿形成和发育的器官,在雌性动物繁殖性能的发挥中具有不可替代的作用。子宫发育异常会导致雌性动物发生月经异常、病理妊娠以及不孕等疾病,在母猪上表现为受精率、着床率、产仔率降低。机体内所有生理活动程序化的正常运行均依赖于不同信号传导通路之间的相互协调,研究表明,Wnt(名称来源于果蝇无翅基因Wingless和小鼠致癌基因int-1)信号通路在调控细胞生长分化、器官发育、胚胎种植以及各种疾病、肿瘤的发生过程中均起到非常重要的作用[1-2]。研究还发现Wnt信号通路在胚胎缪勒氏管发育、生长和分化以及出生后雌性生殖道的发育和功能的正常发挥中均起到重要的作用[3-4]。Wnt信号通路能够调控胚胎植入子宫和维持子宫的稳态[5-7],并且在月经周期诱导雌激素的激活和孕酮的抑制[8-9]。一旦子宫内膜细胞雌激素含量提高或因病变等其他外界因素导致不抵抗雌激素信号,就会激活Wnt信号通路,引发子宫内膜增生,甚至诱发内膜癌[9-10]。总之,信号传导通路的探索是整个生命科学研究前沿领域最活跃的热点之一,然而对Wnt信号通路分子机制的阐释才刚刚开始,许多问题亟待解决。因此,重新定位并积极探索Wnt/β-连环蛋白(β-catenin)经典信号通路的调控机制,无疑成为对Wnt家族再认识的重中之重。
1 Wnt/β-catenin信号通路与子宫发育子宫是哺乳类动物胚胎形成和发育的场所。哺乳动物胚胎发育过程中,子宫会在多种生殖激素的共同作用下发生周期性的变化,并且在妊娠过程中子宫内膜和基质也会发生一定的变化。而子宫发育成为具有繁殖性能器官的过程中,子宫内外的许多因子对其复杂的发育过程进行调控。大量研究表明,Wnt信号通路与细胞的分化联系密切,且在机体发育中起着举足轻重的作用,Wnt信号通路中任何一种影响因子的时空表达或异常激活都会导致动物机体发育异常[11-13]。Wnt信号通路在动物生殖系统的发育过程中同样具有十分重要的作用,而与生殖最相关的便是经典的Wnt/β-catenin信号传导通路[14]。
Wnt/β-catenin信号通路是近年发现的存在于生物体内的一条极其保守的信号传导通路,参与细胞多种复杂的生化反应过程,同时也是高等动物胚胎组织发育分化过程中的关键信号通路,可通过调节靶基因表达参与细胞的增殖、分化、极化、凋亡与抗凋亡等。Wnt/β-catenin信号通路作用于子宫发育过程具体表现为:当Wnt配体、曲卷蛋白(frizzled,Fz)和低密度脂蛋白受体相关蛋白(low-density lipoprotein-receptor-related protein,LRP)结合形成三聚体,经Fz将信号传导给子宫上皮细胞蓬乱蛋白(dishevelled,Dsh),通过Wnt信号 的上游激活,糖原合酶激酶-3β(glycogen synthase kinase 3β,GSK-3β)的活性被Dsh抑制,从而避免β-catenin被磷酸化,进而得以在胞质中聚集,随后转运进入子宫细胞核中,在T细胞特异转录因子(T cell-specific transcription factor,TCF)/淋巴增强子结合因子(lymphoid enhancer-binding factor,LEF)家族转录因子的参与下,完成靶基因激活。若细胞没有接受Wnt信号,结肠腺瘤样息肉基因(adenomatous polyposis coli,APC)、支架蛋白(Axin)和蛋白磷酸酶2A(protein phosphatase 2A,PP2A)的多蛋白复合体会在GSK-3β的协助下将β-catenin磷酸化,磷酸化后的β-catenin经过泛素水解系统的共价修饰,最后在蛋白水解酶复合体作用下被降解,从而关闭Wnt/β-catenin信号传导通路(图 1)。
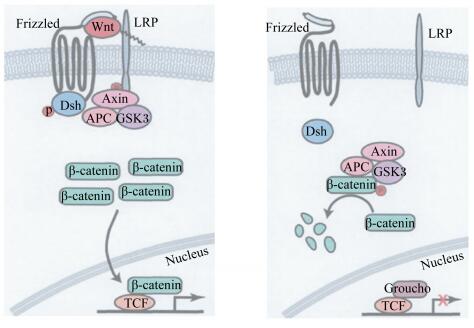
|
Frizzled:曲卷蛋白;LRP:低密度脂蛋白受体相关蛋白 low-density lipoprotein-receptor-related protein;APC:结肠腺瘤样息肉基因 adenomatous polyposis coli;GSK-3β:糖原合酶激酶-3β glycogen synthase kinase 3β;Axin:支架蛋白;Dsh:蓬乱蛋白 dishevelled;Wnt:名称来源于果蝇无翅基因Wingless和小鼠致癌基因int-1;TCF:T细胞特异转录因子 T cell-specific transcription factor;β-catenin:β-连环蛋白。 图 1 Wnt/β-catenin信号通路 Figure 1 Wnt/β-catenin signaling pathway[15] |
目前普遍认为Wnt/β-catenin信号通路的调节模式为:GSK-3β/APC/Axin三元复合物对细胞内β-catenin直接进行磷酸化,调节其稳定性,以保证子宫在无Wnt信号刺激下胞浆内β-catenin维持在较低水平。
2.1 GSK-3β对Wnt/β-catenin信号通路的调节在一条完整的Wnt/β-catenin信号通路中,GSK-3β通过使Axin、β-catenin和APC磷酸化来发挥自身作用,能够直接抑制Dsh从而达到负调控Wnt/β-catenin信号通路的目的[16]。无Wnt信号刺激时,GSK-3β可以在Axin和APC的协助下,与β-catenin形成复合物,磷酸化β-catenin氨基端的丝/苏氨酸位点,β-传导重复相容蛋白(beta-transducinrepeats-containingproteins,β-TrCP)识别氨基端磷酸化的β-catenin,启动泛素水解系统使β-catenin降解。有Wnt信号刺激时,GSK-3β的活性受到抑制,β-catenin逃逸泛素水解系统作用而聚集于胞浆内。值得注意的是,最初研究认为GSK-3β不需要其他激酶的协助可直接磷酸化β-catenin,但近期研究表明β-catenin第45位丝氨酸需要被酪蛋白激酶-1α(casein kinase-1α,CKlα)磷酸化后才能与GSK-3β形成复合物进行下一步反应[17]。研究证实,若β-catenin在Wnt/β-catenin信号通路中持续激活,会导致小鼠子宫内膜细胞过度增生,甚至会形成基质细胞瘤,而条件性敲除β-catenin的小鼠子宫内膜出现鳞片状变化[18]。由此初步推测,GSK-3β的缺失或功能障碍可能导致子宫内膜增生、内分泌紊乱等多种疾病。
2.2 APC对Wnt/β-catenin信号通路的调节APC在Wnt/β-catenin信号通路中具有支架蛋白的作用,能够协助GSK-3β靠近且磷酸化β-catenin。有研究认为,APC不仅自身携带出核信号,而且可以结合β-catenin将其从细胞核带到细胞浆,进行接下来的降解过程;但β-catenin在肿瘤细胞内的转运并不依赖于APC[19-23]。另有研究表明,APC是Wnt/β-catenin信号通路中与细胞凋亡关系最紧密的调节因子[24]。APC变异几率极高,变异后能够与凋亡抑制基因(Bcl-2)蛋白结合,大大提高Bcl-2在线粒体中的表达水平,由此推断APC可能与介导子宫肌瘤细胞增殖系统有关。
2.3 Axin对Wnt/β-catenin信号通路的调节Axin最初是作为抑癌基因被人们所认识的,其编码的Axin蛋白对Wnt/β-catenin信号通路具有重要的调控作用。Axin作为蛋白骨架,含有能与APC、Dsh、PP2A、GSK-3β、β-catenin和CKlα结合的蛋白结合位点,为多种生物学功能的发挥提供保证。Axin通过对胞内β-catenin水平的调控,以达到对Wnt/β-catenin信号通路的负向调控[25]。卵巢子宫内膜样腺癌中能够探测到Axin的突变[22],初步推测,Axin表达异常可能与其在诱导细胞凋亡方面的功能有关。研究发现,Axin通过激活c-Jun氨基末端激酶(c-Jun amino terminal kinase,JNK)信号传导通路或降低β-catenin的胞内含量诱导细胞凋亡,然而当Axin基因发生突变不能激活JNK信号传导通路时,其诱导细胞凋亡能力相应减弱;若Axin基因突变后不能结合β-catenin但仍可以激活JNK信号传导通路时,其诱导细胞凋亡能力的减弱程度更显著;β-catenin与Axin在胞内同时出现高表达情况时,Axin诱导细胞凋亡能力亦会相应减弱[26]。
2.4 成骨细胞抑制因子(Dkk)对子宫内膜容受性的调节子宫内膜对胚胎的接受能力称为容受性,是评价繁殖性能的一个重要指标。研究表明,Dkk通过调节Wnt/β-catenin信号通路来参与调节子宫内膜容受性[27]。Dkk作为一种分泌蛋白,在子宫内膜表面的表达具有时空特异性,种植期Dkk表达水平的上升会引起子宫内膜分泌期容受性改变。Dkk家族由Dkk1、Dkk2、Dkk3和Dkk4组成,4个成员之间的功能区域相互重叠,时空上受到共同的调控,于中胚层共同表达。Dkk家族中,与子宫内膜容受性的改变联系最紧密的是Dkk1和Dkk2 2个成员。Dkk1通过捆绑结合跨膜蛋白kremens 1(Krm1)和kremens 2(Krm2)达到对Wnt信号的抑制。Dkk2对Wnt/β-catenin信号通路的抑制与Dkk1类似,不同的是Dkk2能够在细胞缺少Krm2时完成对Wnt/β-catenin信号通路的激活,且Dkk2对Wnt/β-catenin信号通路的激活作用大于抑制作用。研究表明,Dkk1在正常雌性哺乳动物子宫内膜增殖晚期出现弱表达甚至不表达,分泌中期表达水平相当于增殖期的13.1倍[23],推测Dkk1可能在介导胚胎顺利着床发挥一定作用。研究也表明,Dkk2在种植窗期第4天于子宫腺上皮开始表达,第6天表达水平降低,本时期内子宫容受性发生改变[26]。子宫蜕膜化过程中,Dkk2对Wnt/β-catenin信号通路起抑制作用[28]。妊娠期第6天至第7天Dkk2与Krm2并非同时存在[28],推测Dkk2对Wnt/β-catenin信号通路的抑制作用也许不需要通过Krm2的介导,具体机制尚需更深入的研究。
2.5 Wnt/β-catenin信号通路的其他调节机制随着研究的深入,人们不断发现新的调节因子对Wnt/β-catenin信号通路具有调节作用。例如,与阿尔茨海默氏痴呆症有关的早老素-1(presenilin 1,PS-1)蛋白作为Wnt/β-catenin信号通路的负调节因子,其作用机制一直不为人们所了解,然而最近研究显示,PS-1可以发挥类似Axin的作用,介导β-catenin的磷酸化及降解,而这一过程并不依赖于Axin/CK1α[29]。前列腺素F2α受体(prostaglandin F2α receptor,FPB)可以通过激活磷脂酰肌醇三激酶(phosphatidylinositol-3 kinase,PI3K)/Rho通路进而对Wnt/β-catenin信号通路起正调节作用[29]。Axin结合分子(Axin associating molecule,Axam)作为Axin的结合蛋白能够抑制Wnt/β-catenin信号通路的传导[31]。 另外,胞浆内的去泛素化酶也可以结合β-catenin,使其积累并进入细胞核[32]。抑制性卡巴蛋白激酶-α(IkB kinase-α,Ikkα)和抑制性卡巴蛋白激酶-β(IkB kinase-β,Ikkβ)均能够使β-catenin磷酸化,前者能够增强β-catenin的转录活性,后者抑制其转录[33]。
之前的研究中,研究者更多地把丝/苏氨酸磷酸化对Wnt/β-catenin信号通路的调节作为关注的焦点,对于酪氨酸磷酸化的研究仍停留在调节钙黏蛋白(cadherin)/β-catenin复合物在细胞黏附方面的作用。近期更多的研究表明,酪氨酸磷酸化在Wnt/β-catenin信号通路中同样具有不可替代的作用[34],β-catenin经酪氨酸磷酸化后半衰期得到延长并在核内积累,进而激活靶基因。
2.6 Wnt/β-catenin信号通路的核内激活当Wnt信号出现时,β-catenin能够逃逸泛素水解系统的降解,进而在胞浆内积累并入核,在LEF/TCF的参与下激活靶基因。研究认为,LEF/TCF能够维持β-catenin的核内滞留,而β-catenin可利用自身的出核信号,不依赖核孔转运蛋白(chromosome region maintenance-1,CRM-1)完成出核[35]。β-catenin进入细胞核后与DNA蛋白TCF/LEF结合,然后与DNA形成三元复合物,进而改变DNA构象,并通过募集其他转录因子来启动靶基因,此模型近期已被Graham等[36]的解析晶体结构所证实。另外,许多核内蛋白也参与β-catenin的转录活性调节。LIM蛋白家族成员中,接头蛋白(four and half LIM domain protein,FHL2)能够与β-catenin/TCF共同完成对靶基因细胞周期蛋白D1(cyclinD1)、白细胞介素-8(interleukin-8,IL-8)的激活转录[37]。值得一提的是,果蝇中发现的legless(Lgs)蛋白能够使尾肢同源蛋白pygopus(Pygo)与β-catenin结合,Pygo通过植物同源结构域(plant homeodomain,PHD)使β-catenin或TCF接近染色质,进而实现对Wnt靶基因的转录激活。
3 小结与展望尽管人们对Wnt/β-catenin信号通路在子宫等生殖系统中作用的认识不断深入,但是对该通路分子间信号传递具体机制的阐释才刚刚开始,许多问题亟待解决,如激活的Wnt/β-catenin信号通路中Wnt阻止GSK-3β/APC/Axin对β-catenin磷酸化的具体分子机制、各种因子间的信息如何交换以及β-catenin进入细胞核后作用于不同靶基因产生的不同表达结果。目前,人们对Wnt/β-catenin信号通路的理解仍然是在过表达基础上获得的,采用功能缺失分析的方法来保证所研究影响因子的生理相关性。今后的研究可能会更多地聚焦在不同通路的信号传递方式和阶段应该如何选取合适的研究方法的探索。另外,由于Wnt/β-catenin信号通路的研究涉及到动物机体发育的多个阶段,以及该通路的异常调控将引发多种生殖系统疾病,故对Wnt/β-catenin信号通路及各种因子拮抗剂的研究可以尝试作为治疗性应用的分子目标。
| [1] |
LICKERT H, KISPERT A, KUTSCH S, et al. Expression patterns of Wnt genes in mouse gut development[J]. Mechanisms of Development, 2001 , 105 (1/2) : 181 –184.
( 0) 0)
|
| [2] |
GAGE P J, QIAN M, WU D Q, et al. The canonical Wnt signaling antagonist DKK2 is an essential effector of PITX2 function during normal eye development[J]. Developmental Biology, 2008 , 317 (1) : 310 –324.
DOI: 10.1016/j.ydbio.2008.02.030 ( 0) 0)
|
| [3] |
MERICSKAY M, KITAJEWSKI J, SASSOON D. Wnt5a is required for proper epithelial-mesenchymal interactions in the uterus[J]. Development, 2004 , 131 (9) : 2061 –2072.
DOI: 10.1242/dev.01090 ( 0) 0)
|
| [4] |
MILLER C, PAVLOVA A, SASSOON D A. Differential expression patterns of Wnt genes in the murine female reproductive tract during development and the estrous cycle[J]. Mechanisms of Development, 1998 , 76 (1/2) : 91 –99.
( 0) 0)
|
| [5] |
SONDEREGGER S, POLLHEIMER J, KNÖFLER M. Wnt signalling in implantation, decidualisation and placental differentiation-review[J]. Placenta, 2010 , 31 (10) : 839 –847.
DOI: 10.1016/j.placenta.2010.07.011 ( 0) 0)
|
| [6] |
NEI H, SAITO T, YAMASAKI H, et al. Nuclear localization of β-catenin in normal and carcinogenic endometrium[J]. Molecular Carcinogenesis, 1999 , 25 (3) : 207 –218.
DOI: 10.1002/(ISSN)1098-2744 ( 0) 0)
|
| [7] |
HOU X N, TAN Y, LI M L, et al. Canonical Wnt signaling is critical to estrogen-mediated uterine growth[J]. Molecular Endocrinology, 2004 , 18 (12) : 3035 –3049.
DOI: 10.1210/me.2004-0259 ( 0) 0)
|
| [8] |
WANG Y Y, HANIFI-MOGHADDAM P, HANEKAMP E E, et al. Progesterone inhibition of Wnt/β-catenin signaling in normal endometrium and endometrial cancer[J]. Clinical Cancer Research, 2009 , 15 (18) : 5784 –5793.
DOI: 10.1158/1078-0432.CCR-09-0814 ( 0) 0)
|
| [9] |
WANG Y Y, VAN DER ZEE M, FODDE R, et al. Wnt/β-catenin and sex hormone signaling in endometrial homeostasis and cancer[J]. Oncotarget, 2010 , 1 (7) : 674 –684.
DOI: 10.18632/oncotarget ( 0) 0)
|
| [10] |
VAN DER HORST P H, WANG Y Y, VAN DER ZEE M, et al. Interaction between sex hormones and WNT/β-catenin signal transduction in endometrial physiology and disease[J]. Molecular and Cellular Endocrinology, 2012 , 358 (2) : 176 –184.
DOI: 10.1016/j.mce.2011.06.010 ( 0) 0)
|
| [11] |
LOGAN C Y, NUSSE R. The Wnt signaling pathway in development and disease[J]. Annual Review of Cell and Developmental Biology, 2004 , 20 : 781 –810.
DOI: 10.1146/annurev.cellbio.20.010403.113126 ( 0) 0)
|
| [12] |
PEIFER M, POLAKIS P. Wnt signaling in oncogenesis and embryogenesis-a look outside the nucleus[J]. Science, 2000 , 287 (5458) : 1606 –1609.
DOI: 10.1126/science.287.5458.1606 ( 0) 0)
|
| [13] |
VAINIO S, HEIKKILÄ M, KISPERT A, et al. Female development in mammals is regulated by Wnt-4 signalling[J]. Nature, 1999 , 397 (6718) : 405 –409.
DOI: 10.1038/17068 ( 0) 0)
|
| [14] |
孙晓阳, 王雁玲. Wnt信号通路与哺乳动物生殖[J].
孙晓阳, 王雁玲. Wnt信号通路与哺乳动物生殖[J]. 生物化学与生物物理进展, 2003 , 30 (2) :180 –184.
( 0) 0)
|
| [15] |
LI M, WANG H Y. Mitogen-activated protein kinase p38 regulates the Wnt/cyclic GMP/Ca2+ non-canonical pathway[J]. Journal of Biological Chemistry, 2007 , 282 (39) : 28980 –28990.
DOI: 10.1074/jbc.M702840200 ( 0) 0)
|
| [16] |
DOMINGUEZ I, GREEN J B A. Missing links in GSK3 regulation[J]. Developmental Biology, 2001 , 235 (2) : 303 –313.
DOI: 10.1006/dbio.2001.0317 ( 0) 0)
|
| [17] |
LUCAS J J, HERNÁNDEZ F, GÓMEZ R P, et al. Decreased nuclear β-catenin, tau hyperphosphorylation and neurodegeneration in GSK-3β conditional transgenic mice[J]. The EMBO Journal, 2001 , 20 (1-2) : 27 –39.
( 0) 0)
|
| [18] |
JEONG J W, LEE H S, FRANCO H L, et al. β-catenin mediates glandular formation and dysregulation of β-catenin induces hyperplasia formation in the murine uterus[J]. Oncogene, 2008 , 28 (1) : 31 –40.
( 0) 0)
|
| [19] |
HENDERSON B R, FAGOTTO F. The ins and outs of APC and β-catenin nuclear transport[J]. EMBO Reports, 2002 , 3 (9) : 834 –839.
DOI: 10.1093/embo-reports/kvf181 ( 0) 0)
|
| [20] |
ROSIN-ARBESFELD R, CLIFFE A, BRABLETZ T, et al. Nuclear export of the APC tumour suppressor controls β-catenin function in transcription[J]. The EMBO Journal, 2003 , 22 (5) : 1101 –1113.
DOI: 10.1093/emboj/cdg105 ( 0) 0)
|
| [21] |
HENDERSON B R. Nuclear-cytoplasmic shuttling of APC regulates β-catenin subcellular localization and turnover[J]. Nature Cell Biology, 2000 , 2 (9) : 653 –660.
DOI: 10.1038/35023605 ( 0) 0)
|
| [22] |
WU R, ZHAI Y L, FEARON E R, et al. Diverse mechanisms of β-catenin deregulation in ovarian endometrioid adenocarcinomas[J]. Cancer Research, 2001 , 61 (22) : 8247 –8255.
( 0) 0)
|
| [23] |
KAO L C, TULAC S, LOBO S, et al. Global Gene Profiling in Human Endometrium during the Window of Implantation[J]. Endocrinology, 2002 , 143 (6) : 2119 –2138.
DOI: 10.1210/endo.143.6.8885 ( 0) 0)
|
| [24] |
陈红漫.Wnt10a/Wnt10b及其Wnt/β-catenin通路在子宫内膜癌中的作用研究[D].博士学位论文.天津:天津医科大学, 2014.
http://cdmd.cnki.com.cn/article/cdmd-10062-1014356564.htm
( 0) 0)
|
| [25] |
韩立薇.β-连环素的表达及基因突变在子宫内膜癌中的研究[D].硕士学位论文.沈阳:中国医科大学, 2003.
http://www.cnki.com.cn/article/cjfdtotal-qlzl200723005.htm
( 0) 0)
|
| [26] |
ZHANG Y, NEO S Y, HAN J H, et al. Dimerization choices control the ability of axin and dishevelled to activate c-Jun N-terminal kinase/stress-activated protein kinase[J]. Journal of Biological Chemistry, 2000 , 275 (32) : 25008 –25014.
DOI: 10.1074/jbc.M002491200 ( 0) 0)
|
| [27] |
刘春喜, 苏迎春, 孙莹璞. Wnt信号途径及其调节因子Dkk与子宫内膜容受性[J].
刘春喜, 苏迎春, 孙莹璞. Wnt信号途径及其调节因子Dkk与子宫内膜容受性[J]. 国际生殖健康/计划生育杂志, 2010 , 29 (2) :78 –80.
( 0) 0)
|
| [28] |
WEI W, GLINKA A, DELIUS H, et al. Mutual antagonism between dickkopf1 and dickkopf2 regulates Wnt/β-catenin signalling[J]. Current Biology, 2000 , 10 (24) : 1611 –1614.
DOI: 10.1016/S0960-9822(00)00868-X ( 0) 0)
|
| [29] |
KANG D E, SORIANO S, XIA X F, et al. Presenilin couples the paired phosphorylation of β-catenin independent of axin:implications for β-catenin activation in tumorigenesis[J]. Cell, 2002 , 110 (6) : 751 –762.
DOI: 10.1016/S0092-8674(02)00970-4 ( 0) 0)
|
| [30] |
FUJINO H, SRINIVASAN D, REGAN J W. Cellular conditioning and activation of β-catenin signaling by the FPB prostanoid receptor[J]. Journal of Biological Chemistry, 2002 , 277 (50) : 48786 –48795.
DOI: 10.1074/jbc.M209393200 ( 0) 0)
|
| [31] |
TAKAYUKI K, HIDEKI Y, TOSHIAKI S, et al. Desumoylation activity of Axam, a novel Axin-binding protein, is involved in downregulation of β-catenin[J]. Molecular and Cellular Biology, 2002 , 22 (11) : 3803 –3819.
DOI: 10.1128/MCB.22.11.3803-3819.2002 ( 0) 0)
|
| [32] |
TAYA S, YAMAMOTO T, KANAI-AZUMA M, et al. The deubiquitinating enzyme Fam interacts with and stabilizes β-catenin[J]. Genes to Cells, 1999 , 4 (12) : 757 –767.
DOI: 10.1046/j.1365-2443.1999.00297.x ( 0) 0)
|
| [33] |
LAMBERTI C, LIN K M, YAMAMOTO Y, et al. Regulation of β-catenin function by the IκB kinases[J]. Journal of Biological Chemistry, 2001 , 276 (45) : 42276 –42286.
DOI: 10.1074/jbc.M104227200 ( 0) 0)
|
| [34] |
DANILKOVITCH-MIAGKOVA A, MIAGKOV A, SKEEL A, et al. Oncogenic mutants of RON and MET receptor tyrosine kinases cause activation of the β-catenin pathway[J]. Molecular and Cellular Biology, 2001 , 21 (17) : 5857 –5868.
DOI: 10.1128/MCB.21.17.5857-5868.2001 ( 0) 0)
|
| [35] |
WIECHENS N, FAGOTTO F. CRM1- and Ran-independent nuclear export of β-catenin[J]. Current Biology, 2001 , 11 (1) : 18 –28.
DOI: 10.1016/S0960-9822(00)00045-2 ( 0) 0)
|
| [36] |
GRAHAM T A, WEAVER C, MAO F, et al. Crystal structure of a β-catenin/Tcf complex[J]. Cell, 2000 , 103 (6) : 885 –896.
DOI: 10.1016/S0092-8674(00)00192-6 ( 0) 0)
|
| [37] |
WEI Y, RENARD C A, LABALETTE C, et al. Identification of the LIM protein FHL2 as a coactivator of β-catenin[J]. Journal of Biological Chemistry, 2003 , 278 (7) : 5188 –5194.
DOI: 10.1074/jbc.M207216200 ( 0) 0)
|




