2. 山东农业大学动物科技学院, 泰安 271018
2. College of Animal Science and Technology, Shandong Agricultural University, Tai'an 271018, China
毛囊(hair follicle)是表皮向真皮凹陷后形成的能控制毛发生长的皮肤附属器官,具有独特的结构、合成多种特异角质蛋白的功能以及周期性再生的能力。毛囊在形成与分化过程中至少涉及到20余种不同的细胞群,主要由毛乳头、毛母质、内根鞘和外根鞘等细胞组成[1-2]。其中,外根鞘细胞(outer root sheath cell, ORSC)作为一种重要的毛囊上皮细胞,因具有高度增生的潜能,在毛发再生、伤口愈合、初级毛囊和次级毛囊分化等生理过程中均起着重要作用而越来越受到关注。
自Wetering等[3]利用经钴源照射后的牛晶状体包膜囊作为支持物,成功诱导人毛囊外根鞘细胞迁移出游离毛囊以来,已有不少学者针对外根鞘细胞体外培养体系与技术进行过改进。其中,Oshima等[4]将分离的毛囊直接接种到塑料培养皿中,在控制培养液pH不高于7.2的条件下,贴壁毛囊周围便可游离出外根鞘细胞,但该方法获得的外根鞘细胞产量低且再生能力差,不便于进行进一步的研究与大量的应用。迄今,已有多种细胞分离技术和细胞培养方法运用于外根鞘细胞的体外培养,其中,较为常用的培养方法有2种:一种是将分离的毛囊经胰蛋白酶消化处理后,用含10%胎牛血清(fetal bovine serum, FBS)的DMEM/F12培养液制成细胞悬液,然后接种于经丝裂霉素处理的3T3细胞滋养层上,37 ℃、5% CO2条件下进行原代培养[5-8];另一种则是利用胶原包埋法进行外根鞘细胞的培养,分离带有外根鞘部位的毛囊,37 ℃下进行胰酶消化处理,随后将毛囊转移至Ⅰ型和Ⅳ型胶原包被的塑料培养皿中,加入含有10% FBS的DMEM培养液进行培养,待毛囊牢固贴附于培养皿底壁后,换用无血清的DMEM培养液进行培养[9-10]。以上2种方法虽均能获得毛囊外根鞘细胞,但仍存在少量非外根鞘细胞,且细胞传至第8~10代后出现凋亡现象,以致无法继续进行传代培养。
上述外根鞘细胞的培养多以人的毛囊为细胞的组织来源。对于其他哺乳动物外根鞘细胞的培养,主要借鉴人毛发外根鞘细胞培养方法。研究表明,将分离得到的小鼠触须毛囊接种于含有表皮生长因子(epidermal growth factor, EGF)及10% FBS的RPMI1640培养液中,且细胞培养板预先用经丝裂霉素C处理的表皮细胞滋养层覆盖,可成功分离得到纯一的外根鞘细胞并稳定生长至第8~10代[11]。亦有学者在上述分离培养方法的基础上加以改进,成功分离培养了大鼠、牛、羊驼、猪、兔等动物的毛外根鞘细胞及其他毛囊细胞[12-13]。尽管许多学者在动物毛囊细胞培养方面进行了大量的研究,但有关山羊毛囊细胞体外培养研究,尤其是外根鞘细胞系建立等方面的报道相对较少,可应用于动物毛囊研究方面的细胞株与细胞系亦不多。本试验在借鉴国内外其他学者分离、纯化与接种方法的基础上,拟对蛋白酶处理皮肤组织和次级毛囊分离方法进行改进,提高外根鞘细胞获得率;传代培养达第40代时,进行外根鞘细胞生长特性研究与染色体分析,以建立动物毛囊研究方面的细胞株与细胞系。
因此,建立体外培养的毛囊外根鞘细胞系,完善外根鞘细胞分离培养方法,可为进一步研究动物皮肤毛囊的生长发育规律及其影响因素奠定基础。同时也可为进一步研究毛囊细胞的生长、发育、分化的研究建立离体的细胞模型。对山羊毛囊外根鞘细胞进行研究,探讨毛囊生长调节机制以及羊的绒毛生长退化机理,最终将为提高品种毛、绒、皮产品的产量和质量等开拓新的途径。另外,以山羊毛囊外根鞘细胞系为模型,研究外根鞘细胞与毛乳头、内根鞘、皮肤成纤维等细胞的相互作用,还可为医学领域的毛囊再生、脱发秃顶等提供重要参考。
1 材料与方法 1.1 主要试剂与药品DMEM/F12培养液为Gibco公司产品;无血清角质细胞培养液(keratinocyte-serum free medium, K-SFM)为Gibco公司产品;FBS为MDgenics公司产品;胰蛋白酶为Sigma公司产品;EGF为Sigma公司产品;胰岛素样生长因子-Ⅰ(insulin-like growth factor-Ⅰ, IGF-Ⅰ)和氢化可的松(hydrocortisone)为Peprotech公司产品;青霉素钠(benzylpenicillin sodium)为山东鲁抗辰欣药业有限公司产品;硫酸链霉素(streptomycin sulfate)为山东瑞阳药业有限公司产品;秋水仙碱(colchicine)为Sigma公司产品;Giemsa染液(Giemsa stain)为Fluka公司产品;细胞角蛋白19(cytokeratin-19, CK-19)抗体为Acris公司产品;即用型Biotin SP-HRP免疫组化试剂盒和二氨基联苯胺(DAB)显色试剂盒为北京鼎国昌盛生物技术公司产品。
完全培养液:含10 ng/mL EGF、10 ng/mL IGF-Ⅰ、0.4 μg/mL氢化可的松和10% FBS的DMEM/F12培养液。
工作培养液:含10 ng/mL IGF-Ⅰ、10 ng/mL EGF、0.4 μg/mL氢化可的松的无血清角质细胞培养液。
维持培养液:含10 ng/mL IGF-Ⅰ、10 ng/mL EGF、0.4 μg/mL氢化可的松和2% FBS的DMEM/F12培养液。
D-Hank’s液:由8 g/L NaCl、0.4 g/L KCl、0.06 g/L Na2HPO4·H2O、0.06 g/L KH2PO4、0.35 g/L NaHCO3和0.4 g/L苯酚红组成。
磷酸盐缓冲液(PBS):由8 g/L NaCl、0.2 g/L KCl、1.56 g/L Na2HPO4·H2O和0.2 g/L KH2PO4组成。
冻存培养液:含10%二甲基亚砜(DMSO)和30% FBS的DMEM/F12培养液。
Carnoy’s固定液:3倍体积的甲醇加1倍体积的冰醋酸,现配现用并于冰上保存。
1.2 试验动物与样品采集怀孕母羊购自山东省济宁市嘉祥县种羊场,饲养于山东农业大学动物科技学院畜牧科技试验站羊场。运用外科手术的方法,随机活体采集出生1~3日龄的羔羊背部面积约0.5 cm×0.5 cm的皮肤组织块,将皮肤组织块放入碘酒和酒精约30 s进行消毒,再用生理盐水洗净酒精,迅速将皮肤组织块放入无血清DMEM/F12培养液,于冰盒中带回实验室。在12 h内进行分离培养。
1.3 外根鞘细胞原代培养用细胞培养板的处理将预先培养的山羊皮肤成纤维细胞接种于6孔细胞培养板中,每孔加入3 mL含10% FBS的DMEM/F12培养液,37 ℃、5% CO2浓度的饱和湿度条件下进行培养。经3~5 d细胞生长至汇合时,除去培养液。加入约3 mL的无菌1% Triton X-100于单层细胞上,37 ℃孵育30 min后,去除Triton X-100溶液,用无菌超纯水冲洗干净,置于4 ℃下备用。
1.4 山羊毛囊外根鞘细胞的原代培养将活体采集的皮肤组织块带回实验室,经70%酒精浸泡消毒,D-Hank’s液洗净酒精后,随即置于体式显微镜下,用弯头眼科剪和解剖针在培养皿中尽量刮去残余裸露毛干及皮下脂肪,无菌生理盐水冲洗去表面污物,碘酒擦拭及75%乙醇脱碘,用含有青霉素(400 U/mL)、链霉素(400 μg/mL)和泰乐菌素(Tylosin)(250 μg/mL)的D-Hank’s液再清洗皮肤组织块,直至上清液清亮。浸入新的D-Hank’s液中带入无菌间进行下一步的操作。
进入无菌间后,吸去D-Hank’s液,将前期进行处理的皮肤组织块,浸入约10 mL 0.25%中性蛋白酶,4 ℃消化过夜。然后放入新的D-Hank’s液中,手术刀在真皮与皮下组织之间切开,再用无菌弯头镊揭去表皮层后,在体式显微镜下用灭菌镊子夹住次级毛囊远端,顺毛囊方向拔出毛囊,置于0.25%胰蛋白酶中消化5 min,随后将游离毛囊均匀贴附于预先铺有山羊皮肤成纤维细胞的胞外基质的6孔培养板中,按照每孔3 mL加入完全培养液,37 ℃、5% CO2浓度培养箱中进行培养。待毛囊周围迁移出大量细胞后,更换为相同体积的工作培养液,在37 ℃、5% CO2浓度下启动原代培养。待游离出的毛囊外根鞘细胞生长成单层后,消化移入培养瓶中进行培养,2~3 d更换1次工作培养液。
1.5 细胞的传代培养当毛囊外根鞘细胞生长至会合状态后,进行传代。首先弃掉旧培养液,D-Hank’s液冲洗细胞1次,加入约1 mL浓度为0.25%的胰蛋白酶浸润细胞数秒。弃去液体后,再加入4 mL浓度为0.25%的胰蛋白酶,常温下消化处理约5 min。当观察到有细胞贴附的瓶壁逐渐变白,且轻轻晃动有微小细胞团块脱落时,便可加入6 mL完全培养液终止消化,吹打并悬浮细胞,计数,稀释细胞密度至10个/mL,取5 mL悬液加入25 cm2(最大培养面积)培养瓶中,按每瓶10 mL量加入工作培养液放回培养箱中继续培养,此后每3 d更换工作培养液1次。待外根鞘细胞稳定生长至第8~10代时,更换等量的维持培养液进行培养,以利于外根鞘细胞在体外长期传代。挑选可稳定遗传的对数生长期毛囊外根鞘细胞进行形态学观察并测定生长曲线。
1.6 山羊毛囊外根鞘细胞的Giemsa染色将灭菌盖玻片放入一次性细胞培养皿中,取2 mL第5代毛囊外根鞘细胞悬液加入培养皿中,置于CO2培养箱中培养。待外根鞘细胞在盖玻片上长成良好单层后,取出玻片并浸入无水甲醇中固定15 min,再用新的无水甲醇冲洗细胞,随即放入纯的Giemsa染液中染色5~10 min。从Giemsa染液中取出玻片经过干燥和二甲苯透明。最后,中性树脂封片,显微镜下观察、拍照。
1.7 细胞生长曲线的测定收获第5代处于对数生长期外根鞘细胞,采用细胞传代的方法制成细胞悬液。经计数后,将密度为1.02×104个/mL的细胞悬液接种于24孔细胞培养板中,每孔1 mL。每隔24 h取出3个孔的细胞分别进行计数,取平均值。以培养时间为横轴,每天的细胞数平均值为纵轴,绘制体外培养毛囊外根鞘细胞的生长曲线。
1.8 山羊毛囊外根鞘细胞的染色体核型分析待传代培养第40代的外根鞘细胞生长至对数生长期时,将细胞移入25 mL培养瓶中,CO2培养箱中培养54 h。将0.5 μg/mL秋水仙素加入维持培养液中,37 ℃条件下继续培养约8 h,大部分细胞处于分裂中期。胰蛋白酶消化分离细胞,转入15 mL离心管中,1 000 r/min,4 ℃离心10 min收集细胞。吸去上清液逐滴加入0.5 mL预温37 ℃的低渗液(即0.075 mol/L的KCl溶液)并混匀,随即补加低渗液至10 mL,用吸管轻轻吹打均匀,37 ℃孵育30 min。低渗处理后向管中加入1 mL新鲜Carnoy’s固定液进行预固定,离心去上清后加入10 mL新鲜Carnoy’s液进行固定,重复离心加液进行再固定。将清洁载玻片进行4 ℃预冷处理,取出后将其倾斜45°放置,在上方约1 m高度用吸管迅速滴加2~3滴固定后的细胞悬液,室温干燥。最后,进行Giemsa染色,中性树脂封片,先用低倍镜寻找良好分裂相,再用高倍镜观察。
1.9 毛囊外根鞘细胞的免疫细胞化学鉴定取1.5 mL第5代外根鞘细胞悬液均匀接种于清洁无菌的盖玻片上,置于37 ℃、5% CO2浓度培养箱中培养。待外根鞘细胞长至盖玻片80%以上面积时,取出盖玻片经PBS清洗后,用-20 ℃预冷的醋酸乙醇固定液固定20 min,PBS清洗3次(每次3 min)。按照即用型Biotin SP-HRP免疫组化试剂盒说明步骤进行细胞角蛋白19(CK-19)免疫细胞化学检测。最后用DAB于暗处显色3~10 min,蒸馏水清洗后,观察,照相。
1.10 毛囊外根鞘细胞的冷冻保存与复苏选择第5代对数生长期细胞,利用传代培养的方法制成细胞悬液,1 000 r/min,离心10 min,取上清后加入冻存培养液(含10% DMSO和30% FBS的DMEM/F12培养液),调整细胞密度为5×106个/mL,分装入5 mL无菌冻存管中,封口,标记。将冻存管依次置于4 ℃ 1 h、-20 ℃ 1 h、-70 ℃ 12 h,最后移入液氮中长期保存细胞。
复苏细胞时,用40 ℃温水快速解冻细胞,然后转入15 mL离心管,逐滴加入10 mL维持培养液缓慢稀释冻存液,无菌吸管轻轻吹打混匀后,1 000 r/min离心10 min,弃上清。再用维持培养液适当稀释后,按5×105个/mL的细胞密度接种于培养瓶。
1.11 细胞活率与贴壁率的测定运用台盼蓝染料排斥法,计数1 000个细胞,测定细胞冻存前和复苏后的活率,并观察细胞复苏后的贴壁情况,统计分析细胞活率与贴壁率。
1.12 毛囊外根鞘细胞的形态回复试验收获传至第40代的生长良好的单层外根鞘细胞,在37 ℃、5% CO2浓度的条件下,用10 mL维持培养液和10 mL工作培养液进行传代培养,每3 d更换1次培养液,观察外根鞘细胞的生长情况和形态变化。
2 结果与分析 2.1 原代培养的毛囊外根鞘细胞的形态学观察利用贴壁法分离毛囊外根鞘细胞,在含完全培养液中,4~5 d便可见毛囊外根鞘边缘向外游离生长出单个细胞,细胞呈圆形,随后伸展成多角形的形态(图 1-a)。培养7 d即可明显看到大量细胞从外根鞘边缘生长出来(图 1-b)。随着游离生长细胞的增多,生长速率逐渐加快,在15 d时,细胞进入对数生长期。在倒置相差显微镜下观察,可见游离出的毛囊外根鞘细胞以短梭形和多角形为主,细胞饱满,透明度高,胞体向外伸出2~4个片足,胞核卵圆形,胞质较少(图 1-c)。随后细胞向四周呈克隆状生长,形成致密单层后细胞变化为短梭状平行排列(图 1-d)。
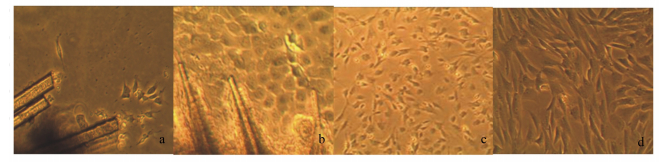
|
图 1 体外培养的青山羊原代毛囊外根鞘细胞 Figure 1 Primary outer root sheath cells of grey goats after in vitro culture (100×) |
体外培养的毛囊外根鞘细胞经Giemsa染色后,可见细胞质呈淡蓝色,胞体近中央处有椭圆形的细胞核,呈深蓝色,其中可见1~2个核仁(图 2-a)。观察处于对数生长期的外根鞘细胞,视野中可见较多量的有丝分裂相细胞,采用该染色法可较清晰地显示出细胞分裂的不同时相(图 2-b)。当培养瓶内的细胞形成良好单层(即达到汇合状态)后,经染色可见只有极少量细胞处于分裂周期(M期),大部分细胞出现接触抑制(图 2-c)。其中,个别细胞出现胞核分裂,胞质未分裂的现象,形成合胞体状(第40代,图 2-d)。
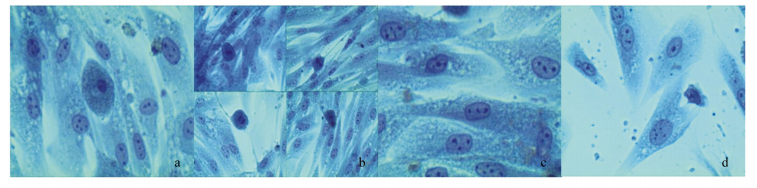
|
图 2 体外培养的青山羊毛囊外根鞘细胞Giemsa染色 Figure 2 Giemsa staining of outer root sheath cells of grey goats after in vitro culture (200×) |
传代培养的外根鞘细胞与其原代细胞在形态及生长速度上均无明显差异,细胞生长与分裂依然十分旺盛。单层细胞传代约7 d后便可重新长成单层,其对于胰蛋白酶消化的敏感性也较原代培养细胞明显增强。从体外培养的外根鞘细胞的生长曲线(图 3)可以看出,细胞贴壁生长的前2 d为迟缓期;3~5 d为对数生长期;5 d后便进入平稳期和衰退期。细胞群体倍增时间为51.9 h,说明外根鞘细胞经传代培养后其生长与分裂能力依然旺盛。
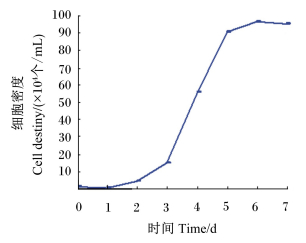
|
图 3 青山羊毛囊外根鞘细胞生长曲线 Figure 3 Growth curve of outer root sheath cells of grey goats |
选取传至第40代的细胞,进行染色体标本计数。结果表明,济宁青山羊染色体为2n=60的细胞占主体,但是个别细胞的染色体发生缺失与丢失,出现了典型的非整倍体性细胞系染色体特征,说明体外培养环境对细胞的遗传稳定性有影响作用;然而,在选取进行计数培养细胞中,拥有60条染色体的细胞数仍可占总细胞数的58.3%,且这些细胞的核型均正常(图 4)。因此,所建立的细胞系确为青山羊细胞系。
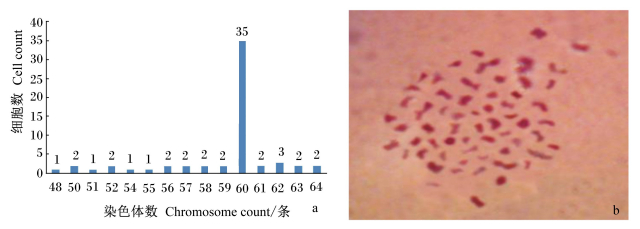
|
a:第40代外根鞘细胞染色体数;b:第40代外根鞘细胞分裂中期染色体。 a: chromosome count of passage 40 outer root sheath cells; b: passage 40 outer root sheath cells at metaphase of cell division. 图 4 第40代青山羊毛囊外根鞘细胞的染色体分析 Figure 4 Chromosome analysis of passage 40 outer root sheath cells of grey goats |
应用免疫细胞化学染色技术检测体外培养的低传代次数(第5代)的外根鞘细胞的骨架蛋白-细胞角蛋白19表达情况。显微镜观察结果显示分离培养的细胞质呈黄褐色,表明外根鞘细胞角蛋白19表达呈阳性(图 5),而角蛋白19为毛外根鞘细胞和皮肤干细胞的标记,因此证实本试验分离培养的细胞确为由毛囊干细胞分化来的外根鞘细胞。
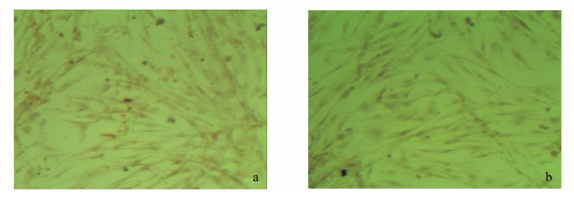
|
图 5 青山羊毛囊外根鞘细胞免疫细胞化学染色 Figure 5 Immunocytochemecal staining of outer root sheath cells of grey goats (100×) |
利用血球计数板测定细胞冻存前24 h的平均活率及细胞复苏后24 h的平均活率与贴壁率,统计分析结果表明,青山羊毛囊外根鞘细胞东存前和复苏后平均活率分别为94.4%和92.1%,复苏24 h后约有85%细胞贴附瓶底生长。由此可见,冻存和复苏对传代细胞活力状况的损害较小,细胞生长状态良好(图 6)。
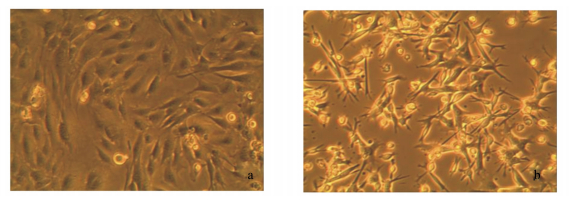
|
a:冻存前的毛囊外根鞘细胞;b:复苏后24 h的毛囊外根鞘细胞。 a: outer root sheath cells before cryopreservation; b: outer root sheath cells after 24 h of recovery. 图 6 冻存前与复苏后的青山羊毛囊外根鞘细胞 Figure 6 Outer root sheath cells of grey goats before cryopreservation and after recovery (100×) |
将传代培养至第40代的外根鞘细胞,在工作培养液进行持续培养。7 d后可观察到,在工作培养液中的外根鞘细胞,其形态由原来的以成纤维样细胞形态为主,逐渐转变成以内皮样细胞形态为主(图 7-a);而外根鞘细胞在含维持培养液中持续培养,其形态仍以成纤维样细胞形态为主(图 7-b)。
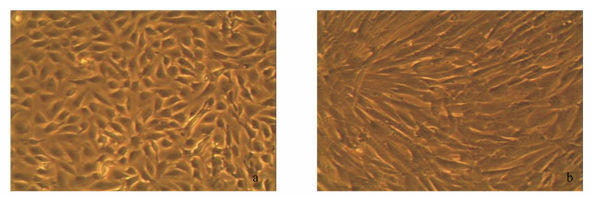
|
a:培养于工作培养液中的外根鞘细胞;b:培养于维持培养液中的外根鞘细胞。 a: outer root sheath cells cultured in working culture medium; b: outer root sheath cells cultured in feeding medium. 图 7 第40代青山羊毛囊外根鞘细胞的形态回复 Figure 7 Morphology recovery of passage 40 outer root sheath cells of grey goats (100×) |
动物毛囊是由多种细胞组成的皮肤附属器官,对毛囊内各种细胞的体外培养是揭示毛囊发育机制的基础。毛囊外根鞘细胞在组织发生、生物学特性等方面与毛囊干细胞密切相关,获得可在体外长期培养的毛囊外根鞘细胞系,可为研究外根鞘细胞与毛乳头细胞等相关细胞的相互作用,最终在体外成功诱导毛发再生奠定基础。
3.1 皮肤成纤维细胞的胞外基质对外根鞘细胞贴壁的促进作用以往对于毛囊外根鞘细胞的培养,常用的方法是将细胞接种于辐射或丝裂霉素处理过的滋养层细胞上,培养液含血清和一些添加剂。这种培养方法不但准备步骤多,而且操作过程中易出现污染[14]。
本试验将游离毛囊接种于预先铺有山羊皮肤成纤维细胞的胞外基质的培养瓶中,在毛囊外根鞘细胞游离出来后,可见细胞生长迅速,经10~15 d便可形成一层膜相结构。分析其中的原因,可能是由于皮肤成纤维细胞对毛囊外根鞘细胞的贴壁生长有促进作用,而且,体内状态下的成熟毛囊,外根鞘细胞和皮肤成纤维细胞紧密相连,关系极为密切。
本试验所建立的这种方法,不仅可以在短时间内获得大量单层外根鞘细胞,而且操作步骤较建立滋养层细胞法更简便易行,并且,有效地避免了操作过程中的微生物污染与杂细胞的混入。此外,利用青山羊皮肤成纤维细胞的胞外基质做培养瓶表面覆盖物,能够为原代培养的细胞提供更为接近体内的细胞外环境,有利于刺激毛囊外根鞘细胞重新恢复分裂能力,这也是能够成功进行细胞传代培养的重要条件之一。
3.2 酶消化法与机械分离法相结合1982年,Wells[15]采用机械分离方法获得游离毛囊,然后将其直接培养于塑料培养皿中。该方法虽然可获得毛囊外根鞘细胞,但是游离毛囊需经15~20 d才有细胞外迁,且外根鞘细胞的产量较低,再生能力较差,无法进行传代培养。1994年,Kurata等[16]将分离出的毛囊经胰蛋白酶消化处理后,获得外根鞘细胞悬液进行培养,但该方法不仅前期准备烦琐费时,且易出现细胞污染。此后,国内外学者对毛囊外根鞘细胞的分离培养相继展开了研究,采用机械分离毛囊贴壁方法培养,虽然容易成功,但费时费力,且细胞增殖缓慢;而采用单纯酶解方法进行培养,也能获得成功,但是,存在其他细胞污染与微生物污染的可能性[17-18]。本试验将在2种培养方法的基础上进行改进和结合既具有操作简便、获得细胞量大、细胞贴壁好等优点,又可有效地避免细胞增殖缓慢、不易传代、细胞与微生物污染等方面的不足。
3.3 生长因子对毛囊外根鞘细胞的调节作用本试验在培养液中添加了10 ng/mL IGF-Ⅰ、10 ng/mL EGF和0.4 μg/mL氢化可的松,这些生长因子是能够顺利启动外根鞘细胞原代培养以及成功进行传代培养的关键因素。
大量研究表明,向培养液中添加适宜浓度的生长因子,对毛囊外根鞘细胞的贴壁与增殖具有明显的促进作用[19-20],许多学者在哺乳动物毛囊外根鞘细胞的体外培养中使用了IGF-Ⅰ和EGF,发现它们能够促进毛囊外根鞘细胞的生长[21-22]。IGF-Ⅰ具有胰岛素样代谢作用,能够刺激毛囊外根鞘细胞、毛乳头细胞以及黑色素细胞的增殖与分化。运用免疫组化方法证实,在毛囊生长周期的不同阶段均有IGF-Ⅰ存在于动物毛囊外根鞘细胞和毛囊其他细胞中,表明IGF-Ⅰ对毛囊细胞的分化和生长有着广泛且必需的作用。EGF是一种调节细胞周期的外源性生长因子,能调节细胞周期进程,对多种细胞增殖有刺激作用。国内外研究者运用免疫组织化学和放射自显影技术发现,离体或在体状态下毛囊外根鞘部位均有EGF和EGF受体的存在。提示,EGF与毛囊外根鞘细胞上的EGF受体结合,可促进细胞内DNA、RNA和羟脯氨酸的合成,调节蛋白质的合成,引起外根鞘细胞的生长、合成与分泌活动的变化[23]。近年来,一些学者就糖皮质激素(氢化可的松)对毛囊外根鞘细胞和毛乳头细胞体外培养的影响作了深入的研究。发现体外培养的外根鞘细胞和毛乳头细胞均有氢化可的松及其受体的表达,并且向培养体系中添加氢化可的松对细胞有较强的有丝分裂作用[24]。
本试验在前人研究和对比试验的基础上,向培养液中添加了10 ng/mL IGF-Ⅰ、10 ng/mL EGF和0.4 μg/mL氢化可的松,这些生长因子顺利协助启动了外根鞘细胞的原代培养以及传代培养。
3.4 非毛囊外根鞘细胞的生长抑制与去除非毛囊外根鞘细胞的生长抑制与去除是保证外根鞘细胞体外培养的原代启动及成功传代的关键因素之一。研究发现,细胞培养液中的血清成分含有多种黏附因子,可促进细胞的分化与形态变化,且有利于成纤维细胞的增殖,从而抑制了上皮样细胞的生长[25-26]。Jahoda等[27]采用无血清培养液培养原代表皮干细胞与毛外根鞘细胞,接种96 h后观察发现,成纤维细胞的增殖得到明显抑制,而表皮干细胞与毛外根鞘细胞的增殖时间缩短、增殖细胞数量增加。近年来无血清角质细胞培养液越来越多的应用于毛囊干细胞与毛外根鞘细胞的纯化培养,无血清角质细胞培养液富含铜、硒、锌等微量元素和丰富的必需氨基酸,可以作为外根鞘细胞培养与纯化的最好选择。除培养液与血清能够影响毛外根鞘细胞纯度外,游离毛囊的分离与接种方法亦可影响毛外根鞘与其他细胞的比例。Limat等[28]首先在显微镜下直接从新鲜采集皮肤中拔出毛囊,随后制成游离毛囊混悬液接种于培养基质上进行培养,该方法虽然个别游离毛囊能够贴壁并向周围生长出细胞,然而多数分离毛囊因未贴壁或贴壁不牢而无法向外游离生长细胞。且该方法因前期未对皮肤组织样品进行消化处理,所获毛囊其外根鞘部分受损伤严重,分离出的细胞中皮脂腺细胞及成纤维细胞居多,不利于进一步的外根鞘细胞纯化培养。Hoeller等[29]将分离毛囊经胰蛋白酶和乙二胺四乙酸(EDTA)溶液处理后,加入到培养液中进行培养,获得了较多量的外根鞘细胞,然而该方法在分离毛囊时亦有部分外根鞘遗留在组织内,且易混杂生长较多成纤维细胞,影响后期的细胞纯化。
本试验在借鉴国内外其他学者分离与接种方法的基础上,首先,利用4 ℃ 0.25%中性蛋白酶对皮肤组织进行预处理,保证所分离得到的游离次级毛囊外根鞘部分的完整性;其次,将分离的次级毛囊采用先贴附培养基质再进行0.25%胰蛋白酶消化处理以及加入少量含高浓度血清(10% FBS)培养液促贴壁等试验手段,提高了游离毛囊的贴壁率及获得细胞中外根鞘细胞所占比例,利于进一步获取纯一的外根鞘细胞。
4 结 论本试验利用皮肤成纤维细胞外基质诱导和机械分离与酶消化结合方法成功启动了外根鞘细胞的原代培养,添加多种生长因子成功建立了山羊毛囊外根鞘细胞系。该细胞系已稳定传至第40代,生长分裂状态良好,细胞群体倍增时间约为51.9 h。经细胞染色体分析与形态回复的试验鉴定结果表明,所建毛囊外根鞘细胞系特征明显,可为研究毛囊生长与分化机制,尤其是毛囊主要细胞间的相互作用机制提供良好模型。
| [1] |
崔志峰, 赵晶, 王慧, 等. 不同培养基对山羊毛囊体外培养的影响研究[J].
崔志峰, 赵晶, 王慧, 等. 不同培养基对山羊毛囊体外培养的影响研究[J]. 山东大学学报:理学版, 2008 , 43 (5) :1 –5.
( 0) 0)
|
| [2] |
董彬, 崔志峰, 尹逊河, 等. 济宁青山羊皮肤毛囊的组织学特性研究[J].
董彬, 崔志峰, 尹逊河, 等. 济宁青山羊皮肤毛囊的组织学特性研究[J]. 山东农业大学学报:自然科学版, 2010 , 41 (2) :258 –262.
( 0) 0)
|
| [3] |
WETERINGS P J J M, VERMORKEN A J M, BLOEMENDAL H. A method for culturing human hair follicle cells[J]. British Journal of Dermatology, 1981 , 104 (1) : 1 –5.
DOI: 10.1111/bjd.1981.104.issue-1 ( 0) 0)
|
| [4] |
OSHIMA H, ROCHAT A, KEDZIA C, et al. Morphogenesis and renewal of hair follicles from adult multipotent stem cells[J]. Cell, 2001 , 104 (2) : 233 –245.
DOI: 10.1016/S0092-8674(01)00208-2 ( 0) 0)
|
| [5] |
唐建兵, 陈璧, 汤朝武, 等. 人毛囊外根鞘细胞的培养[J].
唐建兵, 陈璧, 汤朝武, 等. 人毛囊外根鞘细胞的培养[J]. 中华烧伤杂志, 2003 , 19 (1) :47 –48.
( 0) 0)
|
| [6] |
BAK S S, SUNG Y K, KIM S K. 7-Phloroeckol promotes hair growth on human follicles in vitro[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2014 , 387 (8) : 789 –793.
DOI: 10.1007/s00210-014-0986-0 ( 0) 0)
|
| [7] |
FRESHNEY R I.
Culture of animal cells:a manual of basic technique[M]. 5th ed. New York: Wiley-Liss, 2000 : 149 -175.
( 0) 0)
|
| [8] |
GLEDHILL K, GARDNER A, JAHODA C A B. Isolation and establishment of hair follicle dermal papilla cell cultures[J]. Methods in Molecular Biology, 2013 , 989 : 285 –292.
DOI: 10.1007/978-1-62703-330-5 ( 0) 0)
|
| [9] |
陈杏晔, 李凡, 刘爱军. 毛囊细胞高效分离培养方法的建立[J].
陈杏晔, 李凡, 刘爱军. 毛囊细胞高效分离培养方法的建立[J]. 广州中医药大学学报, 2014 , 31 (5) :807 –809.
( 0) 0)
|
| [10] |
程赛, 张汝芝, 朱静, 等. 人毛囊外根鞘及毛乳头细胞的迁移和生长观察[J].
程赛, 张汝芝, 朱静, 等. 人毛囊外根鞘及毛乳头细胞的迁移和生长观察[J]. 中国皮肤性病学杂志, 2015 , 29 (1) :32 –35.
( 0) 0)
|
| [11] |
LAKO M, ARMSTRONG L, CAIRNS P M, et al. Hair follicle dermal cells repopulate the mouse haematopoietic system[J]. Journal of Cell Science, 2002 , 115 (20) : 3967 –3974.
DOI: 10.1242/jcs.00060 ( 0) 0)
|
| [12] |
GUAN W J, MA Y H, DING H, et al. The establishment of fibroblast cell line and its biological characteristic research in small tail Han sheep[J]. Chinese Journal of Animal and Veterinary Sciences, 2005 , 36 (5) : 511 –516.
( 0) 0)
|
| [13] |
BEHRINGER R R, LEWIN T M, QUAIFE C J, et al. Expression of insulin-like growth factor Ⅰ stimulates normal somatic growth in growth hormone-deficient transgenic mice[J]. Endocrinology, 1990 , 127 (3) : 1033 –1040.
DOI: 10.1210/endo-127-3-1033 ( 0) 0)
|
| [14] |
ASAKAAWA K, TOYOSHIMA K E, ISHIBASHI N, et al. Hair organ regeneration via the bioengineered hair follicular unit transplantation[J]. Scientific Reports, 2012 , 2 : 424 .
( 0) 0)
|
| [15] |
WELLS J. A simple technique for establishing cultures of epithelial cells[J]. British Journal of Dermatology, 1982 , 107 (4) : 481 –482.
DOI: 10.1111/bjd.1982.107.issue-4 ( 0) 0)
|
| [16] |
KURATA S, ITAMI S, TERASHI S, et al. Successful transplantation of cultured human outer root sheath cells as epithelium[J]. Annals of Plastic Surgery, 1994 , 33 (2) : 290 –294.
( 0) 0)
|
| [17] |
XU Z C, ZHANG Q, LI H. Differentiation of human hair follicle stem cells into endothelial cells induced by vascular endothelial and basic fibroblast growth factors[J]. Molecular Medicine Reports, 2014 , 9 (1) : 204 –210.
( 0) 0)
|
| [18] |
KRUGLUGER W, ROHRBACHER W, LACIAK K, et al. Reorganization of hair follicles in human skin organ culture induced by cultured human follicle-derived cells[J]. Expermental Dermatology, 2005 , 14 (8) : 580 –585.
DOI: 10.1111/exd.2005.14.issue-8 ( 0) 0)
|
| [19] |
LU Z F, WU J J, LIU R Q, et al. Expressions of bFGF,ET-1 and SCF in dermal papilla cells and the relation to their biological properties[J]. Journal of Zhejiang University:Medical Sciences, 2004 , 33 (4) : 296 –299.
( 0) 0)
|
| [20] |
刘莉, 张璐, 刘强, 等. 人参对小鼠触须毛囊体外培养的影响[J].
刘莉, 张璐, 刘强, 等. 人参对小鼠触须毛囊体外培养的影响[J]. 今日药学, 2013 , 23 (4) :217 –219.
( 0) 0)
|
| [21] |
FREEMAN M E, KANYICSKA B, LERANT A, et al. Prolactin:structure,function,and regulation of secretion[J]. Physiological Reviews, 2000 , 80 (4) : 1523 –1631.
( 0) 0)
|
| [22] |
SENNETT R, RENDL M. Mesenchymal-epithelial interactions during hair follicle morphogenesis and cycling[J]. Seminars in Cell & Developmental Biology, 2012 , 23 (8) : 917 –927.
( 0) 0)
|
| [23] |
RENDL M, LEWIS M, FUCHS E. Molecular dissection of mesenchymal-epithelial interactions in the hair follicle[J]. PLoS Biology, 2005 , 3 (11) : e331 .
DOI: 10.1371/journal.pbio.0030331 ( 0) 0)
|
| [24] |
TUMBAR T, GUASCH G, GRECO V, et al. Defining the epithelial stem cell niche in skin[J]. Science, 2004 , 303 (5656) : 359 –363.
DOI: 10.1126/science.1092436 ( 0) 0)
|
| [25] |
KRAUSE K, FOITZIK K. Biology of the hair follicle:the basics[J]. Seminats in Cutaneous Medicine and Surgery, 2006 , 25 (1) : 2 –10.
DOI: 10.1016/j.sder.2006.01.002 ( 0) 0)
|
| [26] |
TAUSCHE A K, SKARIA M, BÖHLEN L, et al. An autologous epidermal equivalent tissue-engineered from follicular outer root sheath keratinocytes is as effective as split-thickness skin autograft in recalcitrant vascular leg ulcers[J]. Wound Repair and Regeneration, 2003 , 11 (4) : 248 –252.
DOI: 10.1046/j.1524-475X.2003.11403.x ( 0) 0)
|
| [27] |
JAHODA C, REYNOLDS A. Skin stem cells-a hairy issue[J]. Nature Medicine, 2000 , 6 (10) : 1095 –1097.
DOI: 10.1038/80418 ( 0) 0)
|
| [28] |
LIMAT A, BREITKREUTZ D, HUNZIKER T, et al. Outer root sheath (ORS) cells organize into epidermoid cyst-like spheroids when cultured inside Matrigel:a light-microscopic and immunohistological comparison between human ORS cells and interfollicular keratinocytes[J]. Cell and Tissue Research, 1994 , 275 (1) : 169 –176.
DOI: 10.1007/BF00305384 ( 0) 0)
|
| [29] |
HOELLER D, HUPPERTZ B, ROOS T C, et al. An improved and rapid method to construct skin equivalents from human hair follicles and fibroblasts[J]. Expermental Dermatology, 2001 , 10 (4) : 264 –271.
DOI: 10.1034/j.1600-0625.2001.100406.x ( 0) 0)
|



