2. 江苏蒙彼利生物科技有限公司, 常州 213100;
3. 内蒙古农牧业科学院动物营养与饲料研究所, 呼和浩特 010031;
4. 内蒙古圣牧高科牧业有限公司, 呼和浩特 010018
2. Jiangsu Mengbili Biological Technology Co., Ltd., Changzhou 213100, China;
3. Institute of Animal Nutrition and Feed, Inner Mongolia Academy of Agricultural & Animal Husbandry Sciences, Hohhot 010031, China;
4. Inner Mongolia Holy Priest High-Tech Animal Husbandry Co., Ltd., Hohhot 010018, China
近年来,随着集约化养殖规模的扩大,为了实现生产效率的最大化,高能量饲粮的饲喂模式已成为现代反刍动物集约化生产的显著特征。亚急性瘤胃酸中毒(subacute ruminal acidosis, SARA)正是这种高能量饲喂模式下产生的一种很常见的营养代谢性疾病,具有群发性,对动物健康和养殖效益影响严重。目前已有许多研究表明,当反刍动物发生SARA时,瘤胃内环境发生紊乱,发酵异常,微生物菌群结构改变、异常代谢产物如脂多糖(LPS)和组胺累积,加之瘤胃长期处于低pH环境,会引起瘤胃黏膜损伤,瘤胃屏障功能降低,导致一些异常代谢产物和病原微生物通过破损的瘤胃黏膜移位进入血液,进一步加重酸中毒引起的瘤胃上皮损伤[1-3]。瘤胃对反刍动物至关重要,其上皮结构和功能的完整性是瘤胃执行消化吸收、屏障等功能的基本保障,对维护动物健康和高效生产意义重大。瘤胃黏膜上皮通透性通常是指黏膜上皮比较容易被一些物质分子以简单扩散的方式通过的特性,这一特性的改变可以反映瘤胃黏膜上皮的损伤程度,是检测瘤胃黏膜上皮屏障功能受损程度的一项重要指标,若黏膜上皮通透性增加则说明黏膜完整性被破坏,其屏障功能受损[4]。近年来的研究表明,SARA可损害瘤胃黏膜结构,使瘤胃壁黏膜出现不同程度的脱落,显著降低了瘤胃上皮基底层、棘突层、颗粒层和瘤胃上皮的总厚度,使上皮细胞间紧密连接结构变得疏驰,削弱了瘤胃上皮的屏障功能,引起其通透性增加[5-8]。近期本课题组的研究也发现,SARA影响了瘤胃黏膜上皮的完整性,使瘤胃上皮角质层出现明显脱落和损伤,瘤胃上皮乳头长度、宽度及角质层厚度皆显著降低;同时SARA使瘤胃黏膜上皮细胞增殖细胞核抗原(PCNA)表达下调,显著减弱了瘤胃上皮细胞的增殖活性,而瘤胃上皮细胞出现过度凋亡,破坏了上皮细胞增殖与凋亡间的动态平衡,导致瘤胃上皮屏障功能受损[9]。另有研究表明,饲喂奶牛高精料饲粮可引起瘤胃上皮细胞之间的细胞间隙增大,破坏紧密连接,削弱瘤胃上皮的屏障功能[10]。目前在奶牛[5]、绵羊[6]及山羊[7, 9]的诸多研究表明:SARA可破坏瘤胃黏膜上皮的完整性,其发病机制与瘤胃黏膜屏障功能受损,通透性增加密切相关,但SARA严重程度不同,对瘤胃上皮形态和功能的影响程度也可能有所不同。为此,本研究以奶山羊为动物模型,以逐渐递增饲粮非纤维性碳水化合物与中性洗涤纤维比(NFC/NDF)的方式来诱导奶山羊发生SARA,通过观察瘤胃上皮组织形态结构和通透性的变化,探讨SARA对瘤胃上皮屏障功能的影响,为SARA的深入研究提供理论依据。
1 材料与方法 1.1 试验动物选用9只体况良好,体重35~40 kg,年龄2~3岁,均处于泌乳初期且安装有瘤胃瘘管的经产萨能奶山羊为试验动物。试验动物单笼饲养,每天08:00和18:00分2次等量饲喂,自由饮水。
1.2 试验饲粮参照NRC(1981)[11]奶山羊营养需要及金公亮[12]推荐的《奶山羊饲养标准》进行配制。以玉米、豆粕、麦麸、青干草、苜蓿为主要原料,设计NFC/NDF分别为1.40、1.79、2.31、3.23的4种试验饲粮,精粗比分别为51:49、60:40、68:32、79:21。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets(DM basis) |
采用单因子试验设计,将试验动物随机分为3组,即对照组(n=3)、SARA组(n=3)、恢复组(n=3)。对照组从试验开始至屠宰一直饲喂基础饲粮(NFC/NDF=1.40),SARA组和恢复组通过逐渐递增精料(NFC/NDF依次为1.40、1.79、2.31、3.23)的方式诱导奶山羊发生SARA,每个NFC/NDF饲粮持续饲喂15 d,共诱导60 d,SARA组和恢复组奶山羊SARA诱导成功后,SARA组奶山羊进行屠宰,恢复组奶山羊继续自由采食青干草30 d,使其逐渐恢复。对照组奶山羊分别在饲养30、60(与SARA组3只同时)和90 d(与恢复组3只同时)各屠宰1只。采用动态pH连续监测记录系统对瘤胃液pH进行24 h连续监测,以瘤胃液pH作为判定SARA发生的主要参数,根据Ramanzin等[13]、Penner等[6]和Penner等[14]研究结果,当瘤胃液pH连续24 h内在5.5~5.2持续时间达3 h以上即视为SARA模型成功建立。
1.4 检测指标及方法 1.4.1 瘤胃上皮组织的采集与处理对照组、SARA组和恢复组奶山羊宰杀前禁食12 h,宰杀后立即取瘤胃腹部盲囊处组织,经无菌生理盐水冲洗干净后,用吸水纸吸干组织块表面水分。取上述组织块2 cm×2 cm置于4%多聚甲醛中固定,用于光学显微镜的观察;取瘤胃腹囊处乳头将其切成1 mm×1 mm×1 mm组织块若干置于2.5%戊二醛中固定,用于透射电子显微镜的观察;同时取4块1 cm×1 cm瘤胃腹囊上皮组织用缓冲溶液冲洗干净,迅速放入已充混合气体(95%O2、5%CO2)的保温瓶中用于尤斯灌流系统(Ussing chamber)分析。
1.4.2 瘤胃上皮组织形态结构检测取瘤胃腹部盲囊处组织块2 cm×2 cm置于4%多聚甲醛中至少固定48 h,按照常规方法制作石蜡切片,在光学显微镜观察下瘤胃上皮形态学结构。取1 mm×1 mm×1 mm组织块置于2.5%戊二醛中固定24 h,按照透射电子显微镜的步骤制样,在透射电子显微镜下观察瘤胃上皮超微结构。
1.4.3 瘤胃上皮通透性测定将采集的新鲜瘤胃腹囊上皮组织,于冰浴板上迅速剥离肌层,放于固定环上,插入到Ussing灌流室两半室中央,分别接通电压电极和电流电极。在Ussing chamber中,包括4组单个独立Ussing灌流室,在每个半室中加入5 mL的缓冲溶液(已预热),通入混合气体,连接电脑后平衡大约20 min,待曲线平缓稳定后,供测定短路电流(short-circuit, Isc)、组织导电性(tissue conductance, Gt)和跨膜电位差(potential difference,PD)。曲线平缓稳定后向黏膜侧半室内加入辣根过氧化物酶(horseradish peroxidase,HRP),使其在半室内浓度为2 μmol/L,每隔20 min在浆膜层半室内取200 μL缓冲液装入已经准备好的离心管中,于-20 ℃保存用于测定HRP浓度。Ussing chamber缓冲溶液的配制参照文献[15]。
HRP浓度测定相关溶液配制:1)KH2PO4-Na2HPO4缓冲液,称量KH2PO4 27.2 g和Na2HPO4 28.39 g,用1 000 mL双蒸水溶解,终浓度为0.2 mol/L。2)四甲基联苯胺(TMB)溶液,称量TMB 0.096 2 g,用50 mL无水乙醇溶解,用水定容至100 mL,终浓度为4 mmol/L。3)H2O2,10 μL 30%H2O2与7 990 μL水充分混合,终浓度为0.01 mol/L。
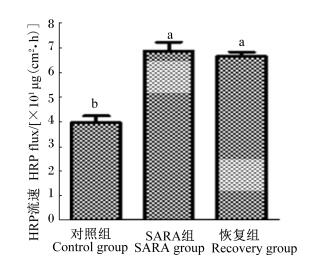
HRP浓度的测定:根据Klevenhusen等[7]和王彤等[16]的2种方法相结合,在15 mL离心管中加入已配制好的KH2PO4-Na2HPO4缓冲液2 mL、0.25 mL的TMB溶液和0.2 mL的H2O2,100 μL含HRP的样品,再加水定容至5 mL,使其充分混匀,在30 ℃恒温水浴中反应1 h,再加蒸馏水定容至10 mL,使反应终止。取200 μL配制好的溶液加入96孔板中,以尤斯灌流缓冲液代替含HRP样品作为空白参比,酶标仪在380 nm处测定吸光度值(A), 根据以下回归曲线方程计算出HRP浓度(CHRP):
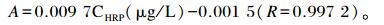
|
根据HRP浓度及尤斯灌流系统试验时间计算HRP从瘤胃上皮浆膜侧向黏膜测的流速。
1.5 数据统计分析所有数据经Excel整理后,采用SPSS 13.0统计软件进行单因素方差分析(one-way ANONA),并进行Duncan氏法多重比较检验差异显著性,结果均以平均值±标准差形式表示。
2 结果与分析 2.1 瘤胃液pH变化由表 2可知,在诱导奶山羊发生SARA的过程中随着饲粮NFC/NDF的增加,瘤胃液pH平均值由6.20降低至5.76,最小值由5.87降低至5.50,最大值由6.59降低至5.98(P<0.05),整体呈下降趋势,瘤胃液pH低于5.5和5.8的时间由0和0.5 h/d延长至3.83和11.33 h/d(P<0.05),瘤胃液pH低于5.5和5.8的曲线面积由0和0.09增加至1.73和3.33。由以上数据可知SARA模型建立成功。
|
|
表 2 奶山羊在诱导SARA的过程中瘤胃液pH的变化 Table 2 Changes of rumen fluid pH in dairy goats during SARA induction |
由表 3和图 1可知,瘤胃上皮总厚度对照组高于SARA组(P>0.05),对照组和SARA组显著高于恢复组(P<0.05)。瘤胃上皮棘突层厚度3组之间无显著差异(P>0.05),对照组最高,恢复组最低。瘤胃上皮颗粒层厚度对照组显著高于SARA组和恢复组(P<0.05),恢复组高于SARA组,但差异不显著(P>0.05)。瘤胃上皮角质层厚度SARA组显著高于对照组和恢复组(P<0.05),对照组显著高于恢复组(P<0.05)。
|
图 1 SARA对奶山羊瘤胃上皮乳头形态学的影响 Figure 1 Effects of SARA on nipple morphology of rumen epithelium in dairy goats |
|
|
表 3 SARA对奶山羊瘤胃上皮各层厚度的影响 Table 3 Effects of SARA on thickness of different stratums of rumen epithelium in dairy goats |
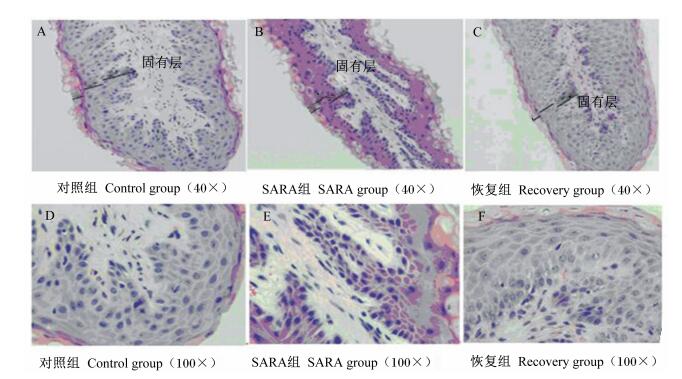
对照组的瘤胃上皮细胞的细胞器正常(图 2-A、图 2-B),完整的紧密连接结构数量较多(图 2-C)。SARA组的瘤胃上皮细胞的界限模糊,棘突层细胞线粒体出现降解(图 2-D),并出现空泡(图 2-E),紧密连接结构被破坏,结构松散并出现降解(图 2-F)。恢复组的瘤胃上皮部分区域紧密连接结构数量较SARA组和对照组多(图 2-G、图 2-H),但是仍有损伤较严重的部位没有恢复(图 2-I),且细胞间有空洞出现。
|
图 2 SARA对奶山羊瘤胃上皮超微结构的影响 Figure 2 Effects of SARA on ultrastructure of rumen epithelium in dairy goats (5 000×) |
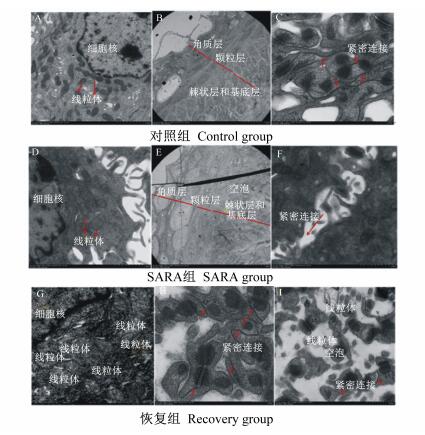
由表 4可知,瘤胃上皮Isc和Gt SARA组显著高于对照组(P<0.05), 略高于恢复组,但差异不显著(P>0.05);PD SARA组显著低于对照组(P<0.05), 也低于恢复组,但差异不显著(P>0.05)。与对照组相比,SARA组和恢复组的瘤胃上皮Isc分别提高了157%和128%,Gt分别提高了24%和20%,PD分别降低了53%和38%;与恢复组相比,SARA组的瘤胃上皮Isc和Gt分别提高了13%和3%,PD则降低了25%。结果提示,SARA对瘤胃上皮电生理参数产生了显著影响,使瘤胃上皮通透性增大,且恢复组仍保持较高的通透性。
|
|
表 4 SARA对奶山羊瘤胃上皮电生理指标的影响 Table 4 Effects of SARA on electric-physiological properties of rumen epithelium in dairy goats |
由图 3可知,瘤胃上皮HRP流速对照组显著低于SARA组和恢复组(P<0.05),恢复组低于SARA组,但差异不显著(P>0.05)。与对照组相比,HRP流速SARA组和恢复组分别提高了73%和68%。
|
图 3 SARA对奶山羊瘤胃上皮HRP流速的影响 Figure 3 Effects of SARA on HRP flux rate of rumen epithelium in dairy goats |
瘤胃上皮由黏膜层到浆膜层分为角质层、颗粒层、棘状层及基底层4层细胞层。因此,与肠单层上皮相比,瘤胃内毒素和细菌不容易通过瘤胃上皮进入浆膜层及外周血液,而且完整的瘤胃上皮形态结构是保持正常瘤胃上皮屏障功能的结构基础,瘤胃上皮角质层和颗粒层细胞等形成的屏障能够将瘤胃内的有害物质隔离出来避免对机体的伤害。瘤胃上皮的完整性受到多种因素影响,饲粮精粗比是主要因素之一,精粗比太高会导致乳头角质化不全,形态异常[17-18]。本试验结果发现,SARA引起瘤胃上皮形态的显著性变化,表现为SARA降低了瘤胃上皮总厚度和棘突层厚度,显著降低了颗粒层厚度,但使角质层厚度显著增加。这与Steele等[5]高谷物饲粮显著降低了瘤胃上皮总厚度、颗粒层厚度和棘突层厚度的试验结果相一致。但邬宇航等[9]研究表明,瘤胃上皮角质层厚度恢复组显著高于SARA组,却显著低于对照组,与本试验结果不相符,产生差异的原因可能在于取样部位不同以及SARA严重程度不同,邬宇航等[9]研究中瘤胃液pH在5.5~5.2每日持续时间长达7.58 h以上,而本试验瘤胃液pH在5.5~5.2波动时间仅3.83 h,pH在5.5~5.2持续时间不同,SARA严重程度也不同。但邬宇航等[9]和本试验结果均发现,瘤胃上皮角质层厚度恢复组显著低于对照组,这表明SARA对瘤胃上皮的形态产生了长期影响作用。同时本试验超微结构结果显示,SARA组瘤胃上皮紧密连接结构被破坏,细胞间隙增大,线粒体出现降解,棘突层出现气泡,上皮细胞界限模糊,而且恢复组损伤较为严重的部位并未完全恢复。以上结果提示,SARA破坏了瘤胃上皮的形态结构,削弱了瘤胃上皮的屏障功能,且对瘤胃上皮形态结构的影响具有长期性。
3.2 SARA对瘤胃上皮通透性的影响瘤胃上皮通透性增高是反映早期瘤胃上皮屏障损伤的重要标志。研究Ussing chamber系统中的电生理指标可反映瘤胃上皮组织的通透性,Isc主要反映离子通过上皮的转运能力,Gt反映上皮细胞对离子的通透性,PD主要说明瘤胃上皮组织的活性,这些电生理指标体现了上皮组织的屏障通透性[19]。在Ussing chamber技术中利用同位素标记或大分子标记物通过胃肠道上皮的比例来检测其上皮通透性已成为比较常用且非常重要的手段[20],常用的标记物如HRP、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、3H-甘露醇[6-7]。随着Ussing chamber技术的不断应用和改良,这一技术已成为目前胃肠道屏障功能研究的金标准。
胃肠道上皮通透性通常是指黏膜上皮比较容易被一些物质分子以简单扩散的方式通过的特性,这一特性的改变能够反映上皮的损伤程度,是检测胃肠道屏障受损的重要指标。若黏膜通透性增加则说明黏膜完整性被破坏,其屏障功能受损。本试验发现,SARA组和恢复组瘤胃上皮Isc与对照组相比显著增加了,分别提高了157%和128%;SARA组和恢复组瘤胃上皮Gt与对照组相比显著增加了,分别提高了24%和20%;PD显著降低了,分别降低了53%和38%;瘤胃上皮HRP流速对照组显著低于SARA组和恢复组,恢复组低于SARA组,但差异不显著;与对照组相比,HRP流速SARA组和恢复组分别提高了73%和68%。Penner等[6]利用Ussing chamber系统研究了轻微的SARA在短期内对瘤胃上皮屏障功能的影响,结果表明Gt升高。Klevenhusen等[7]利用Ussing chamber系统研究了高谷物饲粮对山羊瘤胃上皮通透性的影响,结果发现,高谷物饲粮组瘤胃上皮Isc、Gt和HRP浓度与对照组相比均显著提高;Aschenbach等[21]利用Ussing chamber系统在体外条件下研究发现,pH为5.1时瘤胃上皮Gt增加,Isc降低;Penner等[6]利用直接灌注葡萄糖的方式诱导绵羊发生SARA,结果显示瘤胃上皮Gt和3H-甘露醇标记的同位素从瘤胃上皮浆膜侧向黏膜测的流速增加,Isc降低,瘤胃上皮通透性随着酸度的增加而增加。本试验结果与上述结果部分一致,说明了SARA能破坏瘤胃上皮的完整性,使瘤胃上皮通透性增加,瘤胃上皮的屏障功能受损。
4 结论SARA破坏了奶山羊瘤胃上皮形态结构的完整性,使瘤胃上皮通透性增加,导致瘤胃上皮屏障功能长期受损。
| [1] |
徐俊, 苏衍菁, 张养东, 等. 亚急性瘤胃酸中毒对瘤胃异常代谢产物和微生物组成的影响[J].
徐俊, 苏衍菁, 张养东, 等. 亚急性瘤胃酸中毒对瘤胃异常代谢产物和微生物组成的影响[J]. 中国奶牛, 2012 (9) :17 –20.
( 0) 0)
|
| [2] |
胡红莲, 刘大程, 卢德勋, 等. 日粮不同非纤维性碳水化合物与中性洗涤纤维的比值对奶山羊瘤胃液和血液中内毒素、组织胺含量的影响[J].
胡红莲, 刘大程, 卢德勋, 等. 日粮不同非纤维性碳水化合物与中性洗涤纤维的比值对奶山羊瘤胃液和血液中内毒素、组织胺含量的影响[J]. 中国畜牧兽医, 2012 , 39 (3) :104 –109.
( 0) 0)
|
| [3] |
KHAFIPOUR E, KRAUSE D O, PLAIZIER J C. A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J]. Journal of Dairy Science, 2009 , 92 (3) : 1060 –1070.
DOI: 10.3168/jds.2008-1389 ( 0) 0)
|
| [4] |
刘坚, 侯永清, 丁斌鹰, 等. α-酮戊二酸对脂多糖应激断奶仔猪空肠黏膜蛋白合成和抗氧化能力的影响[J].
刘坚, 侯永清, 丁斌鹰, 等. α-酮戊二酸对脂多糖应激断奶仔猪空肠黏膜蛋白合成和抗氧化能力的影响[J]. 中国畜牧杂志, 2010 , 46 (11) :35 –38.
( 0) 0)
|
| [5] |
STEELE M A, CROOM J, KAHLER M, et al. Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2011 , 300 (6) : R1515 –R1523.
DOI: 10.1152/ajpregu.00120.2010 ( 0) 0)
|
| [6] |
PENNER G B, OBA M, GÄBEL G, et al. A single mild episode of subacute ruminal acidosis does not affect ruminal barrier function in the short term[J]. Journal of Dairy Science, 2010 , 93 (10) : 4838 –4845.
DOI: 10.3168/jds.2010-3406 ( 0) 0)
|
| [7] |
KLEVENHUSEN F, HOLLMANN M, PODSTATZKY-LICHTENSTEIN L, et al. Feeding barley grain-rich diets altered electrophysiological properties and permeability of the ruminal wall in a goat model[J]. Journal of Dairy Science, 2013 , 96 (4) : 2293 –2302.
DOI: 10.3168/jds.2012-6187 ( 0) 0)
|
| [8] |
STEELE M A, GREENWOOD S L, CROOM J, et al. An increase in dietary non-structural carbohydrates alters the structure and metabolism of the rumen epithelium in lambs[J]. Canadian Journal of Animal Science, 2012 , 92 (2) : 123 –130.
DOI: 10.4141/cjas2011-095 ( 0) 0)
|
| [9] |
邬宇航, 殷兆丽, 刘大程, 等. 亚急性瘤胃酸中毒对瘤胃、瓣胃上皮细胞增殖与凋亡的影响[J].
邬宇航, 殷兆丽, 刘大程, 等. 亚急性瘤胃酸中毒对瘤胃、瓣胃上皮细胞增殖与凋亡的影响[J]. 动物营养学报, 2013 , 25 (11) :2612 –2622.
( 0) 0)
|
| [10] |
王娟.不同精粗比日粮对奶牛和山羊瘤胃上皮屏障的影响[D].硕士学位论文.南京:南京农业大学, 2012.
( 0) 0)
|
| [11] |
NRC.Nutrient requirements of goats:angora, dairy, and meat goats in temperate and tropical countries[S].Washington, D.C.:National Academy Press, 1981.
( 0) 0)
|
| [12] |
金公亮. 奶山羊饲养标准[J].
金公亮. 奶山羊饲养标准[J]. 畜牧兽医杂志, 1989 (2) :7 –12.
( 0) 0)
|
| [13] |
RAMANZIN M, BAILONI L, SCHIAVON S, et al. Effect of monensin on milk production and efficiency of dairy cows fed two diets differing in forage to concentrate ratios[J]. Journal of Dairy Science, 1997 , 80 (6) : 1136 –1142.
DOI: 10.3168/jds.S0022-0302(97)76040-5 ( 0) 0)
|
| [14] |
PENNER G, BEAUCHEMIN K A, MUTSVANGWA T. Severity of ruminal acidosis in primiparous Holstein cows during the periparturient period[J]. Journal of Dairy Science, 2007 , 90 (1) : 365 –375.
DOI: 10.3168/jds.S0022-0302(07)72638-3 ( 0) 0)
|
| [15] |
杨淑青.亚急性瘤胃酸中毒对奶山羊瘤胃上皮屏障功能影响机制的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学, 2014.
http://cdmd.cnki.com.cn/article/cdmd-10129-1014375617.htm
( 0) 0)
|
| [16] |
王彤, 刘会峦. 3, 3', 5, 5'-四甲基联苯胺-H2O2-HRP分光光度法测定HRP的研究[J].
王彤, 刘会峦. 3, 3', 5, 5'-四甲基联苯胺-H2O2-HRP分光光度法测定HRP的研究[J]. 青岛大学学报:工程技术版, 2004 , 19 (3) :17 –20.
( 0) 0)
|
| [17] |
张素华, 李岩. 瘤胃生理与奶牛过饲精料引发疾病的研究[J].
张素华, 李岩. 瘤胃生理与奶牛过饲精料引发疾病的研究[J]. 动物科学与动物医学, 2002 , 19 (9) :19 –21.
( 0) 0)
|
| [18] |
NOCEK J E, HEALD C W, POLAN C E. Influence of ration physical form and nitrogen availability on ruminal morphology of growing bull calves[J]. Journal of Dairy Science, 1984 , 67 (2) : 334 –343.
DOI: 10.3168/jds.S0022-0302(84)81306-5 ( 0) 0)
|
| [19] |
LODEMANN U, MARTENS H. Effects of diet and osmotic pressure on Na+ transport and tissue conductance of sheep isolated rumen epithelium[J]. Experimental Physiology, 2006 , 91 (3) : 539 –550.
DOI: 10.1113/expphysiol.2005.032078 ( 0) 0)
|
| [20] |
MAEKAWA M, BEAUCHEMIN K A, CHRISTENSEN D A. Effect of concentrate level and feeding management on chewing activities, saliva production, and ruminal pH of lactating dairy cows[J]. Journal of Dairy Science, 2002 , 85 (5) : 1165 –1175.
DOI: 10.3168/jds.S0022-0302(02)74179-9 ( 0) 0)
|
| [21] |
ASCHENBACH J R, GÄBEL G. Effect and absorption of histamine in sheep rumen:significance of acidotic epithelial damage[J]. Journal of Animal Science, 2000 , 78 (2) : 464 –470.
DOI: 10.2527/2000.782464x ( 0) 0)
|




