肠道稳态(gut homeostasis)是宿主肠道黏膜和免疫屏障、肠道微生物、营养及代谢产物等相互作用所构成的动态平衡状态[1]。肠上皮细胞的增殖、分化、迁移和凋亡受到胞内和胞外诸多因素的调控,其中就包括多胺。多胺可参与调控动物机体内的许多生物学过程,如调节DNA、RNA和蛋白质合成、细胞信号转导、细胞周期和细胞增殖分化等[2-3],尤其是对动物肠道稳态的维持至关重要。近年来的研究表明,快速增殖发育的肠细胞中常常伴随着多胺含量的增加,多胺对于动物肠道发育、肠道黏膜屏障、抗氧化和代谢等生理过程具有重要调控作用。因此,阐明多胺对调节动物肠道稳态及其可能机理的研究有着十分重要的理论和实践意义。本文就多胺对动物肠道稳态的调节功能作一综述,旨在为多胺维持肠道稳态及其调控机制的研究奠定理论基础。
1 多胺概述 1.1 多胺的理化性质多胺是动物体内重要的多聚阳离子脂肪族胺类,主要包括腐胺(putrescine,PUT)、亚精胺(spermidine,SPD)和精胺(spermine,SPM)[4]。腐胺的化学名为丁二胺,分子式为H2N (CH2)4NH2,由鸟氨酸在鸟氨酸脱羧酶(ornithine decarboxylase,ODC)的作用下脱羧后形成。亚精胺的化学名为N-(3-氨基丙基)-1, 4-丁二胺,分子式H2N (CH2)3NH (CH2)4NH2,由腐胺和丙胺基结合而生成。精胺的化学名为N, N’-双-3-丙胺基-1, 4-双胺,分子式为H2N (CH2)3NH (CH2)4NH2,由亚精胺进一步与丙胺基结合而生成。其中,腐胺是机体内最短链的多胺,同时也是合成亚精胺和精胺的前体。精胺则是最长链的带有4个正电荷的阳离子脂肪族多胺[4]。
1.2 多胺的生物合成与代谢多胺广泛存在于生物体内。动物消化道中的多胺不仅可以从母乳和饲粮中获取[5],也可以由体内微生物以及肠细胞通过精氨酸、蛋氨酸、脯氨酸和谷氨酸等氨基酸代谢途径合成[6]。动物体内不断发生着多胺的合成与分解代谢,调节细胞内多胺含量进而维持其在体内的动态平衡[6]。多胺的内源合成及其稳态的维持受到机体精密的调控,机体中鸟氨酸途径是多胺合成代谢的唯一途径[7-8]。动物体内的多胺由L-鸟氨酸脱羧而来,鸟氨酸在ODC作用下脱去羧基生成腐胺。腐胺是合成亚精胺和精胺的前体。腐胺在亚精胺合成酶的作用下经过丙胺基转移反应生成亚精胺,亚精胺又在亚精胺合成酶的催化下再一次与丙胺基作用最终合成精胺。在合成代谢途径中,合成亚精胺和精胺所需的丙胺基来自于S-腺苷蛋氨酸在其脱羧酶(S-adenosylmethionine decarboxylase,AdoMetDC)作用下脱羧后的S-腺苷甲硫丙胺。因此,在多胺从头合成途径中,ODC是多胺合成的第一限制性酶,AdoMetDC则是关键代谢酶[9-10]。除了合成代谢外,细胞内的多胺含量还与其分解代谢有关。精胺和亚精胺在精胺/亚精胺乙酰转移酶和多胺氧化酶作用下,逐步逆向分解为腐胺,腐胺在二胺氧化酶的作用下,降解为丁二酸盐排出体外,从而维持细胞内正常的多胺含量[11]。
2 多胺对动物肠道稳态的作用肠道黏膜处于连接机体内外环境的重要位置,具有消化、吸收、分泌和防御等重要功能。肠道黏膜上皮细胞结构的完整性是执行其消化吸收功能的基本保证。多胺特有的分子结构决定了其在促进肠道黏膜的生长、发育、成熟、适应内环境以及修复损伤等方面具有重要作用。多胺可通过促进肠道发育、维持肠道黏膜屏障功能、提高肠道抗氧化和调整肠道代谢等实现其对肠道稳态的维持作用。
2.1 多胺与肠道发育 2.1.1 促进动物肠道上皮细胞的增殖分化肠道作为高等动物营养物质消化吸收的主要场所,其黏膜层上的隐窝-绒毛结构是肠道结构和功能的基本单元。肠道隐窝干细胞具有强烈的增殖潜能,是成熟上皮细胞的前身。肠道绒毛上成熟的上皮细胞就是由隐窝干细胞不断增殖、迁移和分化而来。肠道黏膜的生长发育即取决于肠上皮细胞的增殖和分化[12]。多胺促进肠道生长发育的重要体现之一就是促进肠道上皮细胞的增殖分化。所有的多胺均能促进细胞的增殖,精胺在低浓度时能显著促进细胞增殖,而亚精胺和腐胺则需要较高浓度才能显著促进细胞增殖[13]。精胺或亚精胺能通过促进肠道形态的成熟和功能的完善进而促进肠道的生长。在仔鼠中的研究表明,精胺能显著增加仔鼠十二指肠和回肠中柱状细胞和杯状细胞的数量[14],调控空肠和回肠的绒毛高度、绒毛宽度和隐窝深度[15-17]。同时,在仔猪上的试验也发现,精胺能线性提高仔猪小肠重量,十二指肠和空肠黏膜重量,黏膜蛋白质、DNA和RNA含量[18],增加绒毛高度和隐窝深度[19]。另外,饲喂不同时间段的精胺也能显著提高哺乳仔猪空肠和回肠的绒毛高度、绒毛宽度和绒毛表面积等[20]。这些绒毛的增生和肠黏膜面积的增大使肠道能够适应日益增加的营养供给。
2.1.2 提高动物肠道的消化酶活性肠黏膜细胞迁移出隐窝后便逐渐分化,合成具有消化和吸收功能的相关酶类,如碱性磷酸酶、乳糖酶、蔗糖酶和麦芽糖酶等。乳糖酶是哺乳期肠道的主要消化酶,而蔗糖酶和麦芽糖酶是断奶后肠道的主要消化酶。小肠刷状缘酶谱特别是乳糖酶活性的降低、麦芽糖酶和蔗糖酶等活性的增加是哺乳动物断奶后肠道功能成熟的重要标志之一[21]。有学者研究表明,多胺能显著提高小鼠肠道中麦芽糖酶和蔗糖酶活性而降低乳糖酶活性[22]。同时,饲喂精胺也能显著提高哺乳仔猪空肠和回肠中蔗糖酶和麦芽糖酶的活性,显著降低乳糖酶活性[20]。除二糖酶外,碱性磷酸酶和二胺氧化酶在肠道发育过程中也具有重要作用。外源性精胺能增加小鼠空肠碱性磷酸酶活性而降低回肠碱性磷酸酶活性[23]。同时,饲喂精胺还能显著提高哺乳仔猪空肠和回肠中二胺氧化酶活性[20]。外源多胺影响肠道二糖酶、碱性磷酸酶和二胺氧化酶活性的研究表明,多胺能通过调节肠道不同的消化酶活性来促进肠道的发育成熟,这对幼龄动物适应离乳前后食物成分的巨大差异具有重要的意义。
2.1.3 调节肠道发育的可能途径目前,有关多胺调节肠道细胞增殖发育途径的报道较少,仅发现多胺可以通过调节人抗原R (human antigen R,HuR)和Jun同源家族成员D (Jun homolog gene family member D, JunD)等相关基因表达的途径来促进肠道发育(图 1[24-25])。探讨多胺调节基因表达的方式多采用多胺耗竭途径,在针对多胺合成代谢关键酶的抑制剂中最具代表性的是特异性靶向ODC的抑制剂--二氟甲基鸟氨酸(difluoromethylornithine,DFMO),它能通过不可逆的抑制ODC活性、抑制多胺合成而耗竭细胞内多胺。
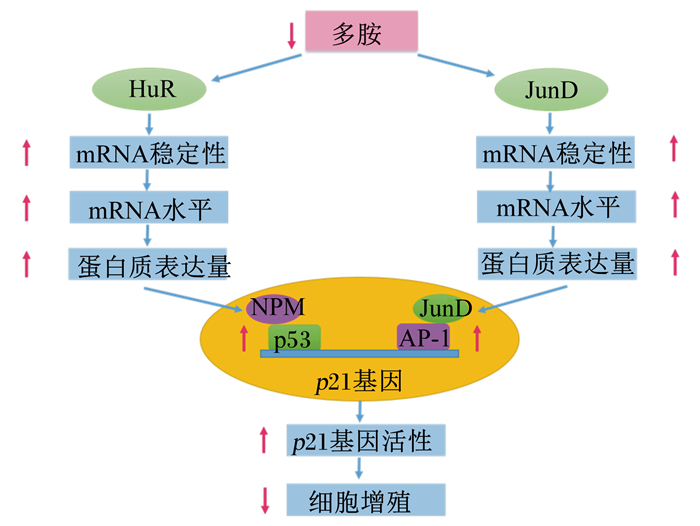
|
HuR:人抗原R human antigen R; JunD: Jun同源家族成员D Jun homolog gene family member D; NPM:核仁磷酸蛋白nucleophosmin; p53:抑癌蛋白53 tumor suppressor protein 53; AP-1:激活蛋白1 activator protein-1; p21: Ras同源家族成员21 Ras homolog gene family member 21. 图 1 多胺耗竭抑制肠道细胞增殖分化信号通路 Figure 1 Signaling pathway following polyamine depletion in growth inhibition of intestinal cell proliferation[24-25] |
HuR是基因转录后的关键调节器,对富含U和AU的mRNA具有较大亲和力和绑定作用,还可以稳定和调节mRNA的翻译[26]。当多胺耗竭时,肠道上皮细胞HuR易位到细胞质,使胞质积累的HuR水平显著提高,但在DFMO处理的同时加入腐胺,胞质积累的HuR水平降低[27-28]。同时,HuR能够通过其3′-非编码区或编码区绑定核仁磷酸蛋白(nucleophosmin,NPM)和抑癌蛋白53(tumor suppressor protein 53,p53)等的mRNA,从而影响NPM和p53基因的表达[24, 29]。p53基因的表达与细胞的生长状态密切相关[3]。DFMO处理肠上皮细胞IEC-6后,p53基因表达量显著增加[30-32]。另外,Zou等[33]发现,多胺耗竭引起的p53基因表达增加与NPM相关。NPM是一种多功能蛋白,参与调控p53蛋白的活性。多胺耗竭后会提高细胞中NMP基因表达和NPM蛋白核转位,使细胞中NPM与p53形成NPM/p53复合体[33]。HuR能在多胺耗竭的情况下通过增加复合体的表达与稳定性,从而抑制肠上皮细胞的增殖。并且,有学者还指出,当用多胺类似物DENSPM处理IEC-6细胞后,细胞中多胺含量降低的同时p53和p21基因表达增加[9]。这些研究结果说明,当细胞多胺含量降低时,能通过增加RNA结合蛋白的HuR的细胞质水平来稳定抑生长基因的mRNA,使其诱导产生蛋白质积累。增加的生长抑制蛋白如p53和NPM水平,再提高细胞周期停滞基因如p21的转录,从而使细胞增殖受到抑制,并抑制小肠黏膜的生长。
2.1.3.2 JunD途径JunD是Jun家族中的一员,同时也是激活蛋白1(activator protein-1,AP-1)转录因子的主要组成部分[34]。AP-1在细胞增殖、分化和凋亡上具有重要作用,但JunD却是一个作用相反的AP-1因子,其基因表达量的增加会降低细胞的增殖分化,使细胞在细胞周期中G0/G1期的比例增加[35]。当多胺耗竭后,小肠中JunD/AP-1活性显著增加,JunD/AP-1活性的增加主要是由于JunD基因表达增加,因为在IEC-6细胞多胺耗竭后,JunD mRNA和JunD蛋白水平显著增加[36]。Li等[25]研究表明,DFMO抑制细胞多胺后,JunD基因的转录没有增加,但JunD mRNA的半衰期增大到4 h。而在DFMO抑制多胺的同时添加亚精胺,JunD mRNA的半衰期降低至60 min,其mRNA的稳定性降低。另外,有学者还研究发现,DFMO耗竭IEC-6细胞多胺后,Ras同源家族成员21(Ras homolog gene family member 21,p21) mRNA水平增加,并且当用JunD的反义寡聚物降低JunD蛋白水平时,p21蛋白水平显著降低[25]。这些研究结果说明,多胺主要是影响JunD基因转录后过程,通过调节相应的mRNA的稳定性来诱导JunD mRNA和JunD蛋白水平的增加。增加的JunD蛋白又通过激活p21启动子来增加p21基因的表达,从而抑制细胞周期蛋白的活性,并抑制肠上皮细胞的增殖。
2.2 多胺与肠道黏膜屏障功能肠道黏膜屏障功能是指肠道上皮具有分隔肠腔内物质,防止致病性抗原侵入的功能。正常肠道屏障功能的维持主要依赖于肠道黏膜物理屏障、化学屏障、免疫屏障和微生物屏障。多胺对肠道屏障功能的维持体现在对肠道黏膜物理屏障、免疫屏障和微生物屏障调节上。
2.2.1 对肠道黏膜物理屏障的调节肠黏膜物理屏障主要包括紧密连接、黏附连接、缝隙连接和桥粒连接等,其中紧密连接主要是由细胞质蛋白和跨膜蛋白组成。细胞质蛋白主要有带状闭合蛋白(zonula occludens,ZO)家族的ZO-1、ZO-2和ZO-3蛋白,跨膜蛋白主要有咬合蛋白(occludin)和闭合蛋白(claudin)。黏着连接主要是由E-钙黏附蛋白(E-cadherin,E-cad)组成,E-cad是一种同质同嗜的钙依赖性跨膜糖蛋白,参与维持上皮细胞的极性、组织器官的发育和损伤修复等。多胺对肠道黏膜上皮屏障的调节主要体现在肠道紧密连接相关蛋白和E-cad的表达调控等方面。在尾型同源盒基因2(CDX2)转染的IEC-6细胞中,多胺耗竭显著降低ZO-1、ZO-2水平。但当DFMO处理细胞中加入亚精胺时,肠道屏障损坏情况得到改善[37]。同时,多胺耗竭会显著降低occludin含量但对其mRNA的表达无影响。当DFMO处理细胞中加入亚精胺时,肠道屏障损坏情况得到改善[37]。这说明多胺在促进ZO-1、ZO-2和occludin的合成和稳定性的维持上具有重要作用。另外,当正常IEC-6细胞多胺耗竭时,细胞内游离Ca2+浓度和E-cad的表达都降低,但这些情况都在添加多胺后得到改善。并且,在多胺缺乏的细胞中,通过Ca2+通道提高细胞内游离Ca2+浓度会增加E-cad的表达[38]。由此说明,多胺既可以通过调节细胞质蛋白和跨膜蛋白来影响肠道紧密连接,还可以通过改变E-cad依赖性黏着连接来调控肠道黏膜的物理屏障。
2.2.2 对肠道黏膜免疫屏障的调节肠道不仅是动物体内最大的消化吸收器官,同时也是体内最大的免疫器官。多胺作为生命物质的组成成分之一,可通过多条途径对肠道免疫系统发挥重要作用。首先,多胺能够促进幼龄动物肠道免疫系统的提前成熟。Pérez-Cano等[39]给哺乳仔鼠的母乳中添加精胺和亚精胺后发现,精胺和亚精胺能够通过促进小肠上皮内淋巴细胞CD8细胞的成熟和提高成熟固有层淋巴细胞CD4细胞的比例来改善仔鼠的免疫系统。同时,多胺作为内源性免疫调节因子,还能够通过调节肠道细胞因子来发挥抗炎作用。有研究表明,精胺能够抑制肿瘤坏死因子(TNF)、白细胞介素(IL)-1、IL-6、巨噬细胞炎性蛋白(MIP)-1α和MIP-1β等促炎性因子的合成[40],阻止由细菌内毒素引起的巨噬细胞中一氧化氮(NO)的产生[41-42],缓解由脂多糖诱导的肠损伤中IL-10含量的增加[43]。上述研究表明,多胺可通过促进肠道免疫系统的成熟和调节免疫因子等发挥免疫作用,但其分子机制还有待进一步研究。
2.2.3 对肠道微生态屏障的调节肠道作为机体最大的细菌库,其中附植有种类繁多的微生物,动物的健康和肠道功能的正常运转与肠道菌群结构息息相关。肠道菌群在长期的进化过程中构成了一个由微生物、宿主和环境三者之间呈动态平衡的统一体。多胺具有显著影响肠道菌群结构组成及其活动的作用。在小鼠配方乳中添加多胺后,小鼠肠道中双歧杆菌、乳酸杆菌和梭状芽孢杆菌等数量显著增加,促进其形成健康的黏膜状态[44]。同时,多胺还能调节新生BALB/cOlaHsd鼠肠道菌群中的乳酸杆菌、双歧杆菌、拟杆菌-普雷沃氏菌和梭状芽孢杆菌水平,促进肠道健康[45]。另外,断奶仔猪饲粮中添加腐胺能显著提高结肠内容物的乳酸杆菌数量,显著降低大肠杆菌数量和仔猪腹泻指数,显著提高小肠中段肠壁ODC活性[46]。因此说明,多胺可能是这些微生物的促生长因子,可以在刺激肠道黏膜细胞增殖和分化的同时有利于调控相关微生物菌群,但多胺调控肠道微生态的分子机理还有待进一步研究。
2.3 多胺与肠道抗氧化动物在健康状态下,体内的氧化能力与抗氧化能力处于动态平衡,但当细胞内蓄积大量自由基时,自由基在与蛋白质、脂肪、核苷酸和碳水化合物等分子发生强烈反应的同时使之变性,引起细胞凋亡、细胞膜的通透性和屏障功能改变以及免疫损伤等[47]。多胺作为机体重要的营养因子,也具有一定的抗氧化功能。Shoji等[48]通过体外试验指出精胺能缓解H2O2对小肠上皮细胞IEC-6造成的氧化损伤。同时,Liu等[49]在氧化应激鼠上的试验也表明精胺在调节氧化应激鼠的代谢中具有重要作用,灌服精胺可以部分缓解由氧化应激所引起的脂质代谢和氨基酸代谢变化。另外,Cao等[15]也研究发现,精胺能够通过提高哺乳仔鼠空肠抗脂质过氧化的能力、氧自由基清除能力、增强酶抗氧化系统和非酶抗氧化系统等来加强空肠抗氧化能力。因此,多胺可提高动物肠道的抗氧化。
2.4 多胺与肠道代谢代谢是生命活动中所有生物化学变化的总称,代谢活动是生命活动的本质特征和物质基础。代谢产物是生命过程中发生生物化学反应的产物,能够从某种程度上反映生命过程的本质。已知生物的表型或整体状况与代谢产物密切相关,多胺对机体生理功能的改变与代谢产物的改变相一致。外源性精胺能影响哺乳仔鼠脂质代谢、能量代谢、氨基酸代谢、微生物代谢以及肠道渗透压等回肠代谢过程,对肠道组织代谢过程产生影响[50]。精胺也能改变断奶大鼠血液中的代谢过程,包括细胞膜代谢、脂质代谢、葡萄糖代谢、氨基酸代谢和微生物代谢等,在调节大鼠血液代谢过程上具有重要作用[51]。同时,精胺还能促进断奶仔鼠肠道氨基酸代谢加强蛋白质合成,促进磷脂合成保护细胞膜完整,促进葡萄糖-丙氨酸循环,影响微生物的生长代谢,从而提高断奶阶段仔鼠肠道健康[52]。另外,在由敌草快(diquat)诱导的氧化应激条件下,精胺能部分消除由氧化应激引起的氨基酸和脂质代谢的变化,在调节氧化应激大鼠的代谢上具有重要作用[53]。由此可以说明,在正常状态或氧化应激条件下,多胺都可以通过改变相关物质代谢过程来调整肠道的整体代谢,促进肠道健康。
3 小结近年来,与多胺相关的研究结果已经证实多胺能通过促进动物肠道上皮细胞的增殖分化、提高肠道消化酶活性、维持肠道黏膜物理屏障、调节肠道免疫、改善肠道微生态、提高肠道抗氧化和调控肠道代谢等实现其对肠道稳态的维持作用。并且,在多胺对肠道发育调节作用机理的研究方面也取得了一定的进展,但有关多胺调节肠道稳态其他方面的精确机制仍不清楚。例如:多胺调节肠道屏障与哪些信号途径有关?多胺改善肠道微生态和调整肠道代谢的具体内在分子机制如何?随着对多胺的深入研究,通过阐明多胺维持肠道稳态的作用机制,将为增强动物肠道健康、提高畜禽生产性能和促进畜牧业发展提供新思路。
| [1] | 刘小伟, 孙瑞娟, 董尔丹. 肠道稳态及相关疾病研究现状与趋势[J]. 生理科学进展, 2013 , 44 (3) :206 –212. |
| [2] | WANG J Y, MCCORMACK S A, VIAR M J, et al. Decreased expression of protooncogenes c-fos, c-myc, and c-jun following polyamine depletion in IEC-6 cells[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 1993 , 265 (2) : G331 –G338. |
| [3] | DEPPERT W. The yin and yang of p53 in cellular proliferation[J]. Seminars in Cancer Biology, 1994 , 5 (3) : 187 –202. |
| [4] | WOSTER P M.Polyamine structure and synthetic analogs[M]//WANG J Y, CASERO R A, Jr.Polyamine cell signaling:physiology, pharmacology, and cancer research.Totowa:Humana Press Inc., 2006:3-24. |
| [5] | LARQUÉ E, SABATER-MOLINA M, ZAMORA S. Biological significance of dietary polyamines[J]. Nutrition, 2007 , 23 (1) : 87 –95. DOI: 10.1016/j.nut.2006.09.006 |
| [6] | WU G Y, FLYNN N E, KNABE D A. Enhanced intestinal synthesis of polyamines from proline in cortisol-treated piglets[J]. American Journal of Physiology:Endocrinology and Metabolism, 2000 , 279 (2) : E395 –E402. |
| [7] | EVAGELIOU N F, HOGARTY M D. Disrupting polyamine homeostasis as a therapeutic strategy for neuroblastoma[J]. Clinical Cancer Research, 2009 , 15 (19) : 5956 –5961. DOI: 10.1158/1078-0432.CCR-08-3213 |
| [8] | MOSCHOU P N, ROUBELAKIS-ANGELAKIS K A. Polyamines and programmed cell death[J]. Journal of Experimental Botany, 2014 , 65 (5) : 1285 –1296. DOI: 10.1093/jxb/ert373 |
| [9] | RAY R M, ZIMMERMAN B J, MCCORMACK S A, et al. Polyamine depletion arrests cell cycle and induces inhibitors p21Waf1/Cip1, p27Kip1, and p53 in IEC-6 cells[J]. American Journal of Physiology:Cell Physiology, 1999 , 276 (3) : C684 –C691. |
| [10] | KRAUSS M, LANGNAESE K, RICHTER K, et al. Spermidine synthase is prominently expressed in the striatal patch compartment and in putative interneurones of the matrix compartment[J]. Journal of Neurochemistry, 2006 , 97 (1) : 174 –189. DOI: 10.1111/jnc.2006.97.issue-1 |
| [11] | IGARASHI K, KASHIWAGI K. Modulation of cellular function by polyamines[J]. The International Journal of Biochemistry & Cell Biology, 2010 , 42 (1) : 39 –51. |
| [12] | CUMMINS A G, THOMPSON F M. Effect of breast milk and weaning on epithelial growth of the small intestine in humans[J]. Gut, 2002 , 51 (5) : 748 –754. DOI: 10.1136/gut.51.5.748 |
| [13] | FUSI E, BALDI A, CHELI F, et al. Effects of putrescine, cadaverine, spermine, spermidine and β-phenylethylamine on cultured bovine mammary epithelial cells[J]. Italian Journal of Animal Science, 2009 , 7 (2) : 131 –140. |
| [14] | GERNER E W. Impact of dietary amino acids and polyamines on intestinal carcinogenesis and chemoprevention in mouse models[J]. Biochemical Society Transactions, 2007 , 35 (2) : 322 –325. DOI: 10.1042/BST0350322 |
| [15] | CAO W, LIU G M, FANG T T, et al. Effects of spermine on the morphology, digestive enzyme activities, and antioxidant status of jejunum in suckling rats[J]. RSC Advances, 2015 , 5 (93) : 76607 –76614. DOI: 10.1039/C5RA15793E |
| [16] | DELOYER P, PEULEN O, DANDRIFOSSE G. Intestinal effects of long-lasting spermine ingestion by suckling rats[J]. Experimental Physiology, 2005 , 90 (6) : 901 –908. DOI: 10.1113/expphysiol.2005.031583 |
| [17] | PEULEN O, DELOYER P, DANDRIFOSSE G. Short-term effects of spermine ingestion on the small intestine:a comparison of suckling and weaned rats[J]. Reproduction Nutrition Development, 2004 , 44 (4) : 353 –364. DOI: 10.1051/rnd:2004040 |
| [18] | CHENG Z B, LI D F, XING J J, et al. Oral administration of spermine advances intestinal maturation in sucking piglets[J]. Animal Science, 2006 , 82 (5) : 621 –626. DOI: 10.1079/ASC200690 |
| [19] | SABATER-MOLINA M, LARQUÉ E, TORRELLA F, et al. Effects of dietary polyamines at physiologic doses in early-weaned piglets[J]. Nutrition, 2009 , 25 (9) : 940 –946. DOI: 10.1016/j.nut.2009.01.017 |
| [20] | FANG T T, LIU G M, CAO W, et al. Spermine:new insights into the intestinal development and serum antioxidant status of suckling piglets[J]. RSC Advances, 2016 , 6 (37) : 31323 –31335. DOI: 10.1039/C6RA05361K |
| [21] | BARSZCZ M, SKOMIAŁ J. The development of the small intestine of piglets-chosen aspects[J]. Journal of Animal and Feed Sciences, 2011 , 20 (1) : 3 –15. DOI: 10.22358/jafs/66152/2011 |
| [22] | KAOUASS M, DELOYER P, WERY I, et al. Analysis of structural and biochemical events occurring in the small intestine after dietary polyamine ingestion in suckling rats[J]. Digestive Diseases and Sciences, 1996 , 41 (7) : 1434 –1444. DOI: 10.1007/BF02088570 |
| [23] | PEULEN O, GHARBI M, POWROZNIK B, et al. Differential effect of dietary spermine on alkaline phosphatase activity in jejunum and ileum of unweaned rats[J]. Biochimie, 2004 , 86 (7) : 487 –493. DOI: 10.1016/j.biochi.2004.06.002 |
| [24] | WANG J Y. Polyamines and mRNA stability in regulation of intestinal mucosal growth[J]. Amino Acids, 2007 , 33 (2) : 241 –252. DOI: 10.1007/s00726-007-0518-z |
| [25] | LI L, LIU L, RAO J N, et al. JunD stabilization results in inhibition of normal intestinal epithelial cell growth through P21 after polyamine depletion[J]. Gastroenterology, 2002 , 123 (3) : 764 –779. DOI: 10.1053/gast.2002.35386 |
| [26] | DE SILANES I L, ZHAN M, LAL A, et al. Identification of a target RNA motif for RNA-binding protein HuR[J]. Proceedings of The National Academy of Sciences of The United States of America, 2004 , 101 (9) : 2987 –2992. DOI: 10.1073/pnas.0306453101 |
| [27] | ZHANG X, ZOU T T, RAO J N, et al. Stabilization of XIAP mRNA through the RNA binding protein HuR regulated by cellular polyamines[J]. Nucleic Acids Research, 2009 , 37 (22) : 7623 –7637. DOI: 10.1093/nar/gkp755 |
| [28] | ZOU T T, MAZAN-MAMCZARZ K, RAO J N, et al. Polyamine depletion increases cytoplasmic levels of RNA-binding protein HuR leading to stabilization of nucleophosmin and p53 mRNAs[J]. The Journal of Biological Chemistry, 2006 , 281 (28) : 19387 –19394. DOI: 10.1074/jbc.M602344200 |
| [29] | RAO J N, WANG J Y. Polyamines in the regulation of mucosal growth[M]. San Rafael: Morgan and Claypool Life Sciences, 2010 . |
| [30] | LI L, LI J, RAO J N, et al. Inhibition of polyamine synthesis induces p53 gene expression but not apoptosis[J]. American Journal of Physiology:Cell Physiology, 1999 , 276 (4) : C946 –C954. |
| [31] | LIU L, GUO X, RAO J N, et al. Polyamine-modulated c-Myc expression in normal intestinal epithelial cells regulates p21Cip1 transcription through a proximal promoter region[J]. Biochemical Journal, 2006 , 398 (2) : 257 –267. DOI: 10.1042/BJ20060217 |
| [32] | KRAMER D L, VUJCIC S, DIEGELMAN P, et al. Polyamine analogue induction of the p53-p21WAF1/CIP1-Rb pathway and G1 arrest in human melanoma cells[J]. Cancer Research, 1999 , 59 (6) : 1278 –1286. |
| [33] | ZOU T T, RAO J N, LIU L, et al. Polyamine depletion induces nucleophosmin modulating stability and transcriptional activity of p53 in intestinal epithelial cells[J]. American Journal of Physiology:Cell Physiology, 2005 , 289 (3) : C686 –C696. DOI: 10.1152/ajpcell.00085.2005 |
| [34] | RYDER K, LANAHAN A, PEREZ-ALBUERNE E, et al. Jun-D:a third member of the jun gene family[J]. Proceedings of the National Academy of Sciences of the United States of America, 1989 , 86 (5) : 1500 –1503. DOI: 10.1073/pnas.86.5.1500 |
| [35] | PFARR C M, MECHTA F, SPYROU G, et al. Mouse JunD negatively regulates fibroblast growth and antagonizes transformation by ras[J]. Cell, 1994 , 76 (4) : 747 –760. DOI: 10.1016/0092-8674(94)90513-4 |
| [36] | PATEL A R, WANG J Y. Polyamine depletion is associated with an increase in JunD/AP-1 activity in small intestinal crypt cells[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 1999 , 276 (2) : G441 –G450. |
| [37] | GUO X, RAO J N, LIU L, et al. Polyamines are necessary for synthesis and stability of occludin protein in intestinal epithelial cells[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2005 , 288 (6) : G1159 –G1169. DOI: 10.1152/ajpgi.00407.2004 |
| [38] | GUO X, RAO J N, LIU L, et al. Regulation of adherens junctions and epithelial paracellular permeability:a novel function for polyamines[J]. American Journal of Physiology:Cell Physiology, 2003 , 285 (5) : C1174 –C1187. DOI: 10.1152/ajpcell.00015.2003 |
| [39] | PÉREZ-CANO F J, GONZÁLEZ-CASTRO A, CASTELLOTE C, et al. Influence of breast milk polyamines on suckling rat immune system maturation[J]. Developmental & Comparative Immunology, 2010 , 34 (2) : 210 –218. |
| [40] | GOLDBERG R F, AUSTEN W G Jr, ZHANG X B, et al. Intestinal alkaline phosphatase is a gut mucosal defense factor maintained by enteral nutrition[J]. Proceedings of the National Academy of Sciences of The United States of America, 2008 , 105 (9) : 3551 –3556. DOI: 10.1073/pnas.0712140105 |
| [41] | ALBERT A, MARGARIT J, JULIA V, et al. Morphology and mucosal biochemistry of gastroschisis intestine in urine-free amniotic fluid[J]. Journal of Pediatric Surgery, 2003 , 38 (8) : 1217 –1220. DOI: 10.1016/S0022-3468(03)00271-9 |
| [42] | SERENA A, HEDEMANN M S, KNUDSEN K E B. Feeding high fibre diets changes luminal environment and morphology in the intestine of sows[J]. Livestock Science, 2007 , 109 (1/2/3) : 115 –117. |
| [43] | VAN BEERS-SCHREURS H M G, NABUURS M J A, VELLENGA L, et al. Weaning and the weanling diet influence the villous height and crypt depth in the small intestine of pigs and alter the concentrations of short-chain fatty acids in the large intestine and blood[J]. The Journal of Nutrition, 1998 , 128 (6) : 947 –953. |
| [44] | GÓMEZ-GALLEGO C, COLLADO M C, ILO T, et al. Infant formula supplemented with polyamines alters the intestinal microbiota in neonatal BALB/cOlaHsd mice[J]. The Journal of Nutritional Biochemistry, 2012 , 23 (11) : 1508 –1513. DOI: 10.1016/j.jnutbio.2011.10.003 |
| [45] | GÓMEZ-GALLEGO C, COLLADO M C, PÉREZ G, et al. Resembling breast milk:influence of polyamine-supplemented formula on neonatal BALB/cOlaHsd mouse microbiota[J]. British Journal of Nutrition, 2014 , 111 (6) : 1050 –1058. DOI: 10.1017/S0007114513003565 |
| [46] | 张翥, 董国忠, 张文火, 等. 断奶仔猪饲粮中添加腐胺的营养生理效应研究[J]. 中国畜牧杂志, 2011 , 47 (9) :69 –72. |
| [47] | LALLÈS J-P. Intestinal alkaline phosphatase:multiple biological roles in maintenance of intestinal homeostasis and modulation by diet[J]. Nutrition Reviews, 2010 , 68 (6) : 323 –332. DOI: 10.1111/nure.2010.68.issue-6 |
| [48] | SHOJI H, OGUCHI S, FUJINAGA S, et al. Effects of human milk and spermine on hydrogen peroxide-induced oxidative damage in IEC-6 cells[J]. Journal of Pediatric Gastroenterology and Nutrition, 2005 , 41 (4) : 460 –465. DOI: 10.1097/01.mpg.0000176180.89261.bf |
| [49] | LIU G M, YAN T, FANG T T, et al. Nutrimetabolomic analysis provides new insights into spermine-induced ileum-system alterations for suckling rats[J]. RSC Advances, 2015 , 5 (60) : 48769 –48778. DOI: 10.1039/C5RA01507C |
| [50] | 商宏伟, 孙盛斌, 肖颖彬, 等. 大鼠体外循环后血浆二胺氧化酶与小肠黏膜基质蛋白变化的相关性研究[J]. 中国体外循环杂志, 2013 , 11 (2) :111 –115. |
| [51] | LIU G M, FANG T T, YAN T, et al. Metabolomic strategy for the detection of metabolic effects of spermine supplementation in weaned rats[J]. Journal of Agricultural and Food Chemistry, 2014 , 62 (36) : 9035 –9042. DOI: 10.1021/jf500882t |
| [52] | 严涛.精胺对哺乳和氧化应激仔鼠营养代谢与肠道发育的影响[D].硕士学位论文.雅安:四川农业大学, 2014:23-26. |
| [53] | LIU G M, FANG T T, YAN T, et al. Systemic responses of weaned rats to spermine against oxidative stress revealed by a metabolomic strategy[J]. RSC Advances, 2014 , 4 (100) : 56766 –56778. DOI: 10.1039/C4RA09975C |




