2. 宁波大学海洋学院, 宁波 315211
2. School of Marine Sciences, Ningbo University, Ningbo 315211, China
鱼粉是水产动物饲料的主要组成部分[1],通常占饲料成本的1/2以上。近年来,水产养殖业飞速发展,鱼粉需求量日益增大,且随着海洋渔业资源的日益衰退,使得鱼粉价格持续走高。为缓解供求矛盾、降低饲料成本、提高经济效益,国内外学者就鱼粉替代进行了大量研究,这些研究表明,在饲料中使用其他廉价蛋白质源替代鱼粉是可行的[2]。豆粕是水产动物饲料中应用最为广泛的植物性蛋白质源,但其含有多种抗营养因子,不利于鱼类的消化吸收,限制了其对鱼粉替代水平的提高[3]。豆粕经过微生物发酵可有效分解和破坏豆粕中的抗营养因子,提高营养价值[4-7]。对石斑鱼(Epinephelus coioides)[8]、南美白对虾(Penaeus vannamei Boone)[9]、方正鲫(Carassius auratus gibelio)[10]、虹鳟(Oncorhynchus mykiss)[11]的研究证实:在水产动物饲料利用效果上发酵豆粕优于普通豆粕。
大黄鱼(Larimichthys crocea),属硬骨鱼纲(Osteichthyes),鲈形目(Perciformes),石首鱼科(Sciaenidae),黄鱼属(Larimichthys),为传统“四大海产”之一,是我国近海主要养殖经济鱼类。随着大黄鱼人工繁育的成功,大黄鱼逐渐成为我国主要的海水养殖鱼类。为应对当前鱼粉价格高昂、供求紧张等问题,国内学者对其人工配合饲料进行了鱼粉的替代研究[12-15],但尚未见发酵豆粕替代鱼粉的报道。因此,本试验用发酵豆粕替代大黄鱼幼鱼饲料中不同比例的鱼粉,研究其对大黄鱼幼鱼生长性能、体成分、血清生化指标及肝脏组织形态的影响,探索发酵豆粕替代大黄鱼幼鱼饲料中鱼粉的适宜比例,丰富大黄鱼饲料营养相关数据库,为大黄鱼幼鱼全价配合饲料的配制提供理论支撑。
1 材料与方法 1.1 试验设计与试验饲料以鱼粉(秘鲁)、小麦蛋白粉为主要蛋白质源,鱼油、大豆油和大豆卵磷脂为主要脂肪源,配制含40%鱼粉的基础饲料。以发酵豆粕(购自宁波天邦股份有限公司)替代基础饲料中0(R0组,作为对照组)、15%(R15组)、30%(R30组)、45%(R45组)、60%(R60组)、75%(R75组)的鱼粉,并在除R0组饲料外的各饲料中添加适量的晶体氨基酸(赖氨酸和蛋氨酸),以消除限制性氨基酸的影响,共配制6种等氮(蛋白质水平为45%)等脂(脂肪水平为10%)的试验饲料。鱼粉和发酵豆粕的必需氨基酸组成见表 1,试验饲料组成及营养水平见表 2,试验饲料的氨基酸组成见表 3。所有饲料原料分别粉碎过80目筛,然后按逐级扩大的方法混合均匀,放入搅拌机加水搅拌,使其充分湿润;用双螺杆挤条机(华南理工大学,F-26Ⅱ型)制作成形,然后用制粒机加工成2和4 mm 2种粒径的颗粒饲料,将颗粒饲料置入90 ℃烘箱中熟化30 min,自然风干,塑封后放入-20 ℃冰箱保存。
|
|
表 1 鱼粉和发酵豆粕的必需氨基酸组成(干物质基础) Table 1 Essential amino acid composition of fish meal and FSM (DM basis) |
|
|
表 2 试验饲料组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 3 试验饲料的氨基酸组成(干物质基础) Table 3 Amino acid composition of experimental diets (DM basis) |
养殖试验在浙江省象山县西沪港区进行,正式试验开始前将试验用大黄鱼幼鱼放入3 m×6 m×3 m海水网箱中暂养2周,使用商业饲料进行投喂使之适应人工配合饲料。2周后,挑选体格强健、大小均一的大黄鱼幼鱼[平均体重(10.49±0.03) g]随机分为5组,每组随机分配3个网箱(1.5 m×1.5 m×2.0 m),每个网箱放养60尾,每天饱食投喂2次(05:00和17:00),养殖周期为56 d。试验期间水温25.5~29.5 ℃,盐度27‰~30‰,溶解氧含量在7 mg/L以上。
1.3 样品采集和指标分析 1.3.1 样品采集56 d的养殖试验结束后,对试验鱼饥饿24 h,以丁香酚(1 : 1 000)麻醉,然后计数,称重。分别从每个网箱随机取5尾鱼,用一次性无菌注射器(2 mL)自尾部静脉取血,注入常规采血管,于4 ℃条件下静置24 h,然后离心(3 000 r/min,4 ℃)10 min,取血清并保存于-20 ℃冰箱中,用于血清生化指标测定。每个网箱另随机取3尾鱼,测量体长、体重后,取内脏团和肝脏称重,用于计算肝体比、脏体比和肥满度。每个网箱再随机取2尾鱼,解剖得其肝脏,清理完表面的脂肪和结缔组织后放入波恩试液中固定保存,所有样品固定24 h后,用70%乙醇清洗,并保存于70%乙醇中。每个网箱再随机另取5尾鱼,置于-20 ℃冰箱保存,用于常规营养成分分析。
1.3.2 常规营养成分分析饲料原料、试验饲料及鱼体常规营养成分的测定采用AOAC (1993)的方法。其中水分含量在105 ℃恒温烘箱中烘至恒重后测定,粗蛋白质含量采用半微量凯氏定氮法(总氮×6.25)测定,粗脂肪含量采用索氏抽提法测定,粗灰分含量于马福炉中550 ℃灼烧6 h后测定。
1.3.3 血清生化指标测定血清生化指标按照试剂盒说明书测定,所用试剂盒均购自南京建成生物工程研究所。
1.3.4 肝脏组织观察取出70%乙醇中保存的肝脏样品,然后酒精梯度脱水,石蜡包埋,组织切片机(Leica RM2135)切片,最后用苏木精-伊红(HE)染色法染色[16],显微镜下观察组织切片结构并拍照。
1.4 计算公式

|
式中:Wo表示初始体重;Wt表示终末体重;No表示初始网箱中鱼尾数;Nt表示终末网箱中鱼尾数;T表示总饲料量;S表示剩余饲料量;t表示试验天数(56 d);Wh表示肝脏重量;Wv表示内脏重量;L表示体长。
1.5 统计分析将试验数据用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),差异显著后进行Tukey’s多重比较,显著性水平设为P < 0.05。试验结果以“平均值±标准差”表示。
2 结果 2.1 发酵豆粕替代鱼粉对大黄鱼幼鱼生长性能的影响从表 4中可以看出,各组大黄鱼幼鱼的存活率无显著差异(P > 0.05),但随替代比例的增加有下降趋势;R0组末体重、特定生长率、增重率均显著高于R60、R75组(P < 0.05);饲料系数以R0组最低,显著低于R60、R75组(P < 0.05)。各组肝体比、脏体比、肥满度均无显著差异(P > 0.05)(表 5)。
|
|
表 4 发酵豆粕替代鱼粉对大黄鱼幼鱼生长指标的影响 Table 4 Effects of replacement of fish meal by FSM on growth indices of juvenile large yellow croaker |
|
|
表 5 发酵豆粕替代鱼粉对大黄鱼幼鱼形体指标的影响 Table 5 Effects of replacement of fish meal by FSM on somatic parameters of juvenile large yellow croaker |
从表 6中可以看出,各组大黄鱼幼鱼的全鱼粗蛋白质、粗脂肪和水分含量均无显著差异(P > 0.05);R60、R75组全鱼粗灰分含量显著高于其他各组(P < 0.05),其他组间差异不显著(P > 0.05)。
|
|
表 6 发酵豆粕替代鱼粉对黄鱼幼鱼体成分的影响(湿重基础) Table 6 Effects of replacement of fish meal by FSM on body composition of juvenile large yellow croaker (wet weight basis) |
从表 7中可以看出,R0组大黄鱼幼鱼血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLOB)的含量与其他组无显著差异(P > 0.05);R30组血清中TP、ALB、GLOB的含量最高,且显著高于R75组(P < 0.05)。血清中总胆固醇(TCHO)、甘油三酯(TG)和葡萄糖(GLU)的含量各组间无显著差异(P > 0.05),但发酵豆粕替代不同比例鱼粉后血清中CHOL的含量均有不同程度的降低。血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)的活力各组间均无显著差异(P > 0.05),但发酵豆粕替代不同比例鱼粉后血清中ALT活力均有不同程度的增加。
|
|
表 7 发酵豆粕替代鱼粉对大黄鱼幼鱼血清生化指标的影响 Table 7 Effects of replacement of fish meal by FSM on serum biochemical indices of juvenile large yellow croaker |
肝脏组织观察(图 1)显示:R0、R15和R30组肝细胞较为正常,但随着发酵豆粕替代鱼粉比例的进一步增加,肝细胞空泡化现象加剧;细胞内脂肪堆积加重,推动细胞核向细胞膜靠近;并且肝细胞核逐渐溶解或缺失,细胞崩解加剧,直至R75组时,肝细胞轮廓模糊,大片肝细胞核消失不见。
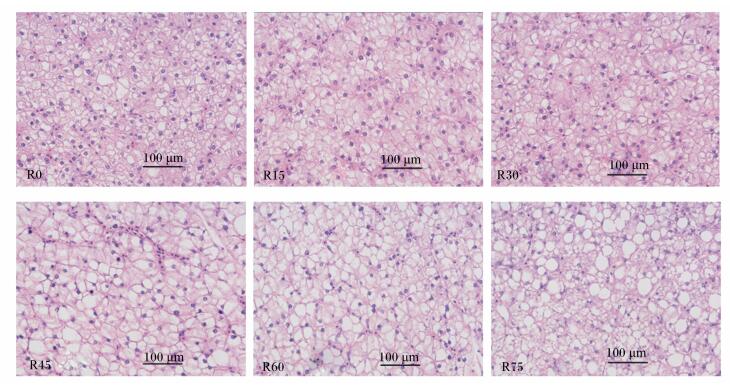
|
图 1 发酵豆粕替代鱼粉对大黄鱼幼鱼肝脏组织形态的影响(HE染色) Figure 1 Effects of replacement fish meal by FSM on liver tissue morphology of juvenile large yellow croaker (HE staining, 400×) |
与普通豆粕相比,发酵豆粕中粗蛋白质含量有所提高,蛋白质品质有了一定程度的提升[17],营养价值得到优化[18]。以往的研究指出,与普通豆粕相比,发酵豆粕可以提高对饲料中鱼粉的替代比例[19]。在本研究中,发酵豆粕替代45%的鱼粉不影响大黄鱼幼鱼的生长,可能原因是豆粕经过发酵使抗营养因子减少,并且提高了小肽含量,使得鱼体对发酵豆粕的消化吸收能力提高,从而提高了对鱼粉的替代比例。在饲料中添加适量的晶体氨基酸(赖氨酸和蛋氨酸)消除了限制性氨基酸的影响可能也是其原因之一[20-22]。例如,饲料中添加晶体氨基酸后,发酵豆粕替代黑鲷(Acanthopagrus schlegeli)幼鱼饲料中高达40%的鱼粉而不影响其正常生长[23];饲料中添加晶体氨基酸后,发酵豆粕甚至可以完全替代虹鳟[11]、日本沼虾(Macrobrachium nipponense)[24]饲料中的鱼粉而不对其生长产生负面影响。另有报道,在饲料中添加植酸酶[14]、复合益生菌等[25]也可以提高植物蛋白质源对鱼粉的替代比例。有研究发现,以植物蛋白质源替代水产动物饲料中的鱼粉,其生长率随着替代比例的升高而有下降趋势[20-21, 26]。本研究也得到相似结果:随着发酵豆粕替代鱼粉比例的升高,大黄鱼幼鱼的增重率、特定生长率呈现出下降的趋势,R60、R75组显著低于对照组(R0组)。其原因可能是过高比例发酵豆粕的添加降低了饲料的适口性,使得摄食率下降,从而不利于大黄鱼幼鱼的生长[27-28]。本研究还发现,发酵豆粕对鱼粉的替代比例对大黄鱼幼鱼的肝体比、脏体比、肥满度没有产生显著影响,这与刘兴旺等[28]在大菱鲆(Scophthatmus maximus L.)饲料中用大豆浓缩蛋白替代鱼粉的研究结果相似。
3.2 发酵豆粕替代鱼粉对大黄鱼幼鱼体成分的影响有研究指出,发酵豆粕替代鱼粉比例不影响鱼体粗蛋白质含量[9, 11]。本试验也观察到相似结果:发酵豆粕替代不同比例鱼粉对大黄鱼幼鱼的全鱼粗蛋白质、粗脂肪和水分含量没有产生显著影响。一些研究认为,随着植物蛋白质源添加量的增加,会引起鱼体粗脂肪含量的下降。如刘兴旺等[28]对大菱鲆的研究结果显示,鱼体粗脂肪含量随着鱼粉替代比例的增加而降低;García-Ortega等[29]对巨型石斑鱼(Epinephelus lanceolatus)的研究也发现这一趋势。推测其原因可能是大豆蛋白中的非淀粉多糖引起肠道病变,使脂肪的吸收下降所致。也有报道称,植物蛋白质源替代鱼粉不会对鱼体粗脂肪含量产生显著影响[30-31],这与本试验得到的结果相似。而石西等[16]认为,随着小球藻(Chlorella)替代鱼粉比例的升高,鲫鱼(Carassius auratus)肌肉粗脂肪含量呈现出上升趋势,肌肉粗蛋白质含量在低比例替代时升高,高比例替代时下降,这可能是由于不同蛋白质源以及鱼体脂肪代谢方式的不同会对肌肉粗脂肪含量产生不同的影响。本试验还发现,随着发酵豆粕替代鱼粉比例的升高,鱼体粗灰分含量呈现出上升趋势,这可能是发酵豆粕的添加增加了鱼体钙或磷的沉积所致,具体的作用机制需要进一步试验验证。
3.3 发酵豆粕替代鱼粉对大黄鱼幼鱼血清生化指标的影响血清TP在肝脏中合成,可以作为肝脏损伤的指示物,肝脏结构上的变化会引起血清TP含量的改变。在本研究中,发酵豆粕替代不同比例的鱼粉对大黄鱼幼鱼血清TP、ALB、GLOB含量无显著影响。有研究认为,植物蛋白质源替代鱼粉可能会影响鱼体内能量代谢,随着替代比例的增加而引起血清TCHO、TG含量的下降[32-34],这与本试验中血清中TCHO含量的变化一致,可能是发酵豆粕中大豆黄酮素作用的结果[35]。正常情况下ALT主要存在于肝脏细胞中,而AST主要存在于肝细胞线粒体,它们在血清中的活力很低,只有当细胞膜通透性增强或细胞坏死时才会大量进入血液,使血清中这2种酶的活力升高。由表 7可见,各组大黄鱼幼鱼血清AST和ALT活力并没有显著差异,但ALT活力随着替代比例的升高而升高,这可能与肝脏组织损伤有关,表明发酵豆粕替代鱼粉比例过高会引起肝脏组织损伤。
3.4 发酵豆粕替代鱼粉对大黄鱼幼鱼肝脏组织形态的影响有研究表明,饲料中植物蛋白质源的添加会降低肝脏的生理机能,肝脏发生病变时,脂蛋白合成减少,肝细胞内的脂肪不能及时转运出来,从而导致脂肪在肝脏堆积[36-37]。提高饲料脂肪水平也会引起脂肪在肝脏中的沉积,脂肪的大量沉积可能会导致脂肪肝[38]。Hu等[39]在鲈鱼(Lateolabrax japonicus)饲料中用混合动物蛋白质源替代鱼粉的研究发现,高替代(60%和80%)组肝细胞出现明显的脂肪性病变,肝细胞损伤严重。本试验对大黄鱼幼鱼肝脏组织学观察显示,R0、R15和R30组肝脏组织较为正常,但随着发酵豆粕替代鱼粉比例的进一步升高,肝细胞空泡化现象加剧,细胞核溶解消失,肝脏细胞病变加剧。这与石西等[16]对鲫鱼的研究结果相似。因此,在养殖实践中应该注意植物蛋白质源的适宜添加量。
发酵豆粕替代饲料(含40%鱼粉)中30%的鱼粉较为适宜,过高的替代比例会造成大黄鱼幼鱼肝脏组织病变,导致生长速度、存活率下降。
| [1] | OLSEN R L, HASAN M R. A limited supply of fishmeal:impact on future increases in global aquaculture production[J]. Trends in Food Science & Technology, 2012 , 27 (2) : 120 –128. |
| [2] | 周岐存, 麦康森, 刘永坚, 等. 动植物蛋白源替代鱼粉研究进展[J]. 水产学报, 2005 , 29 (3) :404 –410. |
| [3] | 刘利晓, 黄志伟, 许小友, 等. 微生物发酵对豆粕中抗营养因子及其营养价值的影响研究进展[J]. 河南畜牧兽医, 2014 , 35 (4) :8 –10. |
| [4] | 高美云, 张通, 刘宾, 等. 豆粕抗营养因子及其生物改性的研究[J]. 中国饲料, 2010 (3) :37 –41. |
| [5] | 胡瑞, 陈艳, 王之盛, 等. 复合益生菌发酵豆粕生产工艺参数的优化及酶菌联合发酵对豆粕品质的影响[J]. 动物营养学报, 2013 , 25 (8) :1896 –1903. |
| [6] | 陈广信, 曹赞, 高振华. 不同发酵豆粕营养价值及应用[J]. 中国畜牧兽医, 2014 , 41 (2) :111 –114. |
| [7] | 杨玉娟, 姚怡莎, 秦玉昌, 等. 豆粕与发酵豆粕中主要抗营养因子调查分析[J]. 中国农业科学, 2016 , 49 (3) :573 –580. |
| [8] | 罗智, 刘永坚, 麦康森, 等. 石斑鱼配合饲料中发酵豆粕和豆粕部分替代白鱼粉的研究(英文)[J]. 水产学报, 2004 , 28 (2) :175 –181. |
| [9] | 冷向军, 王文龙, 周洪琪, 等. 不同大豆产品替代鱼粉饲养南美白对虾的试验[J]. 淡水渔业, 2006 , 36 (3) :47 –49. |
| [10] | 黄雄斌, 李国富. 方正鲫饲料中发酵豆粕和豆粕替代鱼粉的研究[J]. 湖南农业科学, 2010 (13) :143 –145. |
| [11] | YAMAMOTO Y, IWASHITA Y, MATSUNARI H, et al. Influence of fermentation conditions for soybean meal in a non-fish meal diet on the growth performance and physiological condition of rainbow trout Oncorhynchus mykiss[J]. Aquaculture, 2010 , 309 (1/2/3/4) : 173 –180. |
| [12] | AI Q H, MAI K S, TAN B P, et al. Replacement of fish meal by meat and bone meal in diets for large yellow croaer, Pseudosciaena crocea[J]. Aquaculture, 2006 , 260 (1/2/3/4) : 255 –263. |
| [13] | LI J, ZHANG L, MAI K S, et al. Potential of several protein sources as fish meal substitutes in diets for large yellow croaker, Pseudosciaena crocea R[J]. Journal of the World Aquaculture Society, 2010 , 41 (Suppl.2) : 278 –283. |
| [14] | 张帆, 张文兵, 麦康森, 等. 饲料中豆粕替代鱼粉对大黄鱼生长、消化酶活性和消化道组织学的影响[J]. 中国海洋大学学报, 2012 , 42 (增刊) :75 –82. |
| [15] | ZHANG L, MAI K S, AI Q H, et al. Use of a compound protein source as a replacement for fish meal in diets of large yellow croaker, Pseudosciaena crocea R[J]. Journal of the World Aquaculture Society, 2008 , 39 (1) : 83 –90. DOI: 10.1111/jwas.2008.39.issue-1 |
| [16] | 石西, 罗智, 黄超, 等. 小球藻替代鱼粉对鲫生长、体组成、肝脏脂肪代谢及其组织学的影响[J]. 水生生物学报, 2015 , 39 (3) :498 –506. |
| [17] | 李云兰, 高启平, 帅柯, 等. 发酵豆粕替代豆粕对鲤鱼生长性能和肠道组织结构的影响[J]. 动物营养学报, 2015 , 27 (2) :469 –475. |
| [18] | SONG Y S, FRIAS J, MARTINEZ-VILLALUENGA C, et al. Immunoreactivity reduction of soybean meal by fermentation, effect on amino acid composition and antigenicity of commercial soy products[J]. Food Chemistry, 2008 , 108 (2) : 571 –581. DOI: 10.1016/j.foodchem.2007.11.013 |
| [19] | REDDY N R, PIERSON M D. Reduction in antinutritional and toxic components in plant foods by fermentation[J]. Food Research International, 1994 , 27 (3) : 281 –290. DOI: 10.1016/0963-9969(94)90096-5 |
| [20] | WANG Y, KONG L J, LI C, et al. Effect of replacing fish meal with soybean meal on growth, feed utilization and carcass composition of cuneate drum (Nibea miichthioides)[J]. Aquaculture, 2006 , 261 (4) : 1307 –1313. DOI: 10.1016/j.aquaculture.2006.08.045 |
| [21] | LIM S J, KIM S S, KO G Y, et al. Fish meal replacement by soybean meal in diets for Tiger puffer, Takifugu rubripes[J]. Aquaculture, 2011 , 313 (1/2/3/4) : 165 –170. |
| [22] | LIN S M, LUO L. Effects of different levels of soybean meal inclusion in replacement for fish meal on growth, digestive enzymes and transaminase activities in practical diets for juvenile tilapia, Oreochromis niloticus×O.Aureus[J]. Animal Feed Science and Technology, 2011 , 168 (1/2) : 80 –87. |
| [23] | AZARM H M, LEE S M. Effects of partial substitution of dietary fish meal by fermented soybean meal on growth performance, amino acid and biochemical parameters of juvenile black sea bream Acanthopagrus schlegeli[J]. Aquaculture Research, 2014 , 45 (6) : 994 –1003. DOI: 10.1111/are.2014.45.issue-6 |
| [24] | DING Z L, ZHANG Y X, YE J Y, et al. An evaluation of replacing fish meal with fermented soybean meal in the diet of Macrobrachium nipponense:growth, nonspecific immunity, and resistance to Aeromonas hydrophila[J]. Fish & Shellfish Immunology, 2015 , 44 (1) : 295 –301. |
| [25] | BISWAS A K, KAKU H, JI S C, et al. Use of soybean meal and phytase for partial replacement of fish meal in the diet of red sea bream, Pagrus major[J]. Aquaculture, 2007 , 267 (1/2/3/4) : 284 –291. |
| [26] | DENG J M, MAI K S, AI Q H, et al. Effects of replacing fish meal with soy protein concentrate on feed intake and growth of juvenile Japanese flounder, Paralichthys olivaceus[J]. Aquaculture, 2006 , 258 (1/2/3/4) : 503 –513. |
| [27] | 杨耐德, 符广才. 凡纳滨对虾饲料中发酵豆粕替代鱼粉的研究[J]. 饲料工业, 2008 , 29 (10) :24 –26. |
| [28] | 刘兴旺, 艾庆辉, 麦康森, 等. 大豆浓缩蛋白替代鱼粉对大菱鲆摄食生长及体组成的影响[J]. 水产学报, 2014 , 38 (1) :91 –98. |
| [29] | GARCÍA-ORTEGA A, KISSINGER K R, TRUSHENSKI J T. Evaluation of fish meal and fish oil replacement by soybean protein and algal meal from Schizochytrium limacinum in diets for giant grouper Epinephelus lanceolatus[J]. Aquaculture, 2016 , 452 : 1 –8. DOI: 10.1016/j.aquaculture.2015.10.020 |
| [30] | 吴秀峰, 薛敏, 郭利亚, 等. 脱酚棉籽粉替代部分鱼粉对西伯利亚鲟幼鱼生长、体成分及血清生化指标的影响[J]. 动物营养学报, 2010 , 22 (1) :117 –124. |
| [31] | SUN H, TANG J W, YAO X H, et al. Partial substitution of fish meal with fermented cottonseed meal in juvenile black sea bream (Acanthopagrus schlegelii) diets[J]. Aquaculture, 2015 , 446 : 30 –36. DOI: 10.1016/j.aquaculture.2015.04.020 |
| [32] | KIKUCHI K. Partial replacement of fish meal with corn gluten meal in diets for Japanese flounder (Paralichthys olivaceus)[J]. Journal of the World Aquaculture Society, 1999 , 30 (3) : 357 –363. DOI: 10.1111/jwas.1999.30.issue-3 |
| [33] | ZHOU Q C, MAI K S, TAN B P, et al. Partial replacement of fish meal by soybean meal in diets for juvenile cobia (Rachycentron canadum)[J]. Aquaculture Nutrition, 2005 , 11 (3) : 175 –182. DOI: 10.1111/anu.2005.11.issue-3 |
| [34] | 刘伟, 文华, 蒋明, 等. 大豆浓缩蛋白对中华鲟幼鱼生长、血脂和体成分的影响研究[J]. 淡水渔业, 2010 , 40 (4) :27 –32. |
| [35] | LUI M C Y, AGUIAR C L, DE ALENCAR S M, et al. Isoflavones in soy protein isolate and soy protein concentrate[J]. Food Science and Technology, 2003 , 23 (Suppl.) : 206 –212. |
| [36] | ROBAINA L, LZQUIRERDO M S, MOYANO F J, et al. Soybean and lupin seed meals as protein sources in diets for gilthead seabream (Sparus aurata):nutritional and histological implications[J]. Aquaculture, 1995 , 130 (2/3) : 219 –233. |
| [37] | MARTÍNEZ-LLORENS S, BAEZA-ARIÑO R, NOGALES-MÉRIDA S, et al. Carob seed germ meal as a partial substitute in gilthead sea bream (Sparus aurata) diets:amino acid retention, digestibility, gut and liver histology[J]. Aquaculture, 2012 , 338-341 : 124 –133. DOI: 10.1016/j.aquaculture.2012.01.029 |
| [38] | 杜震宇. 养殖鱼类脂肪肝成因及相关思考[J]. 水产学报, 2014 , 38 (9) :1628 –1638. |
| [39] | HU L, YUN B, XUE M, et al. Effects of fish meal quality and fish meal substitution by animal protein blend on growth performance, flesh quality and liver histology of Japanese seabass (Lateolabrax japonicus)[J]. Aquaculture, 2013 , 372/373/374/375 : 52 –61. |




