2. 河南农业大学国家家养动物种质资源平台, 郑州 450002
2. Henan Agricultural University National Germplasm Resources Platform for Animals, Zhengzhou 450002, China
Adipose基因,最初在果蝇中被克隆鉴定为肥胖相关基因并命名为adp[1-3],在哺乳类动物中adipose基因的同源基因被命名为WDTC1(WD and tetratricopeptide repeats 1)基因,该基因从果蝇到人类的保守性均很高[4]。WDTC1蛋白包含WD40重复和肽重复序列结构域,它们对WDTC1蛋白与组蛋白的结合有重要作用[5-6]。WDTC1蛋白通过与组蛋白2B (H2B)、组蛋白4(H4)和组蛋白去乙酰化酶3形成染色质重组复合体,抑制过氧化物增殖激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的转录活性,进而抑制脂肪生成、减少脂肪积累[4, 5, 7-10]。WDTC1蛋白以剂量依赖方式抑制脂肪的积累,当WDTC1基因过表达时,果蝇体内的脂肪沉积减少、血清甘油三酯水平降低;WDTC1基因缺乏时,个体表现为肥胖[4]。Suh等[10]发现遗传型和饲粮诱导肥胖鼠较野生型小鼠和饥饿小鼠脂肪细胞中WDTC1蛋白水平均有所下降,这表明WDTC1蛋白可能参与调控哺乳动物的脂肪发生。在人类的研究中也发现WDTC1基因的变异与肥胖有关,单不饱和脂肪酸摄入量不同对不同WDTC1基因型个体的身体质量指数具有不同的效应[11]。Wu等[12]发现了猪WDTC1基因5′侧翼区有与脂肪细胞分化及炎症相关的关键转录因子的潜在结合位点,提示WDTC1蛋白在能量代谢上有重要作用。目前有关WDTC1基因在畜禽上的研究较少,比较基因组学的分析表明WDTC1基因也是影响鸡脂肪沉积的潜在候选基因,但至今尚未见有关鸡WDTC1基因的系统报道。
玉米油[13]和芝麻油是n-6脂肪酸的代表,含有较高的亚油酸和油酸[14-15];亚麻籽油是n-3脂肪酸的代表,其n-6/n-3多不饱和脂肪酸的比值(约为0.34 : 1.00)远远低于其他油脂[16-17];猪油是富含单不饱和脂肪酸的动物油,其油酸含量高达48.7%[18]。WDTC1基因在动物体脂肪沉积及能量代谢中可能具有重要作用,饲粮油脂可能对其表达调控有重要影响。本试验在分析肉鸡WDTC1基因组织表达谱的基础上,进一步研究油脂类型和水平对其表达调控的影响,旨在深入了解鸡WDTC1基因的表达特性。
1 材料与方法 1.1 试验设计随机挑选5只42日龄商品肉鸡母雏,以用于鸡WDTC1基因的组织表达谱分析。在此基础上,采用具有重复观测值的三因素析因试验设计,探究油脂类型、水平和肉鸡组织以及油脂类型、水平和肉鸡日龄对肉鸡WDTC1基因表达的交互效应。该研究选用240只1日龄科宝肉鸡母雏,随机分为8个组,每组6个重复,每个重复5只鸡。试验鸡采用笼养,每笼5只鸡,自由采食和饮水。免疫程序按常规进行。饲粮参照NRC (1994)肉鸡营养需要配制,分为1~3和4~6周龄2个阶段饲养。1~4组饲粮分别添加2.50%的亚麻油、玉米油、芝麻油和猪油;5~8组饲粮分别添加5.00%的亚麻油、玉米油、芝麻油和猪油。饲粮组成及营养水平同张雯雯[19]文献中“表 1”和“表 2”。
|
|
表 1 PCR引物 Table 1 The primers of PCR |
在无菌操作条件下采集各商品肉鸡母雏的腹脂、皮下脂肪、皮肤、脑、心脏、肝脏、脾脏、肺脏、肾脏、卵巢、胸肌、腿肌、肌胃、小肠、胰腺组织以用于WDTC1基因的组织表达谱分析。在饲粮油脂类型和水平对肉鸡WDTC1基因表达效应的研究中,分别于21日龄和42日龄时从每个重复随机挑选1只肉鸡屠宰,无菌操作条件下收集21日龄鸡只的肝脏组织以及42日龄鸡只的腹脂、肝脏和胸肌组织。所取组织样品均用焦碳酸二乙酯(DEPC)水清洗后,液氮中速冻,-80 ℃保存备用。
1.3 总RNA提取和反转录反应组织样品总RNA的提取参照Trizol试剂盒(TaKaRa)使用说明书(取50~100 mg的组织)。微量分光光度计(NanoDrop 2 000 UV spectrophotometer,Thermo Scientific,德国)分析提取的RNA浓度和纯度;琼脂糖凝胶电泳分析所提取RNA的完整性。反转录反应参照试剂盒(PrimeScript® RTreagent kit with gDNA Eraser,TaKaRa,大连)使用说明书进行操作,该试剂盒可以去除提取RNA中的残余基因组DNA。反应液(总RNA,2.0 μg)置于冰上操作,反应体系为20 μL。瞬时离心混匀后将反应液放到PCR仪中,37 ℃反应15 min,85 ℃反应5 s,-20 ℃保存备用。
1.4 引物设计根据红色原鸡的WDTC1基因序列(GenBank登录号:XM_417728.4),用Oligo 6.0软件设计荧光定量PCR所用的检测引物,并由上海生物工程技术服务有限公司合成。正、反向引物及探针如表 1。
1.5 荧光定量PCR反应条件参照Li等[20]文献,运用探针法荧光定量PCR (qPCR)进行基因的定量表达分析。反应体系为25.0 μL,包括1.0 μL cDNA (0.1 μL总RNA)、0.5 μL上游引物(12.5 μmol/L)、0.5 μL下游引物(12.5 μmol/L)、2.5 μL TaqManTM探针、0.5 μL RoxⅡ、3.5 μL镁离子(Mg2+,25 mmol/L)、12.5 μL 2×Mix (包含1.5 mmol/L Mg2+)、4.0 μL超纯水;荧光定量PCR反应条件为95 ℃预变性2 min;40个循环的95 ℃变性15 s,60 ℃退火1 min。每个样品设置3个重复。纯化的PCR产物采用微量分光光度计(NanoDrop 2 000 UV spectrophotometer)测定浓度后,进行梯度(104、105、106、107、108、109和1010)稀释,用于建立每板的标准曲线。每板均设阴性对照。参照Bustin[21]报道,本研究采用微量定量仪测定RNA的浓度,反应中添加等量的RNA和cDNA进行每个样品的均一化处理,研究已证明该方法是进行基因表达的定量研究中最可靠的均一化方法。组织表达图谱中WDTC1基因的组织相对表达量=样本拷贝数/胰腺拷贝数平均值。油脂添加组中WDTC1基因的相对表达量=样本拷贝数/腹脂平均拷贝数最小组均值(2.50%油脂水平时玉米油组均值)。
1.6 数据统计和分析用SPSS 17.0软件的独立样本t检验方法分析鸡WDTC1基因的组织表达谱;用单变量三因素方差完全交互分析方法分析油脂类型、水平和肉鸡组织以及油脂类型、水平和肉鸡日龄三因素交互作用对WDTC1基因表达量的效应,结果以平均值(mean)表示。P < 0.01为差异极显著,P < 0.05为差异显著。
2 结果与分析 2.1 鸡WDTC1基因组织表达谱分析运用qPCR对鸡WDTC1基因在15个不同组织中的表达情况进行了分析,结果见图 1。鸡WDTC1基因在所有检测组织中均有表达,其中在胰腺组织中表达量最低,在卵巢组织中表达量最高,为胰腺中表达量的16.7倍,其次是肝脏、肾脏、脑、肺脏、胸肌、心脏、小肠等组织。除腹脂、皮下脂肪外,其余组织中WDTC1基因的表达量均显著高于胰腺中的表达量(P < 0.05)。
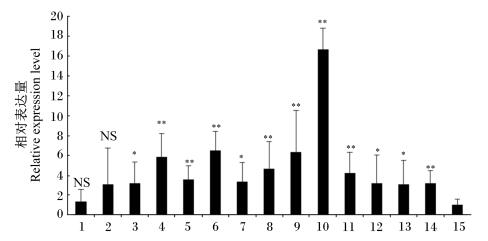
|
1:腹脂abdominal fat; 2:皮下脂肪subcutaneous fat; 3:皮肤skin; 4:脑brain; 5:心脏heart; 6:肝脏liver; 7:脾脏spleen; 8:肺脏lung; 9:肾脏kidney; 10:卵染ovary; 11:胸肌breast muscle; 12:腿肌leg muscle; 13:肌胃muscular stomach; 14:小肠small intestine; 15:胰I像pancreas。 数据柱标注**表示该组织中表达量极显著高于胰腺组织中表达量(P < 0.01),标注*表示该组织中表达量显著高于胰腺组织中表达量(P < 0.05),NS表示该组织中表达量与胰腺组织中表达量差异不显著(P > 0.05)。 Data column with ** mean expression in tissue extremely significantly higher than that in pancreas (P < 0.01) t and with * mean expression in tissue significantly higher than that in pancreas (P < 0.05), while with NS mean no significant difference be¬tween expression in this tissue and that in pancreas (P > 0.05). 图 1 肉鸡WDTC1基因的组织表达谱 Figure 1 Tissue expression profile of WDTC1 gene in broilers |
油脂类型和水平对42日龄肉鸡不同组织WDTC1基因相对表达量的影响见表 2。油脂类型对42日龄肉鸡不同组织中WDTC1基因相对表达量的影响极显著(P < 0.01),且油脂类型与肉鸡组织(P < 0.01)、油脂类型与油脂水平(P < 0.05)的交互效应显著。
|
|
表 2 油脂类型和水平对42日龄肉鸡不同组织中WDTC1基因相对表达量的交互效应 Table 2 Interactive effects of oil type and level on WDTC1 gene relative expression level in different tissues of broilers at 42 days of age |
与组织表达谱结果一致,42日龄肉鸡肝脏组织中WDTC1基因相对表达量高于胸肌和腹脂组织。5.00%油脂水平时亚麻油、玉米油和猪油组42日龄肉鸡肝脏组织中WDTC1基因相对表达量均显著高于腹脂组织(P < 0.05);2.50%油脂水平时亚麻油组42日龄肉鸡肝脏组织中WDTC1基因相对表达量显著高于腹脂组织(P < 0.05);2.50%和5.00%油脂水平时芝麻油组42日龄肉鸡肝脏、腿肌和腹脂组织间WDTC1基因的相对表达量无显著差异(P > 0.05)。
42日龄肉鸡肝脏组织中,2.50%和5.00%油脂水平时亚麻油组WDTC1基因相对表达量均最高,2.50%油脂水平时亚麻油组WDTC1基因相对表达量显著高于其他油脂组(P < 0.05),5.00%油脂水平时亚麻油组WDTC1基因相对表达量显著高于芝麻油组(P < 0.05);42日龄肉鸡腹脂组织中,2.50%油脂水平时芝麻油和猪油组WDTC1基因的相对表达量显著高于亚麻油组和玉米油组(P < 0.05),而5.00%油脂水平时各油脂组间WDTC1基因的相对表达量无显著差异(P > 0.05)。油脂类型和水平对肉鸡胸肌组织中WDTC1基因的相对表达量无显著影响(P > 0.05);
2.3 油脂类型和水平对不同日龄肉鸡肝脏组织中WDTC1基因相对表达量的影响油脂类型和水平对不同日龄肉鸡肝脏组织WDTC1基因相对表达量的影响见表 3。油脂类型对不同日龄肉鸡肝脏组织中WDTC1基因相对表达量的影响极显著(P < 0.01),且油脂类型与油脂水平的交互效应显著(P < 0.05)。
|
|
表 3 油脂类型和水平对不同日龄肉鸡肝脏中WDTC1基因相对表达量的交互影响 Table 3 Interactive effects of oil type and level on the WDTC1 gene relative expression level in liver of broilers at different days of age |
各油脂水平时各油脂组21日龄肉鸡肝脏组织中WDTC1基因相对表达量均高于42日龄时。2.50%油脂水平时玉米油、芝麻油和猪油组21日龄肉鸡肝脏组织中WDTC1基因相对表达量极显著高于42日龄时(P < 0.01);5.00%油脂水平时猪油组肉鸡21日龄猪肝脏WDTC1基因相对表达量显著高于42日龄时(P < 0.05);各油脂水平时亚麻油组21日龄和42日龄肉鸡WDTC1基因相对表达量无显著差异(P > 0.05)。
21日龄时,2.50%油脂水平时猪油组肉鸡肝脏组织WDTC1基因相对表达量最低,显著低于亚麻油组(P < 0.05),而5.00%油脂水平时各油脂组肝脏组织WDTC1基因相对表达量无显著差异(P > 0.05);42日龄时,2.50%油脂水平时亚麻油组肝脏组织WDTC1基因相对表达量显著高于其他油脂组(P < 0.05);5.00%油脂水平时亚麻油和玉米油组肝脏组织WDTC1基因相对表达量显著高于芝麻油组(P < 0.05)。
3 讨论组织表达谱分析是有效研究基因功能的基础工作,为进一步了解基因的表达提供有用的参考信息[22]。与果蝇[4]、鼠[10]和猪[12]上的研究结果一致,WDTC1基因在肉鸡组织中广泛表达,在生殖器官(卵巢)中的表达量远高于其他组织。WDTC1基因在不同物种间的表达也有所不同,猪WDTC1基因在肾脏、肺脏和脂肪组织中表达量高,在骨骼肌组织中的表达量相对较低[12],而鸡WDTC1基因在肝脏、胸肌、腿肌组织中大量表达,在腹脂组织中的表达量较低,提示WDTC1基因在不同物种间功能的差异性。
肝脏组织中WDTC1基因的表达呈现出随日龄的增长而下降的趋势,提示了鸡WDTC1基因表达的时空特异性。亚麻油组肉鸡WDTC1基因呈现出在不同油脂水平、不同日龄时在肝脏组织中的相对高水平稳定表达,提示亚麻酸以非剂量依赖的方式保持WDTC1基因在组织中的稳定表达,延缓肝脏WDTC1基因的表达随日龄的增长而降低的趋势。
研究表明,长链脂肪酸可以调控脂代谢相关基因的表达[23-24]。陈行杰[25]研究发现,饲粮中添加鱼油降低了猪脂肪组织中肥胖基因(ob)和瘦素(leptin)的长型受体基因的表达水平,而豆油提高了脂肪组织中PPARγ基因的表达水平,并提高了背部脂肪和腹部脂肪组织中类胰岛素生长因子(insulin-like grouth factors-1,IGF-1)基因的表达水平,降低了内脏脂肪组织中IGF-1基因的表达水平。本试验中肝脏组织中WDTC1基因的表达量高于腹脂组织,肝脏是肉鸡WDTC1基因的优势表达组织,这可能与鸟类肝脏的脂肪生成能力显著高于脂肪组织,是脂肪合成的主要场所有关[26-30]。2.50%油脂水平时亚麻油上调了42日龄肉鸡肝脏组织WDTC1基因的表达量而下调了腹脂组织WDTC1基因的表达量,芝麻油则下调了肝脏组织WDTC1基因的表达量而上调了腹脂组织WDTC1的表达量,提示油脂类型以组织特异性的方式影响42日龄肉鸡WDTC1基因的表达。n-3脂肪酸(亚麻油)提高肝脏组织WDTC1基因的表达量,而n-6脂肪酸(芝麻油)提高脂肪组织WDTC1基因的表达量,这可能与芝麻油含有较多的固醇、芝麻酚、芝麻酚林和芝麻素等不皂化物,具有抗氧化性和独特的生理作用有关[14]。
本试验发现,随着油脂水平的提高,油脂类型对42日龄肉鸡腹脂组织WDTC1基因表达量影响的差异进一步减小;在21日龄和42日龄肉鸡肝脏组织中也呈现出类似的现象,随油脂水平的提高,WDTC1基因的表达量在不同油脂类型间的差异减小,提示油脂类型以油脂剂量依赖的方式影响WDTC1基因的表达。
4 结论肉鸡WDTC1基因的表达有时空特异性,其优势表达组织为肝脏,在肝脏中的表达量高于在腹脂中的表达量,肉鸡肝脏组织中WDTC1基因的表达量随着肉鸡日龄的增长而降低。油脂类型影响WDTC1基因的表达量并呈现出与油脂水平、肉鸡组织的交互效应,亚麻油可使肉鸡肝脏组织中WDTC1基因的表达量在不同油脂水平和肉鸡日龄均维持较高的水平。油脂类型和水平对42日龄肉鸡胸肌组织中WDTC1的表达量无显著影响。
| [1] | CLARK A G, DOANE W W. Desiccation tolerance of the adipose 60 mutant of Drosophila melanogaster[J]. Hereditas, 1983 , 99 (2) : 165 –175. |
| [2] | DOANE W W. Developmental physiology of the mutant female sterile (2) adipose of Drosophila melanogaster.Ⅰ.Adult morphology, longevity, egg production, and egg lethality[J]. The Journal of Experimental Zoology, 1960 , 145 (1) : 1 –21. DOI: 10.1002/(ISSN)1097-010X |
| [3] | DOANE W W. Developmental physiology of the mutant female sterile (2) adipose of Drosophila melanogaster.Ⅱ.Effects of altered environment and residual genome on its expression[J]. The Journal of Experimental Zoology, 1960 , 145 (1) : 23 –41. DOI: 10.1002/(ISSN)1097-010X |
| [4] | HÄDER T, MVLLER S, AGUILERA M, et al. Control of triglyceride storage by a WD40/TPR-domain protein[J]. EMBO Reports, 2003 , 4 (5) : 511 –516. DOI: 10.1038/sj.embor.embor837 |
| [5] | BLATCH G L, LÄSSLE M. The tetratricopeptide repeat:a structural motif mediating protein-protein interactions[J]. BioEssays:News and Reviews in Molecular, Cellular and Developmental Biology, 1999 , 21 (11) : 932 –939. DOI: 10.1002/(SICI)1521-1878(199911)21:11<>1.0.CO;2-8 |
| [6] | FONG H K, HURLEY J B, HOPKINS R S, et al. Repetitive segmental structure of the transducin beta subunit:homology with the CDC4 gene and identification of related mRNA[J]. Proceedings of the National Academy of Sciences of the United States of America, 1986 , 83 (7) : 2162 –2166. DOI: 10.1073/pnas.83.7.2162 |
| [7] | LI D, YEA S, LI S, et al. Krüppel-like factor-6 promotes preadipocyte differentiation through histone deacetylase 3-dependent repression of DLK1[J]. The Journal of Biological Chemistry, 2005 , 280 (29) : 26941 –26952. DOI: 10.1074/jbc.M500463200 |
| [8] | MORI T, SAKAUE H, IGUCHI H, et al. Role of krüppel-like factor 15(KLF15) in transcriptional regulation of adipogenesis[J]. The Journal of Biological Chemistry, 2005 , 280 (13) : 12867 –12875. DOI: 10.1074/jbc.M410515200 |
| [9] | SMITH T F, GAITATZES C, SAXENA K, et al. The WD repeat:a common architecture for diverse functions[J]. Trends in Biochemical Sciences, 1999 , 24 (5) : 181 –185. DOI: 10.1016/S0968-0004(99)01384-5 |
| [10] | SUH J M, ZEVE D, MCKAY R, et al. Adipose is a conserved dosage-sensitive antiobesity gene[J]. Cell Metabolism, 2007 , 6 (3) : 195 –207. DOI: 10.1016/j.cmet.2007.08.001 |
| [11] | LAI C Q, PARNELL L D, ARNETT D K, et al. WDTC1, the ortholog of drosophila adipose gene, associates with human obesity, modulated by mufa intake[J]. Obesity (Silver Spring, Md.), 2009 , 17 (3) : 593 –600. DOI: 10.1038/oby.2008.561 |
| [12] | WU Y L, LONG Q Q, FENG B, et al. Molecular cloning and characterization of the anti-obesity gene adipose in pig[J]. Gene, 2012 , 509 (1) : 110 –119. DOI: 10.1016/j.gene.2012.07.087 |
| [13] | EHR I J, KERR B J, PERSIA M E. Effects of peroxidized corn oil on performance, AMEn, and abdominal fat pad weight in broiler chicks[J]. Poultry Science, 2015 , 94 (7) : 1629 –1634. DOI: 10.3382/ps/pev131 |
| [14] | PATHAK N, RAI A K, KUMARI R, et al. Value addition in sesame:a perspective on bioactive components for enhancing utility and profitability[J]. Pharmacognosy Reviews, 2014 , 8 (16) : 147 –155. DOI: 10.4103/0973-7847.134249 |
| [15] | 卢建, 王克华, 曲亮, 等. 饲粮中不同水平芝麻油对苏禽青壳蛋鸡产蛋性能、蛋品质、血清脂质指标和蛋黄胆固醇含量的影响[J]. 动物营养学报, 2013 , 25 (10) :2474 –2480. |
| [16] | LEE J Y, KANG S K, HEO Y J, et al. Influence of flaxseed oil on fecal microbiota, egg quality and fatty acid composition of egg yolks in laying hens[J]. Current Microbiology, 2016 , 72 (3) : 259 –266. |
| [17] | BOURRE J M. Effect of increasing the omega-3 fatty acid in the diets of animals on the animal products consumed by humans[J]. Médecine Sciences:M/S, 2005 , 21 (8/9) : 773 –779. |
| [18] | 齐珂珂.日粮ω6/ω3比例对肉鸡脂肪酸组成及肉品质的影响[D].博士学位论文.北京:中国农业科学院, 2009. |
| [19] | 张雯雯, 鲁卫卫, 王婷, 等. 油脂类型和水平对肉鸡组织18S rRNA表达的影响[J]. 动物营养学报, 2014 , 26 (12) :3814 –3820. |
| [20] | LI S Y, CHEN W, KANG X T, et al. Distinct tissue expression profiles of chicken Lpin1-α/β isoforms and the effect of the variation on muscle fiber traits[J]. Gene, 2013 , 515 (2) : 281 –290. DOI: 10.1016/j.gene.2012.11.075 |
| [21] | BUSTIN S. Quantification of mrna using real-time reverse transcription PCR (RT-PCR):trends and problems[J]. Journal of Molecular Endocrinology, 2002 , 29 (1) : 23 –39. DOI: 10.1677/jme.0.0290023 |
| [22] | 李仕新, 高萍, 李加琪, 等. 猪载脂蛋白E基因的组织表达谱分析[J]. 四川农业大学学报, 2011 , 29 (4) :540 –543. |
| [23] | JUMP D B, TRIPATHY S, DEPNER C M. Fatty acid-regulated transcription factors in the liver[J]. Annual Review of Nutrition, 2013 , 33 : 249 –269. DOI: 10.1146/annurev-nutr-071812-161139 |
| [24] | 颜新春, 汪以真, 许梓荣. 动物脂肪酸合成酶(FAS)基因表达的调控[J]. 动物营养学报, 2002 , 14 (2) :1 –4. |
| [25] | 陈行杰.日粮能量水平和油脂来源对猪脂肪ob基因转录表达调控的研究[D].博士学位论文.北京:中国农业大学, 2005. |
| [26] | GONDRET F, FERRÉ P, DUGAIL I. ADD-1/SREBP-1 is a major determinant of tissue differential lipogenic capacity in mammalian and avian species[J]. Journal of Lipid Research, 2001 , 42 (1) : 106 –113. |
| [27] | O'HEA E K, LEVEILLE G A. Lipid biosynthesis and transport in the domestic chick (Gallus domesticus)[J]. Comparative Biochemistry and Physiology, 1969 , 30 (1) : 149 –159. DOI: 10.1016/0010-406X(69)91309-7 |
| [28] | MILDNER A M, CLARKE S D. Porcine fatty acid synthase:cloning of a complementary DNA, tissue distribution of its mrna and suppression of expression by somatotropin and dietary protein[J]. The Journal of Nutrition, 1991 , 121 (6) : 900 –907. |
| [29] | GRIMINGER P.Lipid metabolism[M]//STURKIE P D.Avian physiology.New York:Springer, 1986:345-358. |
| [30] | GALGANI J E, KELLEY D E, ALBU J B, et al. Adipose tissue expression of adipose (WDTC1) gene is associated with lower fat mass and enhanced insulin sensitivity in humans[J]. Obesity, 2013 , 21 (11) : 2244 –2248. DOI: 10.1002/oby.20371 |




