2. 中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206
2. National Institute for Communicable Diseases Control and Prevention Chinese Center for Disease Control and Prevention, State Key Laboratory for Infectious Disease Prevention and Control, Beijing 102206, China
抗生素滥用引发的耐药菌及超级耐药菌株严重威胁着人类的健康,开发微生物添加剂是替代饲料抗生素的重要方向。我国于2013年批准了34种可直接添加的微生物,美国食品药物管理局(FDA)批准42种,其中芽孢杆菌占6种[1]。芽孢杆菌类益生菌除生物占位及生物夺氧作用抑制病原性细菌外,还通过其在肠道内产生多种水解酶类及生长刺激因子等提高饲料利用率,从而促进畜禽生长。叶光斌等[2]用平板法测得猪源芽孢杆菌3种酶的透明圈直径/菌落直径(D/d)值在2~4。唐丽江等[3]、谢凤行等[4]从土壤分离芽孢杆菌并评价产淀粉酶活性,用诱变育种提高其产酶能力,使D/d值翻1倍。现有报道筛选的芽孢杆菌多是具有某1种或2种酶的产生能力,同时具备分泌多种胞外酶能力的芽孢杆菌尚未作研究。能同时分泌淀粉酶、纤维素酶、蛋白酶3种胞外酶的芽孢杆菌能更大限度地发挥其营养效果。本研究拟从偏远山区农户未饲用混合饲料且生产性能优良的经产母猪粪便中筛选出对低pH和高胆盐有较好的耐受性,且同时产淀粉酶、纤维素酶和蛋白酶的芽孢杆菌菌株,为饲用益生菌专一性制剂产品的开发和应用打下基础。
1 材料与方法 1.1 试验材料新鲜粪便,采自重庆北碚散户饲养的太湖母猪。
参考菌株S1-2,来自富硒-枯草芽孢杆菌饲料添加剂(活菌数5×1010 CFU/g,神微生物菌种科技有限公司)。
LB培养基、淀粉培养基、酪素培养基、羧甲基纤维素钠培养基、牛胆盐、盐酸。API50CHB/E和API50CH (北京威泰科生物技术有限公司)、DNA提取试剂盒(北京擎科生物新业生物技术有限公司)。
1.2 试验方法 1.2.1 芽孢杆菌的初筛取少量粪便标本解冻,震荡混匀后分装。取1份粪便样品于80 ℃水浴15 min,梯度稀释后涂布于LB琼脂平板,每板50 μL,于37 ℃培养18~24 h后挑取不同单菌落纯化2代。
1.2.2 耐酸及耐胆盐试验挑取生长旺盛的单菌落到1 mL LB培养基中,于37 ℃振荡(120 r/min)培养6 h后,按5%的接种量转入pH 3.5的磷酸盐缓冲液(PBS)中,对照组为pH 7.0的PBS,2 h后将菌液进行梯度稀释涂板,每个梯度2个重复。于37 ℃培养18 h后进行平板活菌计数并按下式计算存活率。

|
挑取耐酸试验存活率高于40%的菌株进行耐胆盐试验。将培养了6 h后的菌液按5%的接种量转入含0.5%牛胆盐的LB培养基中,对照组不添加胆盐。培养24 h后将菌液梯度稀释后涂板,每个梯度2个重复。培养18 h后取出平板进行活菌计数并计算存活率,计算方法同上。
1.2.3 产酶试验 1.2.3.1 产淀粉酶试验按文献[5]进行,主要方法如下:用无菌牙签蘸取单菌落点种于淀粉平板上,每株菌3个重复点,1个纯水对照点。于37 ℃培养24 h后加入1 mL的碘液使均匀覆盖平板,4 ℃静置10 min后分别测量透明圈直径(D)及菌落直径(d),计算透明圈直径/菌落直径(D/d)值,取平均值。
1.2.3.2 产纤维素酶试验按文献[6]进行,主要方法如下:将待测菌株点种于羧甲基纤维素钠平板上,每株菌3个重复点,1个纯水对照点。于37 ℃培养24 h后,先用0.2%刚果红染色30 min,然后依次用蒸馏水和1 mol/L NaCl彻底洗去染液,每次洗脱时间为5 min,再用5%醋酸固定颜色5 min。分别测量D和d,计算D/d值,取平均值。
1.2.3.3 产蛋白酶试验按文献[6]进行,主要方法如下:将待测菌株点种于酪素平板上,每株菌3重复点,1个纯水对照点。于37 ℃培养48 h后取出。分别测量D和d,计算D/d值,取平均值。
1.2.4 分离菌株的耐酸与耐胆盐能力为了筛选到更适合生产应用的菌株,将能产3种酶的菌株再作进一步的耐酸性分析,测定其在pH 2.0、2.5、3.0条件下处理2 h后的存活率。同时复检其对0.5%胆盐的耐受性。
1.2.5 生化鉴定选择3种产酶试验中D/d值大于1且D-d值大于2 mm的菌株进行微生物学鉴定。
将各株分离菌在LB平板培养18 h,挑取几个一致的菌落在API50CHB/E培养安瓿中制成菌悬液,浊度相当于2 MCF。贴壁加1滴菌悬液到API50CH试剂条的每个反应孔中,再加1滴矿物油进行封闭,放置于37 ℃培养箱,观察并记录24、48 h的生化反应结果,根据API细菌生化反应鉴定系统判定结果具体操作方法按说明书进行。
1.2.6 16S rDNA序列分析用细菌基因组DNA提取试剂盒,按照革兰氏阳性菌基因组DNA的提取方法提取各菌株的基因组DNA。按文献[7]进行PCR扩增16S rDNA,引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-TACGGCTACCTTGTTACGACTT-3′。PCR产物送擎科公司(北京)进行双向测序。
将所测序在NCBI数据库中进行BLAST比对,获得相似性大于99%的菌株及序列。应用软件MEGA 6.0以邻近法构建系统发育树。
1.3 统计分析运用软件SPSS 19.0对D/d值数据进行统计分析,选择LSD法进行多重比较,试验数据以平均值±标准差表示,P < 0.05、P < 0.01分别表示差异显著和极显著。
2 结果与分析将9个样品进行80 ℃水浴15 min后涂板,培养24 h共挑出52株菌。将这些菌株和参考菌株S1-2在pH 3.5条件下处理2 h,在0.5%胆盐条件下处理24 h后,筛选出耐酸、耐胆盐存活率均大于40%的细菌共13株,以供产酶能力的检测。
2.1 产酶能力采用透明圈法定性检测菌株产淀粉酶、蛋白酶、纤维素酶的能力,若有透明圈产生,则说明该菌株能产生该酶。D/d值反映了产酶能力的大小,若D/d值大于1,则表示此菌具备向胞外分泌该酶的能力,D/d值越大,产酶能力越强。
商品化参考菌株S1-2及7株分离菌(P1.1-4、P1.1-10、P1.2-1、P1.2-3、P1.3-1、P1.3-5、P1.4-2)能同时产淀粉酶、纤维素酶和蛋白酶(图 1)。各菌的透明圈大小不一,初步说明菌株之间产酶能力存在差异。其余6株菌因为不同时表达3种酶,未在文中列出。但值得一提的是菌株S1.1-10,虽然不产生淀粉酶,但其产蛋白酶的D/d值是菌株S1-2的3倍。
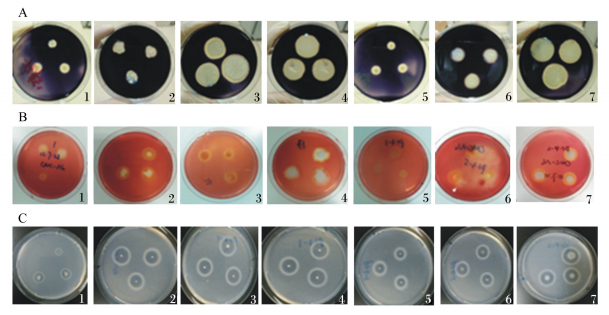
|
A:淀粉酶amylase;B:纤维素酶cellulase;C:蛋白酶protease。 1:P1.1-4;2:P1.1-10;3:P1.2-1;4:P1.2-3;5:P1.3-1;6:P1.3-5;7:P1.4-2. 图 1 产酶试验结果图 Figure 1 Image of enzyme production experiment |
测量各菌株的D和d,并计算两者的比值,由3次试验数据计算平均值与标准差并进行多重比较(表 1)。由表 1可知,所分离的7株芽孢杆菌产纤维素酶水平与S1-2没有显著差异(P > 0.05)。就淀粉酶而言,P1.1-10、P1.2-1、P1.2-3、P1.3-1、P1.3-5与S1-2没有显著差异(P > 0.05),P1.4-2的产酶量显著低于S1-2(P < 0.05),而P1.1-4的产酶量极显著高于S1-2(P < 0.01)。分离的菌株有较强产蛋白酶的能力,其中P1.1-10、P1.3-1产酶量高于S1-2,差异极显著(P < 0.01),P1.2-1、P1.2-3产酶量显著高于S1-2(P < 0.05)。其余3株菌与S1-2没有显著差异(P > 0.05)。由此看来,没有一株菌能同时高产3种酶,所以今后的益生菌制剂需要采取将几种菌配合使用。
|
|
表 1 透明圈直径/菌落直径值 Table 1 The ratio of transparent circle diameter against colony diameter (D/d) |
动物胃中的pH在2.0~4.0之间,食物在胃中的排空时间为2~4 h。我们进一步考察7株能同时分泌3种酶的细菌在pH 2.0、2.5、3.0条件下处理2 h后的存活率。随着pH的降低,7株菌存活率有不同程度地下降(图 2),在pH 2.0极端条件下处理2 h后,仍然有存活细菌(图中未给出)。这7株菌对酸的耐受能力差异较大,P1.1-4和P1.4-2耐受能力较强,在pH 3.0时有较高存活率且明显大于参考菌株S1-2。
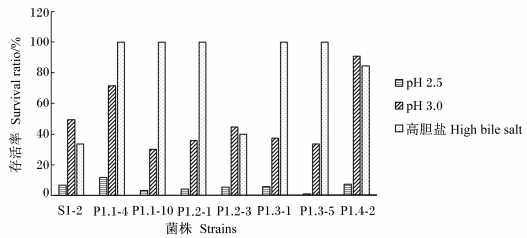
|
图 2 7株菌在不同pH条件下耐受2 h和高胆盐条件下耐受24 h后的存活率 Figure 2 The survival ratio of 7 isolates in different pH for 2 h and high bile salt for 24 h |
经0.5%胆盐培养基处理2 h后,S1-2、P1.2-3、P1.4-2的存活率分别为33.6%、40.0%、84.4%。其他5株菌100%存活,表现出不同程度地生长,其中P1.1-4和P1.2-1的菌数翻了1倍(数据未显示)。
2.3 生化鉴定及16S rDNA分子鉴定根据API鉴定系统,将P1.2-1鉴定为B. stearothermophilus,P1.3-5鉴定为B.licheniformis。虽然对谷氨酸和D-龙胆二糖等的发酵反应并不一致,系统将P1.1-4、P1.1-10、P1.2-3、P1.3-1、P1.4-2及S1-2都鉴定为B. subtilis(表 3)。API鉴定系统还规定,生化反应鉴定百分率(Id)高于80%才有意义,若低于80%则需重新鉴定;T指数表示菌的典型性,T指数越高则菌越典型。从Id值及T指数来看,将S1-2鉴定为B. subtilis属于“极好”的鉴定,满足Id≥99.9%,T指数≥0.75的条件;对P1.2-3及P1.4-2的鉴定属于"很好",满足99.0%≤Id≤99.8%,T指数≥0.75的条件;对P1.3-1鉴定结果为基本可信,其他鉴定结果属于"好",满足90.9%≤Id≤98.9%,T指数≥0.25的条件。总之,对8株菌的鉴定结果是有意义的,是可信的。
|
|
表 3 API细菌生化鉴定结果 Table 3 Results of API bacterial biochemistry characterization |
通过对7株备选株的16S rDNA测序进行核苷酸序列比对,并构建系统进化树(未提供),结果显示7株菌的16S rDNA序列均与芽孢杆菌相似性极高,但亲缘关系较近的种与生化鉴定的种并不完全一致。如表 4所示,与S1-2、P1.1-10、P1.3-1和P1.4-2最近的种是B. subtilis,与API鉴定结果一致,其他4株菌则不同。
|
|
表 4 16S rDNA序列比对结果 Table 4 Results of 16S ribosomal DNA identification |
由于益生菌具有种属特异性,所以选用猪粪便作为芽孢杆菌的分离材料以备后续猪饲料添加剂之用。据Lu等[8]报道,运用454焦磷酸测序技术比较分析仔猪和育肥猪在饲喂天然饲养和合成饲料时肠道微生物菌群结构,结果表明天然饲养条件下肠道菌群种类更为丰富且致病菌的比例更低。Alexopoulos等[9]报道,地衣芽孢杆菌和枯草芽孢杆菌益生菌添加剂不仅降低了母猪产后体重骤减的幅度,提高母猪产后进食率和产奶量,降低母猪泌乳障碍综合征的发生率,而且减少了仔腹泻的发生,使体重增加,并最终提高了仔猪的存活率。对于芽孢杆菌的抗菌活性,Ye等[10]的研究结果表明肠道中的芽孢杆菌对金黄色葡萄球菌、大肠埃希菌、志贺氏菌等都有不同程度的抑制作用,可作为主要研究菌种来开发。所以本次试验选择偏远山区农户未饲用混合饲料且生产性能优良的经产母猪,拟从其健康的肠道菌群中分离出适合作饲料添加剂的益生性芽孢杆菌。
3.2 耐酸耐胆盐能力分析饲用益生菌中的乳酸杆菌、链球菌等胃肠道固有菌类营养要求较高,生长条件苛刻,不适用于工业规模化生产[11]。而芽孢杆菌营养要求低,培养条件简单,作为益生菌可提高饲料的消化性和营养价值,且对胃酸、胆汁、辐射等恶劣条件有很强的抵抗力,获得的芽孢休眠体稳定性能好,可在肠道中萌发成营养细胞参与肠道菌群与有害菌竞争营养和生存空间,并可刺激免疫系统改善宿主功能。本次研究筛选的7株能同时分泌淀粉酶、纤维素酶、蛋白酶的菌株对pH 3.0的耐受性能达到2 h内30%~90%的存活率,且大多数在0.5%胆盐中100%存活,有2株菌还能继续生长繁殖。因此,这几株菌作为微生物添加剂是可以发挥生物占位和生物夺氧作用的。
3.3 产酶性能所有菌株产淀粉酶与纤维素酶的能力普遍较低,D/d值在1~2左右,P1.1-4最大,也仅为2.03。令人可喜的是,有4株分离菌株产蛋白酶的能力很强,D/d值达到6~7之间,是叶光斌等[2]报道菌株的2~3倍。P1.1-10分离株产蛋白酶最强,D/d值达到10,但它不表达淀粉酶。产酶透明圈的大小不能完全说明酶活性的高低,所以透明圈小的菌株不一定酶活性低。从这次试验结果来看,健康猪肠道的芽孢杆菌的理化特性存在很强的多样性,不同菌株产同一种酶的能力差异很大。因此,调节肠道功能的微生态制剂,在耐酸耐胆盐的前提下,要综合考虑其产酶水平,将不同菌株按适当的比例配合才能达到对粗蛋白质及碳水化合物的良好分解作用,尤其以提高粗蛋白质的消化利用率最重要。
3.4 生化鉴定和分子鉴定对于优选的7株芽胞杆菌,我们采取2种方法进行鉴定。其一是用梅里埃生化试剂条进行49项生化反应,其二是基于16S rDNA部分序列的分子鉴定,但鉴定结果并不完全一致,仅S1-2、P1.1-10、P1.3-1和P1.4-2都鉴定为B. subtilis。本文暂时采用API的生化鉴定结果,今后再做更全面的分子鉴定。生化鉴定结果与分子鉴定结果不相符的情况经常发生,原因在于16S rDNA分子的进化与用于酶鉴定的管家基因的进化并不完全同步,也可能是所比对的16S rDNA序列长度有限,不能很好地代表菌株的遗传信息[12]。从这次试验结果来看,健康猪肠道的芽孢杆菌存在很明显的生物多样性,但也存在菌群优势,本试验分离到5株枯草芽孢杆菌,1株嗜热脂肪芽孢杆菌,1株地衣芽孢杆菌。宁豫昌等[13]从猪粪便中分离13株芽孢杆菌,其中有9株为枯草芽孢杆菌。据此初步认为枯草芽孢杆菌为猪肠道的优势芽孢菌。
4 结论本研究通过高温、耐酸和耐胆盐试验分离对低pH和高胆盐都有良好耐受性的菌株,再通过选择性培养基透明圈试验从中筛选到7株能同时分泌淀粉酶、蛋白酶及纤维素酶3种胞外酶的优势菌株,经生化反应和16S rDNA分子鉴定其均为芽孢杆菌属。
| [1] | 高林, 白子金, 冯波, 等. 微生物饲料添加剂研究与应用进展[J]. 微生物学杂志, 2014 , 34 (2) :1 –6. |
| [2] | 叶光斌, 王彩虹, 熊俐, 等. 3株芽孢杆菌产酶性质的初步研究[J]. 江苏农业科学, 2013 , 41 (7) :240 –242. |
| [3] | 唐丽江, 王振华, 王迪. 高产淀粉酶芽孢杆菌菌株的筛选[J]. 安徽农业科学, 2009 , 37 (12) :5362 –5363. |
| [4] | 谢凤行, 赵玉洁, 周可, 等. 产胞外淀粉酶枯草芽孢杆菌的分离筛选及其紫外诱变育种[J]. 华北农业学报, 2009 , 24 (3) :78 –82. |
| [5] | ZHAO W, ZHENG J, WANG Y G, et al. A marked enhancement in production of amylase by Bacillus amyloliquefaciens in flask fermentation using statistical methods[J]. Journal of Central South University of Technology, 2011 , 18 (4) : 1054 –1062. DOI: 10.1007/s11771-011-0803-6 |
| [6] | VIJAYARAGHAVAN P, ARUN A, AL-DHABI N A, et al. Novel Bacillus subtilis IND19 cell factory for the simultaneous production of carboxy methyl cellulase and protease using cow dung substrate in solid-substrate fermentation[J]. Biotechnology for Biofuels, 2016 , 9 : 73 . DOI: 10.1186/s13068-016-0481-6 |
| [7] | ASH C, FARROW J A E, WALLBANKS S, et al. Phylogenetic heterogeneity of the genus Bacillus revealed by comparative analysis of small-subunit-ribosomal RNA sequences[J]. Letters in Applied Microbiology, 1991 , 13 (4) : 202 –206. |
| [8] | LU X M, LU P Z, ZHANG H. Bacterial communities in manures of piglets and adult pigs bred with different feeds revealed by 16S rDNA 454 pyrosequencing[J]. Applied Microbiology and Biotechnology, 2014 , 98 (6) : 2657 –2665. DOI: 10.1007/s00253-013-5211-4 |
| [9] | ALEXOPOULOS C, GEORGOULAKIS I E, TZIVARA A, et al. Field evaluation of the efficacy of a probiotic containing Bacillus licheniformis and Bacillus subtilis spores, on the health status and performance of sows and their litters[J]. Journal of Animal Physiology and Animal Nutrition, 2004 , 88 (11/12) : 381 –392. |
| [10] | YE X L, LI X G, YUAN LJ, et al. Relationship between the antibacterial and immunological activities of houttuyfonate homologues and their surface activities[J]. Journal of Asian Natural Products Research, 2006 , 8 (4) : 327 –334. DOI: 10.1080/10286020500035243 |
| [11] | HYRONIMUS B, MARREC C L, SASSI A H, et al. Acid and bile tolerance of spore-forming lactic acid bacteria[J]. International Journal of Food Microbiology, 2000 , 61 (2/3) : 193 –197. |
| [12] | TOLBA O, EARLE J A P, MILLAR B C, et al. Speciation of Bacillus spp.in honey produced in Northern Ireland by employment of 16S rDNA PCR and automated DNA sequencing techniques[J]. World Journal of Microbiology and Biotechnology, 2007 , 23 (12) : 1805 –1808. DOI: 10.1007/s11274-007-9425-4 |
| [13] | 宁豫昌, 赵绪永, 郑鸣. 猪源芽孢杆菌的分离鉴定及生物学特性研究[J]. 中国畜牧兽医, 2012 , 39 (9) :65 –68. |




